质子治疗儿童常见颅内肿瘤疗效和安全性的系统评价和Meta分析
2017-04-07田金徽张秋宁刘锐锋王小虎
李 祎 田金徽 张秋宁 刘 健 刘锐锋 王小虎
·论著·
质子治疗儿童常见颅内肿瘤疗效和安全性的系统评价和Meta分析
李 祎1,3田金徽2张秋宁3刘 健1刘锐锋3王小虎3
目的 评价质子治疗儿童常见颅内肿瘤的疗效和安全性。方法 检索Web of Science、Embase、Cochrane Library、PubMed和中国生物医学文献数据库,检索截止时间为2016年9月,纳入质子治疗儿童常见颅内肿瘤的临床研究。对纳入的文献进行质量评价,采用MetaAnalyst及STATA12.0进行合并分析,对无法合并的结局指标采用描述性分析。结果 11篇研究进入系统评价,9篇为病例系列报告, 2篇为非随机对照试验,共纳入接受质子治疗的颅内肿瘤患儿531例,颅咽管瘤2篇(45例),星形细胞瘤2篇(59例),髓母细胞瘤4篇(228例),室管膜瘤2篇(120例),未分病理类型报道1篇(79例)。①总生存率(OS):分别有5、10和6篇文献报道了2、3和5年OS。2篇非随机对照试验中,3年OS质子治疗组分别为94.1%和94.0%,光子治疗组分别为96.8%和92.5%;1篇报道了5年OS,质子治疗组和光子治疗组分别为82.0%和87.6%。病例系列报告的文献间存在异质性(I2>50%,P<0.1),亚组采取随机效应模型合并,2、3和5年的OS分别为94%(95%CI:0.90~0.97)、90%(95%CI:0.86~0.93)和87%(95%CI:0.82~0.93)。②局部控制率(LC):分别有3、4和2篇文献报道了2、3和5年LC,文献间有异质性(I2>50%,P<0.1),亚组采取随机效应模型合并,2、3和5年的LC分别为 93%(95%CI:0.88~0.98)、86% (95%CI:0.81~0.92)和77% (95%CI:0.70~0.85)。③第二原发性恶性肿瘤(SMN):4篇文献报道了1例髓母细胞瘤治疗后并发急性髓细胞性白血病。④不良反应: 9篇文献报道了不良反应,1篇未进行分级报道,8篇文献(465例)报道了3级以上听力损伤16例,3级以上视力损伤6例,需要激素替代治疗的内分泌功能障碍16例。结论 质子治疗儿童颅内肿瘤患者前,尚需高质量、大样本的临床验证。
质子治疗; 颅内肿瘤; 儿童; Meta分析
全球每年约20万儿童及青少年被诊断为肿瘤,其中80%集中在中低收入国家[1]。在中国,每年约有45 000例新诊断的癌症患儿,其中发病率最高的时白血病,约占33%,其次为中枢神经系统肿瘤(主要是颅内肿瘤)约占20%[2]。最常见的儿童中枢神经系统肿瘤包括星形细胞瘤、髓母细胞瘤、室管膜瘤和颅咽管瘤,占儿童中枢神经系统肿瘤的70%以上[3,4]。
现今儿童中枢神经系统肿瘤的治疗主要采用以手术治疗和放射治疗为主的综合治疗。常规放射治疗的主要缺点是急性和晚期不良反应。质子治疗是一种新型的放射治疗方法,与常规放射治疗比较,降低了对正常组织的辐射剂量,可以更精确地杀死肿瘤细胞的同时保护肿瘤周围的组织器官,减少急性及晚期放射性损伤,从而利于改善患者的生活质量。随着质子治疗技术的不断发展和推广,接受质子治疗的肿瘤患儿越来越多[5]。
质子治疗儿童颅内肿瘤的随机对照试验不完全符合随机、对照等医学科研原则[6,7],主要是以观察性研究为主,虽然证据级别较低,但仍是干预性研究很好的补充。本研究系统地收集儿童颅内肿瘤质子治疗的文献,评价其有效性和安全性,以期为质子治疗儿童颅内肿瘤的临床实践提供证据支持。
1 方法
1.1 文献纳入标准 ①中文和英文文献;②中位年龄≤14岁的颅内肿瘤 (主要包括星形细胞瘤、颅咽管瘤、髓母细胞瘤、室管膜瘤)患儿;③干预措施为质子治疗(可有或无光子或重离子治疗)。
1.2 排除标准 ①排除样本量<10例的文献;②重复发表的文献;③无本文设定的结局指标的文献。
1.3 结局指标
1.3.1 主要结局指标及定义 ①质子治疗后2、3和5年总生存率(OS);②2、3和5年局部控制率(LC),LC是指影像学肿瘤未增大且治疗后症状未加重; ③第二原发性恶性肿瘤(SMN)发生率,SMN是指因放射治疗诱发的原发性恶性肿瘤。
1.3.2 次要结局指标 不良反应发生率。根据常见不良反应术语评定标准(CTCAE)4.0.3版将不良反应分为5级,本文重点关注3级及以上听力损伤、视力损伤,需要激素替代治疗的内分泌功能障碍,神经认知障碍。
1.4 文献检索策略 检索PubMed、Cochrane Library、Embase、Web of Science和中国生物医学文献数据库(CBM),检索时间均为建库至2016年9月。中文检索词包括星形细胞瘤、颅咽管瘤、髓母细胞瘤、室管膜瘤和质子治疗。英文检索词包括craniopharyngioma、ependymoma、astrocytoma、medulloblastoma、proton therapy、proton beam和protontherapy。以CBM为例,中文检索式为(星形细胞瘤 OR 颅咽管瘤OR髓母细胞瘤OR室管膜瘤) AND 质子治疗,并行主题词检索。以PubMed为例,英文检索式为(craniopharyngioma OR ependymoma OR astrocytoma OR medulloblastoma) AND (proton therapy OR proton beam OR protontherapy),并行Mesh检索。
1.5 文献筛选 由张秋宁和李祎分别独立筛选文献、提取资料并交叉核对,如遇分歧,则由王小虎决定是否纳入。文献筛选过程中,先根据题目与摘要排除不符合纳入标准的文献后,再进一步阅读全文,确定是否纳入。
1.6 资料提取 ①纳入研究的基本信息:研究设计类型、作者、发表年份和国家等;②研究对象的基本特征:样本量、年龄、性别和疾病类型等;③质子治疗的总剂量和分次剂量,患儿是否接受手术及手术类型,随访时间;④疗效结局指标和安全性结局指标。
1.7 文献质量评价 非随机对照试验采用Cochrane DTA工作组标准进行文献质量评价[8]。共8条,0分表示未报告,1分表示报告了但不充分,2分表示报告且充分,<9分为偏倚风险高。病例系列报告采用病例系列报告偏倚评价工具[9],以是、否和不清楚作答,满足7个及以上条目为偏倚风险低。鉴于该评价工具23条过于繁琐,本文精简为8条。文献质量评价由李祎和刘健分别独立完成,二者评分不一致的条目由刘锐锋决定最终评分。
1.8 统计学方法 采用MetaAnalyst及STATA12.0软件进行Meta分析,对无法合并的结局指标采用描述性分析。采用χ2检验分析统计学异质性,根据 Cochrane系统评价指导手册,异质性显著性水平设定为P=0.1,I2设定为50%。当P>0.1、I2≤50% 时,各研究结果之间无统计学异质性,采用固定效应模型进行合并分析;当P≤0.1、I2>50% 时,存在统计学异质性,通过亚组分析和回归分析尽量找出异质性来源,若找不到异质性来源则用随机效应模型进行数据合并。对主要结局指标采用漏斗图及Begg检验明确发表偏倚情况。

表1 纳入研究的基本特征
2 结果
2.1 文献检索结果 以本文设定的文献检索策略,检索到727篇文献,按照排除标准逐层筛选,11篇文献进入本文分析。文献筛选流程见图1。

图1 文献检索流程图
2.2 文献基本特征 表1显示,9篇为病例系列报告, 2篇为非随机对照试验;均提及手术治疗和化疗。接受质子治疗的颅内肿瘤患儿531例,包括颅咽管瘤2篇(45例),星形细胞瘤2篇(59例),髓母细胞瘤4篇(228例),室管膜瘤2篇(120例),综合报道1篇(未报道病理79例)。
2.3 文献质量评价 2篇非随机对照研究中,Bishop等[10]和Eaton等[11]均评分为10分,且9个条目评分相同。①研究开始前确定临界值均0分,②研究开始后检测指标未改变(均2分),③阳性结果意义清楚(2分),④试验者培训不确定(1分),⑤治疗在检测指标检测后停止不确定(1分),⑥观察者间的差异数据在不可接受范围(0分),⑦测量仪器间差异(2分),⑧结局指标未事前确定(0分),⑨未接受商业资助(2分)。表2显示,9篇病例系列报告均无纳入和排除标准,1篇未报道患儿的临床异质性, 1篇不清楚相关结局指标的测量方法是否合理,9篇均无失访,均报告了随访时间和相关的不良事件发生情况。
2.4 Meta分析结果
2.4.1 OS 分别有5、10和6篇文献报道了2、3和5年OS。2篇非随机对照试验[10,11]报道质子治疗3年OS分别为94.1%和94.0%,光子治疗3年OS分别为96.8%和92.5%;文献[11]报道了5年质子治疗和光子治疗的OS分别为82.0%和87.6%。图2显示,分别有5、8和5篇病例系列报告报道了2、3和5年OS,各文献因随访时间不同存在异质性,亚组采取随机效应模型合并, 2、3和5年的总生存率分别为94%(95%CI:0.90~0.97)、90%(95%CI:0.86~0.93)和87%(95%CI:0.82~0.93)。

表2 病例系列报告质量评价表
注 1:纳入标准和排除标准;2:患者的临床异质性,包括病情严重程度、分型、病程和起病时间;3:是否清楚描述了主要的干预措施(剂量、用法和疗程等);4:相关结局指标的测量方法是否合理;5:干预前后是否均测量了结局指标;6:是否报告了失访和随访时间;7:是否报告了临床处置相关的不良事件发生情况;8:对结局测量者是否施盲剔除未报道全切除和次全切除病例数的文献行OS敏感性分析,仅有1篇文献[19]报道2和5年OS,分别为96%(95%CI:0.85~0.99)和84%(95%CI:0.72~ 0.92),3篇文献[15,16,19]报道了3年的OS(图3),为89%(95%CI:0.84~0.93)。与图2显示的2、3和5年的OS相比,P均>0.1。

图2 质子治疗颅内肿瘤患儿2、3、5年生存率
不同肿瘤类型的OS亚组分析 ,仅有1篇文献[17]报道了髓母细胞瘤2年和5年OS,分别为92%(95%CI:0.81~0.96)和83%(95%CI:0.71~0.91),图4显示,3篇文献[15,16,19]报道了髓母细胞瘤 3年的OS,为89%(95%CI:0.84~0.94)。2篇文献[13,14]报道了星形细胞瘤 3年的OS为93%(95%CI:0.80~ 1.00)。2篇文献[18,19]报道了室管膜瘤 2、3和5年的OS分别为96%(95%CI:0.91~1.00)、92%(95%CI:0.86~0.98)和87%(95%CI:0.81~0.93)。与图2显示的2、3和5年的OS相比,P均>0.1。


图3 剔除未报道全切除和次全切除病例的文献后3年总生存率
图4 质子治疗不同类型颅内肿瘤患儿2、3、5年总生存率
2.4.2 LC 图5显示,分别有3、4和2篇文献报道了2、3和5年LC,均为病例系列报告。异质性检验结果显示,各文献因随访时间不同存在异质性。亚组以随机效应模型合并,2、3和5年LC分别为 93%(95%CI:0.88~0.98)、86% (95%CI:0.81~0.92)和77% (95%CI:0.70~0.85)。

图5 质子治疗颅内肿瘤患儿2、3、5年局部控制率
不同肿瘤类型的LC亚组分析,1篇文献[12]报道了颅咽管瘤2和3年的LC均为98%(95%CI:0.75~1.00)。1篇文献[14]报道了髓母细胞瘤3年的LC为78%(95%CI:0.62~0.93)。2篇文献[18,19]报道了室管膜瘤 2、3和5年的LC分别为92% (95%CI:0.86~0.97)、84%(95%CI:0.78~0.91)和77%(95%CI:0.70~0.85)。与图5显示的2、3和5年的LC相比,P均>0.1,差异无统计学意义.
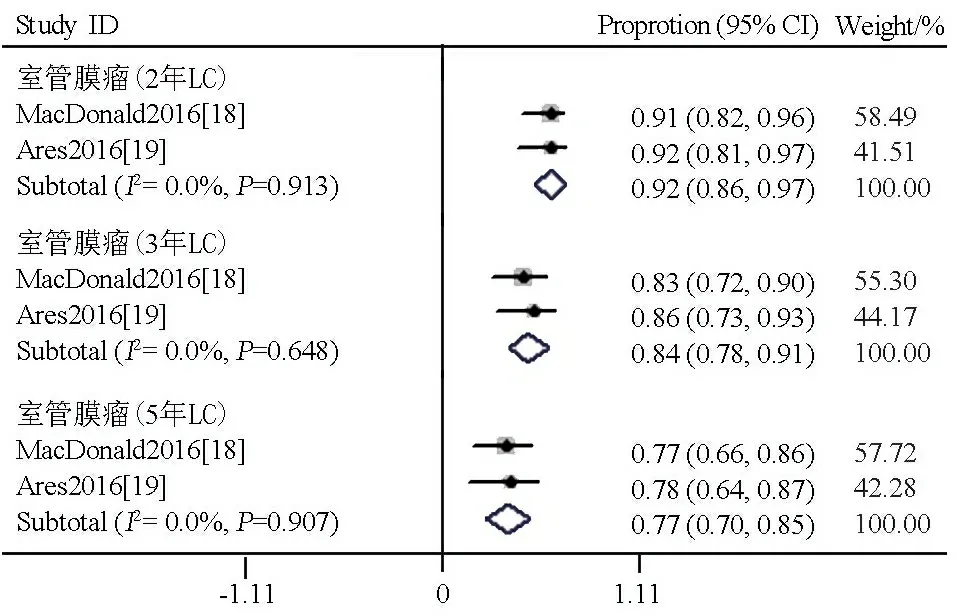
图6 质子治疗室管膜瘤患儿2、3、5年OS
2.4.3 SMN 2篇文献[17,18]报道均未发生SMN。文献[20]报道了1例SMN,为髓母细胞瘤治疗后并发急性髓细胞性白血病。文献[11]报道常规放疗诱发SMN 3例,而质子治疗未发生SMN。上述研究最长中位随访时间7年,最短30.6个月。
2.4.4 不良反应 9篇文献报道了不良反应,1篇未进行分级报道,8篇文献(共441例)报道了3级以上听力损伤16例,3级以上视力损伤6例,需要激素替代治疗的内分泌功能障碍共16例(表3)。其他不良反应: 文献[10]报告了血管性损伤、下丘脑性肥胖、甲状腺功能减退、性腺功能减退及视力损伤的质子治疗和光子治疗的晚期不良反应,未进行分级,P均大于0.01,两种方法差异无统计学意义。文献[13]报告视神经萎缩和需要激素替代治疗的内分泌功能障碍各1例。文献[14]报告了1例需要短期住院治疗中耳炎;4例需要激素替代疗法的垂体功能减退。文献[16]报告了2例3级听力损伤,1例白内障;3例内分泌功能减退,需要激素替代治疗,其中3例均表现为生长激素缺乏,1例促甲状腺激素不足,1例促肾上腺皮质激素缺乏、性早熟。文献[17]报告了9例患者并发3级以上听力损伤和4例白内障; 61%患者内分泌功能减退,其中53%出现生长激素降低。文献[18]报告了2例听力损伤和2例生长激素缺乏病需要激素替代治疗。文献[19]报告了2例单侧3级听力损伤;生长激素缺乏和甲状腺功能减退患者各3例,均需要激素替代治疗。
2.5 研究结果发表偏倚 对文献报道的OS 和 LC分别做漏斗图(图7和8),以评价发表偏倚。2年OS漏斗图I2=16.7%,P=0.308;3年OS漏斗图I2=20.2%,P=0.270;5年OS漏斗图I2=45.8%,P=0.117;2年LC漏斗图I2=0,P=0.653;3年LC漏斗图I2=40.9%,P=0.167;5年LC漏斗图I2=0,P=0.907,均显示无明显发表偏倚。

表3 质子治疗后不良反应例数
注:①代表3级以上的听力损伤,②代表3级以上视力损伤,③代表需要激素替代治疗的内分泌功能障碍


图7 质子治疗颅内肿瘤患儿2、3、5年生存率的漏斗图
图8 质子治疗颅内肿瘤患儿2、3、5年局部控制率的漏斗图
3 讨论
本研究纳入了11篇文献共531例儿童颅内肿瘤患者。Meta分析结果显示质子治疗儿童颅内肿瘤的2、3和5年OS分别为94%、90%和87%,2年、3年和5年的LC分别为93%、86.0%和77%。由此可见,质子治疗儿童颅内肿瘤在OS和LC方面是有效的。质子既具有优良的物理特性,又具有良好的生物特性, 和光子有相似的OS和LC,但可以减少放疗不良反应[11,17,21]。质子治疗的不良反应主要集中在内分泌功能障碍、视力损伤和听力损伤,并且在安全范围之内。各颅内肿瘤的好发部位不同,相应的不良反应差异较大,如颅咽管瘤发生于蝶鞍上区,低级别星形细胞瘤好发于鞍上区,放疗引起视神经、视交叉、下丘脑等相关并发症;而室管膜瘤好发于后颅窝,放疗对耳蜗、脑干、垂体及下丘脑影响较大。有研究报道[22]质子治疗儿童中枢神经系统肿瘤后早期认知较光子治疗要好,本文纳入的15篇文献未报道神经认知功能障碍,可能需要长期随访观察或积累更多的病例。本研究纳入的文献中仅有1篇[20]报道了1例SMN,这可能与治疗后随访时间较短有关系,有研究[23,24]显示,治疗后随访5~10年才有可能对SMN有较全面的了解 。也有文献[25]报道正常组织辐射量减少或辐射剂量降低时,诱发SMN的危险也可以降低。Chojnacka 等[26]的研究表明,放疗剂量、体积、化疗和年龄都可能参与诱发第二颅内肿瘤。Song等[27]研究显示,质子治疗组较光子治疗组PTL减少症和腹泻的发生率低,治疗后1个月WBC减少和PTL减少症恢复快。Mailhot Vega等[28]研究表明,质子治疗比光子治疗的性价比高,下丘脑受照射剂量减少10 Gy就可以影响儿童生长激素缺乏的治疗成本效益。
本文的不足与局限性:①纳入的儿童颅内肿瘤存在临床疗效的差异,未行无进展生存期、无病生存期和复发生存期等评价指标的分析;②本文仅对OS和LC做了分析,质子剂量及分次不同,并且肿瘤生长位置、手术方式和化疗情况均不相同,无法进行更详尽的比较研究。
综上所述,质子是治疗儿童颅内肿瘤一种安全可行的治疗方法,并且放疗不良反应是可接受的。质子治疗作为一种国际标准化的治疗方法应用于儿童颅内肿瘤患者前,尚需进行高质量、大样本的临床研究。
[1] Rodriguez-Galindo C,Friedrich P,Morrissey L,et al.Global challenges in pediatric oncology.Curr Opin Pediatr,2013,25(1):3-15
[2] Rodriguez-Galindo C,Friedrich P,Alcasabas P,et al.Toward the Cure of All Children With Cancer Through Collaborative Efforts:Pediatric Oncology As a Global Challenge.J Clin Oncol,2015,33(27):3065-3073
[3] Ezzat S,Kamal M,El-Khateeb N,et al.Pediatric brain tumors in a low/middle income country:does it differ from that in developed world?.J Neurooncol,2016,126(2):371-376
[4] 周大彪,罗世祺,马振宇,等.1267例儿童神经系统肿瘤的流行病学.中华神经外科杂志,2007,23(1):4-7
[5] Chhabra A,Mahajan A.Treatment of common pediatric CNS malignancies with proton therapy.Chin Clin Oncol,2016,5(4):49
[6] Halperin EC.Randomized prospective trials of innovative radiotherapy technology are necessary.J Am Coll Radiol,2009,6(1):33-37
[7] Goitein M,Cox JD.Should randomized clinical trials be required for proton radiotherapy? J Clin Oncol,2008,26(2):175-176
[8] 曾宪涛,庄丽萍,杨宗国,等.Meta分析系列之七: 非随机实验性研究、 诊断性试验及动物实验的质量评价工具.中国循证心血管医学杂志,2012,4(6):496-499
[9]王小琴,陈耀龙,渠清源,等.病例系列研究方法学质量评价工具解读.中国循证儿科杂志,2015,10(5):381-385
[10] Bishop AJ,Greenfield B,Mahajan A,et al.Proton Beam Therapy Versus Conformal Photon Radiation Therapy for Childhood Craniopharyngioma:Multi-institutional Analysis of Outcomes,Cyst Dynamics,and Toxicity.Int J Radiat Oncol Biol Phys,2014,90(2):354-361
[11] Eaton BR,Esiashvili N,Kim S,et al.Clinical Outcomes Among Children With Standard-Risk Medulloblastoma Treated With Proton and Photon Radiation Therapy:A Comparison of Disease Control and Overall Survival.Int J Radiat Oncol Biol Phys,2016,94(1):133-138
[12] Winkfield KM,Linsenmeier C,Yock TI,et al.Surveillance of Craniopharyngioma Cyst Growth in Children Treated with Proton Radiotherapy.Int J Radiat Oncol Biol Phys,2009,73(3):716-721
[13] Greenberger BA,Pulsifer MB,Ebb DH,et al.Clinical outcomes and late endocrine,neurocognitive,and visual profiles of proton radiation for pediatric low-grade gliomas.Int J Radiat Oncol Biol Phys,2014,89(5):1060-1068
[14] Hug EB,Muenter MW,Archambeau JO,et al.Conformal proton radiation therapy for pediatric low-grade astrocytomas.Strahlenther Onkol,2002,178(1):10-17
[15] Sethi RV,Giantsoudi D,Raiford M,et al.Patterns of Failure After Proton Therapy in Medulloblastoma:Linear Energy Transfer Distributions and Relative Biological Effectiveness Associations for Relapses.Int J Radiat Oncol Biol Phys,2014,88(3):655-663
[16] Jimenez RB,Sethi R,Depauw N,et al.Proton Radiation Therapy for Pediatric Medulloblastoma and Supratentorial Primitive Neuroectodermal Tumors:Outcomes for Very Young Children Treated With Upfront Chemotherapy.Int J Radiat Oncol Biol Phys,2013,87(1):120-126
[17] Yock TI,Yeap BY,Ebb DH,et al.Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma:A phase 2 single-arm study.Lancet Oncol,2016,17(3):287-298
[18] MacDonald SM,Sethi R,Lavally B,et al.Proton radiotherapy for pediatric central nervous system ependymoma:clinical outcomes for 70 patients.Neuro Oncol,2013,15(11):1552-1559
[19] Ares C,Albertini F,Frei-Welte M,et al.Pencil beam scanning proton therapy for pediatric intracranial ependymoma.J Neurooncol,2016,128(1):137-145
[20] Mizumoto M,Murayama S,Akimoto T,et al.Proton beam therapy for pediatric malignancies:a retrospective observational multicenter study in Japan.Cancer Med,2016,5(7):1519-1525
[21] Rombi B,Vennarini S,Vinante L,et al.Proton radiotherapy for pediatric tumors:review of first clinical results.Ital J Pediatr,2014,40:74
[22] Pulsifer MB,Sethi RV,Kuhlthau KA,et al.Early Cognitive Outcomes Following Proton Radiation in Pediatric Patients With Brain and Central Nervous System Tumors.Int J Radiat Oncol Biol Phys,2015,93(2):400-407
[23] Travis LB,Ng AK,Allan JM,et al.Second malignant neoplasms and cardiovascular disease following radiotherapy.J Natl Cancer Inst,2012,104(5):357-370
[24] Berrington de Gonzalez A,Gilbert E,Curtis R,et al.Second solid cancers after radiation therapy:a systematic review of the epidemiologic studies of the radiation dose-response relationship.Int J Radiat Oncol Biol Phys,2013,86(2):224-233
[25] Hall EJ.Radiobiology for the radiologist,5th ed.Philadelphia:Lippincott Williams &Wilkins,2000
[26] Chojnacka M,Pedziwiatr K,Skowronska-Gardas A,et al.Second brain tumors following central nervous system radiotherapy in childhood.Br J Radiol,2014,87(1041):20140211
[27] Song S,Park HJ,Yoon JH,et al.Proton beam therapy reduces the incidence of acute haematological and gastrointestinal toxicities associated with craniospinal irradiation in pediatric brain tumors.Acta Oncol,2014,53(9):1158-1164
[28] Mailhot Vega R,Kim J,Hollander A,et al.Cost effectiveness of proton versus photon radiation therapy with respect to the risk of growth hormone deficiency in children.Cancer,2015,121(10):1694-1702
(本文编辑:张崇凡,孙晋枫)
Efficacy and safety of proton therapy for the most common intracranial tumors in childhood:a systematic review and Meta-analysis
LIYi1 ,3,TIANJin-hui2,ZHANGQiu-ning3,LIUJian1,LIURui-feng3,WANGXiao-hu3
(1TheFirstClinicalMedicalCollegeofLanzhouUniversity,Lanzhou730000,2KeyLaboratoryofClinicalTranslationalResearchandEvidence-basedMedicineofGansuProvince,Lanzhou730000,3GansuProvincialAcademicInstituteforMedicalResearch,GansuProvincialCancerHospital,Lanzhou730050,China)
WANG Xiao-hu, E-mail:xhwanggansu@163.com
Objective To assess the efficacy and safety of the proton therapy for intracranial tumors in childhood.MethodsThe electronic bibliographic databases were searched,including Cochrane library,PubMed,Embase,Web of science,Chinese Biomedical Database to assemble the studies of the proton therapy for the most common intracranial tumors in childhood.The MetaAnalyst Beta 3.13 and STATA 12.0 software were used to combine the extracted data.ResultsEleven studies were included,9 case series reports and 2 case control studies,a total of 531 patients received proton therapy,including 2 of craniopharyngioma (45 patients),2 of astrocytoma (59 patients),5 of medulloblastoma (228 patients),2 of ependymoma (120 patients),1 report of no pathological type (79 patients).①Overall survival (OS):There were 2,3 and 5 years of OS in 5,10 and 6 reports 2 case-control studies,3 years OS proton therapy was 94.1% and 94%,photon therapy was 96.8% and 92.5%; 5 years OS of 1 report,proton therapy and photon therapy were 82% and 87.6%.The heterogeneity was found in case series reports of documents (I2>50%,P<0.1),by sub group random effects model with 2,3 and 5 years of OS were 94%(95%CI:0.90-0.97),90%(95%CI:0.86-0.93) and 87%(95%CI:0.82-0.93).②Local control rate (LC):there were 2,3 and 5 years of LC in 3,4 and 2 reports,The heterogeneity was found in case series reports of documents (I2>50%,P<0.1),by sub group random effects model with 2,3 and 5 years of LC are 93% (95%CI:0.88-0.98) ,86% (95%CI:0.81-0.92) and 77% (95%CI:0.70-0.85).③The second primary malignant tumor (SMN):4 reported the SMN,only 1 patient of medulloblastoma induced acute myelogenous leukemia with PT and no patient in other reports.④Toxicoty:9 papers reported the toxicoties after PT.One paper was not hierarchical report,16 patients of grade 3 above the level of hearing impairment and 6 patients of vascular injury,16 patients of the endocrine dysfunction of replacement therapy were reported in 8 papers (465 patients).ConclusionAvailable data demonstrated that the most common intracranial tumors in childhood are effectively and safely treated with proton therapy.Although current results are promiseing,more evidence is required before the proton therapy can become the standard threatment for intracranial tumors in childhood.
Proton therapy; Intracranial tumor; Child; Meta-analysis
1 兰州大学第一临床医学院 兰州,730000;2 甘肃医学循证中心 兰州,730000;3 甘肃医学科学研究院肿瘤医院 兰州,730300
王小虎 ,E-mail:xhwanggansu@163.com
10.3969/j.issn.1673-5501.2017.01.008
2016-11-17
2017-01-24)
