颞叶难治性癫痫患者致痫灶组织中HMGB1的表达*
2017-04-07王新军杨如意周少龙武跃辉谢井伟杨永辉
陈 超,王新军#,杨如意,周少龙,武跃辉,谢井伟,王 振,杨永辉
1)郑州大学第五附属医院神经外科 郑州 450052 2)郑州大学第三附属医院儿童脑瘫康复科 郑州 450052
颞叶难治性癫痫患者致痫灶组织中HMGB1的表达*
陈 超1),王新军1)#,杨如意1),周少龙1),武跃辉1),谢井伟1),王 振1),杨永辉2)
1)郑州大学第五附属医院神经外科 郑州 450052 2)郑州大学第三附属医院儿童脑瘫康复科 郑州 450052
#通信作者,男,1965年7月生,博士,教授,研究方向:癫痫外科的基础研究与临床治疗,E-mail:wangxj@zzu.edu.cn
高迁移率族蛋白B1;颞叶;难治性癫痫
目的:探讨颞叶难治性癫痫患者致痫灶组织中高迁移率族蛋白B1(HMGB1)的表达及其临床意义。方法:选取手术切除的79例颞叶难治性癫痫患者的致痫灶组织标本,以及同期行颅内减压术的35例高颅压患者的颞叶脑组织标本(对照),采用免疫组化法及Western blot检测标本中HMGB1的表达。结果:免疫组化法检测结果显示致痫灶组织中HMGB1的阳性表达率为86.1%(68/79),高于对照组[40.0%(14/35)](P<0.001),致痫灶组织中HMGB1的表达与性别、年龄无关(P>0.05),而与癫痫病程、癫痫平均发作持续时间、癫痫发作频率及癫痫发作类型有关(P<0.05)。Western blot法检测显示致痫灶组织中HMGB1蛋白的相对表达水平为(1.702±0.158),高于对照(0.912±0.156)(P<0.001)。结论:HMGB1在颞叶难治性癫痫患者致痫灶组织中的表达升高,可能与癫痫的发生有关。
癫痫是一种发病率较高的神经系统功能紊乱疾病,常反复发作、突发突止,严重影响患者的身心健康与生活质量[1]。大部分癫痫患者通过服用抗癫痫药物可以控制发作,但约30%的癫痫患者对抗癫痫药物耐受,往往需要手术切除致痫灶来治疗,其发病机制尚不明确[2-3]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种核蛋白,具有高度保守性,广泛存在于真核细胞内[4-5],其在许多人类疾病的发病中有重要作用,包括传染病、免疫性疾病、神经退行性疾病、代谢紊乱及癌症等[6]。已有研究[7]提示HMGB1及其受体在癫痫小鼠模型的发作中具有重要的作用。该研究通过免疫组化法及Western blot检测颞叶难治性癫痫患者致痫灶组织中HMGB1的表达情况,探究HMGB1在颞叶难治性癫痫发病中的作用。
1 对象与方法
1.1 研究对象 选取2013年7月至2015年11月郑州大学第五附属医院神经外科手术切除的79例颞叶难治性癫痫患者的致痫灶组织(观察组),患者均符合国际抗癫痫联盟所制定的药物难治性癫痫的标准[8]。所有患者术前行头皮视频脑电图联合术中皮层脑电图以提高手术切除致痫灶的精确性[9],术后随访6个月以上且疗效参照Engle标准达Ⅰ、Ⅱ级,即发作控制有效。79例患者中男40例,女39例,年龄7~62岁;癫痫病程≤10 a者48例,>10 a者31例;癫痫平均发作持续时间≤5 min者42例,>5 min者37例;癫痫发作频率≤1次/周38例,>1次/周41例;癫痫发作类型为全面性强直阵挛发作者30例,非全面性强直阵挛发作者49例。35例同期行大骨瓣减压并颞叶切除的重型颅脑损伤患者或难治性脑积水并有即将发生脑疝的临床和影像学证据的患者的颞叶组织标本为对照组。所有标本均在取出后30 min内冻存于-80 ℃冰箱内。该研究所需要的标本和信息的收集均已获得患者、家属同意以及医院伦理委员会批准。
1.2 主要试剂与仪器 兔抗人HMGB1单克隆抗体购自英国Abcam公司,二抗试剂盒、DAB显色剂、PBS、正常山羊血清封闭液均购自上海拜沃生物科技有限公司,ECL化学发光试剂盒购自美国Pierce公司,PVDF膜购自美国Millipore公司,凝胶成像系统购自美国Alpha Innotech公司,DYY-6C型双稳定时电泳仪购自北京六一仪器厂,普通显微镜及荧光显微镜购自日本Olympus公司。
1.3 免疫组化法检测标本中HMGB1的表达 将石蜡包埋的标本连续切片后行脱蜡处理。将切片浸入pH 6.0的枸橼酸缓冲液中进行抗原修复,92~98 ℃微波修复15 min,自然冷却至室温。PBS清洗4次×5 min,置于体积分数为3%的过氧化氢溶液中室温下孵育10 min。PBS清洗4次×5 min,滴加体积分数为10%的正常山羊血清,在37 ℃下封闭30 min。吸去多余血清,滴加HMGB1一抗(1500),4 ℃孵育过夜。PBS清洗4次×5 min,滴加相应生物素标记二抗,室温孵育30 min。PBS清洗4次×5 min,加辣根过氧化物酶标记链霉卵白素工作液,室温孵育30 min。PBS清洗4次×5 min,DAB显色、苏木精复染、常规乙醇脱水、二甲苯透明、中性树胶封片后于显微镜下观察。评价标准[10]:在高倍镜下选择5个视野进行细胞计数。阳性细胞比例评分:无染色细胞计0分,阳性细胞比例<25%计1分,阳性细胞比例为25%~计2分,阳性细胞比例为50%~75%计3分,阳性细胞比例>75%计4分;染色强度评分:无染色计0分,浅棕色计1分,深棕色计2分。采用半定量积分法,将两项指标评分的乘积作为最终得分:0分为阴性(-),1~4分为低表达(+),5~8分为高表达()。
1.4 Western blot法检测标本中HMGB1的表达
取100 mg冰冻组织标本并剪碎,加入蛋白裂解液750 μL,在冰上研磨匀浆30 min;将匀浆后的组织液悬液移入EP管中,煮沸5 min后12 000 r/min离心15 min;将离心后管中的上清液吸出,在冰上分装至200 μL的Ep管中,放于-80 ℃冰箱保存。BCA法进行蛋白定量,取50 μg样品,SDS-PAGE电泳后转移至PVDF膜,置于50 g/L的脱脂奶粉溶液中4 ℃下封闭过夜;加入兔抗人HMGB1抗体(11 000)4 ℃孵育过夜后,加入二抗室温下孵育1 h。TBST振荡洗涤4次×10 min后,显色,采用凝胶成像分析系统测定各条带的光密度值,并与内参GAPDH条带对比,所得比值代表目的蛋白的表达情况。
1.5 统计学处理 应用SPSS 21.0处理数据。采用χ2检验比较2组HMGB1的阳性表达率,采用秩和检验比较不同性别、年龄及临床因素的颞叶难治性癫痫患者HMGB1表达的差异,采用两独立样本的t检验比较2组HMGB1蛋白表达水平的差异,检验水准α=0.05。
2 结果
2.1 HMGB1蛋白的免疫组化检测结果 在神经元细胞中,对照组HMGB1表达较少且染色部位多集中于细胞核,而致痫灶组织中HMGB1表达较多,且细胞核、细胞质甚至细胞外均可观察到大量的染色颗粒;在神经胶质细胞中观察到与神经元细胞相同的变化趋势,即在细胞核及细胞质中表达量均增加,但不如神经元细胞变化明显,见图1。致痫灶组织中HMGB1的阳性表达率为86.1%(68/79),高于对照组[40.0%(14/35)](χ2=25.503,P<0.001)。致痫灶组织中HMGB1的表达与性别、年龄无关,而与癫痫病程、癫痫平均发作持续时间、癫痫发作频率及癫痫发作类型有关(表1)。
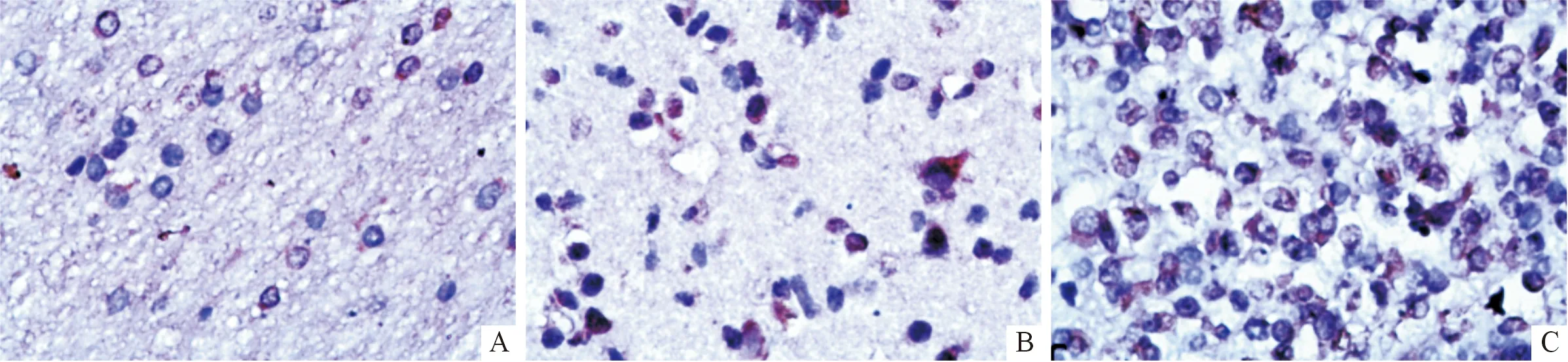
A:对照脑组织中HMGB1少量表达;B:致痫灶组织中HMGB1低表达;C:致痫灶组织中HMGB1高表达。图1 对照脑组织与致痫灶组织中HMGB1的免疫组化法检测情况(SP,×400)
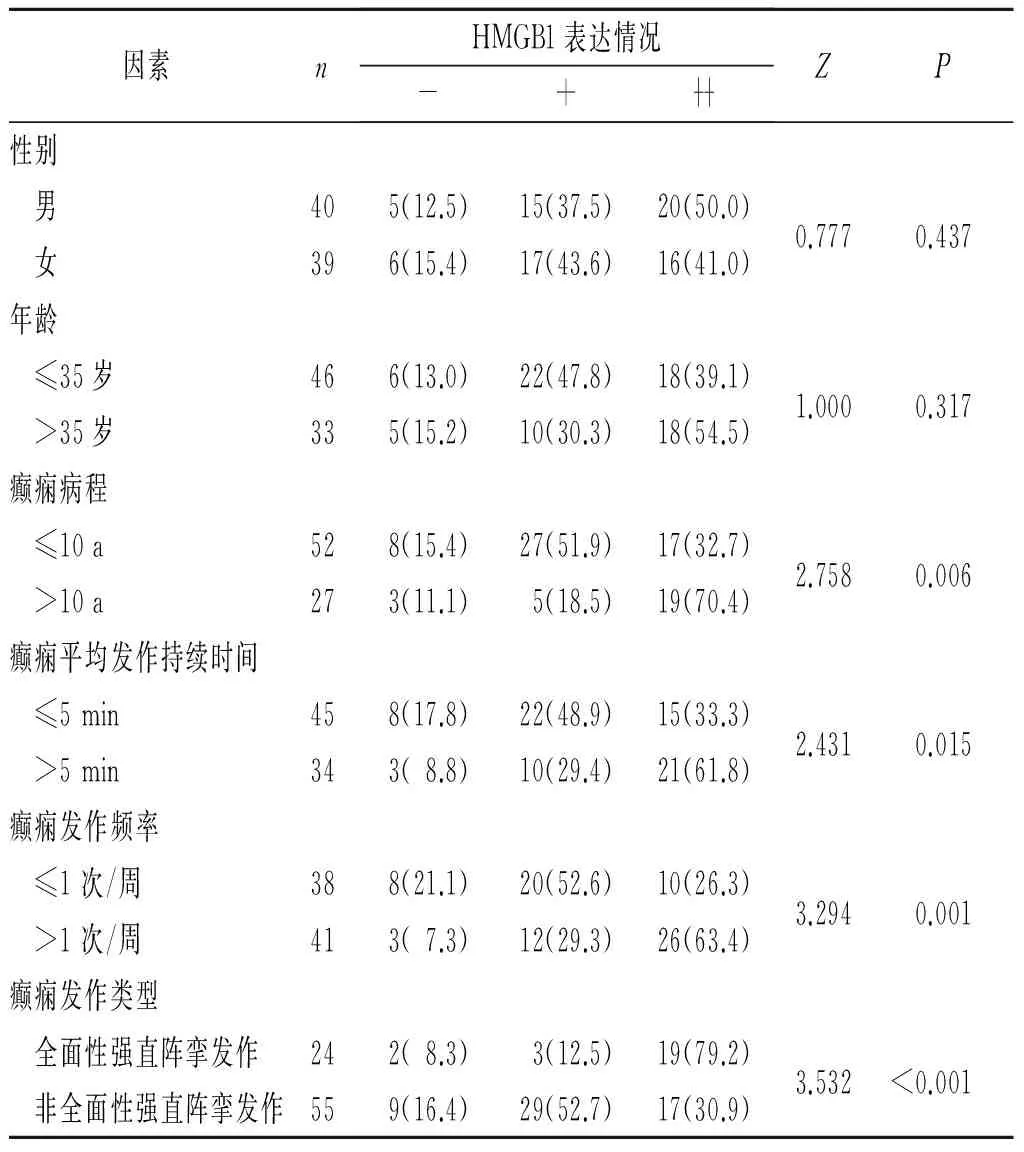
表1 不同性别、年龄及临床因素的癫痫患者HMGB1表达的差异 例(%)
2.2 Western blot的检测结果 结果见图2。致痫灶组织中HMGB1蛋白的相对表达水平为(1.702±0.158),高于对照(0.912±0.156)(t=24.711,P<0.001)。

1:对照脑组织;2:致痫灶组织。图2 2组HMGB1蛋白的Western blot检测结果
3 讨论
癫痫是一种常见神经系统疾病,人群中的患病率大约为1%,且其中大部分患者需要终身服用抗癫痫药物,减少癫痫患者的发作对于节约社会和医疗资源具有重大意义[11]。但仍有1/3的癫痫患者经过系统、正规的抗癫痫药物治疗后病情仍得不到控制且影响日常生活[12],为难治性癫痫,其中以颞叶癫痫最为常见。难治性性癫痫发生的确切原因尚未完全明确,有研究[13]发现其可能与机体耐药有关。HMGB1是高迁移率族蛋白中的研究热点,其作为损伤相关模式分子与许多人类疾病有关[14],并参与调节炎症修复以及机体耐药性[15]。在许多动物癫痫模型实验[16-17]中,研究者证实了在癫痫模型的致痫灶组织中HMGB1介导的炎症途径被激活从而促进癫痫的发生及发展。该研究结果显示,颞叶难治性癫痫患者致痫灶组织中HMGB1的表达高于对照脑组织,且其表达与临床因素关系密切,即癫痫病程长、发作频率高、每次发作持续时间长及全面性强直阵挛发作者HMGB1表达强度高。
既往研究[18]发现,在癫痫模型小鼠脑组织中存在P-糖蛋白的高表达,提示其促进癫痫的发病。此外,有研究[19-20]表明P-糖蛋白作为药物流出转运体,其在血脑屏障上表达的增加与药物难治性癫痫患者的多重耐药密切相关,而炎症因子HMGB1的细胞外分泌可以激活脑内毛细血管及脑神经细胞多耐药基因1进而可以促进P-糖蛋白的表达。推测HMGB1可能协同P-糖蛋白促进癫痫的发病并产生对抗癫痫药物的耐药性,但具体的调控机制及相关通路尚需实验进一步验证。
该研究中免疫组化染色结果显示,神经元中,对照组HMGB1表达较少且染色部位多集中于细胞核,而致痫灶组织中HMGB1表达较多且细胞核、细胞质甚至细胞外均可观察到大量的染色颗粒;在神经胶质细胞中也观察到与神经元细胞相同的变化趋势;Western blot结果显示,致痫灶组织中HMGB1蛋白的表达水平亦高于对照脑组织。动物实验[21]表明,HMGB1可以通过与其受体,如Toll样受体4结合而降低成熟小鼠癫痫发作的阈值。结合该研究结果,长期反复的癫痫病史可造成神经元及神经胶质细胞的损伤,进而引起其被动释放或主动分泌HMGB1,通过与受体的结合激活不同的信号传导通路,增加神经网络的兴奋性及敏感性,促进癫痫的发作而再度加重神经元的损伤。因此,HMGB1高表达与癫痫发作是两个相互促进的因素,此机制在难治性癫痫的发生及发展中具有重要意义。
综上所述,HMGB1在颞叶难治性癫痫患者致痫灶组织中的表达升高,可能与癫痫的发生发作有关。在接下来的研究中,作者将进一步检测癫痫患者致痫灶组织及血液中HMGB1及其受体的表达情况,进一步探讨HMGB1在难治性癫痫发病中的作用。
[1]米明珊,周科成,郭翔宇,等.癫痫发病机制的研究进展[J].神经解剖学杂志,2013,29(6):715
[2]MAROSO M,BALOSSO S,RAVIZZA T,et al.Toll-like receptor 4 and high-mobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J].Nat Med,2010,16(4):413
[3]PERUCCA E,FRENCH J,BIALER M.Development of new antiepileptic drugs: challenges, incentives, and recent advances[J].Lancet Neurol,2007,6(9):793
[4]YANG H,TRACEY KJ.Targeting HMGB1 in inflammation[J].Biochim Biophys Acta,2010,1799(1/2):149
[5]王新军,杨如意,周少龙,等.胶质瘤相关性癫痫致痫灶组织中高迁移率族蛋白 B1的表达[J].郑州大学学报(医学版),2015,50(5):634
[6]KANG R,CHEN R,ZHANG Q,et al.HMGB1 in health and disease[J].Mol Aspects Med,2014,40:1
[7]CHEN Y,HUANG XJ,YU N,et al.HMGB1 contributes to the expression of P-glycoprotein in mouse epileptic brain through Toll-like receptor 4 and receptor for advanced glycation end products[J].PLoS One,2015,10(10):e0140918
[8]KWAN P,ARZIMANOGLOU A,BERG AT,et al.Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J].Epilepsia,2010,51(6):1069
[9]李洁,王新军.头皮视频脑电图联合皮层脑电图在难治性癫痫诊治中的价值[J].中国老年学杂志,2015,35(10):2775
[10]LIU F,ZHANG Y,PENG Z,et al.High expression of high mobility group box 1(hmgb1) predicts poor prognosis for hepatocellular carcinoma after curative hepatectomy[J].J Transl Med,2012,10:135
[11]MIHARA T,INOUE Y,WATANABE Y,et al.Improvement of quality-of-life following resective surgery for temporal lobe epilepsy: results of patient and family assessments[J].Jpn J Psychiatry Neurol,1994,48(2):221
[12]KWAN P,BRODIE MJ,LAURENZA A,et al.Analysis of pooled phase Ⅲ trials of adjunctive perampanel for epilepsy:Impact of mechanism of action and pharmacokinetics on clinical outcomes[J].Epilepsy Res,2015,117:117
[13]RICART JJ.Drug-resistant epilepsy[J].N Engl J Med,2011,365(23):2239
[14]HARRIS HE,ANDERSSON U,PISETSKY DS.HMGB1: a multifunctional alarmin driving autoimmune and inflammatory disease[J].Nat Rev Rheumatol,2012,8(4):195
[15]MAGNA M,PISETSKY DS.The role of HMGB1 in the pathogenesis of inflammatory and autoimmune diseases[J].Mol Med,2014,20:138
[16]WALKER L,SILLS GJ.Inflammation and epilepsy: the foundations for a new therapeutic approach in epilepsy?[J].Epilepsy Curr,2012,12(1):8
[17]VEZZANI A.Epilepsy and inflammation in the brain: overview and pathophysiology[J].Epilepsy Curr,2014,14(1 Suppl):3
[18]VOLK H,POTSCHKA H,LÖSCHER W.Immunohistochemical localization of P-glycoprotein in rat brain and detection of its increased expression by seizures are sensitive to fixation and staining variables[J].J Histochem Cytochem,2005,53(4):517
[19]LAZAROWSKI A,CZORNYJ L.Potential role of multidrug resistant proteins in refractory epilepsy and antiepileptic drugs interactions[J].Drug Metabol Drug Interact,2011,26(1):21
[20]YIN Y,LI W,DENG M,et al.Extracellular high mobility group box chromosomal protein 1 promotes drug resistance by increasing the expression of P-glycoprotein expression in gastric adenocarcinoma cells[J].Mol Med Rep,2014,9(4):1439
[21]GALIC MA,RIAZI K,HEIDA JG,et al.Postnatal inflammation increases seizure susceptibility in adult rats[J].J Neurosci,2008,28(27):6904
(2016-07-15收稿 责任编辑徐春燕)
Expression of HMGB1 protein in epileptogenic tissue from patients with temporal lobe intractable epilepsy
CHENChao1),WANGXinjun1),YANGRuyi1),ZHOUShaolong1),WUYuehui1),XIEJingwei1),WANGZhen1),YANGYonghui2)
1)DepartmentofNeurosurgery,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofCerebralPalsyRehabilitation,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
high-mobility group box-1;temporal lobe;intractable epilepsy
Aim: To investigate the expression and clinical significance of high-mobility group box-1(HMGB1) protein in epileptogenic tissue from patients with temporal lobe intractable epilepsy. Methods: Immunohistochemistry and Western blot were used to detect the expression of HMGB1 protein in epileptogenic tissue from 79 cases of temporal lobe intractable epilepsy and contrast brain tissue from 35 cases accepting intracranial decompression.Results: Immunohistochemistry showed that the positive rate of HMGB1 protein in epileptogenic tissue was 86.1%(68/79),higher than that[40.0%(14/35)] in contrast brain tissue(P<0.001);the expression of HMGB1 protein in epileptogenic tissue was related with the duration of epilepsy,seizure time, seizure frequency and seizure type(P<0.05),but not with gender or age(P>0.05).Western blot showed that the expression level of HMGB1 protein in epileptogenic tissue was (1.702±0.158),higher than that(0.912±0.156) in contrast brain tissue(P<0.001).Conclusion: The expression of HMGB1 protein in epileptogenic tissue is significantly increased, which may be associated with the seizure of temporal lobe intractable epilepsy.
10.13705/j.issn.1671-6825.2017.02.017
*河南省医学科技攻关计划项目 201204047
R741.02
