荆州碘泡虫(粘体动物门,碘泡虫科)重描述及其基于18S rDNA 系统发育关系分析
2017-04-06赵子明刘新华赵媛莉章晋勇
赵子明,刘新华,赵媛莉,袁 圣,章晋勇
(1.江苏农牧科技职业学院,江苏泰州 225300;2.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072)
荆州碘泡虫(粘体动物门,碘泡虫科)重描述及其基于18S rDNA 系统发育关系分析
赵子明1,刘新华2,赵媛莉2,袁 圣1,章晋勇2
(1.江苏农牧科技职业学院,江苏泰州 225300;2.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072)
本实验利用现行主流分类衍征,重新对荆州碘泡虫(Myxoboluskinchowensis)进行了详细描述,其分类特征如下:包囊圆形,寄生于鲫肌肉与肾脏,肌肉包囊大小(126.7±1.8) μm,肾脏包囊直径为94.2 μm;两寄生部位各形态参数无显著差异,成熟孢子正面观呈梨形,缝面观呈纺锤形,含一大一小两梨形极囊;无明显囊间突起,孢子后端无褶皱,无粘液膜。组织病理显示在两寄生部位均未引起严重的炎性反应,且感染强度不高,推测该种对宿主无显著影响。基于18S rDNA进化分析发现荆州碘泡虫与寄生在肌肉部位的碘泡虫属种类聚为一个大枝,然后该大枝又根据地理位置远近分为北美枝、欧洲枝以及亚洲枝。通过形态比较研究以及分子分析可确定荆州碘泡虫为有效种,其寄主为鲫,寄生部位为肌纤维间和肾小囊。此外,两组织差异明显的寄生部位出现说明荆州碘泡虫相应的放射孢子虫在宿主鲫体内存在不同的发育与移行途径,而肌肉可能为其常规寄生部位,肾脏为其异常寄生部位,这种寄生部位的转移与宿主转变可能是粘孢子虫物种多样性形成的机制。
粘孢子虫;荆州碘泡虫(Myxoboluskingchowensis);18S rDNA;肾脏;肌肉
粘体动物(Myxozoans)是一类广范存在的动物寄生虫,寄主范围涉及从无脊椎动物到脊椎动物的广泛宿主,迄今报道的3 000余种主要来自鱼类和底栖环节动物[1],该类寄生虫的多样性依然被严重低估是业界的普遍认识,随着研究力度的加大,越来越多的粘体动物会被发现,尤其是寄生于陆生脊椎动物的种类[2]。我国粘体动物(均为粘孢子虫纲种类)多样性丰富,迄今已记述了700余种[3-4],但大多数种类仅限于形态描述,且数据尚不十分充分。由于粘孢子虫形态结构简单、种内形态存在较大变异及种类丰富等因素,种类鉴定及命名过程中产生了大量同物异名或同名异物的现象,需要后续补充描述并修正[5-6]。此外,长期以来我国学者认为粘体动物(粘孢子虫)属原生动物[3,7],而随着认识的深入,尤其是比较基因组学的应用,粘体动物已被普遍认为是一类适应寄生生活的刺胞动物[8]。因此,利用包括形态数据、生态数据(寄主、组织趋向性及地理分布等)与系统发育特征(基于小核糖体RNA)的现行主流粘孢子虫分类衍征[9]就《中国动物志 粘体动物门 粘孢子纲》所描述的种类,尤其是新种进行厘定,对我们深入理解我国水生粘孢子虫多样性及水生动物粘孢子虫病防控等是十分有必要的[1,4-5,9-11]。

1 材料和方法
1.1 样本采集及处理
于2014年7月发现武汉市蔡甸池塘养殖异育银鲫(C.auratusgibelio)口腔附近有疑似粘孢子虫白色包囊状物,收集实验鱼(10尾,体重40.1~84.1 g) 并活体运回实验室,暂养于50 L水族箱中。先用肉眼、放大镜等仔细观察鱼体表、鳃、鳍、肾脏、肝脏、脾脏、肠道等表面是否具有包囊。同时,各器官均取部分组织进行压片,显微观察是否有肉眼不可见的包囊或离散的粘孢子。若发现包囊或孢子,立即用光学显微镜对新鲜孢子进行观察、测量、拍照。同时将所感染的病灶组织分别保存在95%酒精或10%中性福尔马林中,以用于后续的分子或组织病理分析。
1.2 形态学比较
取少量感染组织于盖玻片上,滴少量蒸馏水,置于显微镜下(Olympus BX53)观察、拍照及测量。参照Lom & Arthur[14]建议的描述标准对肾脏和肌肉感染的疑似荆州碘泡虫进行测量和描述,分别测量了成熟孢子长、宽、厚以及极囊长、宽 (n=50)。测量数值均以微米(μm)为单位,以平均值±标准差(变化范围)的形式表示。统计分析主要通过GraphPad Prism5.0软件来完成。应用CorelDraw X6.0 软件绘制模式图。
1.3 组织病理
样品固定48 h后,即按照常规组织学方法进行石蜡切片制作,切片厚度4~6 μm,HE染色,Olympus BX53拍照存档。
1.4 DNA提取、18S rDNA序列的扩增和测定
取部分用95%酒精保存的组织,剪成碎片并用PBS离心洗涤两次以除去残余酒精。利用细胞/组织基因组DNA提取试剂盒(Qiagen,德国)提取样品基因组DNA。18S rDNA序列片段扩增采用引物MyxospecF (TTCTGCCCTATCAACTWGTTG)[13]和18R (CTACGGAAACCTTGTTACG)[15]。PCR反应体系包括1 μL DNA,12.5 μL 1× PCR mixture (康为,北京),正反引物各1 μL (10 μmol/L),然后加双蒸水至25 μL体系。反应程序为94 ℃预变性4 min,35个循环:94 ℃ 变性1 min;46 ℃ 退火50 s;65 ℃延伸90 s;65 ℃终延伸10 min。PCR产物经1%琼脂糖凝胶电泳后,用胶回收试剂盒(康为,北京)纯化回收,将目的片段连接到PMD18-T载体(Takara,日本),再转化到感受态细胞DH5α中,50 μL/mL氨苄青霉素的LB 固体培养基均匀涂布并培养过夜,挑取阳性克隆,用于测序。测序在自动测序仪ABI PRISM®3730 DNA Sequencer (Applied Biosystems USA)上完成。测序结果通过BioEdit[16]进行拼接,并根据测序峰图人工校正(DNASTAR INC.,Madisom,Wis),将拼接完毕的序列提交至GenBank。
1.5 系统发育关系分析
将所获得序列通过NCBI网站进行BLAST分析,并从GenBank上选取部分粘孢子虫18S rDNA序列数据进行系统发育树的构建。选取萨氏新角形虫(CeratonovaShasta)(GenBank登录号AF001579)为外群。利用CLUSTAL 1.8[17]对选取的序列进行多重比对。分别利用最大似然法 (Maximum Likehood,ML) 和贝叶斯法 (Bayesian Inferences,BI) 进行系统发育分析。通过jModelTest[18]挑选最佳核苷酸替代模型应用于ML和BI分析。ML分析利用PhyML 3.0[19]软件进行运算100代。BI分析利用Mr.Bayes[20]软件进行操作,以随机树 (Random)为起始树,替换模型参数Nst为6,马尔科夫链的蒙特卡洛方法 (Markov Chain Monte Carlo process) 设置为4条链同时运行1 000 000代, 获得的系统发育树用Treeview1.6[21]和Adobe Illustrator (Adobe Systems Inc.美国) 编辑、注释。
2 结果
寄生虫检查发现鲫口腔附近出现的白色囊肿是大量的扁弯口吸虫(Clinostomumcomplanatum)的囊蚴寄生所致,感染率100%,平均感染强度为122个囊蚴每条鱼,但感染鱼的饱满度并未受显著影响 (未发表数据)。涂片发现脾脏、肝脏、肾脏、肌肉均有粘孢子虫感染,其中肌肉和肾脏发现的种类形态相似,疑是荆州碘泡虫,而脾脏与肝脏发现的粘孢子虫形态差异明显(另文分析)。
2.1 形态学描述
由于肌肉中孢囊过小且少,采用双玻片法观察,可见肌肉中有极少量包囊,呈圆形,直径约为(126.7±1.8 μm) (n=3),小心分离出现包囊肌肉组织用于组织学观察,但切片中仅发现散在于肌细胞间的成熟孢子 (图1)。肾脏中发现的包囊也呈圆形,最大的直径可达到94.2 μm (图 1)。肌肉与肾脏的孢子形态非常相似,成熟孢子正面观呈梨形,侧面观呈纺锤形,均含一大一小的梨形极囊,详细形态分类参数如下:肌肉寄生的孢子长(11.2±0.55)μm(9.8~12.1 μm),宽(8.6±0.62)μm(7.1~9.7 μm),厚(6.6±0.36)μm(5.9~7.4 μm),极囊大小不等,呈梨形,大极囊长为(6.8±0.51)μm(5.8~7.7 μm),宽为(3.4±0.33)μm(2.9~4.1 μm),小极囊长(5.8±0.60)μm(4.8~7.0 μm),宽(2.7±0.41)μm(1.9~3.6 μm),极丝圈数不等,其中大极囊长为8~9圈,而小极囊为5~6圈(图2,3)。肾脏寄生的孢子形态大小与肌肉寄生的相差不大,统计分析差异不显著(图4),孢子长(10.8±0.52)μm(10.0~12.1 μm),宽(8.3±0.53)μm(6.0~9.4 μm),厚(6.4±0.28)μm(5.5~7.1 μm),大极囊长(6.8±0.45)μm(5.2~8.0 μm),宽(3.2±0.29)μm(2.4~3.7 μm),小极囊长(5.6±0.52)μm(4.6~7.1 μm),宽(2.6±0.29)μm(2.0~3.4 μm),极丝圈数与肌肉上发现的一致。成熟孢子均无明显囊间突起,孢子后端也无褶皱,粘液膜未观察到(图2,3,4)。两处寄生的孢子形态与荆州碘泡虫基本相似 (表1),但肾脏发现的在大小上与《中国动物志,粘体动物门,粘孢子虫纲》[3]的描述更接近。荆州碘泡虫各次记述及与相似种的形态参数比较,见表1。
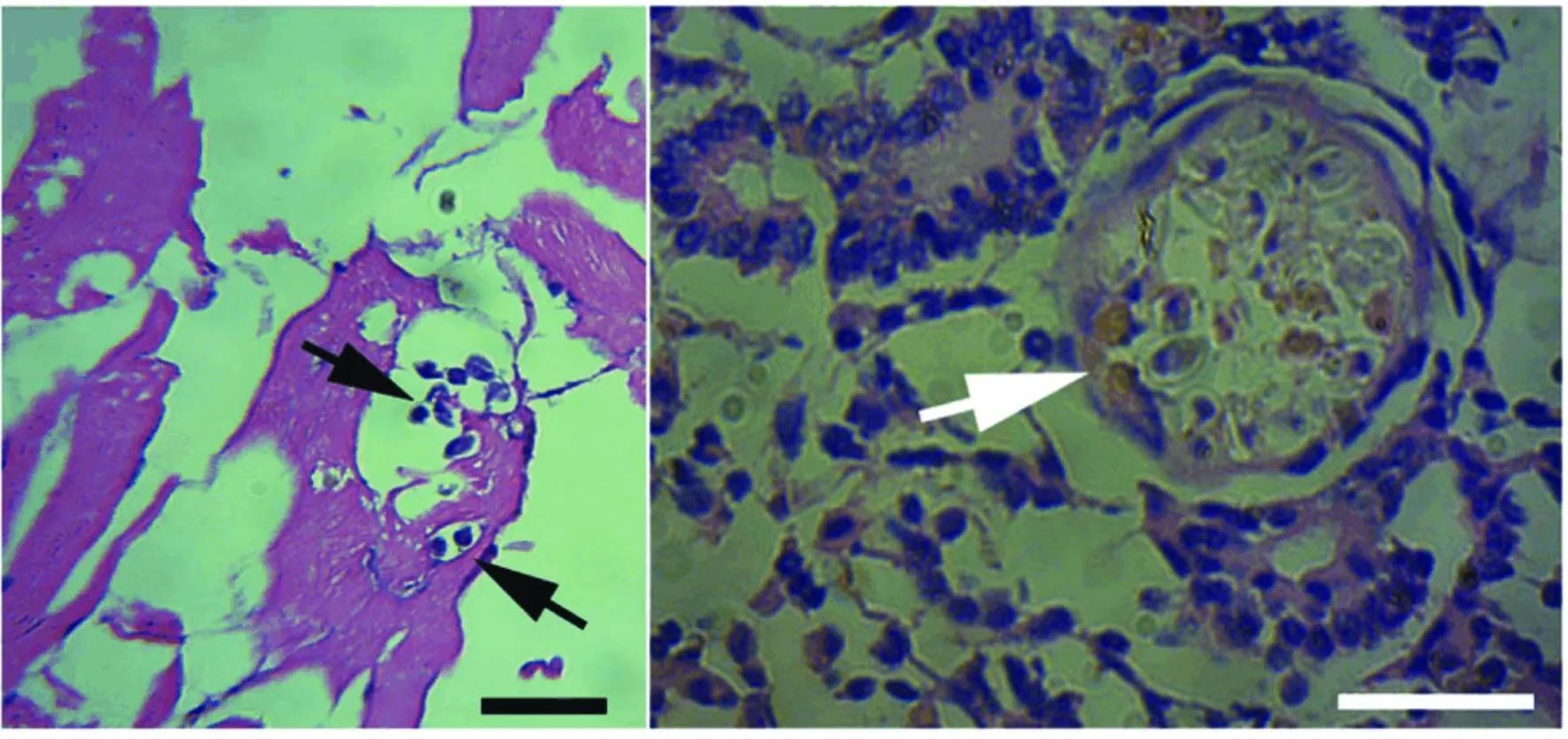
图1 荆州碘泡虫寄生于肌肉与肾脏病理切片.Fig.1 Histopathology of infected muscle and kidney ofC.auratus gibelio by M.kinchowensis.
示孢囊破碎后散在于肌细胞间的成熟孢子(黑色箭头),比例尺=20 μm (左);示寄生于肾小囊的孢囊,比例尺=40 μm (右)。

图2 荆州碘泡虫孢子形态.Fig.2 The spore of M.kinchowensis. (a) 壳面观,比例尺=10 μm;(b) 缝面观,比例尺=10 μm.

图3 荆州碘泡虫模式图.Fig.3 The schematic drawing of M.kinchowensis. (a)壳面观;(b)缝面观;比例尺=5 μm.

图4 寄生在肌肉和肾脏荆州碘泡虫形态学统计分析Fig.4 The statistical analysis of morphometrical differences between kidney and muscle isolates of M.kinchowensis.
2.2 组织病理
组织病理观察发现,肌肉寄生荆州碘泡虫由于压片后分离的组织破碎,未见完整的包囊结构,成熟孢子分布于于肌间,肌纤维几乎保持完整,未见明显的病理变化;而肾脏寄生荆州碘泡虫可见完整包囊位于肾小囊中,包囊外包一层上皮细胞,肾小管及肾实质保持完整,未见显著的炎性反应(图1)。
2.3 分子分析
采用粘孢子虫通用引物成功扩增出其SSU rDNA部分序列,其中肌肉荆州碘泡虫为1 717 bp,而肾脏的为1 712 bp,二者进行比对发现相似性达到99.4%。将二者在NCBI中进行BLAST发现,与以下种类相似性较高:肌肉碘泡虫(M.musculi,93%,JQ388891)、饼形碘泡虫(M.artus,93%,
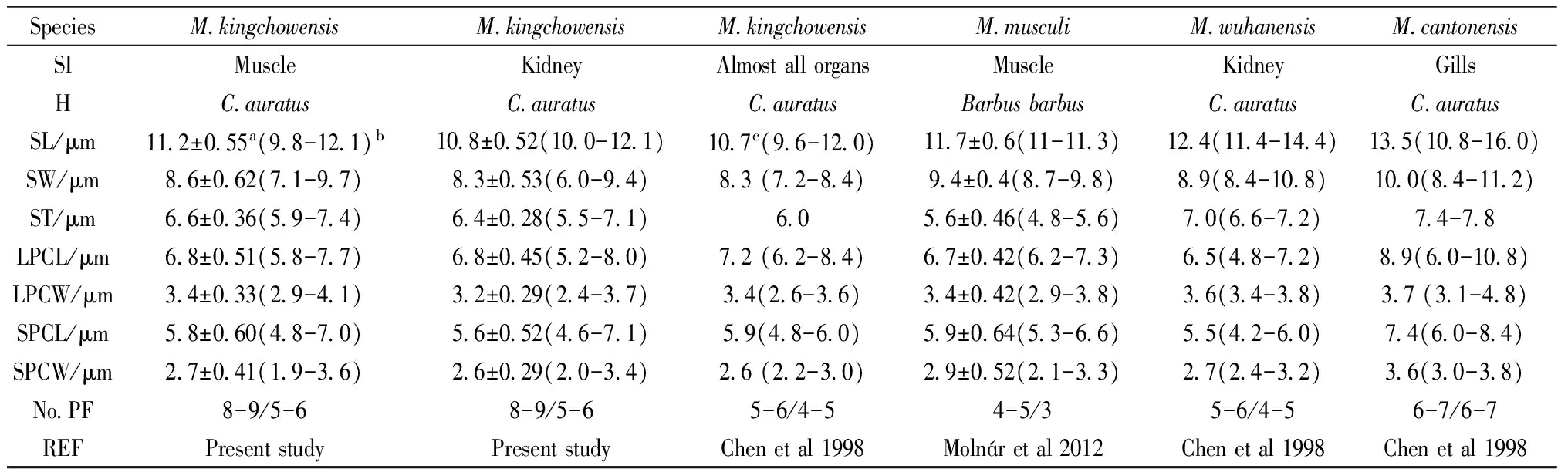
表1 荆州碘泡虫与其他相似种类形态学比较
注:a均值±方差;b最小值-最大值;c均值;SI:寄生部位;H:宿主;SL:孢子长;SW:孢子宽;ST:孢子厚;LPCL:大极囊长;LPCW:大极囊宽;SPCL:小极囊长;SPCW:小极囊宽;NO.PF:极丝圈数;REF:参考文献。
FJ710799)、鲤碘泡虫(M.cyprini,93%,AF380140),军刀碘泡虫(M.pelecicola,92%,KP241961),假异形碘泡虫(M.pseudodispar,92%,AF380142) 等,其中最高相似性为93%,远低于种内相似性水平。系统发育关系分析发现荆州碘泡虫与寄生在肌肉的碘泡虫属种类聚为一个大枝,而后又根据地理位置远近分为北美枝、欧洲枝以及亚洲枝(图5)。

图5 基于荆州碘泡虫 SSU rRNA基因构建所得的贝叶斯树(BI).Fig.5 Phylogenetic tree generated by Bayesian analysis of aligned partial SSU rRNA gene sequences ofM.kinchowensis and related species,rooted at Ceranova shasta. 各分支上的数值依次为BI法产生的后验概率和ML法产生的置信度值;荆州碘泡虫以粗体表示
分类学信息:
荆州碘泡虫M.kingchowensisMa & Chen,1963.
宿主:异育银鲫C.auratusgibelio(Bloch).
采样地点:武汉市蔡甸区.
寄生部位:肌肉和肾脏.
宿主大小:体重40.1~84.1 g.
感染率:肾脏50% (5/10)、肌肉20% (2/10).
样本保存:10%福尔马林固定标本保存于中科院水生生物研究所鱼病研究室,标本号:MTR201407301、MTR201407302.
GenBank序列号:KP400624、KP400625.
3 讨论
碘泡虫属是粘孢子虫中种类数量最多的一个属,目前在中国已报道300多种[3,10-11]。早期的碘泡虫属的鉴定均仅是通过经典形态学比较鉴定,而没有将组织趋向性和宿主特异性这两个重要分类特征考虑进去,导致在我国所记载的许多种类存在多宿主、多组织器官寄生的现象,因而造成许多隐存种的存在[3,12]。同时,早期报道记录的种类由于缺少分子数据的支持,从而出现许多同名异物、同物异名的现象,如此前鲫寄生的圆形碘泡虫 (Myxobolusrotundus) 被鉴定为同名异物种,将其重新命名为丑陋圆形碘泡虫(M.turpisrotundus),嗜鳔碘泡虫(M.physophilus)为伯麦碘泡虫(M.permagnus)的同物异名种,取消伯麦碘泡虫,信阳单极虫(Thelohanllusxinyangensis)被厘定为吉陶单极虫(T.kitauei),官桥碘泡虫(M.guanqianensis)被纠正为吴李碘泡虫(M.wulii)等等[3,5-6]。值得指出的是,早期文献交流不畅也是导致粘孢子虫分类及鉴定混乱的一个重要原因。
荆州碘泡虫在《中国动物志,粘体动物门,粘孢子纲》[3]中的记述非常简单,并存在多宿主、多寄生部位的描述,且缺乏分子证据的支持,因此其作为新种描述有必要根据现行的粘孢子虫分类标准予以厘定并确定其分类的有效性[3]。我们此次在异育银鲫肌肉和肾脏所发现碘泡虫属种类,通过形态学比较及分子系统发育分析发现,两者均为荆州碘泡虫,其成熟孢子形态大小与原始记载虽略有差异,如肌肉上发现的较肾脏以及原始记载的孢子要长,而孢子宽、厚却相差不大,同时原始记载的极丝圈数较少,大极囊5~6圈,而小极囊4~5圈,这可能与当时显微镜分辨率不高有关。在此次研究中,我们所观察到的大极囊圈数为8~9圈,小极囊圈数为5~6圈,但均在种内形态变异范围内。肌肉碘泡虫(M.musculi)主要是在欧洲报道,早期将荆州碘泡虫鉴定为肌肉碘泡虫主要是基于寄生部位而言,但其宿主以及形态大小均与荆州碘泡虫存在较大差异,18S rDNA比对发现二者相似性只有93%,这更进一步说明早期鉴定有误,也说明荆州碘泡虫的有效性[22]。其它与荆州碘泡虫形态相似的种类还有寄生在鲫肾脏的武汉碘泡虫(M.wuhanensis)以及寄生在鲫鳃上的广州碘泡虫(M.cantonensis)[4]。武汉碘泡虫在肾脏未观察到包囊结构,同时其大小、极囊极丝圈数均较荆州碘泡虫少;广州碘泡虫孢子长、宽、厚均较荆州碘泡虫要大,两个极囊也较大,但极丝圈数却少于荆州碘泡虫。此外广州碘泡虫寄生在鲫鱼鳃上,而荆州碘泡虫寄生在肾脏和肌肉。
组织寄生粘孢子虫的严格组织趋向性(Tissue tropism)或特异性(tissue specificity)已成为学界共识[23],但根据现行的粘孢子虫分类标准,近年来频频发现同一种类存在多个寄生部位,如吴李碘泡虫同时寄生于鲫肝脏和金鱼鳃丝[6],吉陶单极虫可同时寄生于鲤肠道与皮肤[24]。粘孢子虫感染鱼类主要通过水柱中的放射孢子虫来完成[25],水柱中的感染源放射孢子虫通过鱼体表、皮肤的粘液细胞始发感染,在这个阶段抗性宿主和易感宿主在相同栖息地受感染的几率是一样的,区别在于侵染后,抗性宿主自身的免疫机制可阻断来自放射孢子虫的感染性胚质的发育及移行至合适的寄生部位,这也是混养不同品种可降低易感品种粘孢子虫病发病率与强度的理论基础[23]。但迄今人们对粘孢子虫寄生部位多样性选择(鱼体几乎每个器官都能被不同粘孢子虫寄生)机制或决定不同粘孢子虫选择不同的寄生部位的关键因子缺乏了解。迄今发现最多类型的三突放射孢子虫对应的粘孢子虫可寄生多种组织器官[23],这是否可推断出粘孢子虫多宿主、多部位寄生与不同类型的放射孢子虫有关?我们认为决定这种选择多样性是由于粘孢子虫-鱼之间的相互作用,且这种选择是可以改变的,即存在感染部位的转变(infection site-shift),与同一粘孢子虫存在宿主转变(host-shift) 一样,这可能是粘孢子虫物种多样性形成的基础[26]。本研究发现存在于肾脏中的荆州碘泡虫包囊,可以排除肾脏中的孢子不是寄生于肌肉中的荆州碘泡虫“老化”后通过排泄系统离开(shedding)而出现的,而是进入宿主的感染性放射孢子虫胚质在经历不同的宿主免疫(环境)压力后选择了不同的发育与移行途径。因此,我们建议在物种鉴定及命名过程中,需要有物种形成是进行时而非完成时的概念,尤其是对于进化速率较快的寄生微生物而言。
综上所述,本研究不仅鉴定了荆州碘泡虫的有效性,还补充了其形态学数据以及系统发育关系,同时也为后续粘孢子虫分类学研究提供了几点思考。
[1]Lom J & DykováI.Myxozoan genera:definition and notes on taxonomy,life-cycle terminology and pathogenic species[J].Folia Parasitol,2006,53:1-36.
[2]Székely C,Atkinson SD,Molnár K,et al.2016.A synopsis of records of myxozoan parasites (Cnidaria:Myxozoa) from shrews,with additional data onSoricimyxumfegatifrom common shrewSorexaraneusin Hungary and pygmy shrewSorexminutusin Slovakia[J].Folia Parasitol,2016,63:21.
[3]陈启鎏,马成伦.中国动物志,粘体动物门,粘孢子纲[M].北京:科学出版社,1998.
[4]周 杨.中国近海部分海水鱼类寄生粘孢子虫的分类学研究与地理分布[C].重庆:重庆师范大学,2007.
[5]Zhang J Y,Wang J G,Li A H,et al.Infection ofMyxobolusturpisrotundussp.n.in allogynogenetic gibel carp,Carassiusauratusgibelio (Bloch),with revision ofMyxobolusrotundus(s.l.) Nemeczek reported fromC.auratusauratus(L.)[J].J Fish Dis,2010,33:625-638.
[6]Zhang J Y,Yokoyama H,Wang J G,et al.Utilization of tissue habitats byMyxoboluswuliiLandsberg & Lom,1991 in different carp hosts and disease resistance in allogynogenetic gibel carp:redescription ofM.wuliifrom China and Japan[J].J Fish Dis,2010,33:57-68.
[7]沈韫芬.原生动物学[M].北京:科学出版社,1998.
[8]Chang E S,Neuhof M,Rubinstein N D,et al.Genomic insights into the evolutionary origin of Myxozoa within Cnidaria[J].PNAS,2015,112(48):12-17.
[9]Atkinson S D,Bartošová S P,Whipps C M,et al.Approach for characterizing Myxozoan species.In Myxozoan Evolution,Ecology and Development by Okamura B,Gruhl A & Bartholomew J L[M].Springer International Publishing,2015,London:111-123.
[10]Eiras J C,Molnár K,Lu Y S.Synopsis of the species ofMyxobolusBǖtschli,1882 (Myxozoa:Myxosporea:Myxobolidae)[J].Syst Parasitol,2005,61 (1):1-46.
[11]Eiras J C,Zhang J Y,Molnár K.Synopsis of the species ofMyxobolusBǖtschli,1882 (Myxozoa:Myxosporea:Myxobolidae) described between 2005 and 2013[J].Syst Parasitol,2014,88 (1):11-36.
[12]Molnár K.Site preference of fish myxosporeans in the gill[J].Dis Aquat Org,2002,48:197-207.
[13]Fiala I.The phylogeny of Myxosporea (Myxozoa) based on small subunit ribosomal RNA gene analysis[J].Int J Parasitol,2006,36:1521-1534.
[14]Lom J,Arthur J R.A guideline for preparation of species descriptions in Myxosporea[J].J Fish Dis,1989,12:151-156.
[15]Whipps C M,Adlard R D,Bryant M S,et al.First report of threeKudoaspecies from eastern Australia:Kudoathyrsitesfrom mahimahi (Coryphaenahippurus),KudoaamamiensisandKudoaminithyrsitesn.sp.from sweeper (Pempherisypsilychnus)[J].J Eukaryot Microbiol,2003,50:215-219.
[16]Hall T A.BioEdit:a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J].Nucleic Acids Symp Ser,1999,41:95-98.
[17]Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL-X window interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,25:4876-4882.
[18]Posada D.jModelTest:phylogenetic model averaging[J].Mol Biol Evol,2008,25:1253-1256.
[19]Guindon S,Dufayard J F,Lefort V,et al.New algorithms and methods to estimate maximum likelihood phylogenies:assessing the performance of PhyML 3.0[J].Syst Biol,2010,59:307-321.
[20]Ronquist F,Huelsenbeck J P.Mr Bayes 3:Bayesian phylogenetic inference under mixed models[J].Bioinformatics,2003,19:1572-1574.
[21]Page R D M.TREEVIEW:an application to display phylogenetic trees on personal computers[J].Comput Appl Biosci,1996,12:357-358.
[22]Molnár K.,Eszterbauer E,Marton S,et al.Comparison of theMyxobolusfauna of common barbell from Hungary and Iberian barbell from Portugal[J].Dis Aquat Org,2012,100:231-248.
[23]Molnár K.,Eszterbauer E.Specificity of Infection Sites in Vertebrate Hosts.In:Okamura B,Gruhl A,Bartholomew J L,Myxozoan Evolution,Ecology and Development[M].Springer International Publishing,2015,London:295-313.
[24]Zhai Y H,Gu Z M,Guo Q X,et al.New type of pathogenicity ofThelohanelluskitaueiEgusa & Nakajima,1981 infecting the skin of common carpCyprinuscarpioL[J].Parasitol Int,2016,65:78-82.
[25]Wolf K,Markiw M E.Biology contravenes taxonomy in the Myxozoa:new discoveries show alternation of invertebrate and vertebrate hosts[J].Science,1984,225:1449-1452.
[26]Forró B,Eszterbauer E.Correlation between host specificity and genetic diversity for the muscle-dwelling fish parasiteMyxoboluspseudodispar:examples of myxozoan host-shift[J].Folia Parasitol,2016,63:19.
(责任编辑:张潇峮)
Redescription and phylogenetic analysis based on 18S rDNA ofMyxoboluskinchowensis(Myxozoa:Myxobolidae)
ZHAO Zi-ming1,LIU Xin-hua2,ZHAO Yuan-li2,YUAN Sheng1,ZHANG Jin-yong2
(1.JiangsuAnimalHusbandry&VeterinaryCollege,Taizhou,225300Jiangsu,China;2.StateKeyLaboratoryofFreshwaterEcologyandBiotechnology,InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,China)
MyxoboluskingchowensisMa & Chen,1963 was originally described from multi-organs of several cyprinid fishes with insufficient data which should be supplemented and validated by current taxonomic criteria.The morphological features of the concerned species are as follows:plasmodia dwelling in trunk muscle and renal capsule,with diameter of 126.7±1.8 μm and 94.2 μm in maximum,respectively;no significant differences among all taxonomic parameters of two isolates;mature spores were pyriform in frontal view and fusiform in sutural view,with tapering anterior end and round posterior end;spore surface smooth with thick straight sutural ridge;polar capsule,unequal,locating in the anterior part of spores;no significant intercapsular process,edge marking on the spore posterior end and mucus envelope surrounding the spore valves.Histopathological observations showed that no significant inflammatory responses occurred in both kidney and muscle,so it can be assumed that the infection of this species has no significant detrimental effects on host taking the low infection intensity into account.Phylogenetic analysis showed thatM.kingchowensisclustered with several muscle-infectingMyxobolusspecies and formed an independent clade among cyprinid-infecting species,and showing a tendency to cluster according to the geographical distribution of their fish hosts.In addition,the occurrence of two infection sites forM.kingchowensisindicated that there are two routes of migration and development after the invasion of the fish host by infective actinospores.However,muscle is the primary infection site and kidney the secondary site.We thought that this infection site-shift and host-shift are the possible mechanisms of the occurrence of high species diversity of fish myxosporean parasites.
Myxosporea;Myxoboluskingchowensis;18S rDNA;kidney;muscle.
2016-07-22;
2016-10-08资助项目:江苏省水产三新工程项目(D2015-11);国家自然科学基金(31472296);江苏农牧科技职业学院课题(NSFRC1304、00010115018)
赵子明(1962- ),男,副教授,主要从事鱼类生物学与养殖技术研究。E-mail:zzm0282678@163.com 通讯作者:章晋勇。E-mail:zhangjy@ihb.ac.cn
S941.5
A
1000-6907-(2017)02-0079-07
