煅烧温度对溶胶−凝胶法制备的Li2FeSiO4/C正极材料性能的影响
2017-04-06义丽玲王先友白艳松刘梅红
义丽玲,王先友,白艳松,王 钢,刘梅红
煅烧温度对溶胶−凝胶法制备的Li2FeSiO4/C正极材料性能的影响
义丽玲1, 2,王先友1, 2,白艳松1, 2,王 钢1, 2,刘梅红1, 2
(1. 湘潭大学化学学院电化学能源储存与转换湖南省重点实验室,湘潭411105;2. 湘潭大学化学学院新能源装备及储能材料与器件国家国际科技合作基地,湘潭411105)
采用溶胶−凝胶法合成锂离子电池正极材料Li2FeSiO4/C,研究煅烧温度对材料结构和电化学性能的影响。通过X射线衍射(XRD)、扫描电镜(SEM)、电化学阻抗测试(EIS)和充放电测试等方法对不同煅烧温度下合成的Li2FeSiO4/C材料的结构、表观形貌及电化学性能进行表征。结果表明:在650℃下合成的Li2FeSiO4/C具有良好的电化学性能,0.1倍率下的首次放电比容量达到159.1 (mA∙h)/g,50次循环后容量保持率高达92.1%。
Li2FeSiO4/C;正极材料;锂离子电池;溶胶−凝胶法
锂离子电池以其高能量密度、高放电电压、比容量大、自放电率低、无记忆效应和无污染等优点受到世界各国的广泛关注。其中,聚阴离子型正极材料具有原料资源丰富、价格便宜、无吸湿性、无毒、环境友好、热稳定性好、安全性高等优点,有望成为下一代锂离子电池的正极材料[1]。Li2FeSiO4由于其主要元素Si在地球上元素中含量第一、对环境和人类都没有危害,且Li2FeSiO4相对于LiFePO4具有原料价格更低廉、与环境的亲和性更好等优势,被认为是最具潜力的锂离子电池正极材料之一[2−4]。
采用Li2FeSiO4作为锂离子电池正极材料最早来源于2000年ARMAND等[5]的专利。Li2FeSiO4理论比容量为166 (mA∙h)/g,其放电平台在3.1 V左右,与同为聚阴离子化合物的磷酸铁锂相似,Li2FeSiO4的电导率不高,致使其电化学性能不理想,且锂离子扩散速率较慢,成为制约其发展为可商业化高能锂电池材料的一道屏障。因此,各国学者和产业界通过多种方法对Li2FeSiO4正极材料进行了研究和改性。主要采用高温固相法、水热法及微波法等方法来改善Li2FeSiO4的性能。NYTÉN等[6]用FeC2O4和Li2SiO3为原料,以碳凝胶为碳源,在还原气氛下通过高温固相法合成了正交结构的Li2FeSiO4/C材料,在60℃下循环8次后,其放电比容量维持在130 (mA∙h)/g,具有良好的高温循环性能。杨金龙等[7]以LiOH·2H2O、Fe(NO3)3·9H2O和(C2H5O)4Si为原料,以抗坏血酸为碳源,通过水热法在200℃下反应6 d得到前驱体,在惰性气氛中通过600℃煅烧合成了纳米棒状的Li2FeSiO4/C材料,其首次放电比容量为137 (mA∙h)/g;20次循环后,其容量基本无衰减。胡国荣等[8]采用微波法制备了Li2FeSiO4材料,在60℃下,其首次放电比容量为119 (mA∙h)/g。然而,上述工艺均较复杂,原材料昂贵,而且大部分研究中所制备的材料含有杂质相,并且电化学性能还有待提高。
采用溶胶−凝胶法制备碳掺杂的Li2FeSiO4是一种非常简单有效的手段,该方法能使原料在分子尺度内混合均匀,从而有利于制备出高结晶度的Li2FeSiO4。研究表明,通过减小粒子尺寸和碳掺杂能够有效地缩短锂离子的扩散路径,提高锂离子电池正极材料的电子导电性,进而改善材料的电化学性能[9−12]。本文作者基于溶胶−凝胶法制备Li2FeSiO4/C正极材料,并对其进行结构和形貌及电化学性能测试和分析,考察煅烧温度对材料结构和电化学性能的影响。
1 实验
1.1 样品的制备
采用溶胶−凝胶法合成Li2FeSiO4/C正极材料,按化学计量比将Fe(NO3)3·9H2O、CH3COOLi·2H2O和柠檬酸分别加入到200 mL去离子水中,形成均一溶液,再向溶液中加入溶于C2H5OH的(C2H5O)4Si。在室温下磁力搅拌3 h使(C2H5O)4Si缓慢水解交联,然后在80℃油浴条件下反应12 h形成凝胶。随后将所得前驱体置于真空干燥箱中,经100℃真空干燥24 h。最后将所得前驱体置于管式炉中,在氩气保护下350℃恒温加热2 h,再分别在600、650和700℃下煅烧10 h,自然冷却至室温后,即得到Li2FeSiO4/C正极材料,分别记为LFS-600、LFS-650和LFS-700。
1.2 材料的表征和性能测试
采用日本Rigaku公司生产的D/Max−3C型X射线自动衍射仪进行物相分析,以Cu K1为射线源,扫描范围为10°~80°,扫描速率为4 (°)/min,管电压为40 kV,管电流为40 mA。用S−4800型扫描电子显微镜(SEM)在20 kV下进行表面形貌分析。采用德国Elementar公司生产的Vario EL Ⅲ型元素分析仪对材料的碳含量进行测试。用美国TA公司生产的SDT Q600型热分析仪对样品进行TG−DTG测试,用N2作保护气体,温度范围为25~850℃,升温速率为 5℃/min。
1.3 材料的电化学性能测试
将Li2FeSiO4/C正极材料、聚偏氟乙烯(PVDF)、乙炔黑和石墨按质量比80:10:5:5混合,分散于适量N-甲基吡咯烷酮(NMP)有机溶剂中,混合均匀,制备浆状物质,并均匀涂在预处理过的铝箔上,置于真空干燥箱中,经110℃真空干燥12 h。在充满高纯氩气的手套箱中,将所得极片作为正极,锂片作为对电极,微孔聚丙烯(Celgard 2400)作为隔膜,以1 mol/LLiPF6/EC+DEC(LiPF6/EC与DEC的体积比为1:1)为电解液,组装成CR2025型扣式电池。用新威电池测试系统、对电池进行电化学测试,充放电终止电压为1.5~4.8 V,本实验中采用VersaSTAT 3电化学工作站测试不同样品的交流阻抗谱,电位振幅5 mV,频率范围为1×105~1×10−2Hz。所有的电化学测试都在室温下进行。
2 结果与讨论
为了研究合成过程中材料的热稳定性,对所制备的Li2FeSiO4/C前驱体在氮气下以5 ℃/min的升温速率进行热分析,其结果如图1所示。从图1可知,升温过程大致可以分为4个阶段,即1) 25~180℃;2) 180~350℃;3) 350~600℃;4) 600~850℃。第一阶段的质量损失约为7%,对应的DTG曲线出现了一个较小的吸热峰,主要是样品中吸附水的蒸发和硝酸铁中结晶水的脱出[13]。第二阶段的质量损失较为明显,约为36%,对应的DTG曲线出现了一个较大的吸热峰,主要是柠檬酸和乙酸盐的分解[14]。第三阶段的质量损失约17%,对应的DTG曲线出现了一个较明显的吸热峰,可能是有机酯类的分解[15]。第四阶段的TG曲线趋于平稳,对应的DTG曲线出现了一个较小的吸热峰(650 ℃),表明在这个温度下形成了硅酸铁锂。根据以上结果,选定样品在350℃煅烧2 h,然后分别在600、650和700℃这3个温度下煅烧10 h,探讨Li2FeSiO4/C正极材料的最佳合成条件。

图1 Li2FeSiO4/C前驱体的TG−DTG曲线
图2所示为不同煅烧温度下合成的Li2FeSiO4/C的XRD谱。由图2可以看出,3组样品的衍射峰均与文献[16]的报道一致,属于单斜结构,空间群为21,且没有检测到铁的氧化物、Li2SiO3、LiFeSi2O6和Fe2SiO4等杂质相。图2中尖锐的衍射峰表明样品结晶度较高,晶粒发育完善。650和700℃时制备的Li2FeSiO4/C的衍射峰比600℃时的更为尖锐,衍射峰半峰宽呈减小趋势,表明随着制备温度的升高,Li2FeSiO4/C的晶粒不断长大,结晶也更为完整[17]。晶粒的尺寸可由如下的Sherr公式计算:
式中:为所规定晶面族法向的晶粒尺寸(晶粒线度);为X射线波长;为半峰宽(因晶粒尺寸造成的衍射峰增宽量);=0.9。
经Sherr公式计算,LFS-600、LFS-650和LFS-700的半峰宽分别为0.358、0.174和0.259,其中LFS-650的半峰宽最小,表明其结晶性最好,从图2中Li2FeSiO4/C的(111)衍射峰的半峰宽(FAW)计算出晶粒的平均粒径为228.4 nm。此外,在图2中未见碳的衍射峰,表明掺杂的碳是无定型的,且量小,对Li2FeSiO4的晶体结构没有影响。元素分析结果表明:LFS-600、LFS-650和LFS-700的碳含量分别为10.71%、10.06%和8.9%(质量分数)。

图2 不同煅烧温度下制备的Li2FeSiO4/C的XRD谱
图3所示为不同煅烧温度下制备的Li2FeSiO4/C的SEM像。从图3可见,样品LFS-600的晶粒尺寸分布不均匀,最大粒径超过1 μm,最小粒径小于100 nm,并且存在明显的团聚现象;样品LFS-650的晶粒结晶良好,晶粒细小,分布均匀,形貌规则为类球 型,尺寸约为50~200 nm。随着温度进一步提高到 700℃,得到的样品出现明显团聚现象,分布不均匀,形貌不规则,颗粒变大,而颗粒粒径较大将不利于锂离子在材料中的扩散。这说明Li2FeSiO4/C颗粒尺寸随着温度升高增大,然而温度过高会导致晶粒粒径太大,不利于锂离子在材料晶格中的扩散,从而影响材料的电化学性能。
图4所示为不同煅烧温度下制备的Li2FeSiO4/C正极材料的第1、2和5次放电曲线。由图4可以看 出,随着煅烧温度从600℃升高到650℃,首次放电比容量逐渐增加,600℃时首次放电比容量为155.2 (mA∙h)/g;650℃时放电比容量达到最高值,为159.1 (mA∙h)/g;然而当温度高于650℃时,放电比容量反而呈下降趋势,700℃时放电比容量下降为150.4(mA∙h)/g。3个材料首次充放电曲线都在3.1 V左右出现充电平台,第2次充电平台下降到2.8 V,第5次放电平台与第2次基本保持一致。这是由于Li2FeSiO4/C电极首次充放电后材料的结构发生了重排,形成稳定的结构,而随后结构趋于稳定,这有利于提高材料的循环寿命。在650℃制备的Li2FeSiO4/C正极材料电压平台性能最好,平均放电电压为2.8 V。

图3 不同煅烧温度下制备的LFS-600、LFS-650和LFS-700的SEM像
图5所示为不同温度下合成的样品的循环性能图。由图5可知,600、650和700℃下合成的Li2FeSiO4/C的首次放电比容量分别为155.2、159.1和150.4 (mA∙h)/g,50次循环后容量保持率分别为86.8%、92.1%和82.2%。显然,本研究中Li2FeSiO4/C正极材料具有较为优异的电化学性能,向楷雄等[18]报道的离子掺杂和碳修饰对Li2FeSiO4结构和性能的影响,在/32倍率下,其首次放电比容量为149 (mA∙h)/g,10次循环后容量保持率为95.30%;赵青等[19]用微乳液法制备了锂离子电池正极材料Li2FeSiO4/C,在/8倍率下,其首次放电比容量为139 (mA∙h)/g,20次循环后其容量保持率为81.2%;彭忠东等[17]用微波合成了锂离子电池正极材料Li2FeSiO4/C,在/20倍率下,其首次放电比容量为121.7 (mA∙h)/g,10次循环后,其容量保持率为97.9%。通常说来,样品的循环性能与材料的结晶程度、晶型和粒径密切相关,结合XRD和SEM测试结果可知,LFS-600的结晶度较低,Li+的迁移隧道在充放电过程中不稳定,使其循环性能较差。而LFS-700的晶粒是3个样品中最大的,晶粒越大,扩散距离越长,这也不利于Li+离子嵌入脱出。综合上述因素的影响,650℃合成的样品结晶程度较高,且粒子大小均一、粒度适中,从而减小了锂离子的扩散阻力,提高了Li2FeSiO4/C正极材料的电化学性能[20]。

图4 不同煅烧温度下制备的LFS-600、LFS-650和LFS-700在0.1C下的充放电性能曲线

图5 不同煅烧温度下制备的Li2FeSiO4/C在0.1C倍率下的循环性能
图6所示为Li2FeSiO4/C正极材料的交流阻抗图谱。从图6可知,交流阻抗谱由高频区的半圆和低频区的斜线组成。通常认为,高频区半圆在轴上的截距欧姆电阻,是材料的欧姆电阻和电解液的欧姆电阻等的总和;高频区半圆半径表现为电解液/电极界面在电荷转移过程中所引起的电荷转移电阻ct。ct越小,Li+越容易穿过活性材料与电解液之间的界面[21]。低频区的斜线对应Li+在电极材料中的扩散,即Warburg阻抗(W)。图6中插图所示为拟合阻抗谱数据的等效电路图,拟合后的元件数值见表1(其中,为界面双电层电容;为幂指数,当=1,代表理想电容;当=0,代表纯电阻,如果指数接近1,值可以看作是对电容的测量)。结合图6和表1可知,3个样品的电荷转移电阻(ct)分别为83.431、51.998和111.081 Ω。可见LFS-650的电荷转移电阻值最小,并且欧姆电阻(s)也是最小,从而有利于提高和改善在充放电过程中锂离子传输和反应动力学特性,提高其电化学性能。
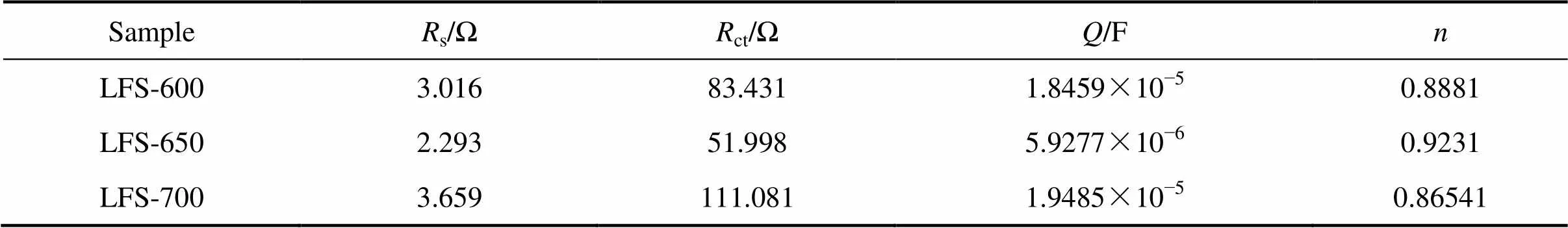
表1 等效电路的阻抗参数

图6 Li2FeSiO4/C在测试频率为1×105~1×10−2 kHz范围内的交流阻抗谱
3 结论
1) 采用溶胶−凝胶法成功制备了锂离子电池正极材料Li2FeSiO4/C,该正极材料具有空间群为21的单斜结构,材料为类球型,形貌规则,粒子尺寸约为50~200 nm,分散性好,并且制备工艺快速、简便、高效。
2) 在650℃下合成的Li2FeSiO4/C正极材料具有最佳的电化学性能。在0.1下,首次放电比容量为159.01 (mA∙h)/g,50次充放电循环后,容量保持率为92.1%,并且具有良好的循环稳定性。
[1] GUO Hua-jun, XIANG Kai-xiong, CAO Xuan, LI Xin-hai, WANG Zhi-xing, LI Li-ming. Preparation and characteristics of Li2FeSiO4/C composite for cathode of lithium ion batteries[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(1): 166−169.
[2] LI Xiang-qun, GUO Hua-jun, LI Li-ming, LI Xin-hai, WANG Zhi-xing, OU Hui, XIANG Kai-xiong. Effects of calcination temperature on properties of Li2SiO3for precursor of Li2FeSiO4[J]. The Chinese Journal of Nonferrous Metals, 2011, 21: 529−534.
[3] YANG Rong, LIU Xiao-yan, QU Ye, LEI Jing, Jou-Hyeon AHN. Synthesis of nanostructured Li2FeSiO4/C cathode for lithium-ion battery by solution method[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(10): 2529−2534.
[4] GAO Hai-yan, HU Zhe, ZHANG Kai, CHENG Fang-yi, CHEN Jun. Intergrown Li2FeSiO4·LiFePO4-C nanocomposites as high-capacity cathode materials for lithium-ion batteries[J]. Chem Commun, 2013, 49(29): 3040−3042.
[5] ARMAND M, MICHOT C, RAVET N, SIMONEAU M, HOVINGTON P. Lithium insertion electrode material based on orthosilicate derives. US Patent 6085015[P]. 2000−07−04.
[6] NYTEN A, ABOUIMRANE A, ARMAND M. Electrochemical performance of Li2FeSiO4as a new Li-battery cathode material[J]. Electrochemistry Communications, 2005, 7(2): 156−160.
[7] YANG Jin-ling, KANG Xiao-chun, HU Lin, GONG Xue, MU Shi-chun. Nanocrystalline-Li2FeSiO4synthesized by carbon frameworks as an advanced cathode materials for Li-ion batteries[J]. Mater Chemistry A, 2014, 2(19): 6870−6878.
[8] 胡国荣, 曹雁冰, 彭忠东, 杜 柯, 蒋庆来. 微波合成法制备锂离子电池正极材料Li2FeSiO4[J]. 物理化学学报, 2009, 25(5): 1004−1008. HU Guo-rong, CAO Yan-bing, PENG Zhong-dong, DU Ke, JIANG Qing-lai. Microwave synthesis of Li2FeSiO4/C cathode materials for lithium ion battery[J]. Acta Phys Chim Sin, 2009, 25(5): 1004−1008.
[9] RANGAPPA D, MURUKANAHALLY K D, TOMAI T, UNEMOTO A, HONMA I. Ultrathin nanosheets of Li2MSiO4(M=Fe, Mn) as high capacity Li-ion battery electrode[J]. Nano Lett, 2012, 2(3): 1146−1151.
[10] DOMINKO R, CONTE D E, HANZEL D. Impact of synthesis conditions on the structure and performance of Li2FeSiO4[J]. J Power Sources, 2008, 178(2): 842−847.
[11] ZHANG Sen, DENG Chao, YANG Sai-yu. Preparation of nano-Li2FeSiO4as cathode material for lithium-ion batteries[J]. Electrochem Solid-State Lett, 2009, 12(7): A136−A139.
[12] HUANG Xiao-bing, LI Xing, WANG Hai-yan, PAN Zhong-lai, QU Mei-zhen, YU Zuo-long. Synthesis and electrochemical performance of Li2FeSiO4/carbon nano-tubes for lithium battery[J]. Electrochim Acta, 2010, 55(24): 7362−7366.
[13] DU Xue-fei, ZHAO Hai-lei, LU Yao, GAO Chun-hui, XIA Qing, ZHANG Zi-jia. Electrochemical properties of nanostructured Li2FeSiO4/C synthesized by a simple co-precipitation method[J]. Electrochimica Acta, 2016, 188: 744−751.
[14] ZENG Xian-guang, GONG Min, CHEN Jian, ZHENG Xing-wen. Preparation and characterization of porous Li2FeSiO4/C microsphere via a spray drying-assisted technique[J]. J Electrochem Sci, 2015, 10: 4453−4460.
[15] 张 宝, 罗文斌, 李新海, 王志兴. LiFePO4/C锂离子电池正极材料的电化学性能[J]. 中国有色金属学报, 2005, 15(2): 300−304. ZHANG Bao, LUO Wen-bin, LI Xin-hai, WANG Zhi-xing. Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(2): 300−304.
[16] SIRISOPANPORN C, BOULINEAU A, HANZEL D, DOMINKO R, BUDIC B, ARMSTRONG A R, MASQUELIER C. Crystal structure of a new polymorph of Li2FeSiO4[J]. Inorg Chem, 2010, 49(16): 7446−7451.
[17] 彭忠东, 曹雁冰, 胡国荣, 杜 柯, 蒋庆来. 锂离子电池正极材料Li2FeSiO4/C的微波合成[J]. 中国有色金属学报, 2009, 19(8): 1449−1454. PENG Zhong-dong, CAO Yan-bing, HU Guo-rong, DU Ke, JIANG Qing-lai. Microwave synthesis of Li2FeSiO4/C cathode materials for lithium ion battery[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(8): 1449−1454.
[18] 向楷雄, 陈 晗, 邹红主. 离子掺杂和碳修饰对Li2FeSiO4结构和性能的影响[J]. 湖南工业大学学报, 2015, 29(5): 92−95.XIANG Kai-xiong, CHEN Han, ZOU Hong-zhu. Effect of Ion Doping and Carbon Modification on the Structure and Performance of Li2FeSiO4[J]. Journal of Hunan University of Technology, 2015, 25(9): 92−95.
[19] 赵 青, 邓坤发, 庞秀芬, 杨 蓉, 路蕾蕾. 微乳液合成法制备锂离子电池正极材料Li2FeSiO4/C[J]. 稀有金属材料与工程, 2015, 44(12): 3065−3068. ZHAO Qing, DENG Kun-fa, PANG Xiu-fen, YANG Rong, LU Lei-lei. Preparation of Li2FeSiO4/C cathode material for lithium-ion batteries by microemulsion synthesis[J]. Rare Metal Materials and Engineering, 2015, 44(12): 3065−3068.
[20] ZHU Hai, WU Xiao-zhen, ZAN Ling, ZHANG You-xiang. Superior electrochemical capability of Li2FeSiO4/C/G composite as cathode material for Li-ion batteries[J]. Electrochim Acta, 2014, 117: 34−40.
[21] YAN Zi-peng, CAI Shu, MIAO Li-juan, ZHOU Xing, ZHAO Yong-ming. Synthesis and characterization of in situ carbon-coated Li2FeSiO4cathode materials for lithium ion battery[J]. J Alloy Compd, 2012, 511(1): 101−106.
Influences of sintering temperature on performances of Li2FeSiO4/C cathode material synthesized by sol-gel method
YI Li-ling1, 2, WANG Xian-you1, 2, BAI Yan-song1, 2, WANG Gang1, 2, LIU Mei-hong1, 2
(1. Hunan Province Key Laboratory of Electrochemical Energy Storage and Conversion, School of Chemistry, Xiangtan University, Xiangtan 411105, China; 2. National Base for International Science and Technology Cooperation, School of Chemistry, Xiangtan University, Xiangtan 411105, China)
The Li2FeSiO4/C composite cathode material was synthesized by sol-gel method, and the influences of sintering temperatures on the electrochemical properties of Li2FeSiO4/C were examined. The structure, morphology and electrochemical performance of Li2FeSiO4/C composites sintered at various temperatures were investigated by X-ray diffractometry (XRD), scanning electron microscopy (SEM), electrochemical impedance spectroscopy (EIS) and charge-discharge tests. The results reveal that the sample sintered at 650 ℃ can deliver the highest reversible capacity of 159.1 (mA∙h)/g at rate of 0.1, with excellent capacity retention of 92.1% after 50 cycles among all the samples.
Li2FeSiO4/C; cathode material; lithium-ion battery; sol-gel method
(编辑 龙怀中)
Project(51272221) supported by the National Natural Science Foundation of China; Project (2012CK1006) supported by the Scientific and Technical Achievement Transformation Fund of Hunan Province, China; Project(2013GK4068) supported by the Key Project of Strategic New Industry of Hunan Province, China
2016-10-20; Accepted date:2016-02-24
WANG Xian-you; Tel: +86-18673261996; Fax: +86-731-58292061; E-mail: wxianyou@yahoo.com
1004-0609(2017)-02-0289-06
TM912
A
国家自然科学基金资助项目(51272221);湖南省重大科技成果转化项目(2012CK1006);湖南省战略性新兴产业项目(2013GK4068)
2016-10-20;
2016-02-24
王先友,教授,博士;电话:18673261996;传真:0731-58292061;E-mail: wxianyou@yahoo.com
