畜禽保种理论与方法在猪保种工作中的应用
2017-04-06甘麦邻蒲红州张顺华
甘麦邻,杨 露,蒲红州,杨 琼,李 智,朱 砺,张顺华
(1.四川农业大学动物科技学院,成都 611130;2.四川省旺苍县畜牧食品局,广元 旺苍 628200;3.四川省南江县农业局,巴中 南江 635600;4.成都农业科技职业学院,成都 6111305;5.四川省泸县畜牧局,泸州 泸县 646100)
畜禽保种理论与方法在猪保种工作中的应用
甘麦邻1,杨 露2,蒲红州3,杨 琼4,李 智5,朱 砺1,张顺华1
(1.四川农业大学动物科技学院,成都 611130;2.四川省旺苍县畜牧食品局,广元 旺苍 628200;3.四川省南江县农业局,巴中 南江 635600;4.成都农业科技职业学院,成都 6111305;5.四川省泸县畜牧局,泸州 泸县 646100)
畜禽遗传资源是重要的生物遗传资源,是实现畜牧业可持续发展的重要基础。文内综述了国内外近年来保种理论与方法在猪保种工作中的应用情况,认为目前猪的保种应当是以群体遗传学为基础的活体保种方法和分子遗传学为基础的生物技术辅助保种方法相结合的保种技术体系。分析了相关理论和方法在实际应用中存在的问题,以期为我国地方品种猪的保种提供参考。
猪;保种理论;保种方法
生物遗传资源是国家的战略资源,是关系到国计民生的基础生物资源。畜禽遗传资源是重要的生物资源,是培育新品种和新品系、保护动物多样性、实现畜牧业可持续发展的重要材料,也是满足人们未来各种需求的重要基因库。猪肉作为世界第一肉类品种,在为人类提供营养需要和解决温饱问题方面做出了重要贡献[1]。纵观世界畜禽养殖业的发展,畜禽养殖正朝着规模化、工厂化的方向发展,这种方向转变和人们对短期经济效益的追求导致了人们饲养畜禽品种的单一化——少数经济价值高的品种,畜禽品种多样性遭到严重破坏。世界上猪主要饲养杜洛克、大白、长白等少数几个品种,品种结构较为单一,同时这些品种在选育过程中不断突出其某一方面的生产性能使得品种内部也高度同质化,猪遗传资源的多样性受到严峻挑战[2]。但是随着人们对生物遗传资源重要性的进一步认识,猪遗传资源的保护正受到人们的关注。
1 保种理论
随着人们对保种工作的不断认识,相关研究也不断深入,尽管不同的学者对保种的理解和认识存在偏差,但目前对于猪保种的理论主要有两种:随机保种和系统保种。
随机保种理论建立在群体遗传学基础上,追求群体遗传结构的平衡,将品种视为一个整体,保存品种的全部基因[3]。尽管随机保种理论最大程度上保存了品种的所有遗传特性,但有限的群体很难实现哈代-温伯格平衡,同时很难实现保种与选育的可持续发展。
系统保种理论根据系统科学的思想,把某一品种在一定时空内的基因库作为保护对象,利用现代生物技术在保种的同时结合选育最大限度保存品种的基因库。系统保种理论在保存品种基本基因体系、特征和特性基因的同时可以实现对品种的选育,打破了随机保种存在的束缚,可实现畜禽遗传资源利用的可持续发展[4]。但由于无法保存品种所有基因,不可避免会丢失一些未知性状基因,随着现代生物技术和信息数据挖掘在保种工作的应用可以有效减少系统保种理论存在的不利影响。目前的猪保种工作主要依据了系统保种的理论思想。
2 活体保种
活体保种是指通过建立以群体为保种对象的保种场、保种基地进行保种。最大的群体是一个品种,而最小的群体是一个家系。活体保种由于可以在保种的同时开展选育工作,实现了在利用中动态的保护遗传资源,是目前最实用的畜禽保种方法[5]。活体保种由于需要维持一定数量个体的保种群并合理规划管理,需要较大的维持成本,同时活畜还面临着疾病、自然灾害等风险。在活体保种工作中近交系数增量可以反映保种效果,群体大小、性别比例、留种交配制度等因素可以影响近交增量。在理想群体(群体每个世代含量保持不变,完全随机交配,无其他系统影响因素存在)中近交系数增量(△F)的大小由群体有效含量(N)决定,假设初始群体无近交存在,则t世代时的近交系数(Ft)与近交系数增量之间存在如下关系:

2.1 群体大小
2.2 性别比例
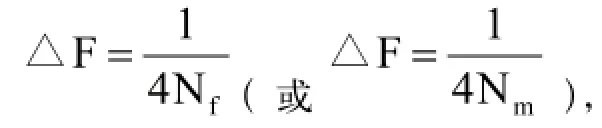
2.3 留种交配制度
常用的留种方式有随机留种和各家系等量留种两种方式[6],考虑到不同性别亲本对后代遗传贡献存在差异,同时尽可能保持每个世代群体大小一致,因此通常采用各家系等量留种的方式在每一个世代留种时,从每一头种公畜的后代中选留一个公畜,每一头种母畜的后代中选留一头雌性个体。对于选留的个体施行非同型交配系统,在随机交配的基础之上进行人为干预,尽量避免全同胞、半同胞等亲缘关系接近的个体进行交配,可以有效控制群体近交系数的增加。
3 生物技术辅助保种
3.1 超低温冷冻保种
利用冷冻保存技术可以将细胞置于-196 ℃的环境中使其暂时脱离生长状态新陈代谢停止进行保存,在需要时再将细胞升温后恢复细胞活力[8]。冷冻保存技术需要遵循一定的操作程序并配套使用相关的冷冻保护剂。冷冻保存的方法目前有程序化慢速冷冻法和玻璃化冷冻法。程序化慢速冷冻采用较低浓度的冷冻保护剂在程序化冷冻仪的控制下缓慢降温使冷冻保护剂进入细胞,稀释细胞内的电解质使细胞内的冰晶损伤和溶质性损伤降到最低。玻璃化冷冻法使用高浓度的冷冻保护剂,降温速度可超过1 500 ℃/ min,使胞质内外的水快速通过冷冻敏感区减少胞内冰晶产生,冷冻效率更高[9,10]。研究表明减少细胞中的脂质含量可以降低细胞在冷冻保存中的损伤[11],Momozawa等发现离心去脂可明显改善卵母细胞解冻后的形态正常率、受精率和卵裂率[12]。目前大量研究表明玻璃化冷冻法优于传统的程序化慢速冷冻法,具有操作简单、冻融效果好、存活率高等特点[13,14]。冷冻保护剂主要分为膜渗透性冷冻保护剂和非膜渗透性冷冻保护剂两种。膜渗透性冷冻保护剂主要使用乙二醇、二甲基亚砜等,可在细胞表面形成一层玻璃样状,同时降低溶液的冰点,防止细胞内冰晶的形成[15]。非膜渗透性冷冻保护剂主要使用蔗糖、葡萄糖、脂蛋白等,可增加溶质的浓度产生跨细胞膜的浓度梯度,不能渗透到细胞内部,作为细胞外液抗冻保护剂[16]。研究表明通过二者联用可以达到更好地抗冻保存效果[17]。目前冷冻保存在猪的保种应用中以配子冷冻(精子和卵细胞)和胚胎冷冻技术较为成熟[18]。
3.1.1 精液的冷冻保存
早在1949年Polge等就已经利用低温保存的精液进行人工授精[19],随后又有人分别利用颗粒状冷冻精液和细管状冷冻精液进行猪的人工授精并获得了成功[20,21]。由于不同动物精子质膜结构不同[22],与牛、羊等动物相比猪精子的抗冻效果差[23],精液冷冻之后存在存活率低,人工授精妊娠低等问题,同时猪是多胎动物使用冷冻精液会导致产仔数下降,因此全世界范围内应用猪冷冻精液进行人工授精的比例不到1%[24]。但是保种更关注时间的延续,冷冻精液保存技术结合人工授精技术的实施得以使配种可以不受公畜所处环境和生命体征的限制,相当于延长了公畜的配种年龄,延续了公畜的性状和基因[18],因此利用猪冷冻精液保存技术对品种予以保护仍然是一种安全经济的猪保种措施,并在猪保种工作中得到了广泛的推广和应用。
3.1.2 卵母细胞或卵巢的冷冻保存
除了对精液进行冷冻保存,还可以通过冷冻卵细胞或卵巢来进行保种。由于卵细胞的体积较大、结构复杂等原因,卵细胞的抗冻能力不如精子,因此复活率往往也比精子更低[24]。但是冷冻卵细胞技术仍在不断的发展,有研究表明在卵母细胞成熟阶段中的GV期、GVBD期和MⅡ期被认为是最有利进行玻璃化冷冻的阶段[25-27],但还有一些研究发现冷冻保存在减数分裂阶段不会影响卵母细胞的发育能力[28]。目前利用超数排卵与活体采卵等技术收集所选雌性个体的卵细胞然后进行冷冻保存,相当于延长了母畜的配种年龄,保存了所选母畜的性状和基因。在合适的时候进行升温,迅速恢复卵细胞的活性,进行体外受精与胚胎移植。
胚胎冷冻保存则可以同时实现延长保种公母畜配种年龄的目的,但胚胎冷冻保存需要采取特殊的保存方法和程序来避免解冻过程中可能造成的胚胎细胞的骨架发生改变、染色体或DNA异常以及细胞膜结构发生的改变。在冷冻保存上,卵母细胞的冷冻保存技术远远落后于胚胎的冷冻保存,早在1972年就有人成功进行了小鼠8细胞期胚胎的冷冻保存[29],此后冷冻胚胎技术成功地应用在了多种动物身上,但是猪胚胎由于对温度和冷冻剂的敏感,猪胚胎冷冻保存效果一直不理想[30],Nagashima等人将猪胚胎离心后通过显微操作移除胚胎中的脂肪有效改善了猪胚胎冷冻保存效果不佳的问题[31]。
3.1.3 体细胞冷冻保存
体细胞冷冻保存,胚胎、幼体或成年动物的肝、肾、皮肤等组织,经体外传代培养,再经酶消化等处理后以预定的程序冷却,然后就可以在液氮中长期保存。通过解冻复苏后可在体外实现增殖、分化。早在1885年W Roux首次提出组织培养这一概念,1907年 R Harrison就进行了体外培养实验,观察到了蛙神经突起生长的过程,之后建立了体外培养活体组织的培养体系[32]。目前全世界范围内建立了多个用于统一保存典型培养物的保存中心,1986年中国科学院昆明动物研究所筹建了野生动物细胞库,2001年中国农业科学院畜牧研究所遗传资源研究室构建了包含狼山鸡、民猪在内的多个地方畜禽品种的成纤维细胞库[33]。
由于目前还没有离体完成胚胎发育全过程的技术,不论是冷冻配子还是冷冻胚胎,最终解冻复苏后都面临需要活体母畜承担受体的功能,尽管可以用亲缘关系较近的品种进行代孕但冷冻保存是否会引起配子和胚胎遗传上的改变还不清楚,因此冷冻保种技术往往还须结合活体保种才能实现。
3.2 基因文库
基因文库可分为基因组文库和cDNA文库[34],利用基因文库进行保种是运用重组DNA技术将需要保种品种细胞的总DNA运用DNA酶切之后随机连接到合适的载体上,然后转移到合适的宿主细胞中,通过宿主细胞的增殖实现各个片段的无性繁殖系,在需要的时候通过转基因工程将保存的基因重新整合到受体动物基因组中,使想要表达的性状在转基因动物中表现出来[35]。
利用基因文库进行保种需要建立完善的基因工程技术、细胞体外培养技术和相关的分子遗传学技术作支撑,难度较大[36]。Murraya 等人首次成功构建了一个长度为55kb的酵母人工染色体[37]。1997年完成了猪的酵母人工染色体构建[38],在2000年李雪梅等人以pBluescriptKS+噬菌粒为载体,构建了猪的小插入片段基因组文库[39]。基因文库保种只有厘清了基因的作用才能有的放矢地利用基因文库中的基因同时避免其带来的副作用,由于基因文库保种相关技术还不够成熟,构建有效的保存文库较困难,加之基因文库在扩增期间有可能发生突变和重组,因此在建立基因文库的同时仍然需要饲养一定数量的保种群体[40]。
3.3 分子遗传标记
分子遗传标记主要有限制性内切酶片段长度多态性(RFLP)、随机扩增多态性DNA(RAPD)、扩增片段长度多态性(AFLP)、单核苷酸多态性(SNP)和微卫星标记几种。利用与目标基因有紧密连锁的DNA标记,对目标基因在保种过程中的分离和重组进行跟踪,通过有意识地选留而加以保护,使之不因遗传漂变而丢失[35]。利用广泛存在于基因组的DNA标记,可以分析各个世代不同个体的基因同源度,指导种畜的选留[41]。在提高保种准确性的同时,使小群体保种成为可能。通过QTL(数量性状位点)定位寻找到相关的基因簇,可以提高猪的保种、选育效率[42]。随着相关配套综合技术的发展,分子遗传标记辅助保种发展迅速,近年来相关研究发现猪的基因组约有1 000多个DNA 标记被定位能较好地覆盖猪整个基因组。Sun等绘制了猪18号染色体上的生长激素受体基因图谱[43],还有人利用微卫星标记研究了大白、约克夏和汉普夏猪的遗传差异[44]。吴丰春等人利用AFLP技术对贵州小型香猪的基因组DNA进行了研究[45]。但是单纯地利用分子遗传标记对保种群体进行选留,往往不能全面考虑到猪保种群的实际生产性能、生活力等因素,因此分子遗传标记仍然要结合传统的猪保种方法进行。
3.4 其他生物技术在猪保种中的应用
尽管猪是多胎动物,利用超数排卵和胚胎分割、移植相关技术可进一步发挥优秀母畜的作用,猪的超数排卵一般采用PMSG + HCG的方法处理,可以获得比正常排卵更多的卵子[46]。克隆胚胎也已在牛、羊、猪等动物获得成功。1997年多利羊的诞生揭开了体细胞克隆技术的序幕,紧接着2002年诞生了第一头体细胞克隆猪[47]。这些生物技术丰富了猪的保种研究和实践工作,为猪保种工作的进一步开展实施提供了思路。
4 总结
随着时间的推移,相关的理论体系不断完善,相关的科学技术和手段也不断发展;不同学科间的交叉越来越普遍,联系越来越密切。保种工作需要利用当前社会可利用的先进科学技术和理论才能实现长足有效的进展。目前猪的保种应当是以群体遗传学为基础的活体保种方法和分子遗传学为基础的生物技术辅助保种方法相结合的保种技术体系,只有这样才能够实现对地方猪种的有效保护。
[1] 程广燕, 刘珊珊, 杨祯妮, 等. 中国肉类消费特征及2020年预测分析[J].中国农村经济,2015(2):76-82.
[2] 武建勇, 薛达元, 王爱华, 等. 生物多样性重要区域(Key Biodiversity Areas, KBAs)识别——国外案例、国内研究进展[J]. 生态学报,2016,36(10): 3108-3114.
[3] 芒来. 随机保种群体遗传结构变化规律的研究[J]. 内蒙古农业大学学报: 自然科学版, 2002, 23(1): 1-8.
[4] 盛志廉. 探索畜禽保种的新理论[C].第五次全国畜禽遗传育种科学学术讨论会,1989.
[5] 路国彬, 王夏晖, 吕文魁, 等. 中国畜禽遗传资源保护问题分析[J]. 家畜生态学报, 2014; 35(4): 1-6.
[6] 张沅. 家畜育种学[M]. 北京:中国农业出版社, 2001:320-322.
[7] 朱武洋. 畜禽品种保存规划[D]. 保定:河北农业大学, 2003.
[8] 李广武, 郑从义, 唐兵. 低温生物学[M]. 长沙:湖南科学技术出版社,1998.
[9] VAJTA G, DIVALD A, PAKU S,et al. Fatty degeneration in cultured hepatocytes[J]. Virchows Archiv B,1986, 52: 177-184.
[10] LIEBERMANN J, NAWROTH F,ISACHENKO V, et al. Potential importance of vitrification in reproductive medicine[J]. Biology of Reproduction, 2002, 67: 1671-1680.
[11] PARK KE, KWON IK, HAN MS,et al. Effects of partial removal of cytoplasmic lipid on survival of vitrified germinal vesicle stage pig oo-cytes[J]. Journal of Reproduction & Development, 2005, 51: 151-160.
[12] MOMOZAWA K, IWASAKI H,ONODA Y, et al. In Vitro Development of Porcine In Vitro Matured Oocytes Vitrified after Removal of Cytoplasmic Lipid Droplets[J]. Journal of Mammalian Ova Research,2013, 30: 36-40.
[13] 丛晶, 吴效科. 玻璃化冷冻技术的研究进展[J]. 国际生殖健康/计划生育杂志, 2008, 27(3): 151-154.
[14] 郑爱燕, 丁洁, 顾斌, 等. 玻璃化冷冻与程序化冷冻对胚胎发育潜能及临床结局的影响[J]. 生殖与避孕, 2013, 33(1): 16-20.
[15] POLGE, AMP C, ROWSON LEA. Fertilizing capacity of bull spermatozoa after freezing at 79 degrees C[J]. Nature, 1952, 169: 626-627.
[16] ORIEF Y, SCHULTZE-MOSGAU A, DAFOPOULOS K, et al. Vitrification: Will it replace the conventional gamete cryopreservation techniques[J]. Middle East Fertility Society Journal, 2005, 10: 171-184.
[17] GUPTA MK, UHM SJ, LEE HT. Cryopreservation of immature and in vitro matured porcine oocytes by solid surface vitrification[J]. Theriogenology, 2007, 67: 238-248.
[18] 陈守云, 徐海涛, 高海燕. 畜禽遗传资源保护和利用的有效途径[J]. 浙江畜牧兽医, 2010, 35(6): 10-11.
[19] POLGE C, SMITH AU, PARKES AS. Revival of spermatozoa after vitrification and dehydration at low temperatures[J]. Nature, 1949, 164:666-666.
[20] PURSEL VG, JOHNSON LA. Freezing of boar spermatozoa: fertilizing capacity with concentrated semen and a new thawing procedure[J]. Journal of Animal Science, 1975, 40: 99-102.
[21] WESTENDORF P, RICHTER L,TREU H. Deep freezing of boar sperma. Laboratory and insemination results using the Hülsenberger paillete method[J]. Dtw Deutsche Tier rztliche Wochenschrift ,1975,82: 261-267.
[22] 胡建宏. 猪精液冷冻保存研究[D]. 杨凌: 西北农林科技大学, 2006.
[23] BWANGA CO, EINARSSON S,RODRIGUEZ-MARTINEZ H. Deep Freezing of Boar Semen Packaged in Plastic Bags and Straws[J]. Reproduction in Domestic Animals, 1991,26: 117-125.
[24] 周鑫. 猪精液冷冻保存的研究[D]. 呼和浩特:内蒙古大学, 2012.
[25] WU G, JIA B, MO X, et al. Nuclear maturation and embryo development of porcine oocytes vitrified by cryotop: Effect of different stages of in vitro maturation[J]. Cryobiology, 2013, 67(1): 95-101.
[26] Mo XH, Fu XW, Yuan DS, et al. Effect of meiotic status, cumulus cells and cytoskeleton stabilizer on the developmental competence of ovine oocytes following vitrification[J]. Small Ruminant Research, 2014,117: 151-157.
[27] WU G, JIA B, MO X, et al. Nuclear maturation and embryo development of porcine oocytes vitrified by cryotop: effect of different stages of in vitro maturation[J]. Cryobiology, 2013, 67: 95-101.
[28] GAL FL, MASSIP A. Cryopreservation of Cattle Oocytes: Effects of Meiotic Stage, Cycloheximide Treatment, and Vitrification Procedure[J]. Cryobiology, 1999, 38:290-300.
[29] WHITTINGHAM DG, LEIBO SP,MAZUR P. Survival of Mouse Embryos Frozen to -196 and -269℃[J]. Science, 1972, 178: 411-414.
[30] SUZUKI T, TAKAGI M, YAMAMOTO M, et al. Pregnancy rate and survival in culture of in vitro fertilized bovine embryos frozen in various cryoprotectants and thawed using a one-step system[J]. Theriogenology, 1993, 40: 651-659.
[31] NAGASHIMA H, KASHIWAZAKI N, ASHMAN RJ, et al. Removal of cytoplasmic lipid enhances the tolerance of porcine embryos to chilling[J]. Biology of Reproduction,1994, 51: 618-622.
[32] 刘希斌, 关伟军, 张洪海, 等. 濒危动物遗传资源的保存[J]. 中国农业科技导报, 2005, 7(5): 34-38.
[33] 屈小平, 宁美艳, 武琳, 等. 动物遗传育种方法研究进展[J]. 家畜生态学
报, 2012, 33(1): 81-85.
[34] EFSTRATIADIS A, KAFATOS FC,MAXAM AM, et al. Enzymatic in vitro synthesis of globin genes[J]. Cell, 1976, 7: 279-288.
[35] 吕蓓, 郑景生. 基因表达文库的构建及其方法分析[J]. 分子植物育种, 2003(Z1): 751-755.
[36] 李海权, 刁现民. 基因组细菌人工染色体文库(BAC)的构建及应用[J]. 生物技术通报, 2005(1):6-11.
[37] MURRAY AW, SZOSTAK JW. Construction of artificial chromosomes in yeast[J]. Physical Review B Condensed Matter ,1983, 51: 10193-10196.
[38] ALEXANDER LJ, SMITH TP, BEATTIE CW, et al. Construction and characterization of a large insert porcine YAC library[J]. Mammalian Genome, 1997, 8: 50-51.
[39] 李雪梅, 龚炎长. 猪 pBluescript KS^+ 文库构建, 微卫星 DNA 克隆及序列测定[J]. 河北农业大学学报,2000, 23(2): 10-12.
[40]关伟军, 马月辉. 频危畜禽品种细胞库的构建与鉴定[J]. 中国农业科技导报,2003, 5(5): 66-70.
[41] 薛慧良. 遗传标记辅助选择及其在动物育种中的应用[J]. 生物学教学, 2007,32(9): 6-7.
[42] 李宁. 基因组学技术在动物遗传育种中的应用[J]. 华南农业大学学报, 2005,26(增刊):12-20.
[43] SUN HS, TAYLOR C, ROBIC A,et al. Mapping of growth hormone releasing hormone receptor to swine chromosome 18[J]. Animal Genetics,1997, 28: 351-353.
[44] KACIREK, STACY L. Variation at microsatellite loci in the Large White, Yorkshire, and Hampshire breeds of pigs[J]. 1998, 23, 640-643.
[45] 吴丰春, 魏泓, 甘世祥, 等. 贵州小型香猪基因组DNA的AFLP检测研究[J]. 遗传, 2001, 23(5): 423-426.
[46] 陈乃清, 苟德明,路兴中,等. 猪的超数排卵[J]. 畜牧兽医杂志, 1997(1):1-3.
[47] POLEJAEVA IA, CHEN SH,VAUGHT TD, et al. Cloned pigs produced by nuclear transfer from adult somatic cells[J]. Nature, 2000,407: 86-90.
2016-12-06)
四川省科技支撑计划项目(2016NZ0089;2015NZ0013),四川省科技富民强县专项行动计划项目“巴山土猪产业化关键技术开发与示范”和四川省教育厅科研项目(16ZB0038)资助
甘麦邻(1993-),新疆喀什人,男,硕士研究生,动物遗传育种与繁殖专业。
E-mail:1660600546@qq.com。
张顺华,博士,硕士生导师,研究方向:猪的遗传育种。E-mail:363445986@qq.com;
朱砺,教授,博士生导师,研究方向:猪的遗传育种。E-mail:zhuli7508@163.com
