研究连续切片联合免疫组化染色在临床Ⅰ、Ⅱ期乳腺癌前哨淋巴结隐性转移检测中的应用
2017-04-06石瑞芳
石瑞芳
研究连续切片联合免疫组化染色在临床Ⅰ、Ⅱ期乳腺癌前哨淋巴结隐性转移检测中的应用
石瑞芳
目的 研究连续切片(SS)联合免疫组化染色(IHC)在临床Ⅰ、Ⅱ期乳腺癌前哨淋巴结(SLN)隐性转移检测中的应用价值。方法 240例确诊为Ⅰ、Ⅱ期乳腺癌的患者, 取术中获取的560枚SLN,第2n片设为对照组[行SS联合伊红-苏木素染色法(SS-HE)], 第2n-1片设为观察组[行SS、伊红-苏木素染色法联合IHC(SS-HE-IHC)], 各280片。对比两组的SLN隐性转移检出率。结果 观察组间距100 μm、200 μm、300 μm的SLN隐性转移检出率分别为8.93%、11.07%、7.86%, 均高于对照组的4.29%、6.07%、3.21%, 差异具有统计学意义(P<0.05)。结论 与SS-HE相比, SS-HE-IHC可以进一步提高SLN隐性转移的检出率, 其最佳检测距离为200 μm, 可将SS-HE-IHC应用于临床Ⅰ、Ⅱ期乳腺癌SLN隐性转移检测中。
连续切片;免疫组化;乳腺癌;前哨淋巴结;隐性转移
SLN指的是自乳房原发肿瘤向内乳及腋窝区域淋巴池引流的第1个或多个淋巴结[1]。SLN活检可以准确的对乳腺癌患者腋窝淋巴结的病理学改变进行评估, 有利于术中尽早确定需行腋窝清扫的部位[2]。术后行病理学检测有助于进一步验证淋巴结是否转移, 方便确立下一步治疗方案。本研究对部分SLN行SS-HE-IHC, 旨在评价其用于乳腺癌SLN隐性转移检测中的应用价值。结果如下。
1 资料与方法
1.1 一般资料 以2015年4月~2016年6月于本院接受乳腺癌SLN活检术并经术中印片细胞学、病理学及术后常规病理检查确诊为Ⅰ、Ⅱ期乳腺癌的患者240例作为研究对象。取术中获取的560枚SLN, 应用前哨淋巴结切割器, 每隔1.5 mm进行切割, 后对切面行印片。第2n片设为对照组, 第2n-1片设为观察组, 各280片。纳入标准:临床检查腋窝淋巴结未提示伴有病灶转移, 经超声检查可见≤5 cm的原发肿瘤的患者。排除标准:①有腋窝手术史的患者;②同一乳腺多发肿瘤的患者。
1.2 方法 对照组行SS-HE, 将第2n片SLN包埋于蜡块中进行切片, 每隔100~150 mm留取3张石蜡白片。其中2张备用,拟行IHC, 1张行常规HE;观察组行SS-HE-IHC。60℃烤片1 h, 两次进行二甲苯脱蜡, 5 min/次。按照无水乙醇-无水乙醇-95%-85%-75%乙醇的顺序浸入梯度乙醇和蒸馏水中充分水化, 5 min/次。后行IHC, 过程为:①10 min内源性过氧化物酶封闭, 磷酸缓冲液(PBS)冲洗;②10 min蛋白非特异性结合点封闭, PBS冲洗;③1 h一抗工作液孵育RT, PBS冲洗;④10 min二抗工作液孵育RT, PBS冲洗;⑤10 min SP工作液孵育RT, PBS冲洗;⑥DBA显色3~7 min, 苏木素复染。⑦采用1%盐酸分化液分化10 s;⑧置于75%-85%-95%-100%-100%乙醇溶液中逐级脱水, 5 min/次, 二甲苯浸没2次, 5 min/次, 加中性树脂盖玻片封片并晾干;⑨显微镜成像系统中拍片。
1.3 观察指标及判定标准 检测后, 对切片重新编号, 镜下观察并根据横截面的最大值确定其转移灶大小。单灶:单灶最大径≥2 mm则判定为宏转移;≤0.2 mm则判定为孤立肿瘤细胞;处于0.2~2 mm之间的转移灶则视为微转移。多灶:若转移灶间距<最大转移灶直径, 则转移灶直径与转移灶间距即为转移灶大小;若转移灶间距>最大转移灶直径, 则转移灶的直径即为其大小。与手术结果对照并对比两组间距100 μm、200 μm、300 μm的SLN隐性转移检出率。
1.4 统计学方法 采用SPSS18.0统计学软件对研究数据进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
观察组间距100 μm、200 μm、300 μm的SLN隐性转移检出率分别为8.93%、11.07%、7.86%, 均高于对照组的4.29%、6.07%、3.21%, 差异具有统计学意义(P<0.05)。见表1。
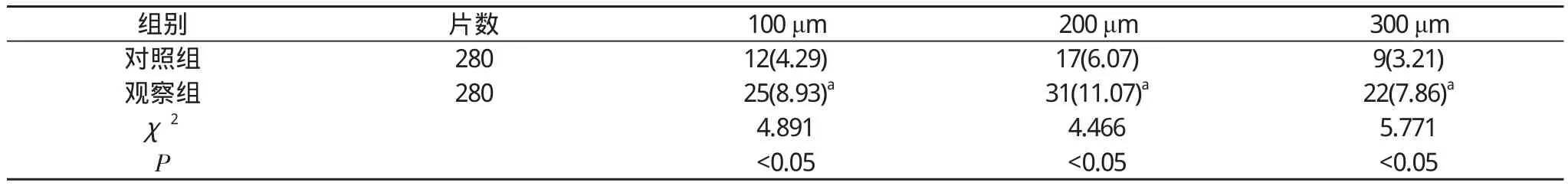
表1 两组的隐性转移检出率比较[n(%)]
3 讨论
SLN阳性尤其是>2 mm的大体转移是乳腺癌的重要预测因素。常规行SLN清扫术有助于及时了解肿瘤的发展趋势并确定分期治疗方案[3]。目前, 临床尚无SLN隐性转移的病理学检测方案[4]。目前认为, 对SLN的检测至少应发现>2 mm的转移灶, 但切片方式、标本置于蜡块中的位置、转移灶较深及淋巴结大小等因素均可能造成漏检, 预后不良[5]。
SS-HE是最早应用于检测乳腺癌SLN隐性转移的方式,其具有经济、操作简单等优势, 但是对于SLN隐性微转移的检出率较低[6-8]。本研究对术中印片、病理学及术后常规病理检查结果均为阴性的患者进行了不同的病理检测。结果显示, 观察组不同间距的SLN隐性转移检出率均高于对照组,且两组以200 μm为检测距离的检出率较高, 提示SS-HEIHC对SLN隐性转移的检出率较高, 且两种检测方法的最佳检测距离均为200 μm。目前认为, SS可以显著提高隐性转移的检出率, 但其近乎将SLN完全切光, 因此工作量较大、耗时长、费用高等劣势也随之体现出来。IHC可以弥补HE病理检测的不足, SS-HE-IHC可以在常规病理学检查的基础上进一步检测出20%的隐性微转移病灶[9-12]。结合SLN病理检测特点及我国国情, 作者推荐以下SLN病理检测模式:①术中SLN的评估方向包括印片细胞学、淋巴结切面的视诊及快速冰冻切片;②所有SLN必须测量大小、计数、记录下放射性核素摄取值及标记是否蓝染;③对于可疑转移患者或高危患者, 可以间距为200 μm进行SS-HE-IHC;④病理学报告需包含隐性转移评断标准并标明其转移方式及分类(微转移、单个或成簇的细胞、普通转移;是否伴有多灶转移等)[13-16];⑤淋巴结需保持≤2 mm的间距沿长轴切开,每枚SLN应准备≥1个完整的切面行HE。
综上所述, 与SS-HE相比, SS-HE-IHC可以进一步提高SLN隐性转移检出率, 其最佳检测距离为200 μm, 可将SS-HE-IHC应用于临床Ⅰ、Ⅱ期乳腺癌SLN隐性转移检测中。
[1] 夏雪梅.快速冷冻切片对乳腺癌前哨淋巴结术中腋窝淋巴结诊断的应用价值.中国实验诊断学, 2015, 19(1):102-103.
[2] 练斌, 覃庆洪, 杨伟萍, 等.彩色多普勒超声对乳腺癌前哨淋巴结微转移的诊断价值.广西医科大学学报, 2016, 33(5):783-786.
[3] 叶春梅, 熊斌, 胡俊波, 等.量子点技术检测乳腺癌前哨淋巴结转移的研究.中华实验外科杂志, 2016, 33(7):1826-1829.
[4] 谢竞, 霍彦平, 赵晓燕, 等.早期乳腺癌前哨淋巴结活检联合腋窝淋巴结取样126例应用报告.中国妇幼保健, 2015, 30(21): 3729-3731.
[5] 叶春梅, 高丹, 黄自明, 等.前哨淋巴结冰冻切片检查在乳腺癌手术中的应用价值.临床外科杂志, 2015, 23(10):763-765.
[6] 何友新, 才忠启.乳腺癌前哨淋巴结活检138例临床分析.中国基层医药, 2016, 23(16):2405-2407.
[7] 刘军, 王宁, 陈平, 等.荧光法联合染色法前哨淋巴结活检在早期乳腺癌中的应用.中华普通外科杂志, 2015, 30(3):227-230.
[8] 朱淑玲, 武彤彤, 方勤, 等.印片细胞学联合快速免疫组化检测在乳腺癌前哨淋巴结活检术中诊断的应用.中国临床医学, 2016, 23(5):633-635.
[9] 张春丽, 刘珺, 杨敏, 等.连续切片联合免疫组化染色在临床Ⅰ、Ⅱ期乳腺癌前哨淋巴结隐性转移检测中的应用.浙江医学, 2012, 34(12):986-989.
[10] 高明照.快速免疫组织化学染色联合术中冰冻切片检测乳腺癌前哨淋巴结微转移的临床效果研究.世界中医药, 2016(B03): 1037-1038.
[11] 席晨辉, 庄大勇, 郑鲁明, 等.术中冰冻切片联合快速免疫组织化学染色检测乳腺癌前哨淋巴结微转移的临床研究.中华乳腺病杂志电子版, 2011, 5(4):408-418.
[12] 王亚兵, 洪书剑, 武健, 等.乳腺癌前哨淋巴结微转移术中快速检测的临床意义.实用医学杂志, 2008, 24(9):1513-1515.
[13] 谭文, 贾晓敏.冰冻切片联合快速免疫组织化学检测在乳腺癌前哨淋巴结诊断中的价值.当代医药论丛, 2014, 12(11):70-72.
[14] 王春建, 穆殿斌, 王永胜, 等.连续切片检测乳腺癌前哨淋巴结隐性转移研究.中国肿瘤外科杂志, 2009, 1(3):148-151.
[15] 漆兰.术中冰冻及快速免疫组化检测在乳腺癌前哨淋巴结诊断中的应用分析.江西医药, 2015(6):585-587.
[16] 张云峰, 高森, 赵敏.乳腺癌前哨淋巴结术中快速冷冻切片的临床意义研究.安徽医学, 2012, 33(8):969-971.
10.14164/j.cnki.cn11-5581/r.2017.05.018
2017-01-22]
453200 新乡市第一人民医院病理科
