UPLC—Q—TOF—MS分析茜草炒炭前后的化学成分变化
2017-04-06陈毅单鸣秋王海丽薛露张丽丁安伟
陈毅+单鸣秋+王海丽+薛露+张丽+丁安伟
[摘要]为了探究茜草炒炭对化学成分的影响,利用超高效液相串联四级杆飞行时间质谱(UPLC-Q-TOF-MS)分析茜草和茜草炭的成分,比较炒炭前后化学成分的变化,并运用主成分分析法(PCA)和正交偏最小二乘判别法(OPLS-DA)进行数据统计,寻找茜草炒炭前后的主要差异成分,同时依据一级质谱精确质荷比和二级质谱碎片信息进行结构解析。结果表明:茜草炒炭前后有6种差异较大的成分,根据其在生品和炭品中的峰面积值,选择其中的3种成分作为主要差异成分,并鉴定为光泽汀、异茜草素、1,3,6-三羟基-2-甲基蒽醌,且炒炭后异茜草素、1,3,6-三羟基-2-甲基蒽醌含量显著增加,光泽汀含量明显减少,可作为化学标记物区分生品和炭品。该实验的研究成果对于揭示茜草炒炭的炮制机制具有重要意义,也为茜草炭药效物质基础的阐明提供了重要依据。
[关键词] 茜草; 茜草炭; UPLC-Q-TOF-MS; PCA; OPLS-DA
[Abstract] In order to explore the effect on chemical constituents after carbonized, the changes of chemical constituents in raw and carbonized Rubiae Radix et Rhizoma were analyzed by UPLC-Q-TOF-MS. The research also used principal component analysis(PCA) and orthogonal partial least squares discriminant analysis(OPLS-DA) for data statistics to find out the main differences on components before and after carbonized. The accurate m/z values of Q-TOF-MS and Q-TOF-MS-MS fragments were applied to identify the structures. The results showed that 6 more discrepant constituents were existed between raw and carbonized Rubiae Radix et Rhizoma. Three constituents were selected as the main discrepant components according to the peak area (276 nm) and identified, as lucidin, xanthopurpurin and 1,3,6-trihydroxy-2-methylanthraquinone. After carbonized, contents of xanthopurpurin and 1,3,6-trihydroxy-2-methylanthraquinone were observably increasing, while lucidin was obviously decreasing. They could be used as the chemical markers for the differentiation between raw and carbonized Rubiae Radix et Rhizoma. The results of this experiment played an important role in the study of processing principle of carbonized Rubiae Radix et Rhizoma. It also provided important evidences for the interpretation of effective material based on carbonized Rubiae Radix et Rhizoma.
[Key words] Rubiae Radix et Rhizoma; carbonized Rubiae Radix et Rhizoma; UPLC-Q-TOF-MS; PCA; OPLS-DA
中藥茜草为茜草科植物茜草Rubia cordifolia L.的干燥根和根茎,味苦,性寒,归肝经,具有凉血、祛瘀、止血、通经的功效,临床上常用于吐血、衄血、崩漏、外伤出血、瘀阻经闭、关节痹痛、跌扑肿痛[1]。国内外对茜草的化学研究表明,茜草中主要含有蒽醌及其苷类、萘醌及其苷类,此外还含有环己肽类、多糖类、萜类等其他化学成分[2]。现代药理研究发现,茜草具有抗肿瘤、升高白细胞及免疫调节、护肝、抗炎抗风湿、抗氧化、止血等作用[3]。
茜草炭是由中药茜草经炒炭炮制而成,是中医临床常用化瘀止血药。余旭东等[4]比较了茜草与茜草炭饮片在抗炎、镇痛、活血化瘀、止血等方面药理作用的强弱,研究发现茜草炒炭后,抗炎、镇痛、活血化瘀等药理作用减弱,但止血作用增强。炒炭前后药理作用的变化必然由化学成分的变化引起。张振凌等[5]对茜草饮片炒炭前后化学成分的变化进行了研究,发现茜草在炒炭后大叶茜草素等化学成分减少的同时也有成分含量增加,提取分离鉴定为1,3-二羟基蒽醌(异茜草素)且有止血作用。单鸣秋等[6]利用UPLC对茜草炒炭前后1,3,6-三羟基-2-甲基蒽醌的含量进行了测定,研究发现炒炭后1,3,6-三羟基-2-甲基蒽醌的含量显著升高,为茜草炭的主要成分。但上述所研究均只针对单个成分在茜草炒炭前后发生的变化,不够全面,UPLC-Q-TOF-MS是近年来发展起来的具有高效分离和定性检测综合能力的分析方法,在中药化学成分分析等研究中已得到较多应用[7]。鉴于此,本研究拟采用该技术分析茜草炒炭前后化学成分的变化,并结合MarkerLynx XS软件进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),以期探讨茜草炒炭前后化学成分的差异。
1 材料
1.1 仪器 ACQUITYTMUPLC系统-PDA检测器(Waters公司);SynaptTMQ-TOF质谱仪(Waters公司),配有Lock-spray接口,电喷雾离子源(ESI),MassLynx V4.1质谱工作站软件(Waters公司);高速万能粉粹机(天津市泰斯特仪器有限公司);HH-S恒温水浴锅(江苏国胜实验仪器厂);KH-500B型超声波清洗器(昆山禾创超声仪器有限公司);HANGPING FA1104N型电子天平(上海精密科学仪器有限公司,d=0.1 mg);MS 105DU型电子分析天平(梅特勒-托利多国际股份有限公司,d=0.01 mg);Milli-Q Direct 8超纯水仪(美国Millipore公司);TGL-16B台式离心机(上海安亭科学仪器厂)。
1.2 试药 95%乙醇(化学纯,南京化学试剂股份有限公司);甲醇(色谱纯,Q/320801GHB005,江苏汉邦科技有限公司);甲酸、甲醇(质谱纯,美国MERCK公司);超纯水(Milli-Q Direct 8超纯水);茜草素、甲基异茜草素、1,3,6-三羟基-2-甲基蒽醌、1-羟基-2-甲基蒽醌均为本实验室自制,经HPLC检测纯度≥ 98%;羟基茜草素(南京森贝伽生物科技有限公司,纯度≥98%);大叶茜草素(中国食品药品检定研究院,纯度≥98%,批号110884-200604);茜草购自安徽丰原铜陵中药饮片有限公司,经南京中医药大学吴啟南教授鉴定为茜草科植物茜草R. cordifolia的干燥根和根茎,按2015年版《中国药典》(一部) 有关要求炒制成茜草炭。
2 方法
2.1 色谱条件 Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),柱温30 ℃;流速0.2 mL·min-1;DAD扫描190~400 nm,经选择在276 nm下进行测定;进样量2 μL;流动相A相为0.3%甲酸-水,流动相B相为甲醇;梯度洗脱(表1)。
2.2 质谱条件 离子源为电喷雾离子化源(ESI),正、负离子模式扫描;相对分子质量扫描范围m/z 100~1 000;离子源温度110 ℃,干燥气温度350 ℃,干燥气流速(N2) 400 L·h-1,锥孔电压30 V,毛细管电压3 kV。
2.3 供试品溶液的配制 称取茜草粉末(过2号筛)4.0 g,置100 mL锥形瓶中,加入40 mL 95%乙醇,水浴加热回流提取5次,每次2 h,滤液合并至蒸发皿中,水浴加热挥干溶剂,得醇提液浸膏;醇提后的藥渣晾干后再加入40 mL水,水浴加热回流提取3次,每次2 h,滤液合并至蒸发皿中,水浴加热挥干溶剂,得醇提后水提液浸膏;将上述2种浸膏合并,用80%甲醇溶解置50 mL量瓶,加80%甲醇至刻度,摇匀,高速离心10 min(15 000 r·min-1),上清液过0.22 μm微孔滤膜,取滤液作为供试品溶液。同法制得茜草炭供试品溶液。
2.4 对照品溶液的配制 精密称取大叶茜草素、羟基茜草素、茜草素、1,3,6-三羟基-2-甲基蒽醌、甲基异茜草素、1-羟基-2-甲基蒽醌各1 mg,分别置5 mL量瓶中,加甲醇至刻度,摇匀。精密量取上述各溶液0.3 mL置2 mL量瓶,加甲醇至刻度,摇匀,即得。
2.5 数据分析 在质谱正、负离子模式下,为保证统计结果的可靠性和重要性,生品和炭品分别连续进6针。基于MarkerLynx XS软件分析茜草生品及其炭品的液质数据,利用PCA和OPLS-DA法进行处理,找出生品和炭品的主要差异成分,经分析得到化学标记物。
3 结果与讨论
3.1 PCA分析 正、负离子模式下MarkerLynx XS分析的Scores图(图1,2)清晰地展示了茜草生品与炭品在X轴和Y轴方向的差别。生品组分布在2,3象限,炭品组分布在1,4象限,2组没有任何交叉,说明经过炒炭后生品和炭品在化学成分上产生了明显的变化。产生变化的成分在UPLC-Q-TOF-MS数据采集过程中,被以分子离子峰的形式记录下来,通过MarkerLynx XS分析生成Loadings图(图3,4),图中离原点最远、分散在四周的点代表了茜草生品和炭品之间的差异成分,离原点越远说明该化合物在2组之间的差异越大,对Scores图的贡献越大。
3.2 OPLS-DA分析 基于MarkerLynx XS软件,在正、负离子模式下将茜草生品与炭品中的化学成分峰信息进行OPLS-DA分析得到散点图(图5,6)。图中每个点代表一个变量,即位于某个保留时间的某个质荷比的信号。横坐标代表变量的贡献度(协方差);纵坐标代表变量的相关性(可信度),在-1~1取值。茜草生品与炭品之间差异显著的分子离子峰分布在S曲线的两端,S曲线的右上角代表了正、负离子模式下茜草炭品与茜草生品相比含量较高的化合物的分子离子峰,S曲线的左下角代表了正、负离子模式下茜草生品与茜草炭品相比含量较高的化合物的分子离子峰。越靠近S曲线两端的点,所代表的分子离子峰对两组样品间的差异贡献越大。根据不确定性值以及对样品差异的贡献度和可信度,从散点图中筛选出不确定性小的、对样品差异贡献度大且可信度高的特征标记物(表2,3)。
3.3 茜草生品与炭品主要差异成分的鉴定 通过对比2组样品UPLC-Q-TOF-MS总离子流图,并结合正、负离子模式下偏最小二乘法从2组样品数据分析散点图中获得的差异较大数据,可寻找茜草生品和炭品间的差异性成分。本实验发现茜草炒炭前后有6种差异较大的成分。
将茜草生品和炭品的UPLC图进行比较(图7),在276 nm检测波长下,6种差异成分在生品和炭品中的峰面积值(表4)。
从表4中可以看出,与点d、点e和点f相比,点a、点b和点c所对应的3种差异成分在茜草生品和炭品中的峰面积值较低,响应较小,不适合作为特征性成分来区分生品和炭品,因此将点d、点e和点f所对应的3种差异成分作为茜草炒炭前后的主要差异成分。
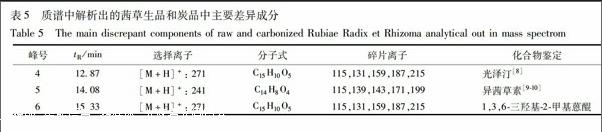
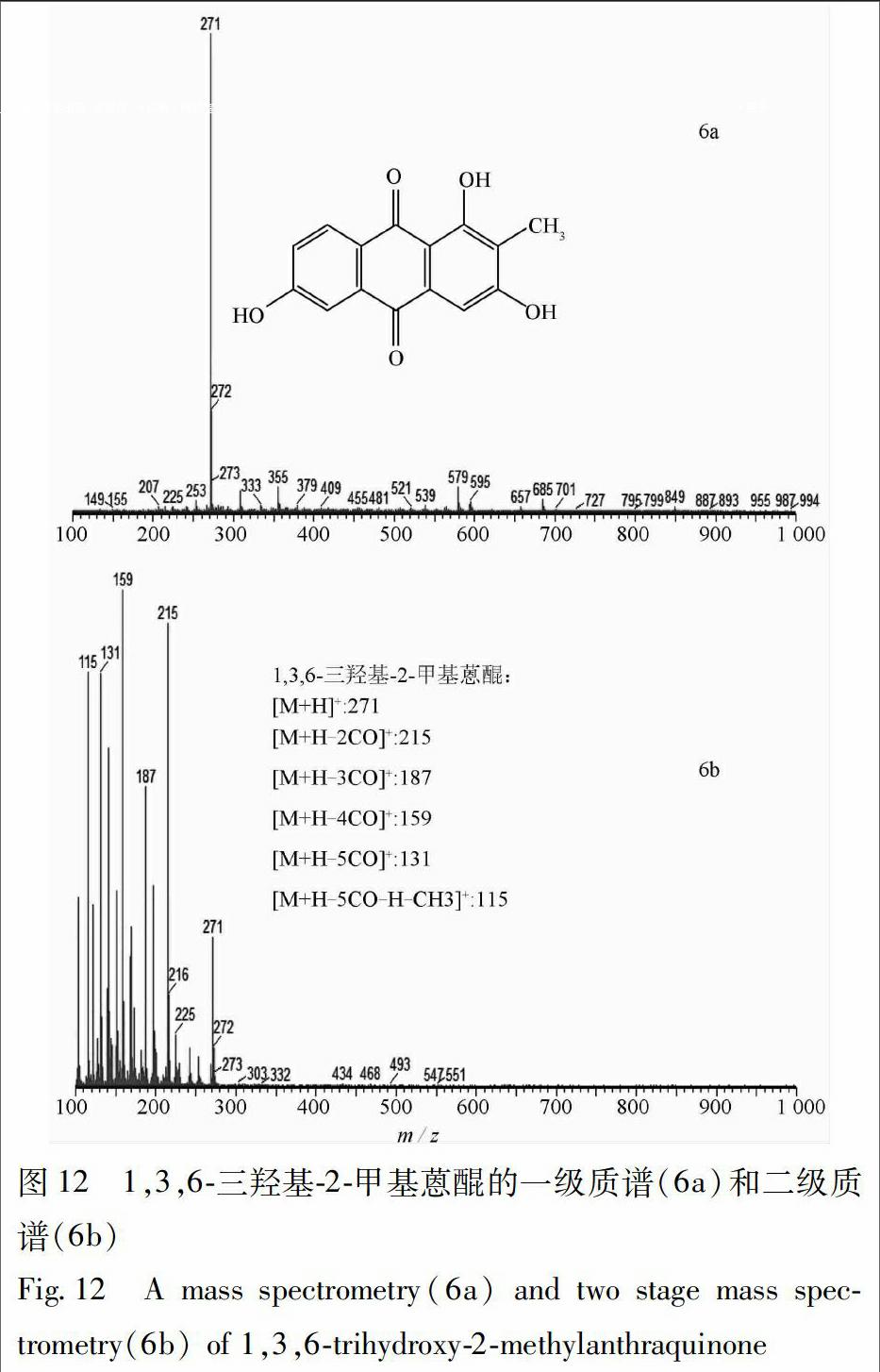
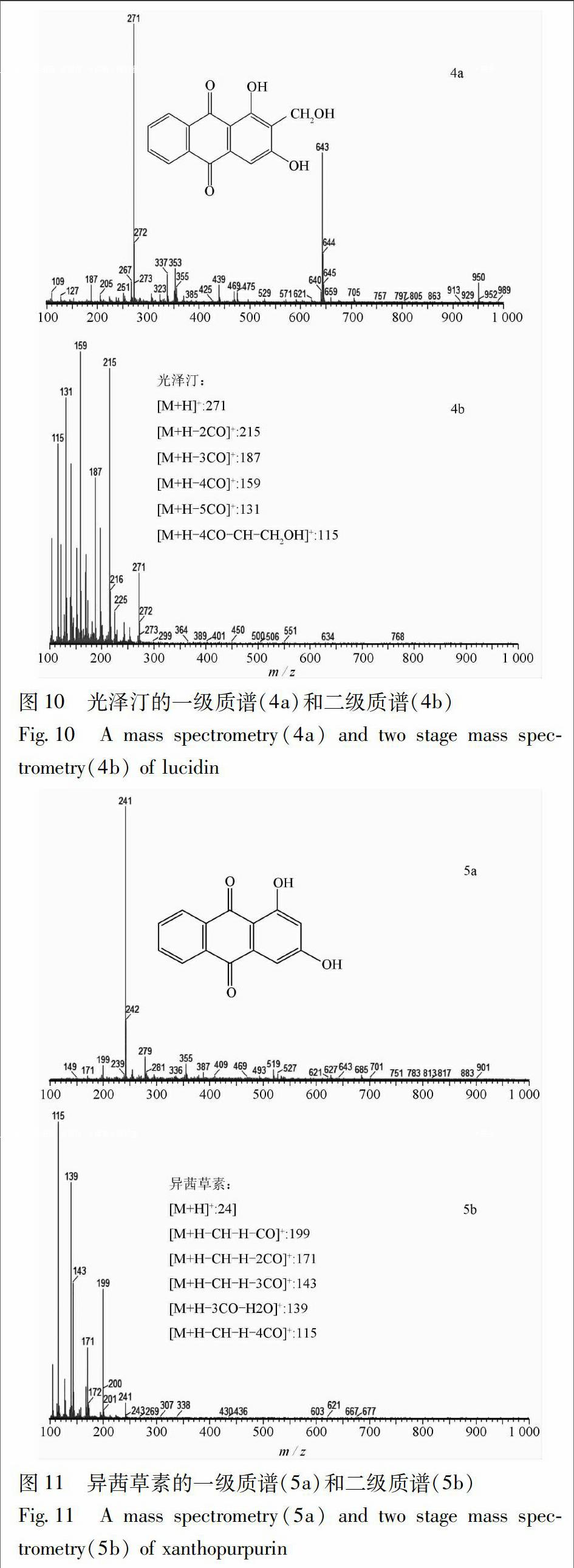
根据茜草生品和炭品总离子流图(图8,9),通过分析这3种主要差异成分的一级质谱准分子离子和二级质谱碎片离子(图10~12),依据其裂解规律,对其进行结构解析,并与对照品或文献数据比对,鉴定出这3种主要差异成分(表5)。
茜草含有大量的蒽醌类化合物,在其电喷雾质谱选择性离子碰撞诱导解离(CID)中,失去母核基团中的CO是其主要裂解方式;另外,侧链基团也是较活跃的裂解部位,侧链取代基(主要为-OH,-CH3,-OCH3,-COOH等)容易以O,H2O,CH3,CH2,CO2等中性小分(原)子片断的形式离去[11]。因此,依据该类化合物的质谱裂解规律,可推测其二级质谱碎片离子的归属,从而推断该化合物的结构。
峰4和峰6的一级及二级质谱基本相同,仅保留时间不一致,推测可能是由于侧链取代基不同而导致两者的极性产生差异,推断两者为同分异构体。对峰6的二级质谱碎片离子(图12)进行归属:m/z 271为少量未被打碎的一级质谱准分子离子峰[M+H]+,m/z 215是准分子离子失去2个CO后的碎片[M+H-2CO]+,m/z 187为m/z 215再失去1个CO后的碎片[M+H-3CO]+,m/z 159是m/z 187又失去1個CO后的碎片[M+H-4CO]+,m/z 131为m/z 159再失去1个CO后的碎片[M+H-5CO]+,m/z 115是m/z 131又再失去1个-CH3和1个H后的碎片[M+H-5CO-H-CH3]+;通过与对照品比对,推断峰6为1,3,6-三羟基-2-甲基蒽醌。峰4的二级质谱碎片离子与峰6一致,通过比较茜草化学成分中1,3,6-三羟基-2-甲基蒽醌的同分异构体的结构及参考文献数据[8],推断峰4为光泽汀(1,3-二羟基-2羟甲基蒽醌)。
对峰5的二级质谱碎片离子(图11)进行归属:m/z 241为少量未被打碎的一级质谱准分子离子峰[M+H]+,m/z 199是准分子离子失去1个CO、1个-CH及1个H后的碎片[M+H-CH-H-CO]+,m/z 171为m/z 199再失去1个CO后的碎片[M+H-CH-H-2CO]+,m/z 143是m/z 171又失去1个CO后的碎片[M+H-CH-H-3CO]+,m/z 139为准分子离子失去3个CO和1分子H2O后的碎片[M+H-3CO-H2O]+,m/z 115是m/z 143再失去1个CO后的碎片[M+H-CH-H-4CO]+;通过与文献数据[9-10]比对,推断峰5为异茜草素(1,3-二羟基蒽醌)。
4 讨论
为了更直观地反映出主要差异成分在茜草生品与炭品间的量变趋势及幅度,作者将鉴定出的3种主要差异成分在茜草炭中的峰面积与茜草生品中峰面积的比值作为量化指标,并结合OPLS-DA分析出的主要差异成分在茜草生品与炭品间的变化因子,从而更好地说明3种主要差异成分在炒炭前后的含量变化情况。
光泽汀在茜草炭品与生品中的峰面积比值为0.32,变化因子为1.6,表明该成分在炒炭后含量明显降低,推测可能是在加热炒炭过程中部分发生了碳碳双键、碳氧双键的断裂或取代基的游离[8]。光泽汀具有一定的抗菌作用[2],但至于该活性是否与茜草炒炭前后药理作用的变化存在某种关联,还需要通过进一步研究来发现。
异茜草素在茜草炭品与生品中的峰面积比值为14.93,变化因子为16.7,说明该成分在炒炭后含量显著升高。关于异茜草素含量增加的具体原因,还未见有文献报道,推测可能是有其他蒽醌类成分在加热炒炭过程中化学结构发生改变,转化成异茜草素。现代药理研究表明,异茜草素确有明显的止血作用[5],并且该成分在炒炭后含量升高显著,这与茜草炭的止血作用增强[4]相吻合,可作为茜草炭止血的有效成分,为本课题对茜草炭化瘀止血效应物质基础的研究提供依据。
1,3,6-三羟基-2-甲基蒽醌在茜草炭品与生品中的峰面积比值为14.31,变化因子为12.2,表明该成分在炒炭后含量显著增加。对于1,3,6-三羟基-2-甲基蒽醌在炒炭前后所发生的含量变化,作者查阅了茜草化学成分的相关文献,发现茜草生品中含有较多的以1,3,6-三羟基-2-甲基蒽醌为苷元的糖苷,如1,3,6-三羟基-2-甲基蒽醌-3-O-α-L-吡喃鼠李糖(1→2)-β-D-吡喃葡萄糖苷[12]、1,3,6-三羟基-2-甲基蒽醌-3-O-新橙皮糖苷[13]、1,3,6-三羟基-2-甲基蒽醌-3-O-β-D-吡喃葡萄糖苷[14]等。在加热炒炭过程中,上述糖苷的苷键可能发生断裂释放出苷元,从而使得茜草炭品中1,3,6-三羟基-2-甲基蒽醌的含量明显高于生品。至于该成分的增加是否会对茜草炭的化瘀止血作用产生影响,目前尚不清楚,还有待于本课题后续对茜草炭药效物质基础的进一步研究。
5 结论
本研究采用UPLC-Q-TOF-MS技术对茜草生品和炭品的化学成分进行分析,用MarkerLynx XS软件进行PCA分析和OPLS-DA分析,发现茜草炒炭前后有6种差异较大的成分,根据其在生品和炭品中的峰面积值,选择其中的3种成分作为主要差异成分。依据化合物质谱裂解规律对这3种主要差异成分进行结构解析,并与对照品或文献数据比对,鉴定为光泽汀、异茜草素和1,3,6-三羟基-2-甲基蒽醌。与茜草生品相比,茜草炭中异茜草素和1,3,6-三羟基-2-甲基蒽醌含量显著增加,光泽汀含量明显减少,作者认为可作为化学标记物区分茜草生品和炭品。
本研究应用UPLC-Q-TOF-MS技术和多元统计学方法研究炒炭对茜草化学成分的影响,该方法能够直观准确地反映茜草炒炭前后化学成分的变化情况,从整体上弥补了HPLC和UPLC分析的不足,对进一步研究茜草炒炭炮制机制具有重要意义,同时也为本课题对茜草炭药效物质基础的阐明提供了重要依据。
[参考文献]
[1] 中国药典.一部 [S]. 2015.
[2] 李鹏,胡正海.茜草的生物学及化学成分与生物活性研究进展[J].中草药,2013(14):2009.
[3] 李海峰,肖凌云,張菊,等.茜草化学成分及其药理作用研究进展[J].中药材,2016(6):1433.
[4] 余旭东,杨季菱.茜草与茜草炭药理作用比较研究[J].中国实验方剂学杂志,2007(9):53.
[5] 张振凌,周艳,黄显峰.茜草炭止血成分的研究[J].中成药,2007(12):1803.
[6] 单鸣秋,陈星,王侃,等.炒炭前后茜草中1,3,6-三羟基-2-甲基蒽醌含量的UPLC测定[J].中国现代中药,2012(12):9.
[7] Li S-L, Lai S-F, Song J-Z, et al. Decocting-induced chemical transformations and global quality of Du-Shen-Tang, the decoction of ginseng evaluated by UPLC-Q-TOF-MS/MS based chemical profiling approach[J]. J Pharm Biomed Anal, 2010, 53(4): 946.
[8] Jegorov A, Cvak L, cejka J, et al. Crystal structures of mollugin and lucidin[J]. J Chem Crystallogr, 2005, 35(8): 621.
[9] 陈星,王侃,单鸣秋,等.UPLC测定茜草炭中4种醌类成分的含量[J].中国中药杂志,2012(19):2922.
[10] Rosenberg E. Characterisation of historical organic dyestuffs by liquid chromatography-mass spectrometry[J]. Anal Bioanal Chem, 2008, 391(1): 33.
[11] 马小红,沈少林,韩凤梅,等.大黄蒽醌类化合物电喷雾质谱研究[J].湖北大学学报:自然科学版,2006(4):403.
[12] Itokawa H, Qiao Y-F, Takeya K. Anthraquinones and naphthohydroquinones from Rubia cordifolia [J]. Phytochemistry, 1989, 28(12): 3465.
[13] 乔亚芳,王素贤,吴立军,等.茜草中抗菌活性成分的研究[J].药学学报,1990(11):834.
[14] 王素贤,华会明,吴立军,等.茜草中蒽醌类成分的研究[J].药学学报,1992(10):743.
[责任编辑 丁广治]
