中药饮片标准汤剂的质量评价案例
2017-04-06代云桃李琦范自全王丹丹董青仝家
代云桃+李琦+范自全+王丹丹+董青+仝家羽+友田健久+陈士林


[摘要]中药饮片标准汤剂是标化中药不同用药形式的参照物,为解决中药配方颗粒等不同中药现代剂型存在的质量不均一、质量标准不明确等问题提供了新的方向。目前,中药单味药标准汤剂在理念、方法和操作层次均缺乏研究。国家也急需这方面的资料,以提高中药制剂的一致性和稳定性。该文将以金银花为例,阐述中药饮片标准汤剂的制备和质量评价方法。收集有代表性的12批合格的金银花药材,建立金银花汤剂指纹图谱,采用UPLCQTOFMS对主要色谱峰进行结构确认,明确煎液中主要成分为有机酸和环烯醚萜类;标准煎液出膏率为(34.2±2.9)%、转移率为(78.6±8.4)%, 变化范围在均值的75%~125%。该文建立了金银花标准煎液的质量评价方法,为所有源于中药水煎剂的终端产品的质量控制方法的制定提供参考。
[关键词] 标准汤剂/煎液; 金银花; 质量评价; 指纹图谱; 质谱鉴定; 出膏率; 转移率
[Abstract] Decoction of single medicinal herb is a reference for the standardization of different dosage form of Chinese medicine and it provides a new direction for solving the problems existing in the quality of Chinese medicinal granules such no uniform dosage forms and no clear quality standard. There are few reports on the idea, method and preparation of single herb standard decoction. Our country is in urgent need of that information in order to improve the consistency and stability of traditional Chinese medicine products. Here, Lonicerae Japinicae Flos was selected as an example to elucidate the preparation and quality evaluation of Chinese single herbal medicine decoction. Twelve batches of representative Lonicerae Japinicae Flos were collected, UPLC fingerprints were established, and the chemical structures of main peaks were identified with UPLCQTOFMS and standard compounds. The main components in the decoction are organic acids and iridoids. The extract rate of the standard decoction was (34.2±2.9)% and the transfer rate is (78.6±8.4)% in the form of chlorogenic acid, within the range of 75%125% of mean. This paper established a method for the quality evaluation of standard decoction of Lonicerae Japinicae Flos and provided reference for the quality control method of terminal products from decoction of Lonicerae Japinicae Flos.
[Key words] decoction of single medicinal herb; Lonicerae Japinicae Flos; quality evaluation; fingerprint; mass spectrometry; extract rate; transfer rate
中藥汤剂/煎液是一种传统的临床广泛使用的用药形式。但饮片质量的参差不齐,严重影响了煎剂的临床疗效。为了满足临床用药的便利性、一致性的需求,中药配方颗粒等现代中药剂型不断出现。但是不同现代剂型之间存在质量标准不明确、剂量不统一、质量不均一等问题。导致上述问题的主要原因是饮片的来源不明确,生产工艺各异,缺乏有效的质量标准和质量监控体系等[1]。2016年,陈士林研究员首次提出采用中药饮片标准汤剂来标准化不同用药形式,以其提高临床用药的准确性和疗效的一致性[2]。
中药标准汤剂,又称中药标准煎液,是以中医理论为指导、临床应用为基础,参考现代提取方法,经标准化工艺制备而成的单味中药饮片水煎剂,用于标准化临床用药,保障用药的准确性和剂量的一致性[2]。中药饮片标准煎液的特点是饮片来源有代表性、制备方法遵循临床经验。标准煎液的制备工艺参数以临床汤剂制法为依据,经实际测定和实验比较,得出关键参数(加水量、煎煮时间)的量化值[2]。中药标准煎液为连接传统中药饮片和现代中药制剂的“桥梁”,为控制中药终端产品的质量提供了参照物;为标化中药不同用药形式,确保质量的均一性、疗效的一致性提供了参照物;为评价不同厂家产品质量的一致性提供了参照物[2]。因此,中药标准汤剂质量标准的制定将为所有源于饮片水煎剂的终产品的质量标准的制定提供基础。
以配方颗粒为例,中药标准汤剂是保证配方颗粒不同批次、不同厂家之间的产品质量一致性的“参照物”,用以矫正原料质量波动(不同批次)和制备工艺差异(不同厂家)造成的终产品质量不均一的问题。配方颗粒生产中,企业通过原料之间的勾兑缩小了浸膏粉(中间体)质量的波动范围。下一步,以标准汤剂作基准,从浸膏粉末到配方颗粒,可以通过调节辅料的加入量而最终获得质量均一的配方颗粒,具体过程见图1。根据标准汤剂制备成配方颗粒所需的辅料量,即可计算出中间体制备成配方颗粒所需加入的辅料量,从而得到质量均一的配方颗粒。因此,中药标准汤剂为实现产品的一致性提供了有效途径。
单味中药标准汤剂的质量标准不同于以往的以药材醇提液为主的质量标准。以往的质量标准,为了使得药材中化学成分最大限度的提取出来,大多以高浓度的乙醇为溶媒。而标准汤剂以水为溶媒,限制了药材中的脂溶性成分的溶出,而提高了水溶性成分的溶出,而且煎煮过程可能导致一些热不稳定成分的降解。因此,单味中药标准汤剂质量标准的建立要建立在对汤剂所含化学物质进行详细研究的基础上。其中,多波长指纹图谱结合共有峰的质谱鉴定是系统研究中药化学成分群的有效方法。
金银花(源于忍冬科植物忍冬 Lonicera japonica Thunb.)的主要化学成分包括有机酸类、黄酮类、环烯醚萜类、挥发油类、三萜类[4]。2015年版《中国药典》以有机酸类的绿原酸和黄酮类的木犀草苷的含量测定作为判断药材是否合格的标准[3]。目前有关于金银花多指标成分含量测定及指纹图谱的研究[57],但研究大多针对醇提取部位,这与中药传统使用的水煎方式还存在着较大的差别。而且以往的指纹图谱研究,研究大多采用药典规定的指标成分的检测波长,忽略了其他波长下可能存在的大量的成分,未能反应汤剂中的主要成分及其相对含量。
本文以金银花标准煎液为例,阐述中药饮片标准煎液的制备和质量评价方法。金银花药材选择主要包括金银花主产区和主要药材市场;金银花标准煎液的制备完全按照《中药饮片标准汤剂研究策略》中推荐的制法[2],对主要工艺参数出膏率范围、指标成分转移率范围和煎剂密度进行了标定;建立了UPLC标准煎液对照指纹图谱,对其主要成分进行了指认; 建立了指标成分绿原酸的含量测定方法并标定了其含量范围。本文展示了对金银花标准煎液从源头药材质量控制、中间过程参数标定和标准煎液的化学指纹标定的整个质量控制过程,以其为中药饮片标准煎液的研究提供参考。
1 材料
Acquity UPLC Hclass 超高效液相系统,Waters Xevo G2XS QTof 質谱系统(Waters Corporation,Milford,MA,USA),Unifi 1.8 软件。水为纯净水,乙腈为色谱纯,其余试剂均为分析纯。绿原酸、木犀草苷纯度大于98.0%,购于北京世纪奥科生物技术有限公司。
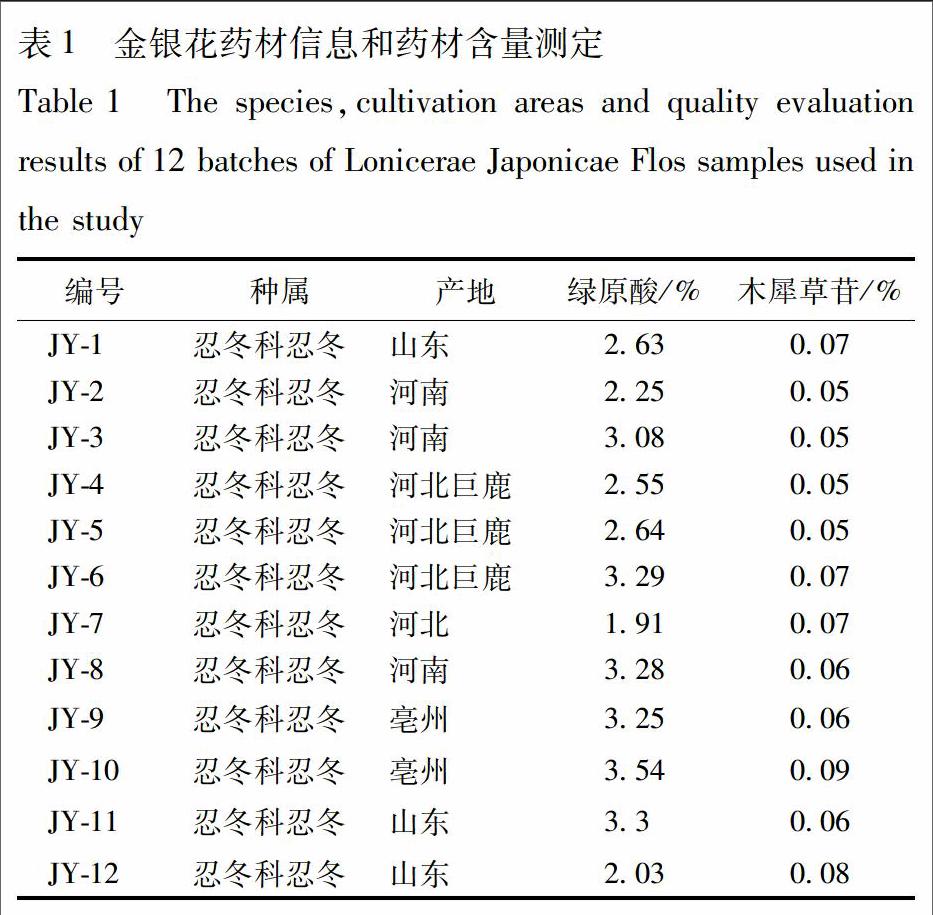
金银花药材共12批金银花药材,购于山东、河南、河北、安徽亳州市场等地,包括了金银花的主产区,道地产区和国内的主要的药材市场;DNA测序与数据库比对鉴定为忍冬科植物忍冬L. japonica的干燥花蕾。根据《中国药典》2015年版金银花的含量测定项测定绿原酸和木犀草苷的含量,见表1,结果显示所有批次的药材绿原酸量均大于1.5%,木犀草苷量均大于0.05%,全部符合药典标准。
2 方法
2.1 标准煎液和供试品的制备
2.1.1 金银花标准煎液制备方法
称取金银花饮片100 g,至于圆底烧瓶中,加12倍水,充分润湿,放置浸泡30 min,加热煮沸后回流提取30 min,趁热3层纱布过滤,滤渣再加入10倍水回流提取20 min,滤过,合并滤液并水浴浓缩至500 mL即得。
2.1.2 供试品溶液的制备
取所得的标准煎液置于2 mL离心管中,12 000×g离心5 min,取上清液既得。
2.1.3 对照品溶液的制备
取绿原酸和木犀草苷对照品适量,精密称定,置棕色量瓶中,加甲醇制成绿原酸质量浓度为1.2 g·L-1,木犀草苷质量浓度为0.67 g·L-1的混合标品溶液,摇匀,作为对照品溶液。
2.2 HPLC色谱条件
含量测定采用Agilent 液相色谱仪进行,配有PDA检测器,采用YCMTriart C18柱(4.6 mm×250 mm,5 μm)进行分离;流动相为0.1%三氟乙酸水(A)乙腈(B),梯度洗脱,洗脱程序为0~12 min,90%~86% A; 12~30 min,86%~76% A; 30~35 min,76%~60% A; 35~40 min,60%~10% A; 40~45 min,10% A;流速为1.0 mL·min-1;检测波长327 nm;柱温20 ℃;进样量为10 μL。
2.3 HPLC方法学考察
2.3.1 线性关系考察
将混合对照品储备液,分别用甲醇稀释2,4,8,16,32,64倍,按2.2项下的色谱条件测定,进样10 μL,以进样量10 μL 中对照品质量(μg)为横坐标,327 nm波长下的峰面积为纵坐标,绘制标准曲线。绿原酸的线性方程为Y=16 742X+5 101,r=0.999 8。
2.3.2 精密度试验
取供试品溶液按HPLC色谱条件进样6次,每次进样量为10 μL,绿原酸峰面积RSD为0.26%,符合含量测定要求。
2.3.3 稳定性试验
取供试品溶液放置0,1,4,6,12,24 h后按HPLC色谱条件进样10 μL进行测定,记录所有共有峰的峰面积,24 h内绿原酸峰面积RSD为0.28%,符合含量测定要求,说明金银花供试液在24 h内稳定。
2.3.4 重复性试验
取同一批样品,按供试品备样方法平行制备6份供试品溶液,分别按HPLC色谱条件进样10 μL进行测定。绿原酸峰面积RSD为0.32%,说明本实验采用的方法重复性良好。
2.3.5 回收率试验
平行精密量取已知绿原酸浓度的供试品溶液6份,分别加入绿原酸对照品0.036 mg,混匀,按照供试品备样方法备样,进样10 μL,记录绿原酸峰面积,计算含量和回收率。
2.3.6 含量测定
分别精密吸取12批供试品溶液10 μL,注入液相色谱仪,记录327 nm波长下绿原酸的色谱峰面积,带入标准曲线进行计算。
2.4 UPLC指纹图谱测定和色谱峰指认
2.4.1 UPLC色谱条件
采用 Acquity UPLC HSST3 C18 柱(2.1 mm×100 mm,1.8 μm,Waters 公司);柱温为30 ℃,体积流量为0.4 mL·min-1;进样量为1 μL;流动相为0.2%甲酸水(A)乙腈(B),B 相比例随时间变化:0~3 min,10%~15.7% B;3~6 min,17.5%~30% B;6~8 min,30%~100% B;8~10 min,100%~10% B。检测波长238,350,327 nm。
2.4.2 质谱条件
采用Xevo G2XS QTOF质谱仪,电喷雾电离离子源 (ESI),离子化模式为正、负离子,离子源温度为150 ℃,脱溶剂气体为高纯度氮气,温度为550 ℃,流速为800 L·h-1,毛细管电压为1.0 kV,锥孔电压为30 V,扫描范围为m/z 50~1 200。亮氨酸脑啡肽(m/z 554.261 5)作为外标(Lock SprayTM)进行质量实时校正。
2.4.3 UPLC分析方法学考察
2.4.3.1 精密度试验 取供试品溶液按HPLC色谱条件进样6次,每次进样量为10 μL,记录所有共有峰的峰面积,同时用相似度评价软件计算各色谱指纹图谱的相似度。
2.4.3.2 稳定性试验 取供试品溶液放置0,1,4,6,12,24 h后按HPLC色谱条件进样10 μL进行测定,记录所有共有峰的峰面积,同时用相似度评价软件计算各色谱指纹图谱的相似度。
2.4.3.3 重复性试验 取同一批样品,按供试品备样方法平行制备6份供试品溶液,分别按HPLC色谱条件进样10 μL进行测定。记录所有共有峰的峰面积,同时用相似度评价软件计算各色谱指纹图谱的相似度。
2.4.4 UPLC指纹图谱采集
分别精密吸取12批供试品溶液1 μL,注入超高效液相色谱仪,得12批金银花提取物238 nm 波长下的UPLC指纹图谱。图谱采用药典委推荐的“中药色谱指纹图谱相似度评价系统(2004A)”软件进行色谱峰匹配,计算谱图的相似度;找出12批药材的共有峰,计算其相对保留时间和相对峰面积。
2.4.5 UPLC指纹图谱共有峰的指认
吸取供试品溶液1 μL,注入UPLCQTOFMS系统,采用完全相同的色谱条件运行,记录质谱信号。采用MassLynx4.1 对正负离子模式总离子流图进行处理,采用UNIFI 1.8 数据处理系统,结合Mass (质量和二级碎片)、保留时间、标准品和文献对照,对238,327 nm波长下色谱图中共有峰进行结构指认。
2.5 金银花标准煎液过程评价指标参数的测定
2.5.1 出膏率
分别取2.1项下的溶液50 mL,冷冻干燥,称取浸膏重量(m),根据如下公式计算标准煎液的出膏率,出膏率(ER%)=干膏量(E)/饮片量(M)×100%=m×10/100×100%。
2.5.2 转移率
分别将2.3.1项下和2.5.1项下的绿原酸含量带入如下公式计算标准煎液中绿原酸的转移率,转移率=煎剂中指标成分含量/饮片中指标成分含量×100%。
2.5.3 密度
将密度仪用空气和蒸馏水分别校正,吸取2.1项下的溶液1.5 mL,注入密度仪,测定其密度值,所测数据均为20 ℃条件下,平行测定3次,取平均值。
3 结果
3.1 金银花标准煎液含量测定
3.1.1 方法学考察
线性关系考察显示,绿原酸的线性方程为Y=16 742X+5 101,r=0.999 8。精密度、稳定性、重复性的结果显示,绿原酸峰面积RSD均小于0.3%,符合含量测定要求,说明所建立的含量测定方法精密度高、稳定性好、重复性高;结果显示平均回收率为96.20%,RSD为2.2%,表明该方法可以用于绿原酸含量的准确测定。
3.1.2 含量测定
分别记录12批药材在327 nm 波长下绿原酸的色谱峰面积,带入标准曲线进行计算,结果见表2。结果显示12批药材(JY1~JY12)的标准煎液中,綠原酸的量范围为1.6%~2.8%,平均质量分数为2.2%; 按照投入药材量计算,绿原酸的提取率为1.7%~2.8%,平均提取率为(2.2±0.4)%;根据各批药材不同的出膏率,浸膏粉中绿原酸的范围为4.0%~7.9%,平均为(6.4±1.1)%。
3.2 金银花标准煎液指纹图谱
3.2.1 方法学考察
精密度、稳定性、重复性的结果显示,所有共有峰的峰面积RSD均小于3%,同时所得指纹图谱的相似度均>0.99,说明所建立的指纹图谱方法良好。
3.2.2 指纹图谱及共有峰参数
12批金银花提取物238,327 nm波长下指纹图谱匹配结果见图2。所有药材的相似度位于0.98~0.99,均大于0.9,符合指纹图谱要求。平均数生成对照指纹图谱,238 nm波长下有20个共有峰,327 nm波长下有9个共有峰,且所有峰在238 nm均有吸收峰,因此选择238 nm波长下的指纹图谱为金银花标准煎液的指纹图谱。238 nm波长下,峰面积百分比大于2%有9个共有峰,以绿原酸峰作参照,计算9个主要共有峰的保留时间、相对保留时间、峰面积、峰面积百分比、相对峰面积,见表3。
3.2.3 金银花标准煎液中主要色谱峰指认
通过比对精确相对分子质量、特征碎片峰,并结合Mass FragmentTM确定化合物的相对分子质量和可能分子式,比对已建立的目标数据库和文献[49],推测共有峰可能的化合物结构,相关离子推断见表4。其中对照品比对确认峰6,14,16 分别为 3咖啡酰奎宁酸(绿原酸)、芦丁和木犀草苷。通过与文献比较色谱峰轮廓[6],确定1,7,18,19,20分别为5咖啡酰奎宁酸(新绿原酸,cryptochlorogenic acid)、4咖啡酰奎宁酸(隐绿原酸,cryptochlorogenin acid)、3,4二咖啡酰奎宁酸(异绿原酸B,isochlorogenic acid B)、3,5二咖啡酰奎宁酸(异绿原酸A,isochlorogenic acid A)、4,5二咖啡酰奎宁酸 (异绿原酸C,isochlorogenic acid C)。
3.2.4 金银花标准煎液过程指标参数的测定
12批煎剂出膏率范围为30%~39%,平均值为34.2%,不同批次的出膏率相差不大。转移率以绿原酸计算为68%~90%,平均转移率为78.6%。平均密度为1.02 g·cm-3,不同批次之间密度没有差异。
4 讨论
本文对标准煎液的质量控制主要从3方面把关:①药材源头控制:药材具有代表性,共12个批次,对药材鉴定精确到物种,质量标准符合2015年版《中国药典》各项规定;②制备过程控制:标准煎液的制备过程有统一的标准化操作[1],所得12批煎剂出膏率为(34.2±2.9)%,转移率以绿原酸计算为(78.6±8.4)%,平均密度为1.02 g·cm-3;③标准煎液的质量控制:采用化学指纹图谱、指标成分含量测定相结合的模式,从整体定性和指标成分定量的角度标定煎剂的化学轮廓和质量标准。且对16个主要的共有峰进行了成分指认,明确了标准煎液中的主要成分。这将为所有源于金银花水煎剂的制剂的制备和质量控制提供参照。
2015年版《中国药典》以绿原酸和木犀草苷含量作为判断药材是否合格的标准。但由于标准煎液中木犀草苷色谱峰小,质量分数为0.016%~0.05%,含量偏低,因此本实验对金银花标准煎液仅标定了绿原酸的含量范围,而木犀草苷作为指纹图谱共有峰进行定性标定。
指纹图谱是有效控制标准煎液、配方颗粒等失去中药外表特征的中药制剂的有效手段。本文所得12批金银花标准煎液的相似度值均大于0.98,相似度良好。对9个主要的共有峰进行相对保留时间和峰面积计算,其中单峰面积占总峰面积大于或等20%共有峰,其差值为6%;相对峰面积在10%以下的色谱峰,其变化范围暂不要求。因此,12批金银花标准煎液具有稳定的相似度结果和相对峰面积,表明不同批次药材水提液之间一致性良好。但峰面积大于10%而小于20%的峰为马钱子苷,该峰宽且峰面积批次间差异大,其原因有待进一步考察。
通过采用UPLC-Q-TOF-MS对指纹图谱中的主要色谱峰进行了结构鉴定,明确了金银花水煎液中的主要成分。通过质谱分析共鉴定了6个有机酸、2
个黄酮类和8个环烯醚萜类成分。已有文献[7]对20批金银花测定结果显示,药材中绿原酸的质量分数范围为1.8%~3.6%,木犀草苷为0.05%~0.185%,芦丁为0.05%~0.19%,总黄酮的质量分数约为0.2%[5],獐牙苦菜苷可高达6.9%[10]。结合已报道的含量测定结果和本文所得的峰面积比例,可知,金银花中有机酸和环烯醚萜类(iridoids)是主要的大类成分,而黄酮类成分所占比例很小。而且环烯醚萜类化合物具有保肝利胆、抗氧化、抗肿瘤等重要活性[9]。因此,建议金银花的多指标含量测定的质量标准应该考虑绿原酸和环烯醚萜类成分。
指纹图谱采集选择了3个检测波长。环烯醚萜类的最大吸收波长为237 nm,绿原酸的最大吸收为327 nm,黄酮类的最大吸收为350,255 nm。因此,327 nm用于绿原酸的含量测定;350 nm 用于木犀草苷的含量测定,但是所测药材中该成分含量均低,没有列入质量标准范围; 238 nm下,含量最高的成分绿原酸的吸收变弱,而环烯醚萜类有最大吸收,黄酮类也有较强吸收,因此本文选择237 nm用于指纹图谱的采集,该波长下的指纹图谱共有峰多,能反应出金银花水煎液中的主要化学成分,因此优于传统的327 nm下的指纹图谱。
对于标准汤剂的质量评价方面,主要采用单成分的含量测定和指纹图谱轮廓分析相结合的模式进行,其中含量测定成分为指纹图谱中的参照峰。含量测定对指标成分进行了定量测定,指纹图谱中以该成分为参照峰,对所有的共有峰进行相对保留时间、相对峰面积和峰面积的标定,二者结合,基本达到了对标准汤剂的整体质量评价。该方法比已有的单成分的含量测定方法,在方法的整体性方面具有很大的进步性。
转移率和出膏率重点主要考察制备工艺的稳定性或者均一性,而含量测定主要考察最终所得不同批次汤剂质量的均一性。对于转移率和含量的计算,采用同一指标成分,优先考虑药典对饮片规定的指标成分。若药典指标成分为脂溶性,转移率很低,基本不能提出来,汤剂中含量也很低,不适合作为评价指标,笔者会重新找新的指标成分。选择不同的指标成分,其转移率可能会有差别,尤其对于同一药材中水溶性好和水溶性差的化合物而言,水溶性好的转移率要高于水溶性低的成分。研究结果显示,如果指标选择合理,工艺一致,转移率的变化范围一般可以固定在均值的75%~125%。
采用本文建立的方法,所得金银花标准煎液的平均出膏率为(34.2±2.9)%,出膏率范围为30%~39%,位于均值的75%~125%;金银花标准煎液中绿原酸的平均转移率为(78.6±8.4)%,转移率范围为68%~90%,位于均值的75%~125%;密度为(1.02±0.0) g·cm-3;所得煎剂中绿原酸平均浓度为(4.3±0.7) g·L-1,浸膏粉中绿原酸平均量为(6.4±1.1)%,均位于均值的75%~125%。这些数据表明金银花标准煎液质量均一性良好。
[参考文献]
[1] 张红梅, 宋景政, 谭红胜, 等. 从煎液到颗粒剂:中药配方颗粒20年回顾与展望[J]. 世界科学技术——中医药现代化, 2012(4):1740.
[2] 陈士林,刘安,朱广伟, 等. 中药饮片标准汤剂研究策略[J].中国中药杂志, 2016, 41(8): 1367.
[3] 中国药典.一部[S]. 2015:221.
[4] 宋亚玲, 倪付勇, 趙祎武, 等.金银花化学成分研究进展[J].中草药,2014,45(24): 3656.
[5] 黄雄, 李松林, 李萍, 等. HPLC法同时测定金银花中8种黄酮的含量[J].药学学报, 2005, 40(3):285.
[6] 何兵, 刘艳, 李春红, 等.多指标定量指纹图谱在中药金银花质量评价中的应用[J].中国药学杂志, 2015, 50 (14):1237.
[7] 王倩, 王建新, 于治国, 等. 金银花药材高效液相色谱指纹图谱研究[J].中成药, 2015,37(9):1973.
[8] Zhang Y-D, Huang X, Zhao F-L, et al. Study on the chemical markers of Caulis Lonicerae Japonicae for quality control by HPLC-QTOF/MS/ MS and chromatographic fingerprints combined with chemometrics methods[J].Anal Methods, 2015,7(5):2064.
[9] 夏远,李弟灶,裴针昭,等.金银花化学成分的研究进展[J].中国现代中药,2012,14 (4):26.
[10] 刘征辉, 徐石勇, 赵琳琳, 等.金银花中抗炎活性成分獐牙菜苷和獐牙菜苦苷定量方法的研究[J].中国现代中药, 2016, 18(3): 321.
[责任编辑 丁广治]
