玄参内生真菌分离、鉴定及系统发育分析
2017-04-06伍晓丽宋旭红杨宏国刘飞张雪刘金
伍晓丽+宋旭红+杨宏国+刘飞+张雪+刘金亮+陈大霞+李隆云


[摘要]分别从武隆产区玄参根、主茎、侧枝、叶片和重庆市区栽培玄参侧枝中分离内生真菌,根据形态学特征和26SrDNA D1/D2测序结果对其进行鉴定,并进行了种群多样性分析,对优势属炭疽菌属内生真菌构建了系统发育树。试验结果显示:真菌种群多样性指数,武隆玄参叶片>主茎=侧枝>根,重庆玄参侧枝>武隆玄参侧枝。共计分离得到内生真菌58株,绝大部分是各种植物病原菌,其优势属为刺盘孢属Colletotrichum,其中绝大多数是C. gloeosporioides和C. boninense。叶片和子芽可能是内生菌侵染的主要途径;内生菌和病原菌可能相互转化,受环境、基因型等多种因素影响。
[关键词] 玄参; 内生真菌; 鉴定; 系统发育分析
[Abstract] The endophytic fungi from root, main stem, branch and leaf of Scrophularia ningpoensis were isolated and identified from Wulong and Chongqing, and the population diversity analysis and phylogenetic analysis were followed. The result indicated that, as to population diversity index, S. ningpoensis from Wulong: leaf>main stem = branch>root, branch from Chongqing>branch from Wulong. Fifty-eight endophytic fungi were obtained, most of which were the pathogens of the plant. Colletotrichum was the prevailing genus, of which C. gloeosporioides and C. boninense were the prevailing strains. Leaf and seedlings might be the main path of infection. Endophytic fungi and pathogen might convert to each other, influenced by such factors as environment, genotype et al.
[Key word] Scrophularia ningpoensis; endophytic fungi; identification; phylogenetic analysis
玄參为玄参科玄参属植物玄参Scrophularia ningpoensis的干燥根,始载于《神农本草经》,性微寒,味甘、苦、咸,具有凉血滋阴、泻火解毒的功效,主治热病伤阴诸证,如骨蒸、痨咳、津伤便秘、温毒发斑,及目赤、咽痛、臃肿等[1]。玄参是我国大宗药材品种,市场需求巨大。目前玄参栽培以施用化肥为主,多年连续施用影响药材品质,损害土壤肥力,破坏生态环境。而很多植物内生菌对宿主具有明显的促生作用。内生菌(endophyte) 广泛存在于植物各器官、组织细胞内及细胞间隙,其种类随宿主植物种类、植株器官、地域、季节气候而变化,具有丰富的多样性,国内外相关研究报道很多[2-5]。有研究表明,内生菌及其代谢产物具有拮抗、促生长、抗肿瘤等多种活性,可广泛应用于农业、工业、医药领域[6-9]。玄参内生菌方面的研究极少,仅见文献报道了玄参块根内生菌产哈巴俄苷的相关研究,且未明确鉴定出内生菌的种类[10]。本研究对玄参内生真菌进行了分离和鉴定,并对优势属炭疽菌属内生真菌进行了系统发育分析,旨在为筛选对玄参具有促生长作用的内生真菌,研发微生物肥料,减少化肥施用奠定基础。同时也揭示了玄参内生真菌的分布规律,为进一步研究玄参化学成分与内生菌的相关性,筛选活性物质提供前期基础。
1 材料
1.1 试验材料采集
2015年8月,在玄参生长盛期,分别采取重庆市中药研究院植物园(以下简称植物园,海拔400 m,北纬29.35°,东经106.33°)人工栽培玄参的侧枝和重庆武隆仙女山杨柳村玄参基地(海拔1 350 m,北纬 29.43°,东经 107.77°)人工栽培玄参全株(叶、主茎、侧枝、根),采回后立即进行内生真菌分离。
1.2 试剂与仪器
Takara9164和RR178试剂盒购自宝生物公司。DYY-6C水平电泳仪,PTC-100 型 PCR仪,Gel Doc XR凝胶成像仪。
1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA):土豆200 g,切碎块,煮汁过滤,加葡萄糖20 g,琼脂粉7 g,定容至1 L。
2 方法
2.1 内生真菌分离与纯化
植物园栽培玄参植株上部、中部、下部健壮无病虫害侧枝各取3~5枝,全部混合后剪3 cm长小段。仙女山玄参植株分解为块根、主茎、侧枝、叶片。块根洗去泥土,轻轻刮去表面薄皮,洗净,切小块;植株主茎上部、中部、下部各取一段(约15~20 cm长)后混合,剪3 cm长小段;植株上部、中部、下部健壮无病虫害侧枝各取3~5枝,全部混合后剪3 cm长小段;植株上部、中部、下部健壮无病虫害叶片各取4~6片后全部混合,剪3~4 cm2小块。以上材料用洗衣粉水洗涤2 min,流水冲洗40 min,75%乙醇洗涤1 min,0.1%升汞消毒5 min,无菌水洗涤4次,取最后一次洗涤的洗液数滴于PDA涂布,共接种3皿,作为对照。材料用无菌滤纸吸干后,再次将根块分为1 cm2小薄片,茎段剪0.5~1 cm长小段,叶片切0.5~1 cm2小片,接种PDA。对照和材料均置于25 ℃培养箱,黑暗,培养5~10 d后,挑取组织周围长出的菌丝转接入 PDA平板中纯化,直到得到纯净无污染的菌落。
2.2 内生真菌鉴定
2.2.1 形态观察 观察培养的内生真菌菌落形态,对照《真菌鉴定手册》[11],根据菌落以及菌丝体和孢子的形态特征进行鉴定。
2.2.2 分子鉴定 采用Takara9164和RR178试剂盒对分离出的内生真菌进行基因组 DNA 提取及26S rDNA D1/D2区域序列 PCR扩增。
真菌基因组DNA提取:挑取少量菌丝体于1.5 mL EP管,加入Takara 9164 真菌裂解液50 μL,80 ℃水浴15 min,4 000 r·min-1离心,取上清液作为PCR模板。
PCR(50 μL) 体系:ddH2O 20 μL;PCR premix(Takara) 25 μL;真菌DNA模板 4 μL;D1/D2 Forward Primer和D1/D2 Reverse Primer(Takara)各0.5 μL PCR扩增条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环30次,72 ℃延伸 10 min。 扩增产物经琼脂糖凝胶电泳检测后送华大基因公司测序。
2.3 种群多样性分析
定义 ITS-rDNA 序列同源性大于97%,同属菌株作为同一分类单元[12],计算Shannon-Wiener 指数(H)[13]。H=-∑(Pi)(log2Pi),Pi为样品中属于第i种的个体的比例。
2.4 DNA 序列分析及系统发育树构建
登陆NCBI(http://www.ncbi.nlm.nih.gov/)利用 BLAST将测序获得的各菌株26S rDNA D1/D2区域序列与GenBank中的已知序列进行比对,查找相似性最高的菌种,结合形态学特征,确定分离菌株的分类地位。并用MEGA6.0 软件按照鄰接法(Neighbour-Joining,N-J),自展数(bootstrap)为 1 000,构建系统发育树。
3 结果与分析
3.1 玄参内生真菌的分离
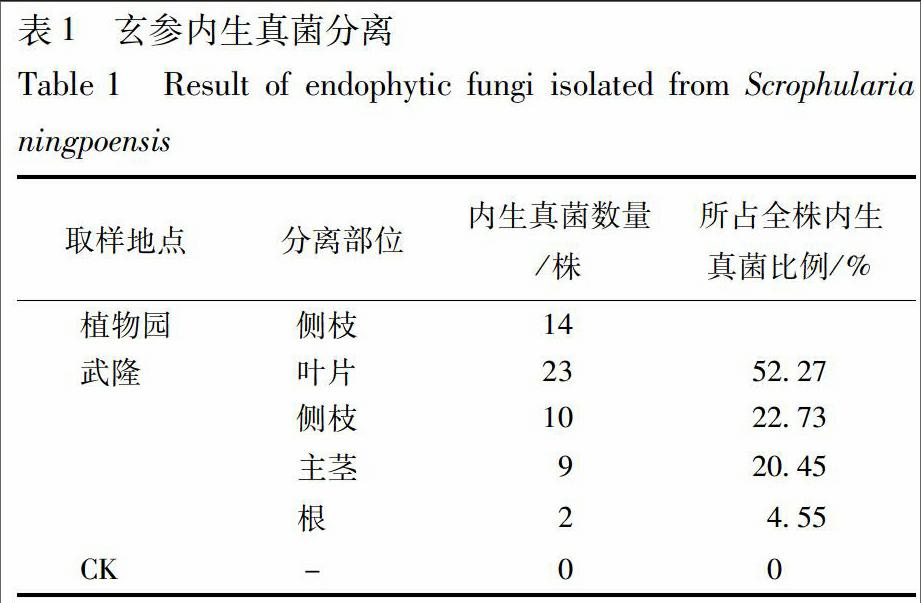
内生真菌分离结果见表1,对照平板没有菌生长。内生真菌含量叶片>侧枝>主茎>根。植物园玄参侧枝>武隆玄参侧枝。研究中还发现,内生真菌的分离效果还受到培养基、培养温度等因素影响。但总体来说,根部内生菌含量不如茎、叶高。
3.2 玄参内生真菌鉴定
玄参内生真菌菌落形态及分子鉴定结果见表2。分离出的内生菌形态多种多样,见图1。
从表2可见,武隆基地玄参内生真菌从种类来看,在所有鉴定出的41株菌株中,炭疽菌属Colletotrichum有24株,占总数的58.54%;其次是枝穗霉属Clonostachys 6株和茎点霉属Phoma 5株,分别占14.63%,12.2%。在24株炭疽菌属菌株中,有41.67%是胶孢炭疽菌C. gloeosporioides,29.17%是博宁炭疽菌C. boninense。可见炭疽菌属Colletotrichum是武隆玄参内生真菌的优势属,而其中胶孢炭疽菌C. gloeosporioides和博宁炭疽菌C. boninense是优势种。
从分布部位看,叶片中Colletotrichum占绝对优势,占叶片内生真菌总量的71.43%,且以C. gloeosporioides和C. boninense为主;侧枝中Colletotrichum也占绝对优势,占侧枝内生真菌总量的77.78%,仍然以C. gloeosporioides和C. boninense为主;主茎中Clonostachys sp.和Phoma sp.各占30%,Colletotrichum数量上占相对弱势;根中的内生真菌仅2种。
各部位横向比较,侧枝和叶片中真菌种类接近,均以C. gloeosporioides,C. boninense为主,兼有Clonostachys sp.,Glomerella fioriniae,即侧枝中77.78%的真菌与叶片中真菌一致;而主茎中只有55.56%的真菌在叶片中存在;主茎和侧枝共有的真菌不多,仅有C. gloeosporioides,Clonostachys sp.这2种菌在叶片中也存在;主茎、叶片和根均有Phoma sp.。
植物园的玄参茎部内生菌,从种类看,50%是Colletotrichum,其中以C. gloeosporioides为主。可见和武隆玄参侧枝一样,Colletotrichum是优势种属,C. gloeosporioides是优势种。
将植物园的玄参侧枝内生真菌和武隆基地玄参侧枝内生真菌横向比较,C. gloeosporioides 是二者共有的菌,且是相同菌株,均是C. gloeosporioides strain CMT53 和C. gloeosporioides strain HC-73,不过植物园玄参侧枝中的C. gloeosporioides isolate IA11在武隆玄参侧枝中未分离到。
以上真菌,有14株仅鉴定到属,主要是Phoma sp.,Clonostachys sp.,Penicillium sp.,Phomopsis sp.,说明这14株可能包含尚未发现的新种。
3.3 玄参内生真菌种群多样性分析
计算多样性指数结果如下:武隆玄参叶片3.268,主茎2.725,侧枝2.725,根1.000,植物园侧枝3.379。以叶片中真菌多样性最高,其次是主茎和侧枝,根部最低。植物园玄参侧枝内生真菌多样性高于武隆基地玄参植株的侧枝。
3.4 玄参炭疽菌属内生真菌系统发育树构建结果
根据前述分子鉴定结果,选取20个近缘种的菌株,与分离所得炭疽菌属菌株构建系统发育树,结果见图2。
从图2可见, 13株与C. gloeosporioides的不同株系聚到一起;12株与C. boninense的不同株系聚到一起;2株与C. crassipes聚为一枝;各有1株分别与C. abscissum,C. destructivum,C. kahawae,C. fructicola聚为一枝。C. gloeosporioides组可分为4个亚组,以C. gloeosporioides strain HC-73亚组菌株数最多;C. boninense组也可分为4个亚组,以C. boninense CMT17亚组的菌株数最多。
4 讨论
4.1 内生真菌的普遍性和多样性
内生菌在植物体中的分布具有普遍性、多样性的特点。在目前研究过的所有植物中均发现有内生菌[14-15]。各植物体中存在的内生菌的数量、种类受植物的种类、组织、生存环境、生长阶段、营养供给及两者的基因型等多种因素影响[16]。本研究结果再一次证明了同一植株,不同器官的内生真菌组成不同;同样的器官和取材季节,不同取材地点的玄参侧枝内生真菌组成不同。武隆玄参侧枝内生真菌多样性就远小于植物园玄参侧枝,推测是由于植物园海拔低(400 m左右),气温较高,环境中真菌种类繁多。而武隆基地海拔高(1 400 m左右),气温低,环境中真菌种类较少。
4.2 玄参内生真菌入侵途径分析
内生菌可通过多种途径对宿主植物进行侵染。可从植物叶片的外表皮渗入,也可以通过分解植物表皮细胞壁或通过各种自然开口(包括侧根发生处、气孔、水孔等)或伤口等传播途经进入植物[17-21]。就玄参而言,内生真菌浸染植株可以通过几个途径:块根浸染,子芽带菌,茎部侵染,叶部侵染。前述真菌多样性分析结果和分子鉴定的结果表明,侧枝中77.78%的真菌与叶片中真菌一致;而主茎中只有55.56%的真菌在叶片中存在;主茎和侧枝共有的真菌仅有C. gloeosporioides,Clonostachys sp.,这2种菌在叶片中也存在;主茎、叶片和根均有Phoma sp.。分析玄参各部位的特性:根部表皮较致密,除了土壤或昆虫造成的微小伤口,其余部位不利于真菌入侵,且根部组织致密不透气,水分较多,不利于多数真菌定殖;叶片表皮细胞柔软,有大量气孔,适合真菌入侵,且叶片内部组织疏松透气,有一定弱光,水分适宜,适合很多真菌定殖;茎部表皮较硬,不适合真菌入侵,但内部疏松透气,水分适宜,适合真菌定殖;此外,笔者曾分离子芽内生真菌,得到多达7个菌,和主茎、侧枝带菌量相近。根据以上分析推测,玄参中大多数内生真菌是从叶片(气孔、伤口等)入侵,经侧枝到主茎,最后进入根部。其次是子芽本身内部带菌以及褶皱带菌侵入幼茎。而根部、主茎、侧枝也可以由微小伤口侵染少量内生真菌。即叶片是玄参内生真菌侵入的主要途径,子芽带菌是次要途径。由此也可以推测,大多数玄参病原真菌也是由叶片和子芽侵入植株。因此,预防玄参病害,应该主要在叶面喷施药剂,其次,应该选择健壮无病子芽以及对子芽进行杀菌药剂浸泡。
4.3 内生菌和病原菌的关系探讨
目前,植物内生菌较被公认的定义是指那些在其生活史的一定阶段或者全部阶段生活于健康植物的各种组织和器官内部的真菌或者细菌,被感染的宿主植物(至少是暂时)不表现出外在症状[22]。它们不仅包括了互惠共利的和中性的内生共生微生物,也包括了那些潜伏在宿主体内的病原微生物。根据这个概念,内生菌和病原菌的界限就比较模糊。有的内生菌对宿主具有一定毒性,在双方的各种力量处于均衡状态,寄主不会产生明显的病症。如果这种均衡被破坏,比如在宿主植物衰老或受环境条件胁迫导致抵抗能力减弱,则内生菌有可能使宿主致病或抑制宿主植物生长[23-24],即转化为了病原菌。如Faeth[25]发现,在贫瘠的土地上感染Festuca arizonica的植物明显比没有感染的植株生长慢,而在營养丰富条件下生长的植株则不存在这种现象。此外,曹理想等[26]发现健康香蕉叶中的内生真菌主要为C. gloeosporioides,占60.7%;而曾大兴[27]的研究文献提到,C. gloeosporioides和引起香蕉果实腐烂的香蕉炭疽病菌C. musae在分子水平其实差异很小,至今C. musae是独立的一个种还是属于C. gloeosporioides仍然存在很大争议。这从一个侧面佐证了内生菌和病原菌其实可能相互转化。
可见,同一植物中,对有的内生真菌而言,是作为内生菌促进宿主生长、对宿主无影响还是作为病原真菌导致宿主病害,受地理位置、季节、外界小环境变化、宿主基因型及生理状态、真菌自身基因型及活性等多种因素影响。这反映了自然界真菌与植物关系极其丰富的多样性、可变性以及动态平衡。可以据此推断,不少病原菌初期就是以内生菌方式潜伏于宿主细胞中。内生真菌与宿主植物的关系见图3。绝大多数玄参内生真菌是各种植物的病原菌,Phoma sp.还是玄参叶斑病病原,见表3。玄参大田病害比较严重,推测分离出的内生真菌中可能有一些是玄参的病原菌,在条件不适宜爆发时,它们以内生菌的形态潜伏于玄参植株内,当条件合适,即导致玄参病害。
既然在外界条件适宜时,内生菌和致病菌是能够相互转换的,因此,在防治植物病害时,不能一味被动地在病害爆发后施用药剂,而应在充分研究发病条件的基础上,通过选择和培育壮苗、选育抗病品种、改变田间通风透光条件、选择栽培适合的地块等农艺措施预防病害,或在病害发生后通过这些措施促使致病菌向内生菌方向转换,从而治疗病害。
下一步笔者拟分别开展分离所得内生真菌对玄参的促生长作用和致病性研究,以筛选促生真菌,同时进一步研究内生菌和病原菌的内在联系。
[参考文献]
[1] 夏聪华,石森林,葛卫红,等.玄参药理活性研究进展[J]. 中国药师,2008,11(8):911.
[2] 王菲. 陕西汉中古旱莲内生菌多样性的研究[D].汉中:陕西理工学院,2016.
[3] 王雪君,贾瑞宗,郭运玲,等.水稻4个生长时期茎部可培养内生菌多样性分析[J]. 热带作物学报,2015,36(6):1078.
[4] 张辑.中国兰属植物内生菌多样性研究[D].北京:中国林业科学研究院,2012.
[5] 杨兵,张春英,王献,等.杜鹃花根系内生菌资源调查及多样性分析[J].河南农业大学学报,2010,44(3):290.
[6] 姚广龙,李乐,邢炎慧,等.海南全缘褶萼苔内生真菌的分离及抑菌活性的初步研究[J]. 化学与生物工程,2016,33(7):52.
[7] 董金香,邓毅,刘靓,等.甘肃栽培甘草内生菌发酵液与宿主水煎液、总黄酮、总皂苷体对LPS致raw264.7分泌炎症因子的影响[J].陕西中医药大学学报,2016,39(4):76.
[8] 阮迪申,曾加会,晁元卿,等.重金属胁迫下内生菌对宿主植物的解毒机制[J].微生物学通报,2016,43(12):2700.
[9] 王真真,徐婷,袁珊珊,等.水稻内生放线菌OsiRt-1的分离鉴定及对稻瘟病的防治作用[J].微生物学通报,2016,43(5):1009.
[10] 张林甦, 赵德刚.玄参愈伤、不定根和内生菌产哈巴俄苷的比较[J].中国实验方剂学杂志,2012,18(20):136.
[11] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:2.
[12] McCaig A E, Glover L A, Prosser J I. Molecular analysis of bacterial community structure and diversity in unim-proved and improved upland grass pastures[J].Appl Environ Microbio1, 1999, 65(4): 1721.
[13] 吴晓菡,李文超,秦路平.天目山山胡椒不同部位内生真菌组成及多样性分析[J].植物资源与环境学报,2012,21(2):107.
[14] Rodriguez R J, White Jr J F, Arnold A E, et al. Fungal endophytes: diversity and functional roles[J]. New Phytol, 2009, 182 (2):314.
[15] Rodriguez R, Redman R. More than 400 million years of evolution and some plants still can′t make it on their own plant stress tolerance via fungal symbiosis[J].J Expe Bot, 2008,59(5): 1109.
[16] 姚领爱,胡之璧,王莉莉,等.植物内生菌与宿主关系研究进展[J].生态环境学报,2010,19(7):1750.
[17] Hashiba T, Narisawa K. The development and endophytic nature of the fungus Heteroconium chaetospira[J].FEMS Microbiol Lett, 2005,252(2):191.
[18] 王坚,刁治民,徐广,等.植物内生菌的研究概况及其应用[J].青海草业,2008,17(1): 24.
[19] 孙剑秋,郭良栋,臧威,等.藥用植物内生真菌多样性及生态分布[J].生命科学, 2008, 38(5): 475.
[20] Kumar D S, Hyde K D. Biodiversity and tissue-specificity of endophytic fungi in Tripterygium wilfordii[J].Fungal Divers,2004,17(1):69.
[21] Arbara S, Christine B. The endophytic continuum[J]. Mycol Res,2005, 109(6): 661.
[22] 胡桂萍,郑雪芳,尤民生,等.植物内生菌的研究进展[J].福建农业学报,2010,25(2):2264.
[23] 杜素娟,郭晓恒.植物内生真菌对植物次生代谢产物的影响[J]. 现代农业科学, 2009, 16(5): 17.
[24] Kogel K H, Franken P,Ckelhoven R. Endophyte or para-site-what decides[J]. Curr Opin Plant Biol,2006,12(9):358.
[25] Faeth S H, Helander M L,Saikkonen K T. Asexual neotyphodium endophytes in a native grass reduce competitive abilities[J].Ecol Lett, 2004,7(4): 304.
[26] 曹理想,田新莉,周世宁.香蕉内生真菌、放线菌类群分析[J].中山大学学报:自然科学版,2003,43(2):70.
[27] 曾大兴,戚佩坤,姜子德.香蕉炭疽菌菌株亲缘关系的RAPD分析[J].菌物系统,2001,20(3):324.
[28] 琚亮亮.葡萄座腔菌(Botryosphaeria spp.)致病性分化及苹果轮纹病侵染来源研究[D].杨凌:西北农林科技大学,2014.
[29] 马健.杨树(Populus spp.)与茶藨子葡萄座腔菌(Botryosphaeria dothidea)互作中SA和H2O2的信号转导特征[D].北京:中国林业科学研究院,2012.
[30] 崔朝宇.江西葡萄生长后期3种烂果病害病原菌的初步研究[D].南昌:江西农业大学,2015.
[31] 邵帅,戴军,杜馨,等.降解黄曲霉毒素B-1菌株的发酵条件优化及降解机制[J].食品科学,2016,37(5):138.
[32] 曾学英.大叶桉炭疽病病原菌的鉴定及室内药剂筛选[J].林业科技开发,2015,29(4):121.
[33] 汤铱泠,周国英,李河,等.多基因序列鉴定油茶炭疽病原Colletotrichum boninense新种[J].热带作物学报,2015,36(5):972.
[34] 张国辉,王龙,任永权,等.药用植物太子参3种病害的病原鉴定与病害分析[J].江苏农业科学,2016,44(7):177.
[35] 何平,周娟,李敏慧,等.荔枝叶部真菌病害鉴定[C]. 广州:中国菌物学会第五届会员代表大会暨2011年学术年会,2011:2.
[36] 刘威,蒋妮,叶云峰,等.砂仁茎枯病病原菌的分离与鉴定[J].贵州农业科学,2014,42(11):127.
[37] 赵振玲,张智慧,杨维泽,等.云南黄莲、唐松草、开口箭炭疽病病原的初步鉴定[J].西南农业学报,2014,27(4):1543.
[38] 贾玉,郑翠梅,张广民,等.山东省主产烟区烟草炭疽病菌的鉴定与分子检测[J].山东农业科学,2012,44(4):10.
[39] 马甲强,王生荣,袁庆华,等. 苜蓿毁灭刺盘孢菌的主要生物学特性[J].植物保护,2016,42(4):105.
[40] 邢红梅,丁平,王克荣,等.红掌毁灭炭疽菌的分子检测[J].华中农业大学学报,2011,30(5):589.
[41] 李河,周国英,徐建平,等.一种油茶新炭疽病原的多基因系统发育分析鉴定[J].植物保护学报,2014,41(5):602.
[42] 刘威,叶乃兴,陈玉森,等.茶树炭疽菌Colletotrichum fructicola的鉴定及系统发育分析[J].茶叶科学,2014,34(1):95.
[43] 王薇,符丹丹,张荣,等.苹果炭疽叶枯病病原学研究[J].菌物学报,2015,34(1):13.
[44] 刘倩丽,周国英,刘成锋,等.檀香炭疽病病原鉴定及其生物学特性研究[J].热带作物学报,2014,35(11):2266.
[45] 张春霞,李加智,何明霞,等.两种橡胶炭疽病菌生物学特性的比较[J].西南农业学报,2008,21(3):667.
[46] 张荣,王素芳,崔静秋,等.陕、豫两省苹果炭疽病病原鉴定[J].中国农业科学,2009,42(9):3224.
[47] 赵振玲,刘丹婷,杨维泽,等.川芎炭疽病病原鉴定及4种杀菌剂对病原的抑制作用[J]. 安徽农业科学,2010,38(12):6260.
[48] 杨蕊,石明旺,赵荣艳,等.蒜薹炭疽病病原鉴定及其生物学特性研究[J].中国农学通报,2011,27(4):160.
[49] 张敬泽,胡东维,徐同.柿树炭疽菌侵染寄主的細胞学研究[J].菌物系统,2003,22(4):645.
[50] 戴启东,李广旭,杨华,等.树莓炭疽病病原菌鉴定[J].果树学报,2013,30(4):672.
[51] 张国辉,张文华,刘冬莲.八月瓜炭疽病的病原菌鉴定及病害分析[J].中国农学通报,2011,27(13):277.
[52] G O Alwora, E K Gichuru. Advances in the use of fungicides to manage coffee leaf rust and coffee berry disease in Kenya[C]. 北京:第十届国际植物病理学大会暨中国植物病理学会2013年学术年会,2013:1.
[53] 李秀丰,谢美华,李雪玲,等.一株石榴炭疽病病原真菌的鉴定[J].楚雄师范学院学报,2014,29(3):53.
[54] 杨友联,李树江,刘作易.虎耳草炭疽病病原菌鉴定[J].微生物学通报,2016,43(6):1.
[55] 周娜,胡军华,姚廷山,等.江津龙华W·默科特桔叶片黄化致病真菌的分离与鉴定[J]. 中国南方果树,2015,44(3):38.
[56] 杨友联,蔡磊,喻子牛,等.兰科植物上炭疽菌属真菌系统学研究[C].张家界:2010年中国菌物学会学术年会,2010:2.
[57] 商鸿生,贾明贵.白三叶黄斑病的发现和病原菌鉴定[J].草业科学,1990,7(2):35.
[58] 尹万瑞. 核桃枝枯病病原鉴定及药剂防治研究[D].雅安:四川农业大学,2015.
[59] 李淑斌,张颢.柏木枯萎病病原菌的形态特征及分子鉴定[J].华北农学报,2011,26(2):190.
[60] 袁志林,陈益存,汪阳东.一种新发生的油桐叶枯病病原真菌[J].菌物学报,2011,30(4):658.
[61] 杨友联,李树江,胡海雪,等.灰毡毛忍冬顶枯病病原菌的分子鉴定[J].西南农业学报,2015,28(5):2107.
[62] 倪萌.玄参叶斑病的病原学、发生规律及防治技术研究[D].武汉:华中农业大学,2009.
[63] 吕茹婧. 荸荠茎点霉秆枯病病原学及其毒素基本性质研究[D].武汉:华中农业大学,2012.
[64] 严加林.紫茎泽兰褐斑病的诊断鉴定及病原菌的主要生物学特性研究[D].重庆:西南大学,2014.
[65] 李诚,王禄,蒋军喜,等.猕猴桃果实熟腐病菌生物学特性及其寄主抗病性鉴定研究[J]. 江西农业大学学报,2014,36(5):1061.
[66] 梁臣,张宏敏,郎子建,等.桦树枯枝病病原菌的生物学特性研究[J].中国森林病虫,2008(2):4.
[67] 潘欣,邹立扣,彭培好,等.杜鹃褐斑病病原菌的分离与鉴定[J].北方园艺,2008(6):198.
[68] 张永信,刘晓杰,冯争光,等.金银花褐斑病病原检测和ITS鉴定[J].河北农业大学学报,2016,39(4):73.
[责任编辑 吕冬梅]
