麦冬寡糖的提取纯化及抑制α—葡萄糖苷酶活性的研究
2017-04-06许定舟苏薇薇王永刚彭维吴忠
许定舟+苏薇薇++王永刚++彭维++吴忠
[摘要] 目的 研究麦冬中寡糖的提取分离纯化工艺,并考察其抑制α-葡萄糖苷酶活性。 方法 采用乙醇和水提取麦冬寡糖,以Sephadex G-75柱层析法进行脱色脱蛋白,利用基质辅助激光解析飞行质谱仪(MALDI-TOF-MASS)检测其分子量范围;采用来源于啤酒酵母的α-葡萄糖苷酶和来源于大鼠的具有α-葡萄糖苷酶活性的小肠绒毛提取物,考察麦冬寡糖的抑制α-葡萄糖苷酶活性。 结果 采用乙醇和水提取得到的麦冬提取液中寡糖含量为86.73%,提取率为69.4%;利用Sephadex-G75柱层析法能有效地纯化麦冬寡糖,除去色素和蛋白质分子,麦冬寡糖提取物的总寡糖含量达到97.64%,其分子量范围在500~2500之间;该麦冬寡糖对α-葡萄糖苷酶活性具有显著抑制作用。 结论 本研究提取纯化麦冬寡糖的方法是合理、可行的;麦冬寡糖具有显著抑制α-葡萄糖苷酶活性。
[关键词] 麦冬寡糖;提取纯化;α-葡萄糖苷酶
[中图分类号] R284.1 [文献标识码] A [文章编号] 1673-7210(2017)02(a)-0020-03
Extraction、purification and α-glucosidase inhibitory activity of oligosaccharide from Ophiopogonis japonicas
XU Dingzhou SU Weiwei WANG Yonggang PENG Wei WU Zhong LI Peibo
College of Life Sciences,Sun Yat-sen University,Guangzhou 510275, China
[Abstract] Objective To investigate the extraction,purification and α-glucosidase inhibitory activity of oligosaccharide from Ophiopogonis japonicas. Methods In this study,Ophiopogonis japonicas oligosaccharides were extracted with 95% alcohol and water successively, and the extract was purified by Sephadex G-75 chromatography to remove protein and pigment.The molecular weight range was determined by MALDI-TOF-MASS. The α-glucosidases of rat intestines and Saccharomyces cerevisiae were used to evaluate the inhibitory activity of Ophiopogonis japonicus oligosaccharides. Results The content of oligosaccharide extracted with 95% alcohol and water successively was 86.73%,and the extraction rate was 69.4%. After being purified by Sephadex G-75 chromatography, the protein and pigment in oligosaccharide extract was removed effectively and the content of oligosaccharide increased to 97.64%.The molecular weights were in the range of 500-2500. Furthermore,Ophiopogonis japonicas oligosaccharide could significantly inhibit the activity of α-glucosidase. Conclusion The methods of extraction and purification are technically reasonable and feasible;Ophiopogonis japonicus oligosaccharide possess significant α-glucosidase inhibitory activity.
[Key words] Ophiopogonis japonicus oligosaccharide;Extraction and purification;α-glucosidase
麥冬为百合科植物麦冬[Ophiopogon japonicas (L.f) Ker-Gawl.]的干燥块根,有养阴生津、润肺清心之功,主要用于肺燥干咳、津伤口渴、内热消渴和肠燥便秘等[1]。《本草正义》记载[2]:“凡消谷能食,无非胃火极旺,必以甘寒大剂清胃解渴,麦冬固在必需之列者也”。有研究表明麦冬对四氧嘧啶[3]、链脲佐菌素[4-5]诱导的高血糖动物和自发性糖尿病大鼠[6]具有显著降血糖作用。麦冬中含有皂苷、黄酮、氨基酸和糖类等成分[7-8]。由于我国糖尿病发病人数逐年上升[9],麦冬显著的降血糖作用引起了越来越多的重视[10-12]。已有研究表明,麦冬多糖具有显著降血糖作用[3,5,12]。本课题组前期研究表明,麦冬寡糖具有显著抗2型糖尿病作用[13],但其作用机制尚不明确。本实验研究麦冬中寡糖的提取纯化工艺,并考察其抑制α-葡萄糖苷酶活性,现报道如下。
1 材料与方法
1.1 材料
1.1.1 原料与试剂 麦冬,购于广州清平药材市场,经中山大学生命科学学院彭维主任药师鉴定,为百合科植物麦冬Ophiopogon japonicas(L.f)Ker-Gawl.的干燥块根;α-葡萄糖苷酶(美国,SIGAMA);阿卡波糖(中国,拜耳医药保健有限公司);对硝基苯-β-D-半乳糖吡喃糖苷(美国,SIGAMA);蒽酮、无水乙醇、无水乙醚、丙酮、D-果糖等试剂均为分析纯。
1.1.2 设备与仪器 常压蛋白层析仪(美国,BIO-RAD);自动部分收集器(美国,BIO-RAD);双光束紫外可见分光光度计(TU-19101,北京普析通用公司);基质辅助激光解析飞行质谱仪(MALDI-TOF-MASS;美国,Bruker Daltonics);酶标仪(美国,THERMO公司);Sephadex G-75(瑞典,Pharmacia公司)。
1.2 动物
Wistar大鼠,7周龄,雄性,体重180~200 g,SPF级,由广东省医学实验动物中心提供,动物合格证号:SCXK(粤)2008-0002。
1.3 方法
1.3.1 麦冬寡糖的提取与纯化 取麦冬药材适量,剪碎,加10倍量95%乙醇,回流2 h,过滤,弃滤液,挥干乙醇,加10倍量蒸馏水,水浴提取2次,滤过,合并滤液,减压浓缩至密度为1.2 g/mL,加乙醇至醇浓度为80%,静置12 h,沉淀,分别以无水乙醇、无水乙醚、丙酮洗涤,55℃烘干,即得麦冬粗提取物。取麦冬粗提取物,溶于适量蒸馏水中,以3000 r/min的转速离心,除去沉淀,Sephadex G-75层析柱(3 cm×80 cm)上样,以蒸馏水洗脱,流速为0.5 mL/min。每管5 mL,自动部分收集器收集,合并洗脱峰,冷冻干燥,得到纯化后的麦冬寡糖。硫酸-蒽酮法测定总寡糖含量。将Sephadex G-75柱层析所得麦冬寡糖样品溶于超纯水,配成2 μg/mL溶液,分别取0.5 μL样品溶液与5mg/mL 的基质2,5-二羟基苯甲酸(DHB)互溶挥干溶液,采用MALDI-TOF-MASS进样检测麦冬寡糖的分子量范围。
1.3.2 麦冬寡糖对α-葡萄糖苷酶活性的影响 (1)大鼠小肠α-葡萄糖苷酶提取液的制取,参照文献方法[14],取Wistar大鼠,禁食24 h后,脱颈椎处死,立即取出小肠,用冰冷生理盐水冲洗小肠内外,将洗净的小肠置于冰台上,用载玻片轻刮小肠黏膜,称重后加入5倍量的4 ℃磷酸盐缓冲液(pH 6.8),匀浆后于4℃、5000 r/min冷冻离心30 min,取上清液,考马斯亮蓝法测定上清液蛋白含量,于-20℃下保存备用。(2)样品溶液配制,称取麦冬寡糖样品,用磷酸盐缓冲液(pH 6.8)溶解配制成浓度为400 mg/mL、200 mg/mL、100 mg/mL的麦冬寡糖溶液;取阿卡波糖片,以磷酸盐缓冲液(pH 6.8)溶解,2000 r/min离心10 min,弃沉淀,使终浓度为50 mg/mL。(3)α-葡萄糖苷酶抑制活性的测定,参照文献方法[15-16],以96孔微板为反应载体,经改进优化后的反应体系为:每孔加入67 mmoL/L磷酸盐缓冲液20 μL、3 mmoL/L谷胱甘肽溶液10 μL、大鼠小肠绒毛α-葡萄糖苷酶提取液或0.04 mg/mL α-葡萄糖苷酶溶液10 μL、受试样品20 μL,37℃温孵10 min后,加入0.01 moL/L对硝基苯-β-D-半乳糖吡喃糖苷溶液20 μL,反应20 min,用0.1 moL/L Na2CO3溶液100 μL终止反应,在波长为400 nm的条件下,用酶标仪测定吸光值。每组设三个平行,每个浓度测定三次抑制率,取平均抑制率计算受试样品和阳性对照阿卡波糖对α-葡萄糖苷酶活性的抑制率。
2 结果
2.1 麦冬寡糖的提取与纯化
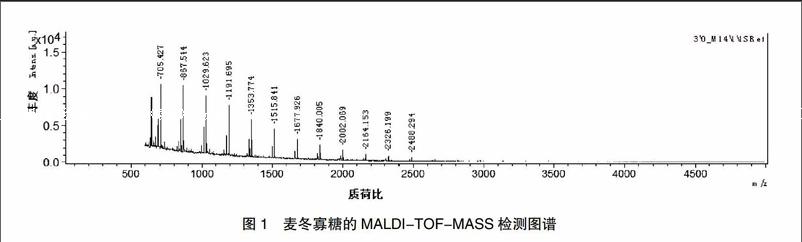
采用95%乙醇和水提取后,得到的麦冬提取物中寡糖的含量为86.73%,提取率为69.4%。经Sephadex G-75柱层析所得样品的寡糖含量为97.64%,样品颜色变为纯白色,色素得到有效去除。经MALDI-TOF-MASS进样检测,该麦冬寡糖的分子量范围在500~2500之间。见图1。
2.2 麦冬寡糖对α-葡萄糖苷酶活性的影响
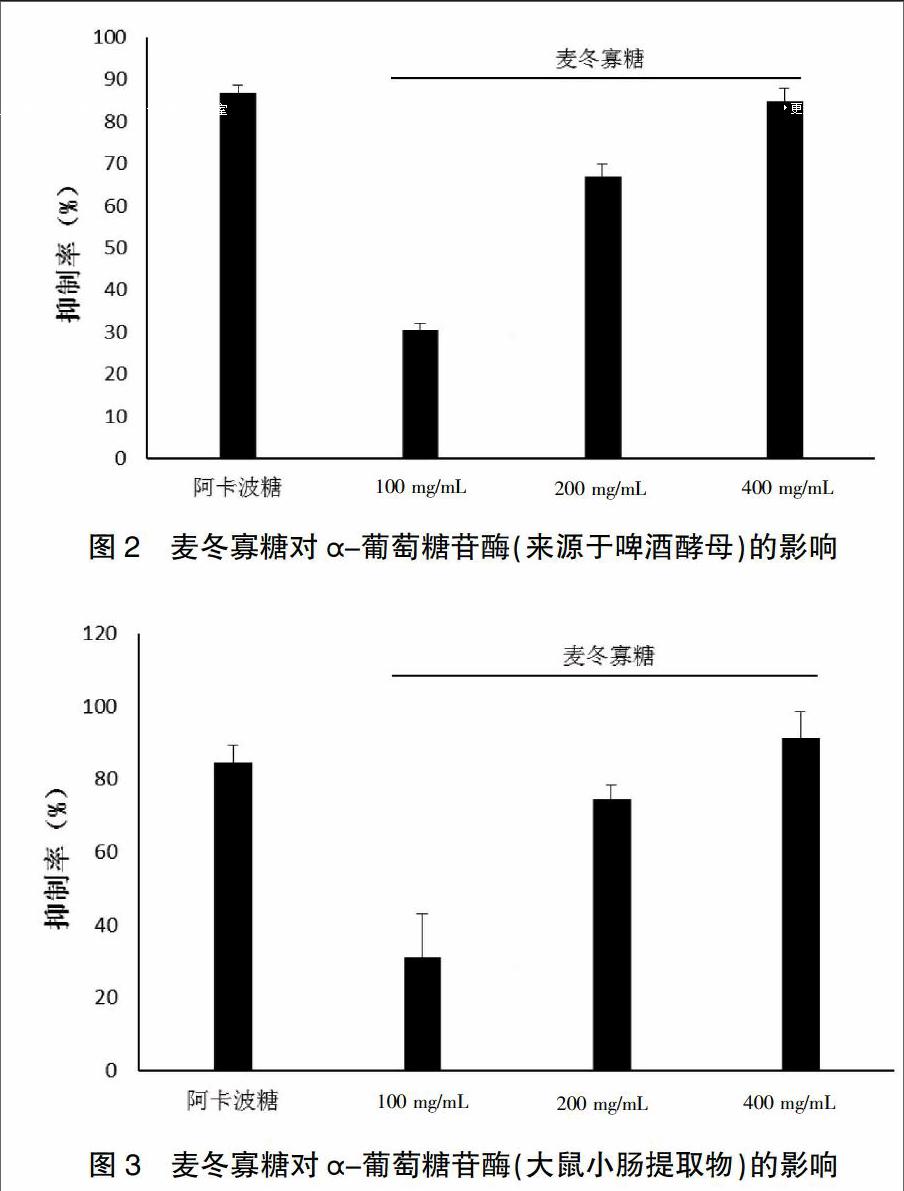
麦冬寡糖对来源于啤酒酵母的α-葡萄糖苷酶和大鼠小腸绒毛中提取的α-葡萄糖苷酶的酶活性都具有抑制作用,在浓度为100~400 mg/mL之间,抑制作用具有剂量依赖关系,当浓度为400 mg/mL时,抑制强度与阿卡波糖相当。说明麦冬寡糖具有抑制α-葡萄糖苷酶活性的作用。见图2~3。
3 讨论
寡糖一般是指由2~10个单糖以糖苷键相连形成的糖分子聚合物。寡糖及其衍生物是一类重要的生物活性物质,已发现其具有免疫调节、降血糖、改善菌群结构等多种作用[17-18]。目前,寡糖的制备方法主要有从天然产物直接提取、酶催化合成或酶解天然多糖、酸水解天然多糖和化学合成等4种[17]。天然寡糖的提取方法主要有水提法、有机溶剂抽提法、微波提取法、超声波提取法;常见的寡糖分离和纯化方法有薄层层析法、活性炭柱层析法、色谱柱分离法、膜分离技术等[19-20]。许多中药含有寡糖,且有些具有较好的药理活性,但目前对中药寡糖的研究较少,值得进一步深入开发研究。
本研究采用乙醇和水提取麦冬寡糖,得到的麦冬提取物中寡糖含量为86.73%,提取率为69.4%,说明本方法能较好地提取麦冬寡糖;经Sephadex G-75柱层析法除去色素和蛋白质分子后,麦冬寡糖提取物的总寡糖含量达到97.64%,样品颜色变为纯白色,提示该方法可以有效去除提取物中的蛋白和色素,适宜于麦冬寡糖的纯化。经MALDI-TOF-MASS检测,该麦冬寡糖的分子量范围在500~2500之间。课题组前期研究显示麦冬寡糖具有显著抗2型糖尿病作用[13],本研究结果表明,该麦冬寡糖能显著抑制来源于啤酒酵母的α-葡萄糖苷酶和来源于大鼠小肠绒毛的α-葡萄糖苷酶的活性。本研究为麦冬寡糖在糖尿病的预防和治疗方面的应用及相关产品的开发提供了一定的实验基础。
[参考文献]
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:155-156.
[2] 张山雷,程东旗,路志正.本草正义[M].福州:福建科学技术出版社,2006:118.
[3] 毛訊.麦冬多糖对糖尿病小鼠的作用研究[J].中医临床研究,2013,5(17):4-6.
[4] 陆小元.麦冬多糖对2型糖尿病大鼠肾脏的保护作用[J].实用临床医药杂志,2012,16(24):11-14.
[5] 何陵湘.麦冬多糖降血糖作用的药效学观察[J].中国实用医药,2007,2(16):48-50.
[6] 沙建平,马红英,陈晓文,等.麦冬对糖尿病大鼠胰岛β细胞的保护作用[J].成都中医药大学学报,2014,37(3):23-24.
[7] 袁春丽,孙立,袁胜涛,等.麦冬有效成分的药理活性及作用机制研究进展[J].中国新药杂志,2013,22(21):2496-2502.
[8] 罗霄,张兴国,杨言琛,等.麦冬黄酮类成分的研究进展[J].中国中医药科技,2015,22(5):603-605.
[9] 吉柳,汤新强,彭金咏.基于糖代谢酶调节作用的中药抗糖尿病研究进展[J].中国中药杂志,2012,(23)16:3519-3525.
[10] 王慧,杨硕,李巍.可用于保健食品-中药麦冬的药理活性研究新进展[J].亚太传统医药,2011,7(7):153-155.
[11] 宁萌,潘亮,谢文利,等.麦冬提取物的降糖作用及其抗胰岛素抵抗的机制研究[J].解放军医学杂志,2013,38(1):26-29.
[12] 杨金颖,孙芳芳.麦冬多糖的药理作用研究[J].天津药学,2016,28(2):52-55.
[13] Li PB,Lin WL,Wang YG,et al.Antidiabetic activities of oligosaccharides of Ophiopogonis japonicus in experimental type 2 diabetic rats[J].International Journal of Biological Macromole,2012,51(5):749-755.
[14] Dahlqvist A.Method for assay of intestinal disaccharidases[J].Anal Biochem,1964,7(1):18-25.
[15] 张冉,刘泉,申竹芳,等.应用α-葡萄糖苷酶抑制剂高通量筛选模型筛选降血糖中药[J].中国药学杂志,2007, 42(10):740-743.
[16] 李婷,张小东,宋聿文,等.一种用微孔板筛选alpha-葡萄糖苷酶抑制剂的方法[J].中国临床药理学与治疗学,2005,10(10):1128-1134.
[17] 董权锋,于荣敏.寡糖研究新进展[J].食品与药品,2009, 11(7):63-66.
[18] McCranie EK,Bachmann BO.Bioactive oligosaccharide na?鄄tural products[J].Nat Prod Rep,2014,31(8):1026-1042.
[19] 管宁,韩建东,李瑾,等.天然寡糖的研究进展[J].山东农业科学,2013,45(7):141-145.
[20] 傅青,张秀莉,郭志谋,等.寡糖色谱分离研究进展[J].生命科学,2011,23(7):703-710.
(收稿日期:2016-09-28 本文编辑:王雪)
