疏水修饰磁性壳聚糖载药纳米粒子的制备与表征
2017-04-05郝和群郑慧芳
郝和群,郑慧芳,张 舰
(1. 皖西学院材料与化工学院,安徽六安 237012;2. 安徽省仿生传感与检测技术省级实验室,安徽六安 237012;3. 皖西学院高分子材料改性工程技术研究中心,安徽六安 237012)
研究论文
疏水修饰磁性壳聚糖载药纳米粒子的制备与表征
郝和群1,2,郑慧芳1,张 舰3*
(1. 皖西学院材料与化工学院,安徽六安 237012;2. 安徽省仿生传感与检测技术省级实验室,安徽六安 237012;3. 皖西学院高分子材料改性工程技术研究中心,安徽六安 237012)
利用O-羧甲基壳聚糖(O-CMC)的表面多种官能团(如-NH2,-OH,-COOH等)与胆酸(CA)进行化学修饰得到两亲性共聚物,再以反溶剂法将Fe3O4和阿霉素(DOX)包埋在两亲性共聚物疏水的核中,制备两亲性的磁性壳聚糖载药纳米粒子,并对磁性载药纳米粒子的形貌、粒径大小、磁性、药物控释等进行了研究。结果表明:磁性壳聚糖纳米粒子有较高的药物包埋效率(92.3%),与自由阿霉素相比,磁性复合物具有明显的缓释作用和pH响应性;同时,有较好的超顺磁性。这些说明制备的疏水修饰磁性壳聚糖载药纳米粒子具有双重响应性,有望作为药物输送载体对肿瘤进行实时跟踪、诊断和治疗。
O-羧甲基壳聚糖 Fe3O4阿霉素 控释
癌症是导致人类死亡的主要疾病之一。在抗肿瘤研究领域,虽然许多国家在过去的几十年里都投入了巨额的研究经费,但在降低癌症死亡率方面并不是很理想。导致这一现象的原因有很多,其中一个重要原因是缺乏对肿瘤的早期诊断、检测以及疗效监测的方法。而早期诊断在很大程度上依赖于分子影像技术,如核磁共振成像(MRI)、X射线、CT、PET、超声和光学成像等影像技术,获取有用的生物学信息,满足肿瘤的诊断、监测[1-2]。
目前,国内外已经报道了多条靶向可控治疗途径,如以抗体识别直接靶向治疗;通过特殊性能的纳米微粒为药物载体导向治疗等。其中,通过聚合物纳米载体实现药物的靶向与可控释放成为了近年来的一个研究热点。通过纳米载体对药物进行控制释放和靶向定位给药可以在减少药物用量的情况下有着更好的治疗的效果,这些给患者带来了许多的便利,也为患者减轻了很大的痛苦[3]。
O-羧甲基壳聚糖(O-CMC)是壳聚糖通过6位羟基与羧基反应得到的,相比于壳聚糖,其好的水溶性、生物相容性、生物活性、抗肿瘤活性等在早期的文献中已报道[4-5]。O-CMC表面富含多种官能团,如-OH、-NH2和-COOH,利用这些官能团,对其进行化学修饰便得到不同功能作用的纳米粒子。如疏水修饰可以制备两亲性共聚物,在水中自组装形成胶束,可以将脂溶性分子包埋在其疏水的核中,而亲水的壳在纳米粒子的表面。基于上述的理论,本文以胆酸疏水修饰的O-CMC为载体制备两亲性的磁性壳聚糖载药纳米粒子,并对磁性载药纳米粒子的粒径大小、形貌、磁性、药物控制等方面进行了表征和测试。
1 试 验
1.1 实验原料
O-羧甲基壳聚糖,分子量10万,生物试剂,山东海得贝海洋生物有限公司;盐酸阿霉素,纯度>98%,浙江海正药业有限公司;胆酸(CA),纯度98%,Bio Basic 公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺 (EDC),分析纯,SIGMA-ALDRICH公司;牛血清白蛋白(BSA,Grade Ⅳ),Amersharm Bioscience公司;N-羟基琥珀酰亚胺磺酸钠(NHS),分析纯,SIGMA-ALDRICH公司;二甲基亚砜(DMSO)分析纯,国药集团。其余试剂未经说明均为分析纯,使用前均未纯化,实验中所有的溶液均用电阻为18.2 MΩ 超纯水,经 0.45 μm 滤膜过滤后配制的溶液。
1.2 主要仪器设备
水浴锅,长城科工贸,W201B型;冷冻干燥仪,宁波新芝,SCIENTZ-10N;傅立叶变换红外光谱仪,美国赛默飞,IS5,测试波数范围400~4 000 cm-1;X-射线粉末衍射仪,丹东通达,TD-3500型,测试角度为20°~80°;纳米粒度仪,美国布鲁克海文,90PLUS ZETA型;紫外可见分光光谱,北京普析,TU-1950,测试波长范围为190~700 nm;核磁共振仪(1H-NMR),美国赛默飞, NEXUS-470型;动态光散射仪,德国ALV,ALV/CGS-SF;透射电子显微镜,日本电子,JEM-2100plus;磁性分析仪(VSM),美国Quantum,MPMS。
1.3 疏水修饰磁性壳聚糖载药纳米粒子的制备
O-羧甲基壳聚糖的疏水性修饰的制备在文献[6]的方案上进行了修改,称取0.200 5 g CA ,0.156 4 g NHS和0.111 8 g EDC,溶于25 mL DMSO,并在避光、30 ℃和氮气气氛下活化溶液中的胆酸。活化0.5 h后向上述溶液加入0.200 5 g O-羧甲基壳聚糖,继续反应24 h。所得溶液(O-CMC-CA)用截留分子量为3 500的透析袋对PBS缓冲液(10 mmol/L,pH7.4磷酸缓冲液含有0.15 mol/L氯化钠)透析3天,除去没有反应掉的CA,再对去离子水透析3天,最后冻干备用。合成的O-CMC-CA共价复合物用红外光谱及核磁共振对其结构进行表征。
用共沉淀法制备Fe3O4纳米粒子[7],实验步骤如下:将0.04 mol FeCl3·6H2O和0.01 mol FeSO4·7H2O在氮气保护下搅拌充分溶解于50 mL水中,然后,在常温下,将25 mL 10 mol/L的NaOH的溶液在30 min内缓慢滴加到上述溶液中,继续搅拌1 h,再升温至90 ℃,反应2 h。反应结束后磁分离洗涤至中性,产物烘干备用。
疏水修饰磁性壳聚糖载药纳米粒子的制备:通过反溶剂的方法,制备不同包埋效率的载药磁性纳米粒子。在壳聚糖的水溶液中加入一定量的有机溶剂乙醇,在室温下微搅拌24 h,然后缓慢地将DOX和Fe3O4溶液逐滴加入到胆酸的修饰的羧甲基壳聚糖溶液,并调节pH至6.6,在室温下微搅拌,最终聚合物浓度为4 mg/mL,DOX与聚合物的质量比为1∶4,DOX与Fe3O4的质量比为1∶1,平衡48 h。溶液全部转移至截留分子量为3 500的透析袋里,对去离子水透析,直至完全除去乙醇,便得到包埋DOX和Fe3O4的磁性壳聚糖载药纳米粒子。
载药纳米粒子中抗肿瘤药物阿霉素的包埋效率和负载量可以利用下面的公式计算得到。
其中Y表示阿霉素的包埋效率,W0表示投入阿霉素总质量,W1表示体系中没有包埋的自由的阿霉素质量;L表示为阿霉素的包埋量,W2表示疏水修饰的壳聚糖纳米粒子的质量。
1.4 疏水修饰磁性壳聚糖载药纳米粒子中DOX体外释放研究
将0.5 mL纳米粒子溶液置于透析袋中(截留分子量为14 000),然后将透析袋浸入24.5 mL PBS缓冲液或者0.1 mol/L、pH5.0的醋酸缓冲液中。在37C搅拌,每隔一定时间取出3 mL 释放介质,然后加入3 mL新鲜介质。在释放介质中的阿霉素浓度通过测量480 nm处的吸光度得到。
2 结果与讨论
2.1 疏水修饰磁性壳聚糖载药纳米粒子的表征
用红外光谱对合成的O-羧甲基壳聚糖疏水进行表征。图1A是O-羧甲基壳聚糖的红外光谱图,图1B是用胆酸接枝改性后的O-羧甲基壳聚糖的红外光谱图。图1A中1 634 cm-1是羧甲基中C=O伸缩振动的强吸收峰,1 419 cm-1及1 546 cm-1处吸收峰为COO-的对称及不对称伸缩振动峰。当胆酸接枝到O-羧甲基壳聚糖上时,在红外谱图中1 634 cm-1强吸收峰消失(图1B),出现了酰胺Ⅰ带1 653 cm-1和酰胺Ⅱ带1 584 cm-1的振动峰,这是由于C=O 伸缩振动和N-H变形振动的组合[8]造成的,证明胆酸接枝在O-羧甲基壳聚糖的氨基上,形成新的酰胺键。
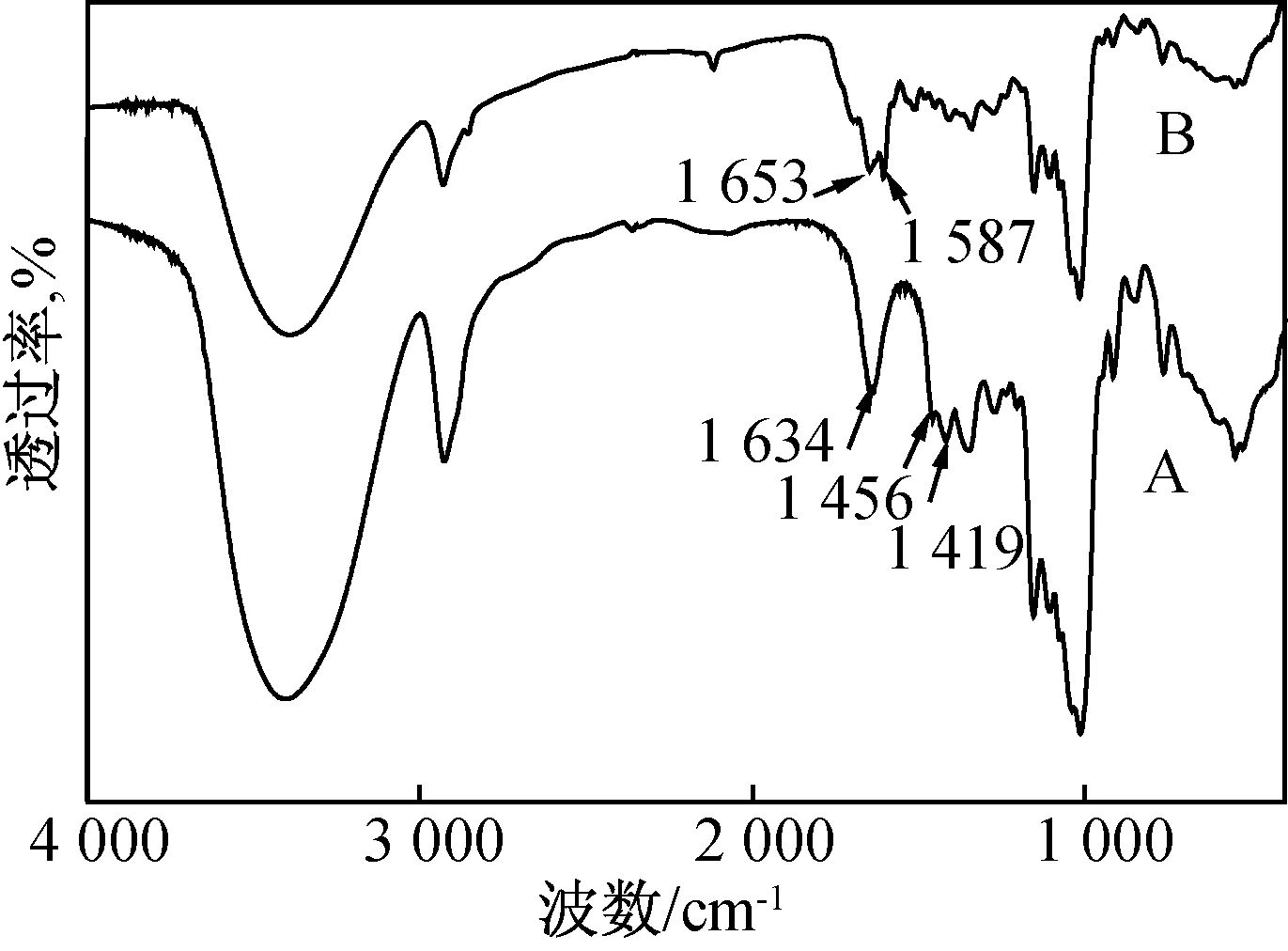
图1 O-CMC(A)和O-CMC-CA(B)的红外谱图
2.2 DOX和Fe3O4的包埋效率及长期稳定性
采用纳米粒度仪对磁性壳聚糖载药纳米粒子(DOX/Fe3O4/O-CMC-CA)的水合粒径和长期稳定进行了研究,结果见表1。从表1中可以看出,载药纳米粒子的水合直径为182 nm,粒径分布指数(PDI)分布在0.24左右,说明粒径分布比较均匀。当载药纳米粒子在放置6个月后(4 ℃),光散射结果显示粒径变化不大。同时从表1可以看出,阿霉素在新鲜制备的疏水修饰磁性壳聚糖载药纳米粒子中的包埋效率和包埋量分别达到92.3%和10.1%,放置6个月后包埋效率和包埋量稍有降低,但总体变化不大。这些结果表明制备的疏水修饰磁性壳聚糖载药纳米粒子的稳定性很好。
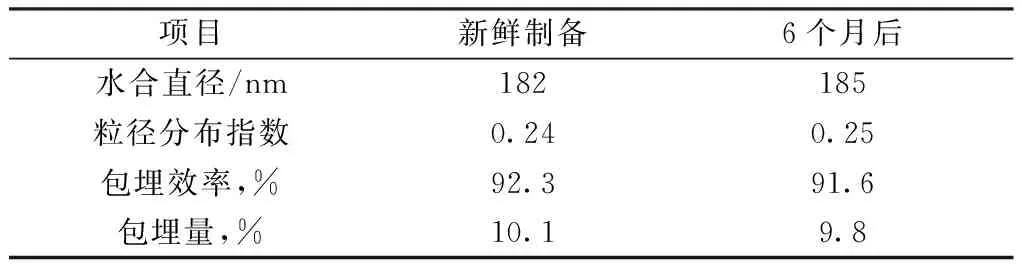
表1 疏水修饰磁性壳聚糖载药纳米粒子的粒径和稳定性
图2是所制备的样品和纯的Fe3O4X射线衍射样品图(XRD)。疏水修饰磁性壳聚糖载药纳米粒子与纯Fe3O4类似,都出现了六个特征峰,对照PDF卡片No.19-0629数据,2θ=30.54°、36.03°、43.25°、54.13°、57.12°和62.65°的六个衍射峰可指标化为面心立方尖晶石结构Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)晶面。说明聚合物对Fe3O4的晶体结构并没有发生明显改变。利用谢乐(Scherrer)公式[9]计算(311)晶面可得纯的Fe3O4的晶胞粒径约为12 nm。
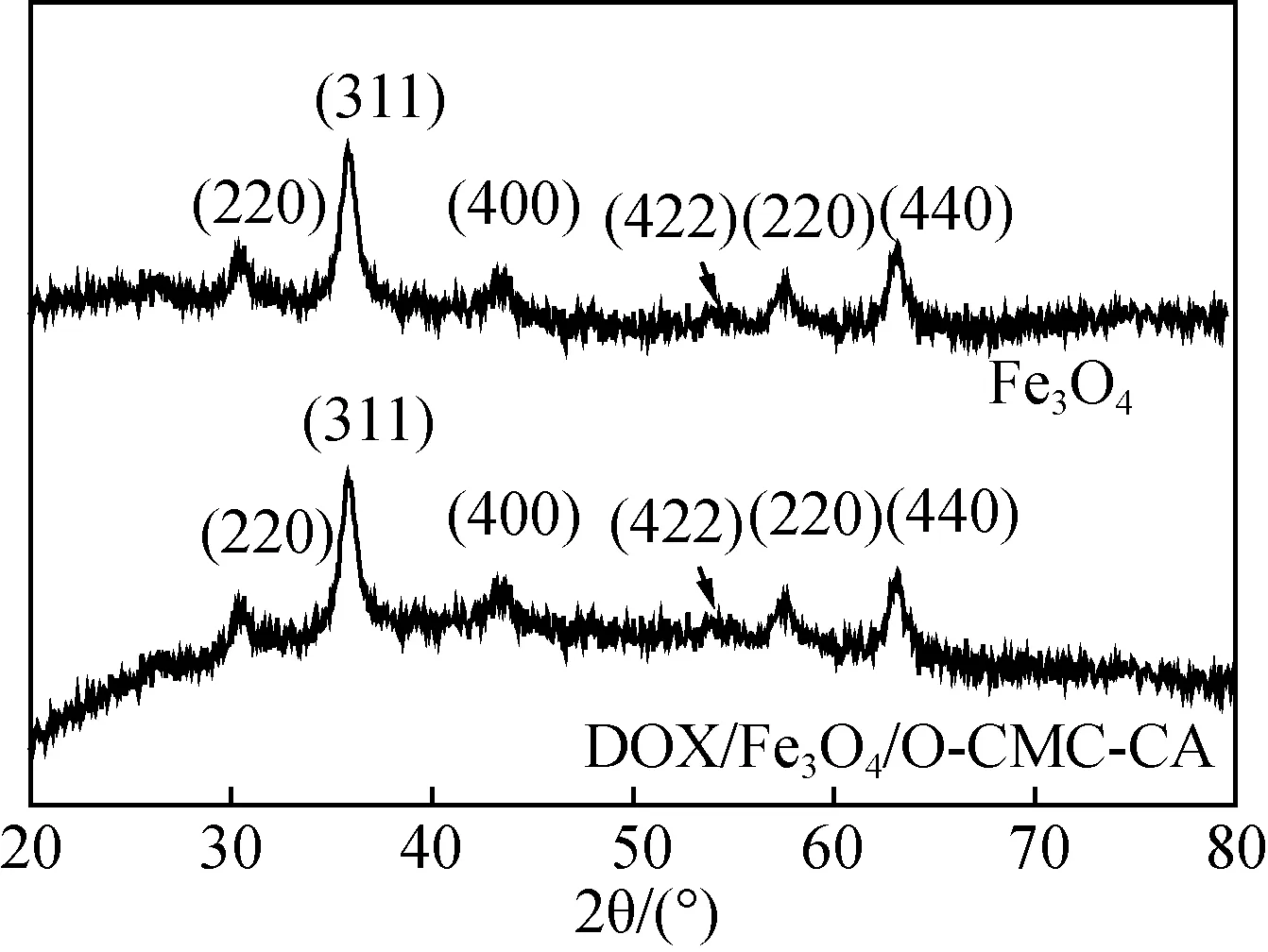
图2 DOX/Fe3O4/O-CMC-CA纳米粒子的XRD图
图3是疏水修饰磁性壳聚糖载药纳米粒子的形貌。由图可知,粒子相对比较均一,许多单个的Fe3O4成簇聚集在一起被共价复合物包裹在核中,构成了磁性壳聚糖载药纳米粒子,粒子直径平均在180 nm左右,与动态光散射(DLS)测得182 nm的结果大致相同。

图3 DOX/Fe3O4/O-CMC-CA纳米粒子透射电镜照片
2.3 疏水修饰磁性壳聚糖载药纳米粒子中DOX的体外释放模拟
通常肿瘤组织的pH值比正常组织的pH值低(10~12),为了考察疏水修饰磁性壳聚糖载药纳米粒子中抗肿瘤药物阿霉素在体液中释放情况,选用pH值分别为7.4和5.0两种缓冲液来考察阿霉素的释放行为(图4)。从图4可知,在两种不同释放环境下,疏水修饰磁性壳聚糖载药纳米粒子释放DOX的速率都比自由的DOX慢,说明具有聚合物对DOX的释放行为具有缓释效果。另外,DOX/Fe3O4/O-CMC-CA纳米粒子在pH5.0条件下较pH7.4的释放速率快,一方面可以降低DOX对正常组织的毒副作用,另一方面有利于疏水修饰磁性壳聚糖载药纳米粒子在肿瘤部位释放药物。同时该释放行为说明所制备的疏水修饰磁性壳聚糖载药纳米粒子具有一定的pH响应性。
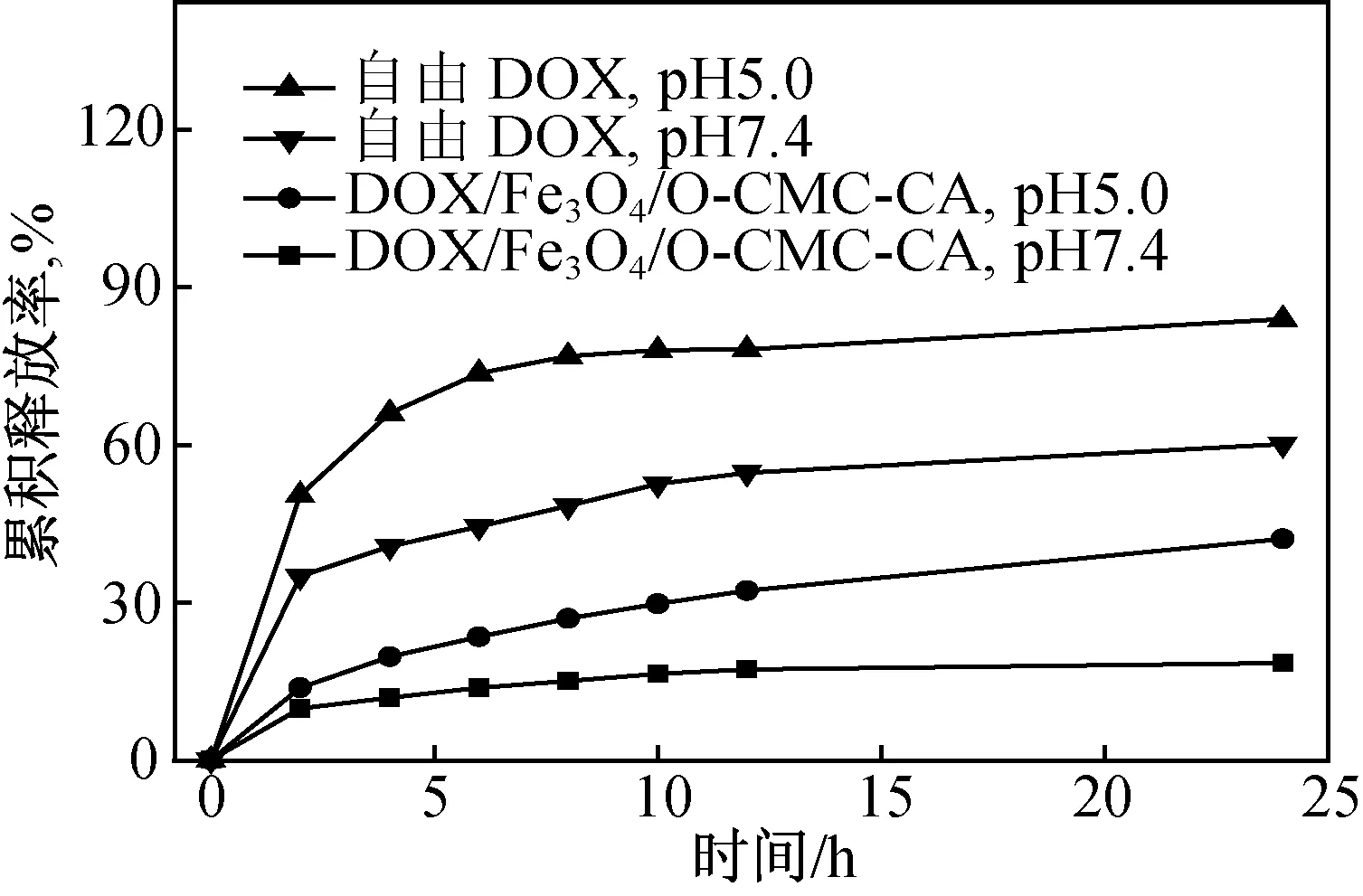
图4 载药磁性纳米粒子的体外累积释放情况
2.4 疏水修饰磁性壳聚糖载药纳米粒子的VSM表征
磁性纳米粒子的磁性行为是决定其能否应用于造影剂和磁靶向治疗的重要因素。用磁性分析仪VSM测定DOX/Fe3O4/O-CMC-CA纳米粒子的磁性行为,如图5所示,其磁滞曲线在300 K条件下测得。由图可知,DOX/Fe3O4/O-CMC-CA纳米粒子在室温下表现出零矫顽力和零剩余磁化强度,说明我们制备的DOX/Fe3O4/O-CMC-CA纳米粒子具有超顺磁性行为。DOX/Fe3O4/O-CMC-CA纳米粒子的饱和磁化度(Ms) 是8.1 emu/g,相比纯Fe3O4的饱和磁化度78.0 emu/g要小很多。由于Fe3O4在载药聚合物中的含量减少,同时,高聚物凝胶化使Fe3O4的自旋无序[13],结果疏水修饰磁性壳聚糖载药纳米粒子的饱和磁化度较低。但根据文献,一般认为Ms的值在7~22 emu/g范围可用于生物应用[14-16],因此我们制备的疏水修饰磁性壳聚糖载药纳米粒子可用于肿瘤核磁共振(MRI)成像,以及可以通过外加磁场靶向作用将药物输送的病灶部位用于治疗。

图5 疏水修饰磁性壳聚糖载药纳米粒子的磁滞曲线
3 结 论
a) 本文成功合成了疏水修饰的壳聚糖,实现了其与DOX和Fe3O4的复合包埋,得到了磁性载药纳米粒子,包埋效率可达到 90%以上。
b) 该磁性载药纳米粒子具有双重响应性,即pH响应性和磁靶向性,可以有效地输送阿霉素到肿瘤组织和细胞中,对肿瘤进行实时跟踪和诊断,可以实现MRI诊断和治疗一体化。
参考文献:
[1] Xing H Y, Bu W B, Zhang S J, et al.Multifunctional Nanoprobes for Upconversion Fluorescence, MR and CT Trimodal Imaging[J]. Biomaterials, 2012, 33(4): 1079-1089.
[2] Zhou J, Yu M X, Sun Y, et al.Fluorine-18-labeled Gd3+/Yb3+/Er3+Co-doped NaYF4Nanophosphors for Multimodality PET/MR/UCL Imaging[J].Biomaterials, 2011, 32(4):1148-1156.
[3] Chen X G, Park H J. Chemical Characteristics of O-carboxymethyl Chitosans Related to the Preparation Conditions[J]. Carbohydrate Polymers, 2003, 53(4): 355-359.
[4] Chen L Y, Du Y M, Tian Z G, et al. Effect of the Degree of Deacetylation and the Substitution of Carboxymethyl Chitosan On its Aggregation Behavior[J]. Journal of Polymer Science Part B: Polymer Physics, 2005, 43(3):296-305.
[5] 何练芹, 朱亮. 前药叶酸-牛血清白蛋白-氟尿嘧啶偶联物纳米粒体内分布及药效学研究 [J]. 中国药学杂志, 2010, 45(2): 107-110.
[6] Huang C, Neoh K G, Kang E T, et al. Surface Modified Superparamagnetic Iron Oxide Nanoparticles (SPIONs) for High Efficiency Folate-receptor Targeting with Low Uptake by Macrophages[J]. Journal of Materials Chemistry, 2011, 21(40): 16094-16102.
[7] Fan Q L, Neoh K G, Kang E T, et al. Solvent-free Atom TransfersRadical Polymerization for the Preparation of Poly(poly(ethyleneglycol) Monomethacrylate)-grafted Fe3O4Nanoparticles: Synthesis, Characterization and Cellular Uptake [J]. Biomaterials, 2007, 28(36): 5426-5436.
[8] Tartaj P, Serna C J.Synthesis of Monodisperse Superparamagnetic Fe/silica Nanospherical Composites[J]. Journal of the American Chemical Society, 2003, 125(51): 15754-15755.
Preparation and characterization of hydrophobically modified magnetic drug-loaded chitosan nanoparticles
Hao Hequn1,2,Zheng Huifang1,Zhang jian3*
(1.CollegeofMaterialsandChemicalEngineering,Lu’anAnhui237012,China;2.AnhuiProvincialLaboratoryofBiomimeticSensorandDetectingTechnology,WestAnhuiUniversity,Lu’anAnhui237012,China;3.TheEngineeringTechnologyResearchCenterforModificationofPolymerMaterials,WestAnhuiUniversity,Lu’anAnhui237012,China)
Amphiphilic copolymers were prepared by the chemical modification of cholic acid with O-carboxymethyl chitosan(O-CMC), while O-CMC have functional groups on the surface, such as-OH,-NH2,-COOH and so on. The magnetic drug-loaded chitosan nanoparticles were prepared by embedding Fe3O4and doxorubicin (DOX) in their hydrophobic nuclei using the antisolvent method. The morphology, size, magnetism, drug release of the nanoparticles was studied. The research results showed that the magnetic chitosan nanoparticles had higher drug entrapment efficiency (92.3%). Compared with free adriamycin, the magnetic complexes have obvious sustained-release and pH-responsive properties. Meanwhile, they have better superparamagnetic magnetic properties. These results indicated that hydrophobic modified magnetic chitosan nanoparticles can expected to be used as a drug delivery carrier to track, diagnose and treat tumors in real time.
O-carboxymethyl chitosan; Fe3O4; doxorubicin; controlled release
2017-01-04
安徽省高校优秀青年人才支持计划重点项目gxyqZD2016245和大学生创新创业计划201610376008。
郝和群(1978-),女,安徽无为人,讲师,博士,研究方向为生物医用高分子材料。
0636.1
A 章编号:1006-334X(2017)01-0015-04
*通讯作者: 张舰,zhangjianhhq@163.com。
