利用CRISPR/CAS9技术编辑水稻香味基因Badh2
2017-04-05邵高能谢黎虹焦桂爱魏祥进圣忠华唐绍清胡培松
邵高能 谢黎虹 焦桂爱 魏祥进 圣忠华 唐绍清胡培松
实验技术
利用CRISPR/CAS9技术编辑水稻香味基因Badh2
邵高能 谢黎虹 焦桂爱 魏祥进 圣忠华 唐绍清*胡培松*
(中国水稻研究所/水稻生物学国家重点实验室/农业部水稻生物学与遗传育种重点实验室,杭州310006;*通讯联系人, E-mail: sqtang@126.com, hupeisong@caas.cn)
【目的】香稻作为一类特殊的水稻群体,以其清香可口的品质特性备受消费者的欢迎。到目前为止,水稻中的香味主要受第8染色体上编码甜菜碱醛脱氢酶基因Badh2控制。【方法】通过CRISPR/CAS9技术对中花11的香味基因Badh2进行编辑。【结果】获得转基因T0代植株并对其所衍生的T1代20个单株进行了鉴定分析,获得了一个剔除了载体骨架且第1外显子上插入一个碱基T 的突变体材料。该材料中Badh2 RNA水平显著下调;利用GC-MS技术测定野生型及突变体材料籽粒2-乙酰-1-吡咯啉含量,结果表明突变体材料中的香味物质显著增加;此外,我们还对野生型及T2代香型植株水稻产量及稻米蒸煮食味品质进行了考查及测定分析,发现除分蘖数及结实率呈现出显著差异外(P<0.05),其余各项指标在两组材料间都无显著差异。【结论】通过CRISPR/CAS9技术成功地对水稻香味基因进行了编辑,可为香稻育种提供丰富的理论指导,加快香稻的育种进程。
水稻;Badh2;CRISPR/CAS9;香味
近些年来,大量研究报道了水稻香味基因的研究,主要包括香味基因的遗传分析,基因的克隆以及香味基因的育种利用等[2-4]。早期研究表明香味基因主要由1~3对显性或隐性基因控制[2,4],随着研究的深入,遗传分析结果表明水稻中香味主要受位于第8染色体上的一个单隐形基因Badh2控制,该基因编码甜菜碱脱氢酶[5],包含15个外显子和14个内含子,共编码503个氨基酸,研究表明该基因与香味密切相关并成功克隆[5-6]。香味物质的合成也是香稻研究的重要方面,前人报道了脯氨酸和鸟氨酸可能为香味物质2-乙酰-1-吡咯啉(2-AP)的前体物质[7],当Badh2突变后导致香味物质2-AP含量的大量积累,非香稻材料中该基因所编码的蛋白甜菜碱脱氢酶可能通过催化其底物4-氨基丁醛进而转化为4-氨基丁酸,而香稻材料中则可能促进4-氨基丁酸转化为1-吡咯啉,进而与乙酰基团结合,从而形成香味物质2-AP,但具体的Badh2蛋白功能及2-AP代谢途径还没有彻底研究清楚[6]。
分子标记辅助选择被认为是一种有效的育种手段,特别适合于一些性状考查比较困难的基因。香味性状的鉴定相对比较困难,容易受主观因素的影响,因此,香味基因分子标记辅助选择可以大大提高其选择的效率。Badh2第7外显子8 bp缺失的突变体基因badh2首先被报道。此外,Chen等[5]还发现了Badh2另外一个等位基因,即第2外显子存在7 bp的缺失,并将有功能的Badh2基因转化到第2外显子缺失的香稻材料中,发现转基因植株的2-AP含量显著下降,该研究结果表明第2外显子上7个碱基的缺失也可引起水稻香味的产生。此外,随着香味基因Badh2的克隆[6],一系列Badh2等位变异基因被成功鉴定,相关的功能标记也被开发利用[8-11]。近些年来研究人员希望通过生物技术手段对水稻品种中的香味基因进行编辑,从而加快育种进程。Niu等[12]通过RNAi技术,对日本晴中的香味基因BADH2进行敲除,结果发现,转基因后代植株中的香味物质2-乙酰-1-吡咯啉(2-AP)含量明显增加;Chen等[13]采用人工小RNA转基因技术,对日本晴中的香味基因BADH2进行敲除,结果表明转基因后代籽粒中2-AP含量明显提高。转录激活因子效应物核酸酶(TALEN)是基因组编辑核酸酶,可以有效地对靶向基因组进行编辑,Shan等[14]通过TALEN技术,对水稻香味基因BADH2进行基因组编辑,获得了大约30%的杂合BADH2基因型的遗传材料,通过后代分离鉴定,获得剔除了转基因克隆载体的香型突变体材料,突变体材料的2-AP含量明显提高。
本研究利用CRISPR-CAS9技术,以中花11为研究对象,对水稻香味基因Badh2进行编辑,获得不携带转基因克隆载体及表现出香味的植株,以期为加快水稻香味育种进程提供一定的理论指导。
1 材料与方法
1.1试验材料
本研究以中花11为遗传转化受体,开展常规的转基因试验,转基因材料种植于中国水稻研究所富阳试验基地,常规田间种植及管理。
1.2载体构建及转基因研究
利用试剂盒快速方便地将gRNA靶点序列插入到Cas9/gRNA质粒中。构建好的Cas9/gRNA质粒能够同时表达植物密码子优化的Cas9蛋白及gRNA,应用CRISPR技术进行目标基因的敲除和编辑,构建载体及具体插入位置信息如图1所示(北京唯尚立德生物科技有限公司)。
在油脂化学领域,与脂肪酸羧基相关的反应是非常基础和重要的,其中很多工艺都被大量的运用于日常生活当中,比如酯化、酰胺化等反应;也有一些几乎不为人所知。所以有必要全面的加以了解,尤其是对其可发生的化学反应应该具有一定的宏观认知,这样有利于在创新上开阔思维,扩展相关反应在不同领域中的运用。
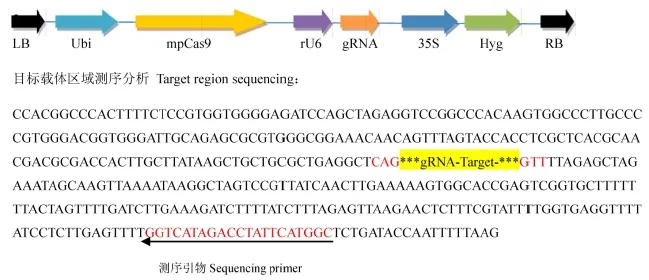
图1 Cas9/gRNA载体图Fig. 1. Vector map of Cas9/gRNA.
1.3香味物质测定
香味物质2-乙酰-1-吡咯啉(2-AP)含量利用气相色谱-质谱联用仪测定。测定过程中采用2,4,6-三甲基吡啶作为内标,将气体成分以氦气作为传送媒介连续地注射到配置有光离子探测器的气相色谱仪,气相色谱仪与5975质量选择检测器连接,其中采用一个HP-5MS色谱毛细管柱气体样品直接作为离子源,通过电子碰撞的模式起作用,最后经由NIST2005检测香气物质的峰值,2-AP的出峰时间为6.324 min。该方法样品处理简单、快速、灵敏,样本和试剂消耗少,能较容易地区分香稻和非香稻品种,降低了人为判断香味的主观性,提高了香味鉴定的准确性,特别适合大批量香稻育种材料的鉴定,具体方法参考Shan等[14],并作了相应的改进。

表1 本研究所使用的引物Table 1. List of primers used in this study.
1.4突变体表型分析
利用中花11及突变体材料,考查株高、分蘖数、结实率及每穗粒数等产量性状。考查8个单株,获得数据通过Excel进行统计分析;千粒重的测定方法为数300粒种子并测定其质量,8个重复。此外,还对直链淀粉含量,胶稠度及碱消值等三项蒸煮食味品质指标进行了测定,3次重复,获得的数据通过Excel进行统计分析。
1.5PCR鉴定分析及qRT-PCR分析
分蘖盛期取参试材料单株叶片,采用CTAB法提取全基因组DNA,之后放置于-20℃冰箱中保存。然后将提取的DNA用于PCR扩增实验,PCR体系如下:DNA 5 μL,正反向引物(10 μmol/L)各1.5 μL,dNTPs(2 μmol/L)10 μL,2×缓冲液 25 μL,KOD Fx酶1 μL,加ddH2O补足50 μL。PCR产物在2%琼脂糖凝胶上进行电泳,电泳结束后EB溶液显色并拍照,需要测序的样品直接切胶回收送上海博尚生物技术有限公司。
利用RNA 提取试剂盒(Axygen)提取突变体和野生型叶片总RNA。 首先利用DNaseⅠ处理总RNA,接着以消化处理后的RNA为模板,采用cDNA 合成试剂盒(TOYOBO)反转录合成第1链cDNA,然后利用实时定量PCR (qRT-PCR)方法分析Badh2在野生型和突变体中的表达量,其中Ubiquitin基因作为内参基因。qRT-PCR体系如下: cDNA 模板1 μL,2×SYBR qPCR Mix (TOYOBO) 10 μL,正反引物(10 μmol/L)各1 μL,ddH2O 补足至20 μL。PCR扩增程序如下:95℃下预变性3 min,95℃下10 s,60℃下30 s,72℃下20 s,45个循环。利用公式2-ΔΔCT方法计算基因的相对表达量。
1 结果与分析
2.1CRISPR-CAS9表达载体的构建
通过对中花11编码甜菜碱脱氢酶基因Badh2进行测序分析,发现该基因开放阅读框ORF序列与日本晴高度一致,属于典型的非香型粳稻材料。此外,该材料在转基因过程中由于其转化效率高、生育期适中、结实率较高等优点,因此,我们以中花11为转基因受体,借助CRISPR/CAS9基因敲除技术开展转基因实验。首先我们通过已知的香味基因Badh2登录号LOC_Os08g32870,获得了其全长cDNA序列,结合http://crispr.dbcls.jp/生物信息学网站,通过序列比对分析,在Badh2外显子上找到一条长度为20 bp特异性较好的靶点序列Target 1(表1, 图2-A、B),将其构建到表达载体中(图1),并开展转基因实验。
2.2Badh2的编辑及无标记后代的鉴定分析
首先我们获得了8个独立的T0代转基因植株,我们对每个转基因苗提取相应的DNA,同时在表达载体上设计特异性引物Vector-identify-F/R对靶点序列进行了测序验证(表1)。测序结果表明,我们验证了靶点序列的载体已成功插入到植物基因组,通过利用设计特异性测序引物Seq-F/R对Badh2靶点位置的基因组序列进行了测序分析(表1)。结果表明,其中3个独立转基因系材料在PAM附近发生了编辑,由于两个转基因系没有收到足够的种子,因此仅对其中一个转基因系进行了遗传研究(图2-C)。
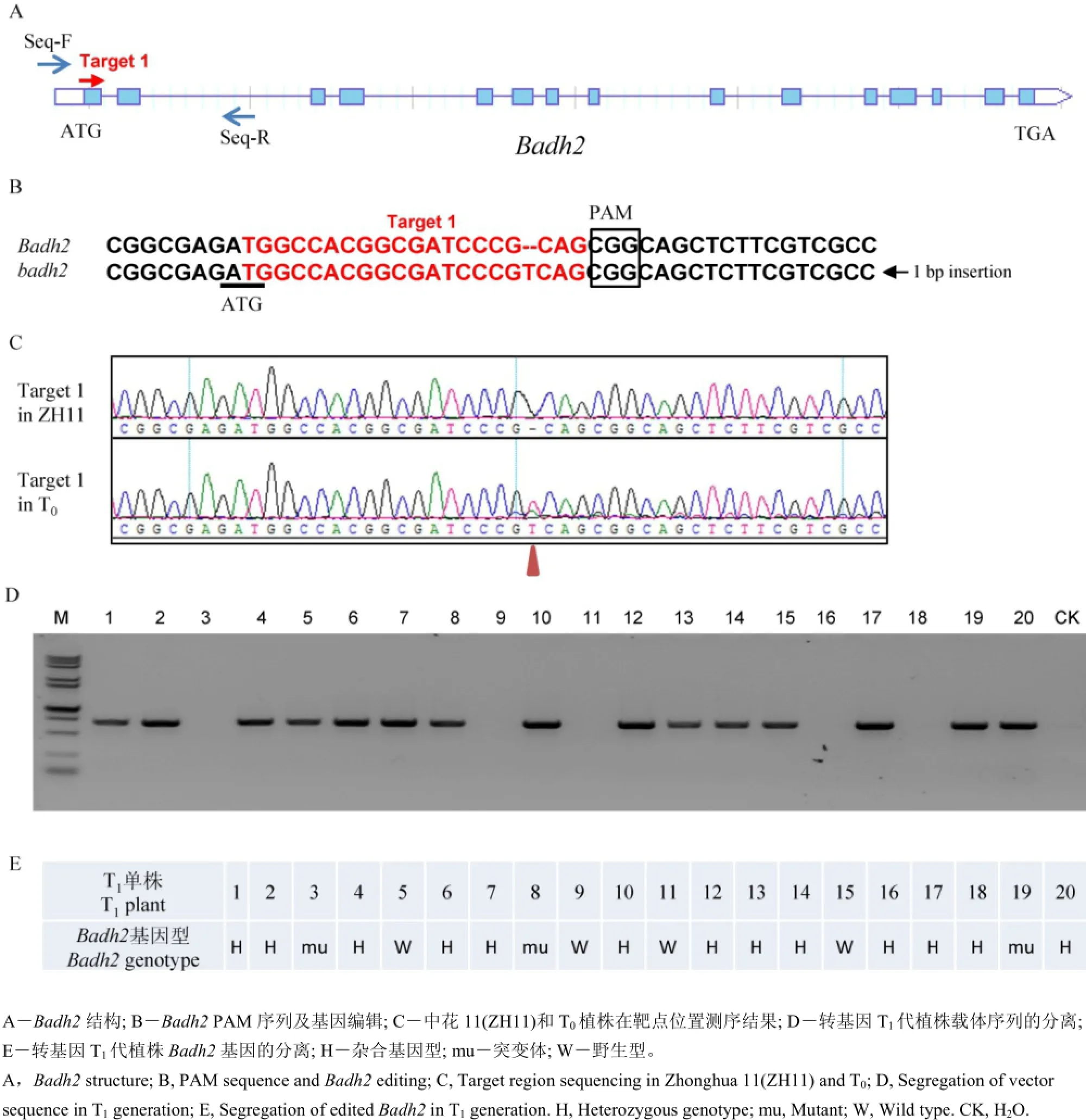
图2 Badh2及基因编辑Fig.2. Badh2 and its CRISPR-CAS9-mediated editing.
我们将T1代材料种植到转基因实验田,通过DNA提取及载体序列扩增,发现载体在后代中发生了分离(图2-D)。此外,我们进一步对T1代植株Badh2进行了测序分析,发现在Badh2第一外显子上距离起始密码子ATG下游18 bp位置插入一个碱基T,导致了蛋白质的移码,影响了Badh2蛋白的结构和功能(图2-B)。通过对T120个单株Badh2编辑位点进行测序分析,发现了该基因突变位点也发生了分离(图2-E)。通过CRISPR-CAS9 技术对水稻中的香味基因进行编辑,希望获得剔除了载体骨架,同时还有香味的遗传材料,结合载体序列PCR鉴定和Badh2靶点测序结果,发现单株3中的载体骨架已经分离出去,而且还携带有突变形式的香味基因badh2(图2-D、E)。
2.3转基因后代Badh2 RNA水平检测及香味物质2-AP含量的测定
前期我们获得了一个转基因材料badh2,该材料中不包含载体序列且Badh2已被成功编辑,野生型与badh2表现出相似的植株表型(图3-A)。此外,为了进一步研究香味基因在转基因后代中的功能,我们对中花11和突变体材料中Badh2 RNA表达水平进行了检测。前人已报道水稻苗期叶片适合于Badh2 RNA 检测[5],因此我们提取了两组材料苗期14 d左右叶片总RNA,然后通过qRT-PCR技术,对Badh2进行了定量分析,我们发现突变体材料中Badh2表达水平显著降低(图3-B)。该结果表明香味基因第1外显子一个核苷酸的插入,影响了该基因的转录水平,导致该基因在突变体材料中表达显著下调。
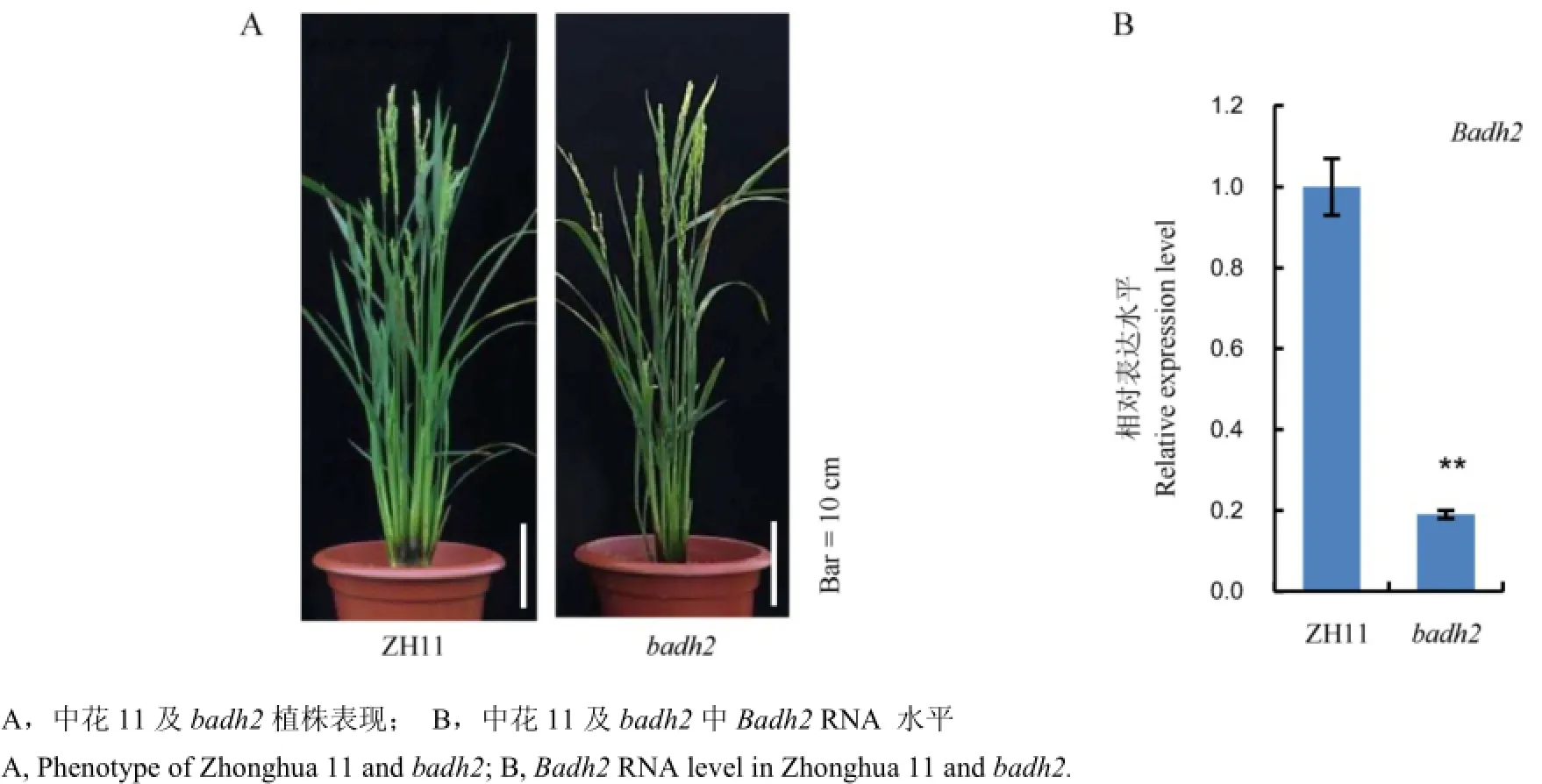
图3 Badh2基因编辑后代表型及RNA表达水平的检测Fig. 3. Phenotype and Badh2 RNA level of ZH11(Zhonghua 11) and badh2.
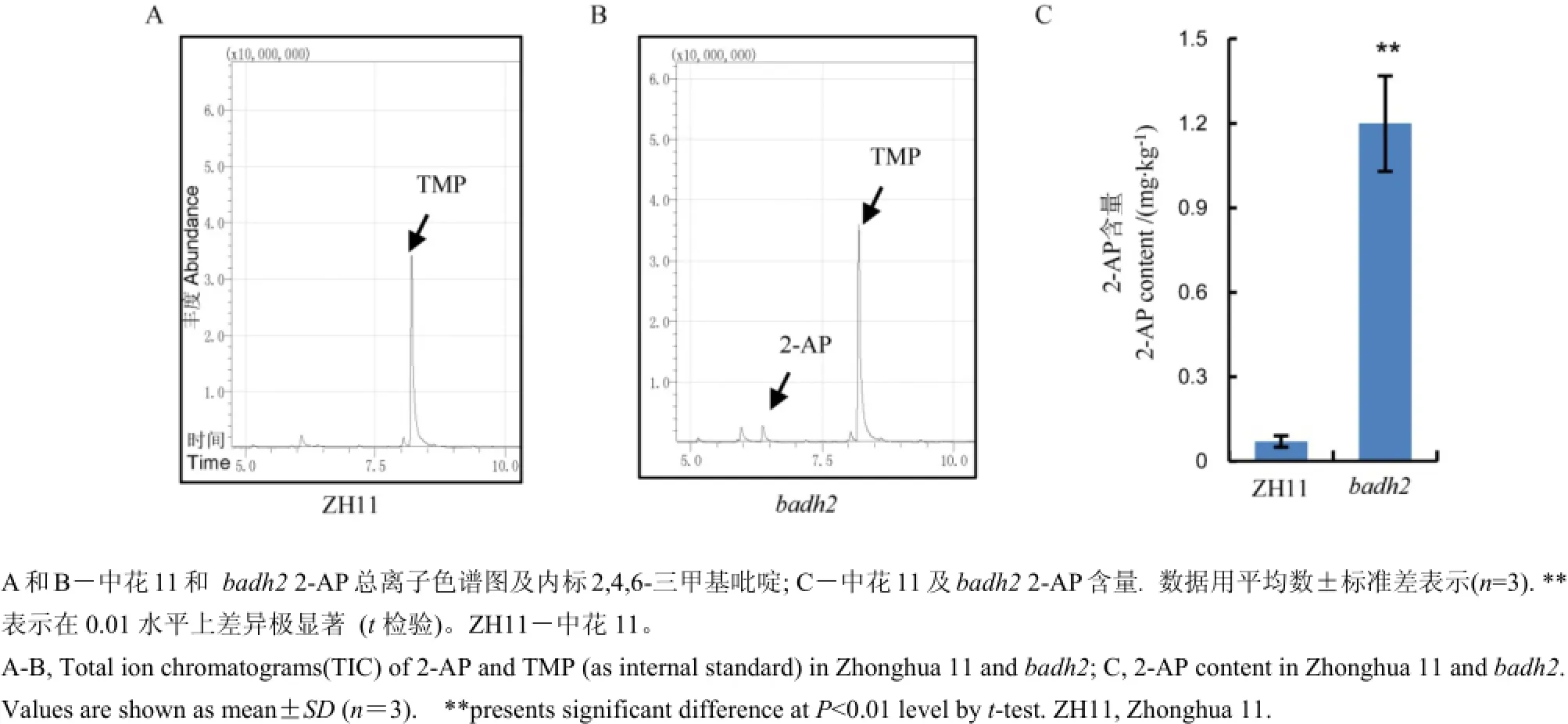
图4 中花11及badh2中总离子色谱分析及香味物质2-AP的含量Fig. 4. Total ion chromatograms(TIC) and 2-acetyl-1-pyrroline(2-AP)content of Zhonghua 11 and badh2.
与此同时,我们进一步分析了该基因的突变及表达水平的降低是否与香味的产生相关。采用气相色谱-质谱联用技术对两份材料中花11及突变体材料籽粒中的2-AP含量进行了分析(图4-A、B),与野生型中花11对照相比,突变体材料中的香味物质2-AP显著提高,中花11中2-AP含量约0.07mg/kg,而突变体中则增加到1.2 mg/kg(图4-C),因此,我们的结果表明Badh2突变是引起香味的一个关键基因。

图5 水稻产量及蒸煮食味品质在野生型及突变体材料中的表现Fig. 5. Performance of rice yield and cooking and eating quality in ZH11 and badh2.
2.4Badh2基因编辑后代产量性状的考查及蒸煮食味品质的测定
为了研究香味基因是否与水稻产量及稻米品质密切相关,我们对中花11及其T2代突变体材料中的产量性状及蒸煮食味品质等几项指标进行了考查及测定。产量性状主要包括株高、分蘖数、千粒重、每穗粒数及结实率,而蒸煮食味品质主要包括直链淀粉含量、胶稠度及碱消值。通过生物统计分析,我们发现除了分蘖数及结实率在两组材料中表现出显著差异外(P<0.05),其余各项指标间都无显著差异(图5)。因此,通过以上数据的分析结果,推断该基因并不影响稻米品质,但是有可能影响水稻的产量。
3 讨论
全球香稻资源丰富、栽培历史悠久、种植范围分布广泛,印度的Basmati系列、泰国的KDML105、日本的宫香、美国的Della都是颇有名气的香稻品种。我国也是香稻的主要种植区域,种植历史悠久,各水稻主产区都有适应当地气候的原始香稻类型,如云南的螃蟹谷、贵州的香禾、广西有靖西香糯等。实际生产过程中,传统香稻存在地域性强、生育期长、抗倒伏和抗病能力差、产量低等缺点,使得香稻的推广和生产应用受到了较大的限制[15]。传统的香稻育种主要通过香型和非香型品种间杂交,由于后代分离植株香味鉴定的不确定性,以及香味基因可能与一些产量、品质或抗病基因存在连锁累赘,因此成功选育成香型优良品种比较困难。
众所周知,传统香稻育种还是主要通过传统的育种手段,品种间杂交及后代鉴定筛选,需要花费大量时间和精力,因此,前人已尝试通过转基因的技术,直接对我们所培育品种中的香味基因Badh2进行敲除或编辑,从而加快育种进程[12-14]。CRISPR-CAS9系统是继RNAi技术、锌指核酸酶和TALEN核酸酶之后最新发展起来的另一个可精确定点编辑基因组DNA的新技术,其具有设计构建简单快速等优点。该技术首先在动物中广泛利用,随后科研人员将该技术应用于植物基因组编辑。我们通过在Badh2基因ORF区域上设计特异性靶位点(图2-A),进行转基因特异性敲除实验,成功获得了一个携带有香味且剔除了载体序列的突变体材料badh2,该基因第一外显子上发生了一个核苷酸T的插入(图2-B),不仅导致Badh2 RNA水平显著降低(图3-B),而且引起了该蛋白质的移码,突变后的Badh2不能发挥正常蛋白功能,进而导致了香味的产生(图4-C),由于该材料未携带转基因元件,可直接应用于育种研究,培育新的香型水稻材料,因此,利用该转基因技术策略及特异性靶点,可以直接对不同水稻品种的Badh2进行编辑,创制香型遗传材料,这将大大加速香稻品种的选育进程。
前人已报道香味基因与产量、品质及抗病性存在一定的关系,我们通过对野生型材料中花11及转基因后代材料的产量及品质指标进行了统计分析,发现香味基因的变异与稻米品质没有表现出一定的相关性,只有分蘖数和结实率两项指标在中花11及突变体材料中表现出显著差异,株高、千粒重、每穗粒数以及三项蒸煮食味品质指标在两组材料都无显著差异(图5)。转基因植物容易导致植株变矮,分蘖数变少及结实率降低,所以我们推测该差异可能归因于脱靶或转基因过程中的组织培养,因此,我们目前将对突变体材料与野生型材料进行回交,进一步研究香味基因与分蘖数及结实率的关系。
[1] 胡培松, 唐绍清, 魏兴华. 泰国香米事件及启示. 中国稻米, 2006, 12(4): 1-2.
Hu P S, Tang S Q, Wei X H. Thailand's aromatic rice incident and its revelation. China Rice, 2006, 12(4): 1-2. (in Chinese)
[2] Ahn S N, Bollich, C N, Tanksley S D. RFLP tagging of a gene for aroma in rice. Theor Appl Genet, 1992, 84:825-828.
[3] Pinson S. Inheritance of aroma in six rice cultivars. Crop Sci, 1994, 34: 1151-1157.
[4] Sakthivel K, Sundaram R M, Shobha Rani N, Balachandran S M, Neeraja C N. Genetic and molecular basis of fragrance in rice. Biotechnol Adv, 2009, 27:468-473.
[5] Chen S H, Yang Y, Shi W W, Ji Q, He F, Zhang Z D, Cheng Z K, Liu X N. Badh2, encoding betaine aldehyde dehydrogenase, inhibits the biosynthesis of 2-acetyl-1-pyrroline, a major component in rice fragrance. Plant Cell, 2008, 20: 1850-1861.
[6] Bradbury L M, Fitzgerald T L, Henry R J, Jin Q S, Waters D L. The gene for fragrance in rice. Plant Biotechnol J, 2005, 3: 363-370.
[7] Bradbury L M, Gillies S A, Brushett D J, Waters D L, Henry R J. Inactivation of an aminoaldehyde dehydrogenase is responsible for fragrance in rice. Plant Mol Biol, 2008, 68: 439-449.
[8] Kovach M J, Calingacion M N, Fitzgerald M A, McCouch S R. The origin and evolution of fragrance in rice (Oryza sativa L.). Proc Natl Acad Sci U S A, 2009, 106: 14444-14449.
[9] Shao G N, Tang S Q, Chen M L, Wei X J, He J W, Luo J, Jiao G A, Hu Y C, Xie L H, Hu P S. Haplotype variation at Badh2, the gene determining fragrance in rice. Genomics, 2013, 101: 157-162.
[10] Shao G N, Tang A, Tang S Q, Luo J, Jiao G A, Wu J L, Hu P S. A new deletion mutation of fragrant gene and the development of three molecular markers for fragrance in rice. Plant Breeding, 2011, 130: 172-176.
[11] Shi W W, Yang Y, Chen S H, Xu M L. Discovery of a new fragrance allele and the development of functional markers for the breeding of fragrant rice varieties. Mol Breed, 2008, 22: 185-192.
[12] Niu X L, Tang W, Huang W Z, Ren G J, Wang Q L, Luo D, Xiao Y Y, Yang S M, Wang F, Lu B R, Gao F Y, Lu T G, Liu Y S. RNAi-directed downregulation of OsBADH2 results in aroma (2-acetyl-1-pyrroline) production in rice (Oryza sativa L.). BMC Plant Biol, 2008, 8: 100.
[13] Chen M L, Wei X J, Shao, G N, Tang S Q, Luo J, Hu P S. Fragrance of the rice grain achieved via artificial microRNA-induced down-regulation of OsBADH2. Plant Breeding, 2012, 131: 584-590.
[14] Shan Q W, Zhang Y, Chen K L, Zhang K, Gao C X. Creation of fragrant rice by targeted knockout of the OsBADH2 gene using TALEN technology. Plant Biotechnol J, 2015, 13: 791-800.
[15] 余亚莹, 邵高能, 圣忠华, 蒋汉伟,贺记外,孙园园,蔡怡聪,胡培松,唐绍清. 国内外香稻资源遗传多样性研究. 植物分类与资源学报, 2015, 37(6): 871-880.
Yu Y Y, Shao G N, Sheng Z H, Jiang H W, He J W, Sun Y Y, Cai Y C, Hu P S, Tang S Q. Genetic diversity of global aromatic rice varieties. Plant Div&Resour, 2015, 37(6):871-880. (in Chinese with English abstract)
CRISPR/CAS9-mediated Editing of the Fragrant Gene Badh2 in Rice
SHAO Gaoneng, XIE Lihong, JIAO Guiai, WEI Xiangjin, SHENG Zhonghua, TANG Shaoqing*, HU Peisong*
(State Key Laboratory of Rice Biology, Key Laboratory of Rice Biology and Breeding of Ministry of Agriculture, China National Rice Research Institute, Hangzhou 310006, China;*Corresponding author, E-mail: sqtang@126.com, hupeisong@caas.cn)
【Objective】Fragrant rice, which is favored because of its quality characteristics of faint scent and tastiness, is a special rice type. Fragrance in rice is mainly controlled by the gene encoding betaine aldehyde dehydrogenase on chromosome 8.【Method】The fragrant gene Badh2 in Zhonghua 11 was edited by CRISPR/CAS9.【Result】Twenty T1individuals derived from T0generation were genotyped. One plant, which contains an additional T base in the first exon of Badh2 without the vector skeleton, was finally produced. qRT-PCR result suggested that Badh2 RNA level was decreased in the mutant. Compared with the wild type, the mutant increased 2-acetyl-1-pyrroline content by the GC-MS method. Furthermore, two rice yield-related traits including tiller numbers and seed-setting rate showed significant difference at the 0.05 level among five traits related to yield and three traits related to cooking and eating quality.【Conclusion】We succeed editing the Badh2 by CRISPR-CAS9 technical in rice, and it would provide abundant theoretical guidance and accelerate the breeding process of fragrant rice.
rice; Badh2; CRISPR/CAS9; fragrance

Q755; S511.032
A
1001-7216(2017)02-0216-07
2016-06-20; 修改稿收到日期:2016-09-10。
国家自然科学基金国际(地区)合作与交流项目(31161140348); 浙江省自然科学基金资助项目(Y14C130040)。
