序批式生物膜反应器处理养猪废水降解细菌特性
2017-04-05万金保邬容伟邱起地万莉
万金保++邬容伟+邱起地++万莉


摘要:从某猪场废水处理系统序批式生物膜反应器(sequencing batch biofilm reactor,简称SBBR)中分离纯化得到菌株A和菌株B,经形态学鉴定菌株A为乳白色、革兰氏阳性长杆菌;菌株B为灰白色、革兰氏阳性短杆菌。菌株A最佳生长条件为温度30~50 ℃、盐度1%~2%、pH值6~8;菌株B最佳生长条件为温度20~40 ℃、盐度1%~2%、pH值6~8。在不同因素组合下,将菌株A、B分别接种于供試废水中,对废水化学需氧量(chemical oxygen demand,简称COD)去除率最高分别为64.11%、54.74%;NH3-N最佳降解率分别为54.57%、55.54%。
关键词:养猪废水;序批式生物膜反应器(SBBR);生物降解;形态特征;降解特性
中图分类号: X703文献标志码: A
文章编号:1002-1302(2016)12-0480-04
收稿日期:2015-10-28
基金项目:国家科技支撑计划(编号:2007BAB23C02);江西省教育厅科技落地计划(编号:GJJ12433);南昌市对外科技合作与成果转化推广计划(编号:2013HZCG001);南昌大学鄱阳湖环境与资源利用教育部重点实验室开放基金(编号:13005875)。
作者简介:万金保(1952—),男,江西南昌人,教授,博士生导师,主要从事水污染控制及资源化技术研究。Tel:(0791)88305941;E-mail:jbwan@ncu.edu.cn。
养猪废水中含有大量有机污染物、氨氮、总磷、病虫卵、重金属以及产生的恶臭气体等[1-10]。纵观人类废水处理技术的发展史,微生物处理废水有独特的优势,它通过自身的新陈代谢来吸收、分解和转化污染物,从而达到治理污染物的目的[11-15]。本研究采用江西省某猪场实际工艺升流式固体厌氧反应器(USR)与序批式生物膜反应器(sequencing batch biofilm reactor,简称SBBR)处理猪场废水[16-19],以实际养猪废水的序批式生物膜反应器中生物膜和污泥为分离源[20-23],采用Luria-Bertani(简称LB)培养基,通过培养、分离和纯化等,以其中的化学需氧量(chemical oxygen demand,简称COD)和氨态氮(NH3-N)含量为检测指标,旨在探讨从 SBBR 中分离所得菌株的废水处理特性以及生理特性。
1材料与方法
1.1LB液体培养基
在950 mL去离子水中加入10 g胰化蛋白胨、5 g酵母提取物、10 g NaCl,摇动容器直至溶质溶解,调pH值为7.4,用去离子水定容至1 L,在0.103 45 MPa高压下蒸汽灭菌 20 min。
1.2菌株
从某猪场废水处理系统SBBR中取少量含生物膜的污水充分摇匀打碎,然后接种于LB液体培养基,在37 ℃下,振荡培养1 d,重复操作2~3次,作为备用菌液。用倍比稀释法选出长势良好、形态不同的菌落,进行划线分离,将分离得到的菌株A和菌株B的纯菌进行斜面保存[24-26]。
1.3分析方法
菌株的形态学鉴定:参照《常见细菌系统鉴定手册》[27]。
菌株的生长曲线测定:将菌株以1%接种量分别接种于装有20 mL LB液体培养基的12支试管中,接种后首先取1支试管保存于4 ℃冰箱作为对照,之后将其余试管置于 37 ℃、180 r/min水浴恒温振荡器培养,每隔1~2 h取样,于双光束紫外-可见分光光度计下测定菌体生长吸光度D600 nm,即可绘制菌株的生长曲线[28];温度、盐度、pH值对菌株生长的影响:将纯菌液以1%接种量接种到装有高温灭菌过的LB液体培养基的锥形瓶中,通过调节培养基的摇床温度、盐度,pH值,180 r/min水浴恒温振荡,培养24 h,测定培养液中菌体生长量(D600 nm)[30-33]。温度梯度设置为4、10、20、30、40、50、60 ℃;盐度为0.5%、1%、2%、3%、4%、5%、10%;pH值为4、5、6、7、8、9、10;COD定量测定:重铬酸钾法;NH3-N的定量测定:纳氏试剂分光光度法。
通过设计培养温度、pH值、培养时间、碳氮比的4因素3[JP3]水平正交试验,研究菌株去除废水中COD、NH3-N的最佳条件。
1.4菌株的生物学特性
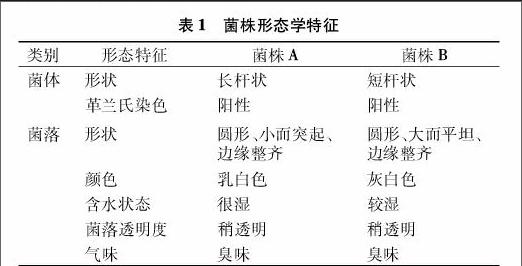
菌株A与菌株B的形态特征如表1所示,油镜观察结果及菌落形态如图1至图4所示[29]。
2.1温度对菌株的生长影响
温度主要影响微生物体内的酶活性,高温会破坏酶蛋白
质活性,而低温则会降低酶的活性。由图5可见,菌株A最佳生长温度介于30~50 ℃,且在20~50 ℃之间菌株A都能较好地生长;菌株B的最佳生长温度介于20~40 ℃,且在 20~40 ℃之间都能较好地生长。菌株A、B的生长温度范围较广,对温度变化的适应性也较强。
2.2盐度对菌株的生长影响
废水中盐度会影响微生物生长环境的渗透压。在高盐度下,微生物会失水,从而降低活性;低盐度下,微生物会吸水,导致细胞膨胀甚至破裂。由图6可见,菌株A最佳生长盐度介于1%~2%,且在0.5%~2%之间都能较好地生长,而当盐度大于3%后基本不生长,生长盐度范围相对较窄,对于盐度变化适应性较弱;菌株B的最佳生长盐度为1%~2%,且在0.5%~4%的盐度之间都能较好地生长,生长盐度范围相对较广,对于盐度变化适应性相对较强。
2.3pH值对菌株的生长影响
pH值主要是影响微生物的酶活性,微生物体内酶都有各自适应的pH值范围。由图7可见,菌株A最适生长pH值为6~8之间,且在pH值为5~10之间都能较好地生长,对于pH值变化适应性强;菌株B的最佳生长pH值介于 6~8之间,且菌株B在pH值为5~10之间同样都能较好地生长,其生长pH值范围也较宽,对于pH值变化适应性强。
2.4菌株的废水处理特性试验
将纯菌液以5%接种量接种到供试废水中,分别以pH值、碳氮比、培养时间和培养温度为因素,各因素设3个水平,设计4因素3水平正交试验,进行菌株培养条件优化,以筛选出菌株降解养猪废水中有机污染物的最佳条件。
2.4.1菌株A的废水处理特性
2.4.1.1菌株A对供试废水COD的去除结果
由表2、图8可见,各因素对菌株A去除废水中COD的影响由大到小依次是pH值>碳氮比>培养时间>培养温度;去除最佳条件为培养温度35 ℃、pH值75、培养时间72 h,碳氮比=4 ∶[KG-*3]1。
2.4.1.2菌株A对供试废水NH3-N的去除结果
由表3、图9可见,各因素对菌株A去除废水中NH3-N的影响由大到小依次是培养时间>培养温度>碳氮比>pH值;各因素对菌株A去除供试废水中NH3-N的结果都有明显的影响。菌株A对供试废水中NH3-N的去除最佳条件为培养温度 25 ℃、pH值6.5、培养时间72 h和碳氮比为1 ∶[KG-*3]1。
2.4.2菌株B的废水处理特性
2.4.2.1菌株B对供试废水中COD的去除结果
由表4、图10可见,对菌株B去除供试废水COD的结果各因素影响大小依次是培养时间>碳氮比>pH值>培养温度;菌株B对供试废水COD去除的最佳条件为培养温度30 ℃、pH值75、培养时间48 h、碳氮比=2 ∶[KG-*3]1。
2.4.2.2菌株B去除供试废水中NH3-N的去除结果
由表5、图11可见,菌株B去除供试废水中NH3-N的结果各因素的影响大小为碳氮比>培养时间>pH值>培养温度;菌株B去除供试废水中NH3-N的最佳条件为培养温度25 ℃、pH值7.0、培养时间 72 h、碳氮比=1 ∶[KG-*3]1。
3结论
从江西省某养猪场废水处理系统SBBR中分离纯化得到菌株A和菌株B,经倍比稀释法、平板划线法以及形态学鉴定表[CM(25]明,菌株A为乳白色、革兰氏阳性长杆菌;菌株B为灰白[CM)]
色、革兰氏阳性短杆菌。菌株A的最佳生长条件为温度30~50 ℃、盐度1%~2%、pH值为6~8;菌株B的最佳生长条件为温度20~40 ℃、盐度1%~2%、pH值为6~8。经试验可得,菌株A对供试废水中COD的最佳去除条件为培养温度35 ℃、pH值7.5、培养时间72 h、碳氮比=4 ∶[KG-*3]1;菌株B对供试废水中COD的最佳去除条件为培养温度30 ℃、pH值7.5、培养时间 48 h、碳氮比=2 ∶[KG-*3]1。菌株A对NH3-N最佳去除条件为温度25 ℃、pH值6.5、培养时间72 h和碳氮比为 1 ∶[KG-*3]1;菌株B对NH3-N最佳去除条件为培养温度25 ℃、pH值为7、培养时间为72 h、碳氮比为1 ∶[KG-*3]1。
参考文献:
[1]范文军,宁站亮,刘勇诚. 我国水资源现状探讨[J]. 北方环境,2011,23(7):68.
[2]陈苏兰. 猪场污水中脱氮微生物的分离与鉴定的研究[D]. 武汉:华中农业大学,2007.
[3]梁鹏,谢英,邱俊. 养猪废水处理工艺应用研究[J]. 江西畜牧兽医杂志,2012(6):24-26.
[4]孟佳. 养猪废水厌氧消化液的亚硝化调控与功能微生物分析[D]. 哈尔滨:哈尔滨工业大学,2013.
[5]宋炜,付永胜,李小华. 猪场废水处理技术研究进展[J]. 养猪,2006(2):44-46.
[6]蒋昕. 广州市规模化养猪场废水污染调查与防治对策探讨[J]. 环境研究与检测,2011,30(1):69-72.
[9]Sánchez E,Borja R,Travieso L,et al. Effect of organic loading rate on the stability,operational parameters and performance of a secondary upflow anaerobic sludge bed reactor treating piggery waste[J]. Bioresource Technology,2005,96(3):335-344.
[10]马彦涛,薛金凤. 养猪废水处理技术进展[J]. 环境与可持续发展,2009,34(5):29-32.
[11]Rittman B E,Mclarty P L. Environmental biotechnology:principles and applications[M]. New York:McGraw-Hill Education,2001.
[12]梁立伟,赵兴龙,林李娟,等. 生物强化技术在污水处理中的应用[J]. 油气田环境保护,2006,16(4):1-3.
[13]顾夏声,胡洪营,文湘华,等. 水处理生物学[M]. 4版. 北京:中国建筑工业出版社,2006.
[14]杨世平,阎立华,程琳. 废水生物处理技术及其研究进展[J]. 辽宁化工,2009,38(9):636-638.
[15]国家环境保护总局. 水和废水监测分析方法[M]. 北京:中国环境科学出版社,2002.
[16]马文静. SBBR工艺及影响因素探讨[J]. 科技情报开发与经济,2010,20(10):148-150.
[17]陈晓娟,皇甫铮. SBBR废水生物处理新工艺的研究发展及应用[J]. 广州化工,2011,39(23):31-33.
[18]王亞宜,李探微,彭永臻,等. 序批式生物膜(SBBR)法和SBR法的对比研究[J]. 工业用水与废水,2002,33(6):4-6.
[19]杨治国. SBR法在养猪厂废水处理中的应用[J]. 现代农业科技,2013(13):254-255.
[20]万风,王海燕,周岳溪,等. 养猪废水处理技术研究进展[J]. 农业灾害研究,2012,2(1):25-29.
[21]高廷耀,顾国维,周琪. 水污染控制工程(下册)[M]. 北京:高等教育出版社,1999.
[22]Xu G J,Xu X C,Yang F L,et al. Partial nitrification adjusted by hydroxylamine in aerobic granules under high DO and ambient temperature and subsequent anammox for low C/N wastewater treatment[J]. Chemical Engineering Journal,2012,213(12):338-345.
[23]Cheng J,Liu B. Nitrification/denitrification in intermittent aeration process for swine wastewater treatment[J]. Journal of Environmental Engineering,2001,127(8):705-711.
[24]符吴萸,杜丽明,杨平,等. 养殖水体氨氮降解菌的分离与降解特性研究[J]. 广东石油化工学院学报,2013,23(4):22-26.
[25]裴瑞林,信欣,张雪乔,等. 养猪废水培养微生物絮凝剂产生菌群B-737及发酵特性[J]. 环境科学,2013,34(5):1951-1957.
[26]方会,陈梅雪,秦德韬,等. 集约化养猪废水SBR中17β-雌二醇高效降解菌的分离鉴定及其降解特性[J]. 环境工程学报,2012,6(10):3361-3366.
[27]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 2版. 北京:科学出版社,2001,364-398.
[28]Chiemchaisri C,Jaitrong L,Honda R,et al. Photosyntheetic bacteria pond system with infra-red transmitting filter for the treatment and recovery of organic carbon from industrial wastewater[J]. Water Science and Technology,2007,56(7):109-116.
[29]陳源源. 基于分子标识的工业微生物资源快捷分类与鉴定[D]. 无锡:江南大学,2012.
[30]江紫薇. 二甲四氯降解菌的分离鉴定及降解特性研究[D]. 长沙:湖南农业大学,2012.
[31]杨新萍. 污水处理中脱氮功能微生物特性及固定化应用研究[D]. 南京:南京农业大学,2009.
[32]张海军. 两株拟除虫菊酯类农药降解菌的分离鉴定及其降解特性研究[D]. 杭州:浙江大学,2010.
[33]王莉. 甲胺磷降解菌株的分离鉴定、降解特性及菌株MAP-1的应用研究[D]. 南京:南京农业大学,2010.
[34]刘瑞江,张业旺,闻崇炜,等. 正交试验设计和分析方法研究[J]. 实验技术与管理,2010,27(9):52-55.
[35]陈翔,梁卫玖. 建立Excel宏快速处理正交试验设计数据[J]. 中国卫生检验杂志,2009,19(11):2696-2697.
[36]董如何,肖必华,方永水. 正交试验设计的理论分析方法及应用[J]. 安徽建筑工业学院学报:自然科学版,2004,12(6):103-106.
[37]Wu L,Peng C Y,Peng Y Z,et al. Effect of wastewater COD/N ratio on aerobic nitrifying sludge granulation and microbial population shift[J]. Journal of Environmental Sciences,2012,24(2):234-241.
