低氧胁迫对菲律宾蛤仔抗氧化酶的影响
2017-04-03聂鸿涛卢长炜柴成林闫喜武
聂鸿涛, 卢长炜, 柴成林, 杨 凤, 闫喜武
(大连海洋大学, 水产与生命学院, 辽宁省贝类良种繁育工程技术研究中心, 辽宁 大连 116023)
菲律宾蛤仔(Ruditapes philippinarum)隶属软体动物门、帘蛤目、帘蛤科、蛤仔属, 是重要海产经济贝类, 广泛分布于我国南北海区。然而, 近年来蛤仔养殖存在因品种单一、苗种自给率低、良种率低、缺少高产抗逆优良品种等问题, 因此进行良种选育十分必要[1]。“斑马蛤”是通过群体累代人工定向选育培育而成的我国第一个新品种, 具有壳色美观[2]、耐低温[3]、耐低盐[4]和存活率高[5]等优点。
大多数栖息在潮间带的无脊椎动物, 经常面临低氧环境, 抑制代谢率是低氧耐受最重要的适应之一[6-10]。生活在潮间带的海洋贝类容易受到缺氧环境的影响。目前关于贝类对低氧的生理反应已有许多研究报道, 主要包括组织行为、生理生化等不同水平的缺氧影响[11-13], 表现出可逆的蛋白磷酸化, 以限制缺氧期间许多酶和功能蛋白的活性[14]。在贝类养殖过程中, 夏季经常会出现低氧环境, 尤其池塘中严重低氧, 明显制约贝类的生长和存活[15-18]。本实验通过测定不同低氧水平下菲律宾蛤仔抗氧化酶的变化, 研究其耐受能力, 旨在为蛤仔养殖提供了基础数据和参考。
1 材料与方法
1.1 实验材料
实验所用的菲律宾蛤仔为大连庄河养殖群体,共 300个个体。实验所用海水为黑石礁海区, 经沉淀、砂滤后储存备用水。实验开始前, 先将蛤仔暂养3 d, 暂养期间不投喂, 水温12℃±0.3℃, 每天换水1次。实验统一都用水质分析仪来测定海水的盐度和pH, 实验所用海水pH8.0, 盐度32。挑选100个大小相近的蛤仔, 分别放在4个30 L暂养缸里, 溶解氧DO分别为2.0 mg/L和7.0 mg/L, 0.5 mg/L和7.0 mg/L。低氧控制方法为固定充氮设备, 充氮的同时将水质分析仪探头伸入暂养缸测溶解氧 DO的变化。当溶解氧DO快到达所需浓度时, 停止充氮。等待5 min再测 DO, 低于所需浓度时充点氧气; 高于所需浓度时再充点氮气。其他3个缸为重复。每隔3 h测1次DO, 保证 DO水平偏离目标低氧水平太多, 要及时充氮或充氧。
1.2 实验方法
取蛤仔的鳃和消化腺装进冻存管放入液氮保存。解剖完毕后做好标记装进密封袋再统一放进–80℃冷冻冰箱保存, 用酶标仪测定乳酸脱氢酶 LDH、琥珀酸脱氢酶SDH、碱性磷酸酶AKP。
1.3 数据处理
计算公式:酶活性(U/g)=测定OD值–对照OD值/标准OD值–
空白OD值×标准品浓度(2mmol/L)/
匀浆蛋白浓度(g/mL)
结果分析比较采用单因素方差分析(One-Way ANOVA)分析, 用 SPSS20.0处理数据, 差异显著性设置为P<0.05。
2 结果
在低氧(0.5 mg/L)和对照组中, 随着时间的延长,消化腺和鳃中琥珀酸脱氢酶活力呈现下降趋势(图1),消化腺琥珀酸脱氢酶活力高于鳃, 低氧胁迫组的消化腺中琥珀酸脱氢酶活力高于对照组, 在对照组消化腺中琥珀酸脱氢酶活力也高于鳃(图1)。
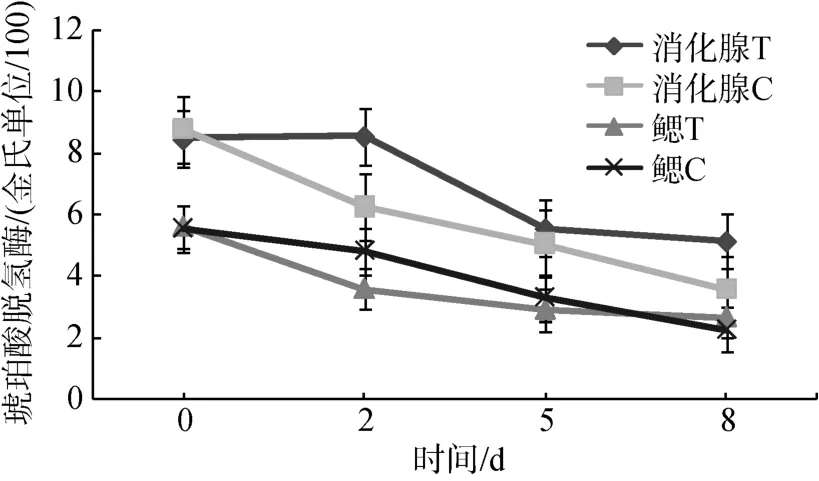
图1 琥珀酸脱氢酶在低氧(0.5 mg/L)和对照组比较Fig. 1 SDH activity in Ruditapes philippinarum under hypoxia stress (0.5 mg/L)
琥珀酸脱氢酶在低氧(2.0 mg/L)时和对照组比较见图 2, 琥珀酸脱氢酶含量上下波动不大, 仅有对照组消化腺在第5 天和第8 天波动较大(图2)。

图2 琥珀酸脱氢酶在低氧(2.0 mg/L)和对照组比较Fig. 2 SDH activity in Ruditapes philippinarum under hypoxia stress (2.0 mg/L)
随低氧(0.5 mg/L)胁迫时间延长, AKP酶活力在低氧水平呈不规律变化(图3)。消化腺中碱性磷酸酶含量比鳃含量多, 处理组、对照组中碱性磷酸酶在消化腺和鳃含量相差不大。低氧水平对琥珀酸脱氢酶活力影响都不显著(P>0.05)。

图3 碱性磷酸酶在低氧(0.5 mg/L)和对照组比较Fig. 3 AKP activity in Ruditapes philippinarum under hypoxia stress (0.5mg/L)
随低氧(2.0 mg/L)胁迫时间延长, 消化腺中AKP呈先升高后降低趋势, 对碱性磷酸酶活力影响较大,在低氧胁迫第5 天消化腺中AKP酶含量高于鳃。处理组和对照组中碱性磷酸酶的含量相差不大, 低氧胁迫组消化腺和鳃中的酶活力高于对照组(图4)。

图4 碱性磷酸酶在低氧(2.0 mg/L)和对照组比较Fig. 4 AKP activity in Ruditapes philippinarum under hypoxia stress (2.0mg/L)
从整体可以看出随着时间的延续, 同一部位乳酸脱氢酶活力在逐渐降低。对照组消化腺中乳酸脱氢酶活力略高于低氧胁迫组, 低氧胁迫下鳃中乳酸脱氢酶活力高于对照组, 消化腺中乳酸脱氢酶活力高于鳃(图5)。
如图 6所示, 消化腺中的乳酸脱氢酶活力呈一个上升趋势, 对照组中的酶活力较处理组相比更强,而鳃中酶活力呈现不规律变化(图6)。
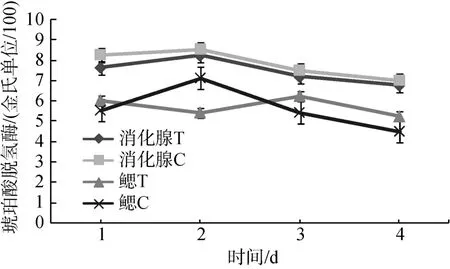
图5 乳酸脱氢酶在低氧(0.5 mg/L)和对照组比较Fig. 5 LDH activity in Ruditapes philippinarum under hypoxia stress (0.5mg/L)

图6 乳酸脱氢酶在低氧(2.0 mg/L)和对照组比较Fig. 6 LDH activity in Ruditapes philippinarum under hypoxia stress (2.0mg/L)
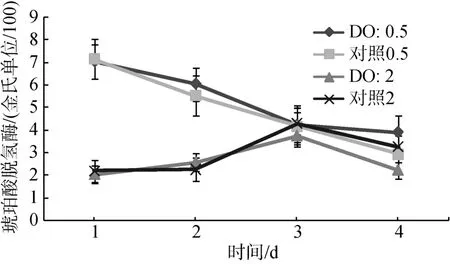
图7 琥珀酸脱氢酶在低氧(0.5 mg/L和2.0 mg/L)与对照组比较Fig. 7 SDH activity in Ruditapes philippinarum under hypoxia stress (0.5 mg/L and 2.0mg/L)
琥珀酸脱氢酶活力在两个低氧水平(0.5 mg/L和2.0 mg/L)胁迫下总体上是呈现下降趋势(图7)。处理组和对照组比较, 处于低氧胁迫下的菲律宾蛤仔琥珀酸脱氢酶活力略高, 说明蛤仔需要这种酶来协助极限低氧环境下, 自己的正常呼吸; 可以得出低氧胁迫抑制了琥珀酸脱氢酶活力。低氧组DO(0.5 mg/L)在第 8 天对琥珀酸脱氢酶活力影响显著(P<0.05),在 0、第 2 天、第 5 天均不显著(P>0.05), 低氧组DO(2.0 mg/L)时在第2 天、第8 天对琥珀酸脱氢酶活力影响显著(P<0.05)。
对比两个不同低氧水平DO (0.5 mg/L和2.0 mg/L),碱性磷酸酶总体呈现上升趋势(图 8), 说明在低氧胁迫下, AKP活力升高, 低氧(0.5 mg/L)下的酶活力略高于低氧(2.0 mg/L), 处理组的酶活力基本都高于对照组酶活力。溶氧DO(0.5 mg/L)时在0、第2天、第5天、第8天对碱性磷酸酶活力影响都显著; 溶氧DO(2.0 mg/L)时在第2天、第5天、第8天对琥珀酸脱氢酶活力影响显著(P<0.05)。
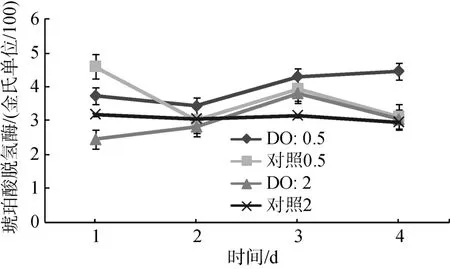
图 8 碱性磷酸酶在低氧(0.5mg/L)和低氧(2.0mg/L)与对照组的比较Fig. 8 AKP activity in Ruditapes philippinarum under hypoxia stress (0.5 mg/L and 2.0mg/L)
对比两个低氧水平DO (0.5 mg/L和2.0 mg/L),低氧胁迫抑制了乳酸脱氢酶活力(图9)。在较低溶氧下, 乳酸脱氢酶活力高, 说明乳酸脱氢酶参与了适应低氧环境; 通过比较处理组和对照组可以看出,对照组 LDH酶活力高, 说明在低氧胁迫下, 蛤仔LDH酶活力受到抑制, 活力较弱。溶氧DO(0.5 mg/L)时在第 2天对乳酸脱氢酶活力影响都显著(P<0.05);溶氧DO(2.0 mg/L)时在第2 天、第5 天、第8 天对乳酸脱氢酶活力影响显著(P<0.05)。

图9 乳酸脱氢酶在低氧(0.5 mg/L和2.0 mg/L)与对照组比较Fig. 9 LDH activity in Ruditapes philippinarum under hypoxia stress (0.5 mg/L and 2.0mg/L)
3 讨论
琥珀酸脱氢酶在溶氧水平 DO(0.5 mg/L)时在低氧环境下, 菲律宾蛤仔为了维持自身生存, 产生琥珀酸脱氢酶SDH的组织活动不活跃, 导致合成琥珀酸脱氢酶受到抑制作用。对照组消化腺和鳃中琥珀酸脱氢酶活力较低, 是因为在氧气充足的环境下,蛤仔新陈代谢较旺盛, 需要的量也就越多, 琥珀酸脱氢酶活力高。在低氧水平(2.0 mg/L)时, 琥珀酸脱氢酶活力较稳定。在低氧环境下能够促进碱性磷酸酶产生, 菲律宾蛤仔的消化腺主要用来分泌消化酶分解食物, 在低氧胁迫下乳酸脱氢酶活力升高; 而对照组的消化腺酶活力高于处理组消化腺酶活力是因为长期低氧抑制了酶的活性, 使酶活力反而下降;低氧胁迫组鳃的酶活力高于对照组鳃酶活力道理类似, 在低氧胁迫下, 低氧处理组需要更多地能量用于呼吸作用, 因此酶活力也就越大[19]。Chen等[20]的研究表明, 栉孔扇贝的血细胞总数随溶氧浓度的降低而逐渐减少, 并且在溶氧降至 2.5 mg/L时下降46%, 显著低于对照组。David等[11]在牡蛎低氧胁迫研究中发现, 低氧胁迫会影响牡蛎的先天性免疫系统, 从而导致死亡率升高。
低氧环境下, 溶氧水平较低能够促进碱性磷酸酶产生, 处于低氧胁迫下的菲律宾蛤仔琥珀酸脱氢酶活力先升高后降低, 说明蛤仔需要这种酶来协助极限低氧环境下自身的正常呼吸, 但长期低氧胁迫或极端低氧条件下抑制了琥珀酸脱氢酶活力。两个低氧水平(0.5 mg/L和2.0 mg/L)处理组比较, 酶活力相差较大, 说明不同低氧程度对蛤仔酶活力的影响有所差异[21]。蛤仔在低氧胁迫下第5 天和第8 天酶活力差异不明显, 说明逐步适应了低氧环境[22]。从处理组和对照组可以看出, 消化腺中的乳酸脱氢酶活力呈上升趋势, 对照组中的酶活力较处理组相比更高, 而鳃中酶活力忽高忽低。原因可能是低氧胁迫抑制了乳酸脱氢酶活力, 所以对照组消化腺活力高于处理组。处理组和对照组消化腺中酶活力都高于鳃中乳酸脱氢酶活力, 原因可能是消化腺新陈代谢更旺盛, 酶活力相对更高。溶氧水平为2.0 mg/L的低氧胁迫抑制了菲律宾蛤仔乳酸脱氢酶活力[23]。而两种低氧水平(0.5 mg/L和2.0 mg/L)比较发现, 在极端低氧条件下, 菲律宾蛤仔乳酸脱氢酶活力反而升高, 说明乳酸脱氢酶参与了蛤仔机体抵御极端低氧引起的不适, 并通过生理生化指标改变以适应低氧环境[24,25]。通过低氧胁迫处理组和对照组比较可以看出, 对照组酶活力高, 说明在低氧胁迫下, 蛤仔酶活力受到抑制, 活力降低[26]。
综上, 本实验研究了两种低氧胁迫(0.5 mg/L和2 mg/L)对菲律宾蛤仔抗氧化酶的影响。在低氧胁迫时间越长的条件下, 乳酸脱氢和琥珀酸脱氢酶活力逐渐降低, 而碱性磷酸酶活力逐渐升高, 两种低氧水平蛤仔的抗氧化酶表现出不同的变化规律。研究结果为菲律宾蛤仔在低氧生理生态学奠定了基础,为蛤仔人工养殖提供了参考。
参考文献:
[1] 孟学平, 董志国, 程汉良, 等.西施舌的耗氧率与排氨率研究[J].应用生态学报, 2005, 16(12): 2435-2438.Meng Xueping, Dong Zhiguo, Chen Hanliang, et al.Oxygen consumption and nmmonia N excretion rates of Coelomactra antiquate. Chinese Journal of Applied Ecology, 2005, 16(12): 2435-2438.
[2] 闫喜武, 张跃环, 孙焕强, 等. 菲律宾蛤仔两道红与白斑马品系的三元杂交[J]. 水产学报, 2010, 34(8):1190-1197.Yan Xiwu, Zhang Yuehuan, Sun Huanqiang, et al. Three way crosses between two-band red and white zebra strains of Manila clam, Ruditapes philippinarum[J].Journal of Fisheries of China, 2010, 34(8): 1190-1197.
[3] 胥贤, 杨凤, 朱恒涛, 等.低温对三种壳色菲律宾蛤仔(Ruditapes philippinarum)幼贝耗氧率和排氨率的影响[J]. 大连海洋大学学报, 2015, 30(6): 627-633.Xu Xian, Yang Feng, Zhu Hengtao, et al. Effects of low temperature on oxygen consumption rate, ammonia excretion rate of juvenile Manila clam Ruditapes philipinarum with three color shells[J]. Journal of Dalian Fisheries University, 2015, 30(6): 627-633.
[4] 丁鉴锋, 王锐, 闫喜武, 等.菲律宾蛤仔 3种壳色群体低盐耐受能力的比较研究[J]. 大连海洋大学学报,2013, 28(3): 264-268.Ding Jianfeng, Wang Rui, Yan Xiwu, et al. Comparative tolerance to low salinity stress in Manila clam Ruditapes philippinarum with three shell colors[J]. Journal of Dalian Fisheries University, 2013, 28(3): 264-268.
[5] 闫喜武, 张跃环, 霍忠明, 等. 不同壳色菲律宾蛤仔品系F2的表型性状[J]. 水产学报, 2010, 34(6): 701-709.Yan Xiwu, Zhang Yunhuan, Huo Zhongming, et al.Studies on phenotypic traits of different shell color strains F2 of Manila clam (Ruditapes philippinarum)[J].Journal of Fisheries of China, 2010, 34(6): 701-709.
[6] 顾孝连, 徐兆礼. 河口及近岸海域低氧环境对水生动物的影响[J]. 海洋渔业, 2009, 31(4): 426-437.Gu Xiaolian, Xu Zhaoli. A review on the effects of hypoxia on aquatic animals in estuaries [J]. Marine Fisheries, 2009, 31(4): 426-437.
[7] Gray S G, Wu R S, Or Y Y. Effects of hypoxia and or-ganic enrichment on the coastal marine environment[J].Mar Ecol Prog Series 2002, 238: 249-279.
[8] Jørgensen B B. Material flux in the sediment[J]. American Geophysical Union, 2013 , 52: 115-135
[9] Cloern J E. Our evolving conceptual model of the coastal eutrophication problem[J]. Mar Ecol Prog Series, 2001, 210: 223-253.
[10] Hermes-Lima M, Storey J M, Storey K B. Antioxidant defenses and metabolic depression: The hypothesis of preparation for oxidative stress in land snails[J]. Comp Biochem Physiol B Biochem Mol Biol, 1998, 120(3):437-448.
[11] David E, Tanguy A, Pichavant K, et al. Response of the Pacific oyster Crassostrea gigas to hypoxia exposure under experimental conditions[J]. FEBS, 2005, 272:5635-5652.
[12] Larade K, Storey K B. A profile of the metabolic responses to anoxia in marine invertebrates [J]. Cell and Molecular Responses to Stress, 2002, 3(2) 27-46.
[13] Greenway S C, Storey K B. Effects of seasonal change and prolonged anoxia on metabolic enzymes of Littorina littorea[J]. Can J Zool, 2001, 79: 907-915.
[14] Hagerman L, Uglow R F. Heart and scaphognathite activity in the shrimp, Palaemon adspersus Rathke[J].Ophelia, 1979, 18(1): 89-96.
[15] Hermes-Lima M, Storey J M, Storey K B. Antioxidant defenses and animal adaptation to oxygen availability during environmental stress[J]. In Cell and Molecular Responses to Stress, 2001, 2: 263-287.
[16] Greenway S C, Storey K B. The effect of prolonged anoxia on enzyme activities in oysters (Crassostrea virginica) at different seasons[J]. J Exp Mar Biol Ecol,1999, 242: 259-272.
[17] 陈政强, 陈昌生, 战文斌. 低氧胁迫对九孔鲍免疫防御因子的影响[J]. 水产学报, 2012, 36(11): 1739-1747.Chen Zhengqiang, Chen changsheng, Zhai Wenbin. Effect of hypoxia on the immune response of the abalone Haliotis diversicolor supertexta and its susceptibility to pathogen Vibrio parahaemolyticus[J]. Journal of Fisheries of China, 2012, 36(11): 1739-1747.
[18] 冯显逵, 王绍琰. 九孔鲍工厂化养殖应警惕缺氧死亡[J]. 中国水产, 1999, (6): 38.Feng Xiankui, Wang Shaoyan, The challenge of hypoxia stress induced death in abalone aquaculture industry[J]. Fisheries of China, 1999, (6): 38.
[19] Greenway S C, Storey K B. Effects of seasonal change and prolonged anoxia on metabolic enzymes of Littorina littorea[J]. Can J Zool, 2001, 79: 907-915.
[20] Chen J, Mai K, Ma H, et al. Effects of dissolved oxygen on survival and immune response of scallop (Chlamys farreri Jones et Preston)[J]. Fish & Shellfish Immunology, 2007, 22(3): 272-281.
[21] Richier S, Merle P L, Furla P, et al. Characterization of superoxide dismutase in anoxia- and hyperoxia-tolerant symbiotic cnidarians[J]. Biochem Biophy Acta, 2003,1621: 84-91.
[22] Storey K B. Molecular mechanisms of metabolic arrest in molluscs[C]//Surviving hypoxia: mechanisms of control and adaptation. Boca Raton: CRC Press, 1993: 253-269.
[23] Ho Y S, Dey M S, Crapo J D. Antioxidant enzyme expression in rat lungs during hyperoxia[J]. Am J Physiol,1996, 270: 810-818.
[24] Pannunzio T M, Storey K B. Antioxidant defenses and lipid peroxidation during anoxia stress and aerobic recovery in the marine gastropod Littorina littorea[J]. J Exp Mar Biol Ecol, 1998, 221: 277-292.
[25] 李 照, 宋书群, 李才文. 长江口及其邻近海域叶绿素a分布特征及其与低氧区形成的关系[J]. 海洋科学,2016, 2: 1-10.Li Zhao, Song Shuqun, Li Caiwen. Distribution of chlorophylla and its correlation with the formation of hypoxia in the Changjiang River Estuary and its adjacent waters[J]. Marine Science, 2016, 2: 1-10.
[26] Wilbur A E. Physiological energetics of the ribbed mussel Geukensia demissa (Dillwyn) in response to increased temperature[J]. J Exp Mar Biol Ecol, 1989, 131:161-170.
