4种壳色蛤仔TYR基因的表达特性研究
2017-04-03姜力文聂鸿涛李东东霍忠明李妹妍闫喜武
姜力文, 聂鸿涛, 李东东, 霍忠明, 李妹妍, 闫喜武
(大连海洋大学 水产与生命学院, 辽宁省贝类良种繁育工程技术研究中心, 辽宁 大连 116023)
菲律宾蛤仔(Ruditapes philippinarum)是我国重要经济贝类之一。据联合国粮食与农业组织(FAO)显示, 2016年全世界蛤仔产量约400万t, 我国大陆沿海养殖蛤仔产量约占 90%[1]。在海产经济贝类中, 壳色的缤纷多彩倍受人们关注, 人们更愿意选择色彩丰富的贝类, 随之提高其经济价值, 以壳色为目标性状进行定向选育, 对贝类遗传育种有重要指导意义。
酪氨酸酶(单酚, DOPA; 氧化还原酶, tyrosinase,E.C.1.14.18.1)是一种含铜金属酶, 主要作用酪氨酸酶催化酪氨酸氧化成多巴, 多巴氧化形成多巴醌反应, 同时多巴醌能自发地相互反应或与氨基反应,使相关蛋白相互交联, 形成具有化学惰性的深色不溶性蛋白聚合物[2-4], 在哺乳动物酪氨酸酶催化产生的黑色素被分泌进入到表皮和毛发的角质细胞中,使体表着色, 从而起保护皮肤和眼睛、抵御紫外线的辐射和防止内部组织过热等作用[5]。在双壳类动物中TYR基因的研究也一直在进行, 在牡蛎的4种壳色研究中表明酪氨酸酶与金色壳色形成有关[6]。目前在扇贝研究中报道, 酪氨酸酶家族可能参与生物矿化和黑色素的生物合成[7]。Yu等[8]克隆了长牡蛎的酪氨酸酶基因, 并对其各个组织中的表达量进行分析, 研究表明酪氨酸酶在色素带中的含量最多。Huan等[9]在长牡蛎稚贝中克隆和分析了酪氨酸酶表达, 表明酪氨酸酶可能参与早期幼虫壳的形成。井岩[10]克隆获得文蛤 TYR基因 cDNA全长, 并利用荧光定量PCR(Polymerase Chain Reaction, PCR)的方法对4种不同壳色文蛤中 TYR基因的表达差异进行分析, 表明 TYR基因在黑壳中表达量最高, 为以后利用壳色作为遗传标记进行品种改良与杂交育种提供理论基础。在合浦珠母贝伤口愈合过程中, 酪氨酸酶均在外套膜中特异性表达, 推测参与了角质层及外壳柱状层形成[11]。其中最主要的是酪氨酸酶控制黑色素细胞的活性, 是黑色素合成的关键酶之一[12]。在菲律宾蛤仔中, 还未有对TYR基因表达特性的报道。
本实验通过二代测序得到菲律宾蛤仔TYR基因,并对不同壳色蛤仔及不同组织进行相对定量分析,分析不同壳色蛤仔 TYR基因的表达特性, 以期揭示色素控制基因与壳色及组织之间关系, 为下一步深入研究其不同壳色表达机制奠定基础。
1 材料与方法
1.1 实验材料
实验采用 4种壳色菲律宾蛤仔, 分别为: 斑马蛤(Z)、白斑马蛤(WZ)、白蛤(W)和橙蛤(O)。2005年从福建莆田野生菲律宾蛤仔群体中采用选育技术, 经过连续7代选育而成。获得具有稳定性状的个体。采自瓦房店养殖场基地壳长20.0 mm±0.5 mm。在实验室中暂养2周, 每种壳色取3个个体作为生物学重复, 对每个个体的7种不同组织分别进行分析。7种组织分别为:鳃、外套膜、闭壳肌、唇瓣、水管、性腺和消化腺。
1.2 序列分析和系统发育树构建
取约 0.03 g组织, 利用试剂盒海洋动物组织总RNA提取试剂盒(天根)提取样本总 RNA, 并在提取过程中用 RNase-Free DNase Set(天根)去除DNA。检测总RNA浓度后, 利用 PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒进行反转录。根据菲律宾蛤仔TYR基因保守区域使用Primer Premier 5.0设计引物进行扩增, PCR产物用2%的琼脂糖凝胶电泳分离后用胶回收试剂盒 (Axygen Bioscience)纯化, 送到公司(上海生工)测序。利用Clustal X 2将蛤仔TYR蛋白序列与现有GenBank中的TYR蛋白序列进行完全比对分析[13], 然后用MEGA 5.05[14]以邻接法 (Neighbor-Joining, NJ)和Poisson模型构建系统发育树, 设置 Bootstrap重复分析1 000次[15]。
1.3 TYR基因相对定量分析和数据处理
根据菲律宾蛤仔TYR基因序列设计荧光定量扩增引物 (表1)。以β-actin为内参基因, 检测4种壳色菲律宾蛤仔以及不同组织中TYR基因的表达水平。用TaKaRa SYBR Green Premix Ex TaqTM||试剂盒。在罗氏荧光定量PCR仪上进行反应, 实验设3个平行样品。荧光定量采用两步法, PCR程序: 94℃ 30 s,94℃ 5 s, 60℃ 30 s, 40 个循环; 溶解。用 2–ΔΔCt法处理各基因荧光定量所得数据, 并用SPSS17.0进行单因素方差分析(One-way ANOVA), 当 P<0.05时, 表示差异显著。
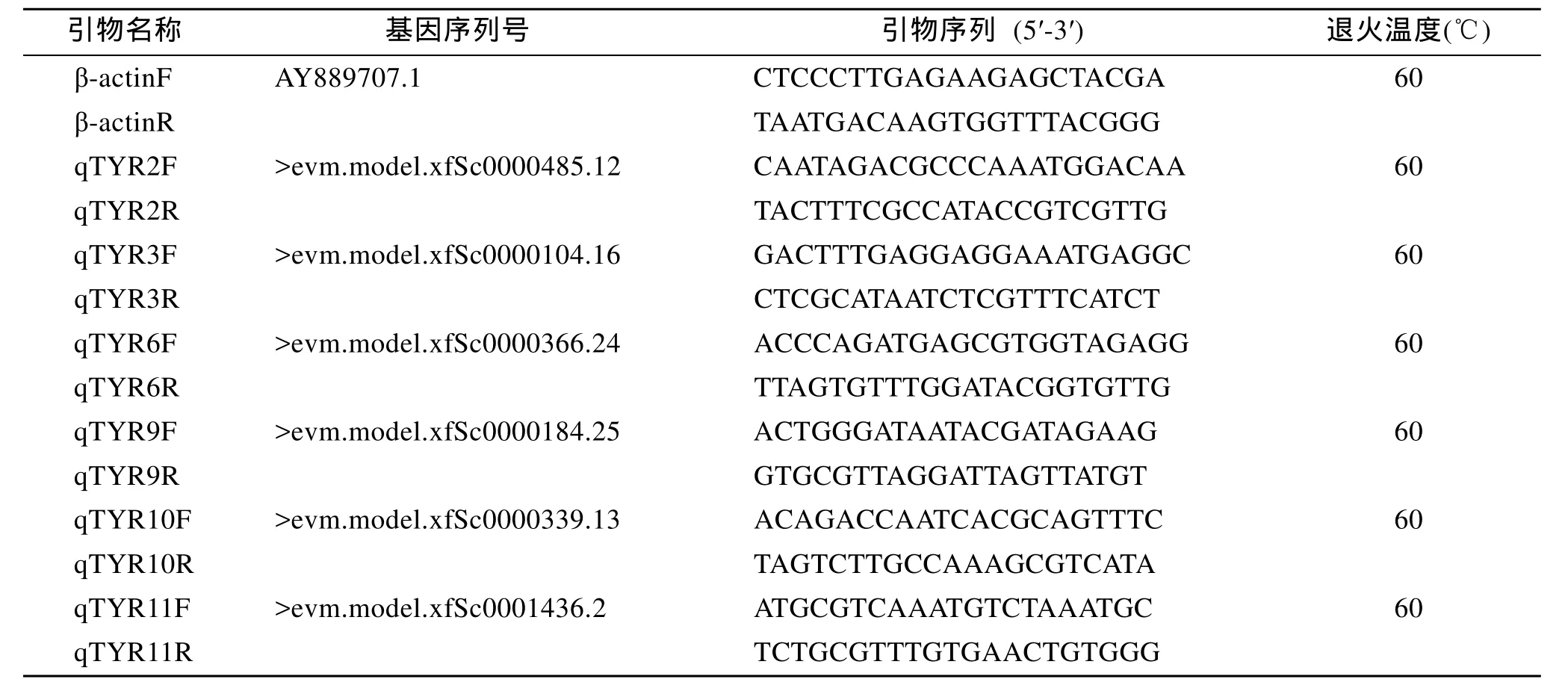
表1 TYR基因荧光定量引物Tab. 1 Primers used in TYR quantitative real-time PCR
2 结果
2.1 菲律宾蛤仔TYR基因序列多重比对及系统发育树的构建
使用 Clustal X 2软件将测序结果与其他物种TYR基因进行多序列比对, 其中测序得到的TYR3基因为280 bp, TYR10基因为750 bp。实验测序所得到的序列与之前设计引物的序列一致。发现 TYR3与TYR10的同源性为48%。TYR3与马氏珠母贝(Pinctada martensii)同源性最高为 64%, 其次为大珠母贝(Pinctada maxima)为63%。TYR10与加州双斑蛸(Octopus bimaculoides)同源性最高, 为53%, 其次为大珠母贝(Pinctada maxima)为51%。均具有同源性(图1)。
图2为 TYR基因进化树。由图可知, 菲律宾蛤仔的TYR3与TYR10最先聚为一支, 菲律宾蛤仔与长牡蛎进化关系最近, 遗传距离最小, 最先聚为一支,再与珠母贝和合浦珠母贝聚为一支, 然后与其余贝类聚为一支, 最后再与脊椎动物聚为一大支。

图1 菲律宾蛤仔TYR3和TYR10与其他物种 TYR 氨基酸序列多序列比对Fig. 1 Multiple alignment of the TYR3 and TYR10 amino acid sequence between Ruditapes philippinarum and other species
2.2 TYR基因在不同组织中的表达模式
TYR2基因在蛤仔7种组织中均有表达, 在鳃、外套膜、闭壳肌、唇瓣、性腺、内脏团以及水管的表达量不尽相同(图 3)。TYR2基因在橙蛤的外套膜中表达量最高, 除白蛤外其他壳色的外套膜表达量也较高,与其他组织表达量差异显著(P < 0.05)。鳃和唇瓣表达量次之。总体来说, TYR2基因在不同壳色蛤仔的7个组织中表达量最高的为外套膜, 闭壳肌中表达量最低。
2.3 TYR基因在四种壳色蛤仔外套膜中的表达模式
菲律宾蛤仔TYR基因在4种壳色外套膜中的表达量如图4所示。不同TYR基因在4种壳色中均有表达。TYR2、TYR3、TYR6和TYR9基因均在白斑马蛤仔壳色中有较高表达, 同时与斑马蛤和白蛤均差异显著(P < 0.05)。TYR2、TYR6、TYR9、TYR10 和TYR11基因均在橙蛤中表达量较高, 其中 TYR2,TYR6和TYR10在橙蛤中表达量最高, 同时与斑马蛤和白蛤均差异显著(P < 0.05)。TYR11在斑马蛤中表达量最高, 与白斑马蛤和斑马蛤壳色差异显著(P <0.05)。(图 4)。
3 讨论
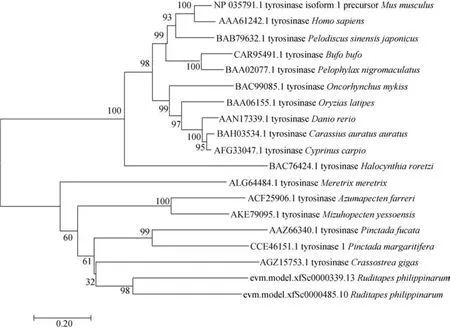
图2 菲律宾蛤仔 TYR3和TYR10与其他物种TYR 氨基酸序列系统进化树Fig. 2 Phylogenetic tree of the TYR amino acid sequences between R. philippinarum and other species

图3 菲律宾蛤仔不同壳色TYR2基因在7种组织的表达量Fig. 3 Expression of TYR2 in seven tissues of four shell color strains of Manila clam
在贝类的发育过程中, 外套膜外表皮细胞中色素细胞不断分泌色素颗粒, 色素颗粒通过微绒毛到达外套膜的表面聚集形成色素带, 从而能够在贝壳的表面形成不同的颜色花纹[16-17]。菲律宾蛤仔外套膜位于左右贝壳内面, 从软体部背侧向腹侧伸展,将内脏团, 鳃等包围起来。本研究发现 6个 TYR基因在不同壳色外套膜中具有不同的表达特性, 可能是由于菲律宾蛤仔复杂的花纹, 在不同的壳色性状中, 都有黑色素合成过程。进一步验证酪氨酸酶与黑色素形成的关系。不同TYR基因在4种壳色中均有表达。TYR2、TYR3、TYR6和TYR9基因均在白斑马蛤外套膜中有较高表达, 白斑马蛤作为斑马蛤和白蛤的杂交后代, 具有抗逆性强等杂种优势[18]。TYR基因在白斑马蛤中高表达可能由于杂种优势, 与免疫调节相关。Muñoz等[19]研究发现, 用寄生虫感染3种双壳类, 发现感染组的血淋巴以及血细胞中酪氨酸活性比对照组显著增加, 证明了酪氨酸酶参与了贝类天然免疫反应。在哺乳动物中, 褐黑色素能使毛发或皮肤表现为黄色和红色, 真黑素表现为褐色和黑色, 它们的相对数量与分布决定了颜色深浅等多种表型[20-21]。橙蛤作为一种特殊的颜色性状, TYR2、TYR6、TYR9、TYR10和TYR11基因均在橙蛤中表达量较高, 推测酪氨酸酶可能与橙蛤中橙色的形成有关。这与之前酪氨酸酶基因在金色牡蛎中表达量高的结果相似[11]。但酪氨酸酶在非黑色素细胞的作用尚不明确, 仍需进一步研究。TYR11在斑马蛤中表达 量最高, 可能与背景色形成有关。
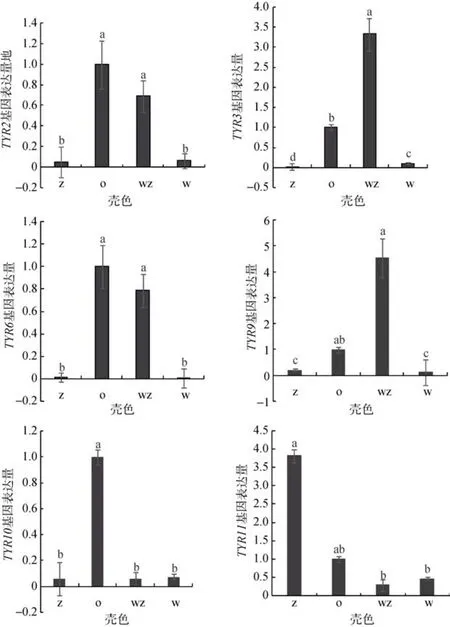
图4 不同TYR基因在4种壳色蛤仔外套膜中的表达量Fig. 4 Analysis of expression difference of different TYR gene in the mautle of different shell colors of Ruditapes philippinarum
TYR基因在蛤仔7种组织中表达量有显著差异,TYR2基因在外套膜和鳃中表达量较高, 可能与不同组织的功能有关。外套膜不断分泌色素及壳形成相关成分, 鳃除了呼吸滤水外, 也是主要的免疫器官,可以调节自身免疫, TYR基因也有可能参与了免疫调节作用, 在其他物种中已被验证[22-23]。酪氨酸酶基因除黑色素形成机制外, 与免疫, 生长等都有密切联系。在光滑双脐螺卵块中检测到了酪氨酸酶活性, 说明与卵泡形成有着密切关系[24]。同时在贝类足丝中也发现了酪氨酸酶的存在, 说明酪氨酸酶与软体动物足丝形成有关[25]。
综上, 本实验利用实时荧光定量 PCR研究了TYR基因在不同壳色蛤仔和不同组织中的表达特性,验证酪氨酸酶基因与黑色素形成的关系, 同时推测了酪氨酸酶基因与非黑色素形成的关系, 以及不同组织中酪氨酸酶基因表达量的变化。为进一步对菲律宾蛤仔壳色的遗传机制研究提供参考。
参考文献:
[1] FAO. Global production statistics: Ruditapes philippinarum [EB/OL]. [2016-12-14]. http: //www.fao.org/fishery/species/3543/en
[2] Waite J H. Quinone-Tanned Scleroproteins[M]. New York: Academic Press. 1983.
[3] And T L H, Kramer K J. Insect cuticle sclerotization[J].Entomology, 1992, 37(37): 273-302.
[4] Kramer K J, Kanost M R, Hopkins T L, et al. Oxidative conjugation of catechols with proteins in insect skeletal systems[J]. Tetrahedron, 2001, 57(2): 385-392.
[5] 陈清西, 宋康康. 酪氨酸酶的研究进展[J]. 厦门大学学报(自然版), 2006, 45(5): 731-737.Chen Qingxi, Song Kangkang. Tyrosinase: recent prospects[J]. Journal of Xiamen University (Natural Science), 2006, 45(5): 731-737.
[6] Feng D, Li Q, Yu H, et al. Comparative transcriptome analysis of the Pacific Oyster Crassostrea gigas characterized by shell colors: identification of genetic bases potentially involved in pigmentation[J]. Plos One, 2015,10(12): e0145257.
[7] Sun X, Yang A, Wu B, et al. Characterization of the mantle transcriptome of yesso scallop (Patinopecten yessoensis): identification of genes potentially involved in biomineralization and pigmentation[J]. Plos One,2015, 10(4): e0122967.
[8] Yu X, Yu H, Kong L F, et al. Molecular cloning and differential expression in tissues of a tyrosinase gene in the Pacific oyster Crassostrea gigas[J]. Molecular Biology Reports, 2014, 41(8): 5403-5411.
[9] Huan P, Liu G, Wang H X, et al. Identification of a tyrosinase gene potentially involved in early larval shell biogenesis of the Pacific oyster Crassostrea gigas[J]. Development Genes and Evolution, 2013,223(6): 389-394.
[10] 井岩. 文蛤 SNP位点的开发和酪氨酸酶基因的克隆及表达分析[D]. 宁波: 浙江万里学院, 2015.Jing Yan. The development of SNP and the clone and expression anlysis of tyrosinase gene in hard clam Meretrix meretrix[D]. Ningbo: Zhejiang Wanli University, 2015.
[11] Zhang C, Xie L, Huang J, et al. A novel putative tyrosinase involved in periostracum formation from the pearl oyster (Pinctada fucata) [J]. Biochemical & Biophysical Research Communications, 2006, 342(2):632-639
[12] Mason H S. Oxidases[J]. Annual Review of Biochemistry,1965, 34(34): 595.
[13] Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007,23(21): 2947-2948.
[14] Tamura K, Peterson D, Peterson N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[15] Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39(4):783-791.
[16] 张安国, 李太武, 苏秀榕, 等. 不同花纹文蛤外套膜的显微及亚显微结构的初步研究[J]. 水产科学, 2011,30(3): 132-135.Zhang Anguo, Li Taiwu, Su Xiurong, et al. Microstructure and ultrastructure of mantle in clam Meretrix meretrix linnaeus with various decorative patterns[J].Fisheries Science, 2011, 30(3): 132-135.
[17] Simkiss K, Wilbur K M. Biomineralization: cell biology and mineral deposition[J]. Quarterly Review of Biology, 1989, 1(3): 257-264.
[18] 闫喜武, 张跃环, 孙焕强, 等. 菲律宾蛤仔两道红与白斑马品系的三元杂交[J]. 水产学报, 2010, 34(8):1190-1197.Yan Xiwu, Zhang Yuehuan, Sun Huanqiang, et al. Three way crosses between two-band red and white zebra strains of Manila clam, Ruditapes philippinarum[J]. Journal of Fisheries of China, 2010, 34(8): 1190-1197.
[19] Muñoz P, Meseguer J, Esteban M A. Phenoloxidase activity in three commercial bivalve species. Changes due to natural infestation with Perkinsus atlanticus [J].Fish & Shellfish Immunology, 2006, 20(1): 12-19.
[20] Venizelos A, Benetti D D. Pigment abnormalities in flatfish [J]. Aquaculture, 1999, 176(176): 181-188.
[21] 孟浩浩, 许瑞霞, 代蓉, 等. 绵羊黑色素合成相关基因的研究进展[J]. 生物技术通报, 2014, 8: 34-39.Meng Haohao, Xu Ruixia, Dai Rong, et al. Research progress of genes related to melanin synthesis in sheep[J]. Biotechnology Bulletin, 2014, 8: 34-39.
[22] Naraoka T, Uchisawa H, Mori H, et al. Purification,characterization and molecular cloning of tyrosinase from the cephalopod mollusk, Illexargentinus[J]. European Journal of Biochemistry, 2003, 270(19): 4026-4038.
[23] Asokan R, Arumugam M, Mullainadhan P. Activation of prophenoloxidase in the plasma and haemocytes of the marine mussel Perna viridis Linnaeus [J]. Developmental & Comparative Immunology, 1997, 21(1): 1.
[24] Bai G, Brown J F, Watson C, et al. Isolation and characterization of phenoloxidase from egg masses of the gastropod mollusc, Biomphalaria glabrata [J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 1997, 118(2): 463.
[25] Waite J H, Tanzer M L. The bioadhesive of Mytilus byssus: a protein containing L-dopa[J]. Biochemical &Biophysical Research Communications, 1980, 96(4): 1554.
