肝癌组织中CUL4A的表达及其对肝癌细胞生长的影响
2017-04-02郑春雷鲍红光高红
郑春雷,鲍红光,高红
(1.齐齐哈尔医学院附属第二医院 肿瘤外科, 黑龙江 齐齐哈尔 16100;2.黑龙江省齐齐哈尔市第二医院 外科, 黑龙江齐齐哈尔 161006)
泛素-蛋白酶系统能够降解蛋白质,具有重要的生物学功能,泛素-蛋白酶系统参与细胞增殖、分化和细胞凋亡,参与炎症反应,具有递呈抗原、转录调控等生命活动,泛素连接酶E3在癌症的发生发展中具有重要作用,Cullin家族高度保守,属于E3连接酶,CUL4A是其家族成员之一,CUL4A的结构和功能与泛素连接酶Cullin 4B(Ubiquitin ligase Cullin 4B,CUL4B)比较相似,通过和DNA损伤蛋白、ROC1环指蛋白结合形成泛素连接酶复合物,发挥降解底物蛋白的作用[1-2]。CUL4A在乳腺癌、鳞状细胞癌、恶性胸膜间质瘤等多种肿瘤中呈高表达[3-5],也有研究[6]发现CUL4A在肝癌中也呈高表达,但CUL4A在肝癌发生发展中的生物学作用尚不十分明确,本研究对肝癌组织中CUL4A的表达情况进行研究,并研究CUL4A对肝癌细胞生长的影响,探讨CUL4A在肝癌发生发展中的作用。
1 资料与方法
1.1 研究对象
选择2013年1月—2015年12月齐齐哈尔医学院病理中心72例肝癌术后肝癌组织标本及其癌旁组织(距离肝癌组织5 cm以上)标本和72例肝血管瘤术后正常肝组织标本做为研究对象,所有肝癌患者术前未进行过放化疗等治疗,首次进行手术治疗。所有研究对象均签署知情同意书,均经齐齐哈尔医学院附属第二医院伦理委员会批准。
1.2 细胞及主要试剂
实验前对正常肝细胞和Hep-G2、QSG-7701肝癌细胞株中CUL4A的表达情况进行检测,CUL4A在正常肝细胞中表达水平低,在Hep-G2、QSG-7701肝癌细胞株中呈较高表达,因此选择Hep-G2和QSG-7701肝癌细胞株进行研究,细胞株均购自上海中科院细胞所。试剂: CUL4A siRNA(美国sigma公司),胰蛋白酶、胎牛血清(北京索莱宝科技有限公司),抗CUL4A抗体、抗β-actin抗体(CST公司)等。
1.3 方法
1.3.1临床资料收集收集72例肝癌患者的年龄、性别及临床病理等资料。
1.3.2检测CUL4A的表达采用免疫组化法检测肝癌组织、癌旁组织和正常肝组织中CUL4A的表达情况。免疫组化结果评分:根据免疫组化染色范围和强度进行评分:染色范围:染色范围为0%为0分,染色范围为1%~25%为1分,染色范围为26%~50%为2分,染色范围为51%~75%为3分,染色范围为76%~100%为4分;染色强度:染色阴性为0分,染色弱阳性为1分,染色阳性为2分,染色强阳性为3~4分。免疫组化评分为染色范围和染色强度相乘。
1.3.3细胞增殖实验将对数生长的Hep-G2和QSG-7701肝癌细胞接种到96孔板中,用CUL4A-siRNA转染肝癌细胞,并以NC-siRNA做为对照,转染后继续培养,转染24 h后吸出培养基,加入CCK混合液孵育,酶标仪测定波长450nm的OD值,每天同一时间进行检测,连续监测7 d。
1.3.4细胞周期监测将对数生长的Hep-G2和QSG-7701肝癌细胞接种到12孔板中培养,待肝癌细胞达85%以上融合时,用CUL4A-siRNA转染肝癌细胞,并以NC-siRNA做为对照,转染48 h后胰蛋白酶消化并收集细胞,进行PI染色,流式细胞仪检测肝癌细胞周期。
1.3.5侵袭实验在24孔板中加入RPMI1640培养液,孔上置入处理过的铺有Matrigel基质胶的小室,将CUL4A-siRNA 和NC-siRNA转染的Hep-G2和QSG-7701肝癌细胞悬液加入小室的上室中培养48 h,取出小室加入甲醇固定,加入结晶紫染液染色,高倍显微镜下拍照并观察穿膜细胞数。
1.3.6迁移实验小室中不铺Matrigel基质胶,细胞接种培养后12 h进行染色,其余步骤同侵袭实验。
1.4 统计学处理
采用SPSS 20.0软件进行分析,两组均数比较采用t检验,多组均数比较采用方差分析,相关性研究采用Spearman相关分析,取P<0.05为差异有统计学意义。
2 结 果
2.1 CUL4A在肝癌组织中的表达
肝癌组织中CUL4 A的免疫组化评分(7.64±2.47)分明显高于癌旁组织(1.23±0.36)分和正常肝组织(0.87±0.12)分(P=0.000);癌旁组织和正常肝组织中CUL4A的表达无统计学差异(P>0.05)(图1)。

图1 CUL4A的不同肝组织中的表达情况(×200) A:肝癌组织;B :癌旁组织;C :正常肝组织
2.2 CUL4A与肝癌临床病理特点的关系
肝癌组织中CUL4 A的表达与肝癌的分化程度、肿瘤直径、淋巴结转移、T N M分级有关(P<0.05),与患者的年龄和性别无关(P>0.05);低分化程度肝癌组织中CUL4A的表达明显高于中/高分化肝癌组织(P<0.05),肝癌直径>5 cm肝癌组织中CUL4A的表达高于直径≤5 cm肝癌组织(P<0.05),有淋巴结转移肝癌组织中CUL4A的表达高于无淋巴结转移者(P<0.05),TNM分级III级肝癌组织中CUL4A的表达高于I~II级(P<0.05)(表1)。
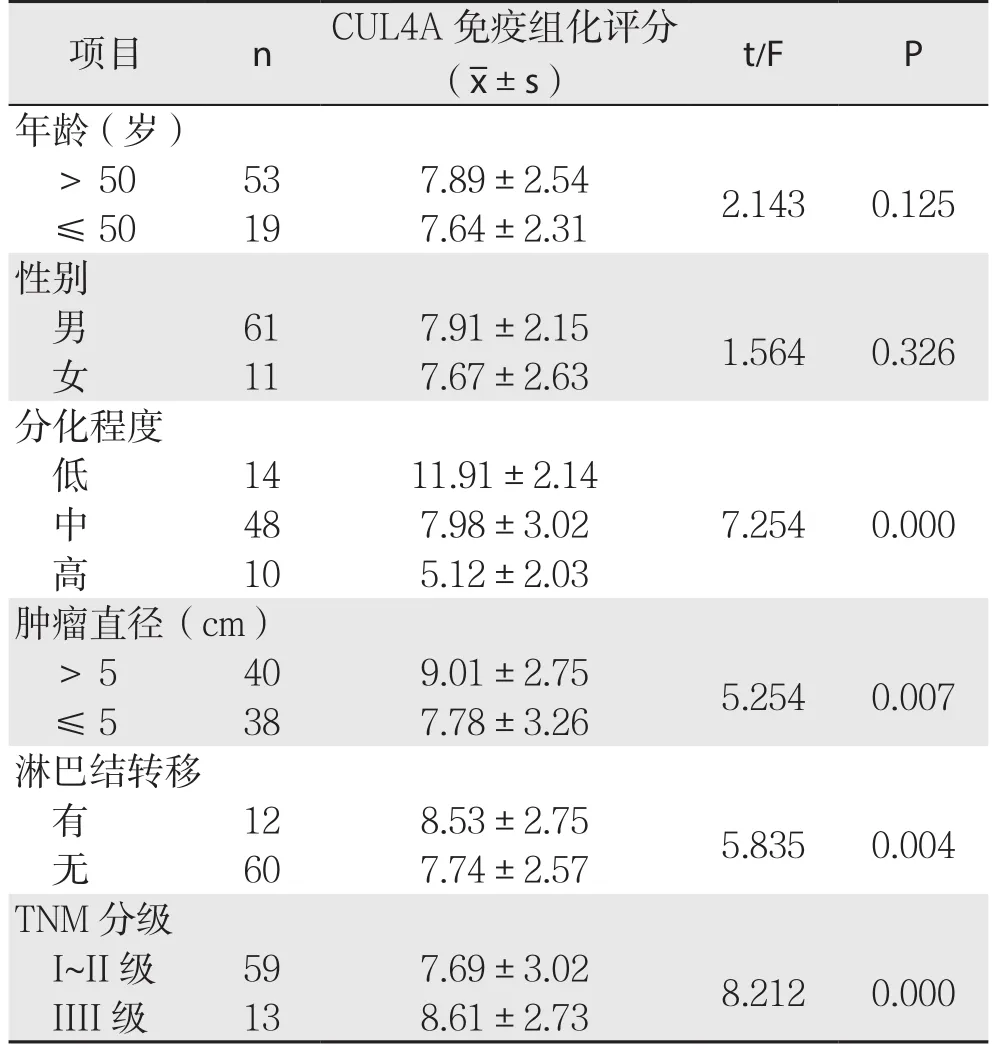
表1 CUL4A的表达与肝癌临床病理特点的关系
2.3 CUL4A对肝癌细胞生长能力的影响
转染CUL4A-siRNA的Hep-G2肝癌细胞株在3 d和7 d时的OD值明显低于NC-siRNA组(P<0.05)(表2);转染CUL4A-siRNA的QSG-7701肝癌细胞株在3 d和7 d时的OD值明显低于NC-siRNA组(P<0.05)(表3)。
2.4 CUL4A对肝癌细胞生长周期的影响
转染CUL4A-siRNA的Hep-G2肝癌细胞株S期细胞比例低于NC-siRNA组(P<0.05)(表4);转染CUL4A-siRNA的QSG-7701肝癌细胞株S期细胞比例低于NC-siRNA组(P<0.05)(表5)。
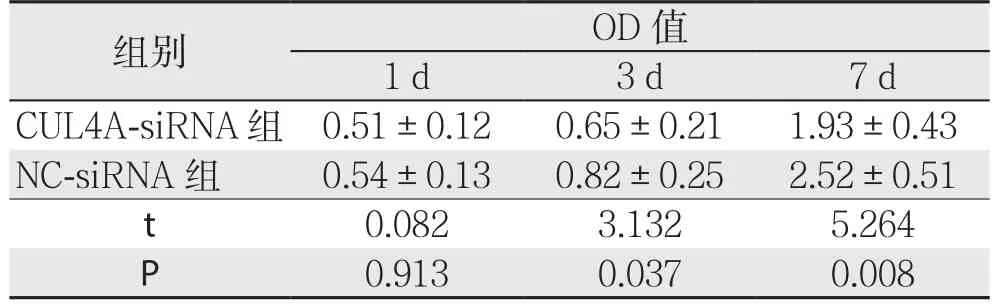
表2 CUL4A对Hep-G2肝癌细胞株增殖的影响

表3 CUL4A对QSG-7701肝癌细胞株增殖的影响
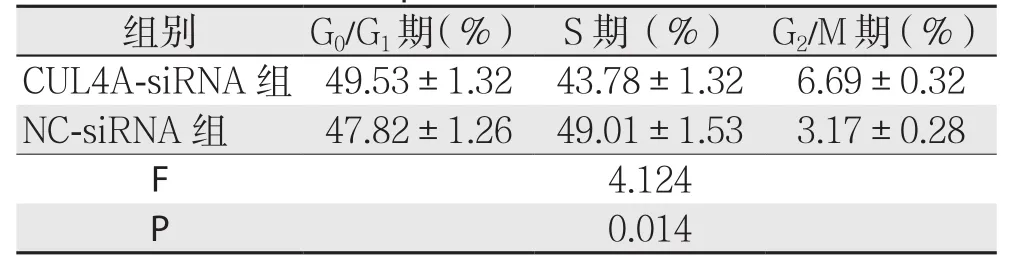
表4 CUL4A对Hep-G2肝癌细胞株生长周期的影响
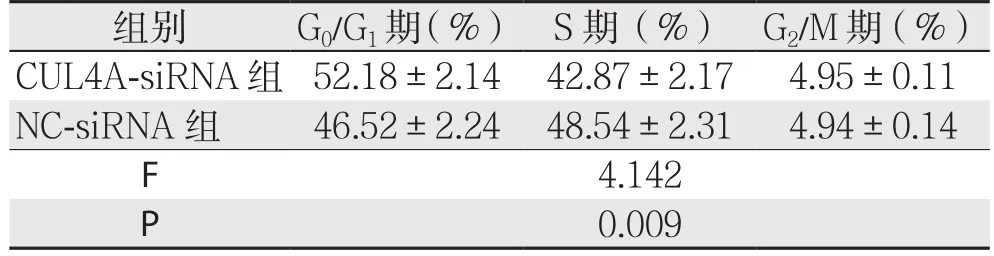
表5 CUL4A对QSG-7701肝癌细胞株生长周期的影响
2.5 CUL4A对肝癌细胞侵袭转移的影响
转染CUL4A-siRNA的Hep-G2肝癌细胞株侵袭转移能力低于NC-siRNA组(P<0.05)(图2);转染CUL4A-siRNA的QSG-7701肝癌细胞株侵袭转移能力低于NC-siRNA组(P<0.05)(图3)。
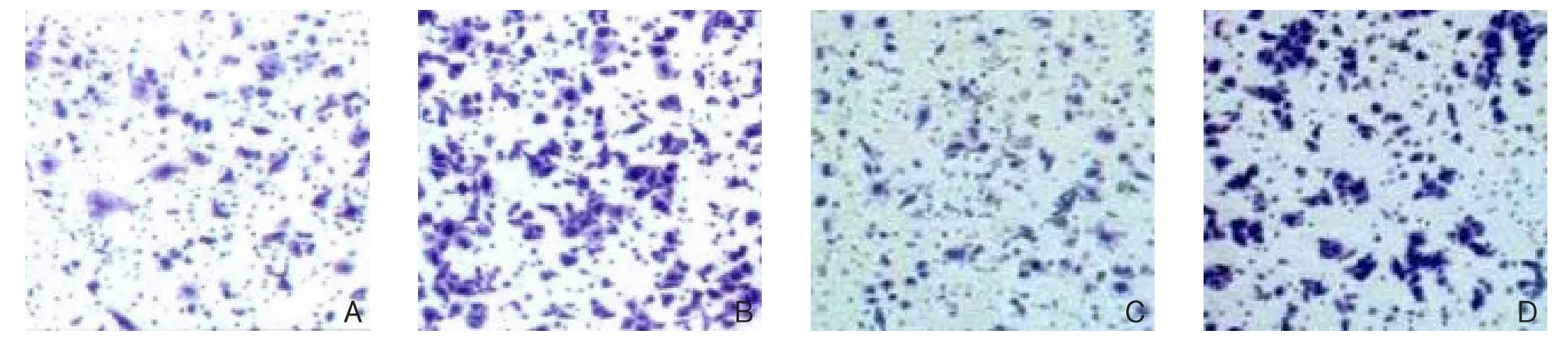
图2 CUL4A对Hep-G2肝癌细胞株侵袭迁移的影响 A:CUL4A-siRNA侵袭;B:NC-siRNA侵袭;C:CUL4A-siRNA迁移;D:NC-siRNA迁移
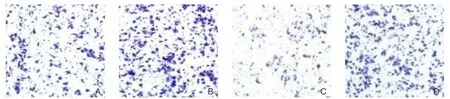
图3 CUL4A对QSG-7701肝癌细胞株侵袭迁移的影响 A:CUL4A-siRNA侵袭;B:NC-siRNA侵袭;C:CUL4A-siRNA迁移;D:NC-siRNA迁移
3 讨 论
CUL4A属于通过泛素化调节蛋白质的降解,Cullin家族成员[7],是最大类的E3泛素连接酶,CUL4A能够调节粒细胞的分化,能够调节造血干细胞的分化和增殖,与肿瘤的发生发展关系密切[8-9]。在乳腺癌、前列腺癌、肾细胞癌、鳞状细胞癌等多种肿瘤中呈高表达[10-12],被推断为是癌基因,CUL4A可以激活E2F1的活性,对损伤的DNA进行修复;CUL4A还可以修饰p27、p21、p53等蛋白使细胞周期停滞,抑制细胞增殖,CUL4A 能够通过MDM2对P53进行调节,CUL4A表达的升高能够降解P53,从而促进恶性肿瘤的发生[13-20]。
王允山等[5]发现CUL4A在乳腺癌的侵袭转移中发挥重要作用;李振宇[10]发现CUL4A在结肠癌中异常表达,并和结肠癌的转移和进展关系密切;韩小妮等[13]发现CUL4A在卵巢癌中异常表达,促进卵巢癌的侵袭和转移。有研究[6]发现CUL4A在正常肝组织中低表达,在肝癌组织中为高表达,但CUL4A在肝癌发生发展中的具体机制尚不清楚,CUL4A是否也影响肝癌细胞的生长?是否影响肝癌细胞的侵袭和转移?本研究对肝癌组织中CUL4A的表达情况进行研究,并探讨CUL4A对肝癌细胞生长的影响,结果发现:肝癌组织中CUL4A的表达明显高于癌旁组织和正常肝组织。肝癌组织中CUL4A的表达和肝癌的分化程度、肿瘤直径、淋巴结转移、TNM分级有关。转染CUL4A-siRNA的Hep-G2、QSG-7701肝癌细胞株在3 d和7 d时的OD值明显高于NC-siRNA组。转染CUL4A-siRNA的Hep-G2、QSG-7701肝癌细胞株S期细胞比例低于NC-siRNA组。转染CUL4A-siRNA的Hep-G2、QSG-7701肝癌细胞株侵袭转移能力低于NC-siRNA组。本研究结果证实了CUL4A在肝癌组织中呈高表达,CUL4A的高表达和肝癌的临床病理特点关系密切,Hep-G2和QSG-7701肝癌细胞株中CUL4A下调后细胞的增殖受到抑制、S期细胞比例降低、侵袭转移能力下降,表明CUL4A可以促进肝癌细胞的生长、影响肝癌细胞周期,促进肝癌细胞的侵袭转移能力。CUL4A在肝癌中发挥促癌基因的作用,CUL4A促进肝癌细胞增殖,影响肝癌细胞周期以及促进侵袭转移能力的机制有待进一步研究,可能与CUL4A修复损伤的DNA,修饰p27、p21、p53等蛋白阻止细胞周期从而抑制细胞增殖,CUL4A 和P53关系密切,CUL4A高表达可以降解P53,从而影响肝癌细胞的生物学特性[21-25]。
[1] Hannah J, Zhou P. Distinct and overlapping functions of the cullin E3 ligase scaあolding proteins CUL4A and CUL4B[J]. Gene, 2015,573(1):33–45. doi: 10.1016/j.gene.2015.08.064.
[2] Yang YL, Ni J, Hsu PC, et al. Cul4A overexpression associated with Gli1 expression in malignant pleural mesothelioma[J]. J Cell Mol Med, 2015, 19(10):2385–2396. doi: 10.1111/jcmm.12620.
[3] Ren W, Shen S, Sun Z, et al. Jak-STAT3 pathway triggers DICER1 for proteasomal degradation by ubiquitin ligase complex ofCUL4A(DCAF1) to promote colon cancer development[J]. Cancer Lett, 2016, 375(2):209–220. doi: 10.1016/j.canlet.2016.02.055.
[4] Deng J, Lei W, Xiang X, et al. Cullin 4A (CUL4A), a direct target of miR-9 and miR-137, promotes gastric cancer proliferation and invasion by regulating the Hippo signaling pathway[J]. Oncotarget,2016, 7(9):10037–10050. doi: 10.18632/oncotarget.7048.
[5] 王允山. CUL4A促进乳腺癌细胞上皮间质转化及侵袭转移的作用机制研究[D]. 济南: 山东大学, 2014.Wang YS. The mechanism of CUL4A promoting breast cancer cell epithelial-mesenchymal transition and metastasis[D]. Jinan:Shandong University, 2014.
[6] 李玉琼. CUL4A在肝细胞癌发生和转移中的作用及机制[D]. 上海: 第二军医大学, 2012.Li YQ. The mechanism of CUL4A in hepatocellular carcinoma and metastasis[D]. Shanghai: Second Military Medical University, 2012.
[7] Kim K, Lee B, Kim J, et al. Linker Histone H1.2 cooperates with Cul4A and PAF1 to drive H4K31 ubiquitylation-mediated transactivation[J]. Cell Rep, 2013, 5(6):1690–1703. doi: 10.1016/j.celrep.2013.11.038.
[8] Wang Y, Wen M, Kwon Y, et al. CUL4A induces epithelialmesenchymal transition and promotes cancer metastasis by regulating ZEB1 expression[J]. Cancer Res, 2014, 74(2):520–531.doi: 10.1158/0008–5472.CAN–13–2182.
[9] Hannah J, Zhou PB. The CUL4A ubiquitin ligase is a potential therapeutic target in skin cancer and other malignancies[J]. Chin J Cancer, 2013, 32(9):478–482. doi: 10.5732/cjc.012.10279.
[10] 李振宇. 结肠癌组织中CUL4A的表达及临床病理学意义[J]. 中外医疗, 2013, 32(34):194–195.Li ZY. Expression of CUL4A in colon cancer tissue and the clinicopathologic significance[J].China Foreign Medical Treatment,2013, 32(34):194–195.
[11] Hung MS, Chen IC, You L, et al. Knockdown of Cul4A increases chemosensitivity to gemcitabine through upregulation of TGFBI in lung cancer cells[J]. Oncol Rep, 2015, 34(6):3187–3195.
[12] Song J, Zhang J, Shao J. Knockdown of CUL4A inhibits invasion and induces apoptosis in osteosarcoma cells[J]. Int J Immunopathol Pharmacol, 2015, 28(2):263–269. doi: 10.1177/0394632015586656.
[13] 韩小妮, 方念, 孙玉芳, 等. CUL4 A促进人卵巢癌细胞侵袭转移及其机制探讨[J]. 现代妇产科进展, 2015, 24(12):889–892.doi:10.13283/j.cnki.xdfckjz.2015.12.003.Han XN, Fang N, Sun YF, et al. Eあect and mechanism of CUL4A on migration and invasion in ovarian cancer cells[J]. Progress in Obstetrics and Gynecology, 2015, 24(12):889–892. doi:10.13283/j.cnki.xdfckjz.2015.12.003.
[14] Liu G, Zhu Z, Lang F, et al. Clinical significance of CUL4A in human prostate cancer[J]. Tumour Biol, 2015, 36(11):8553–8558.doi: 10.1007/s13277–015–3580–2.
[15] Yang YL, Hung MS, Wang Y, et al. Lung tumourigenesis in a conditional Cul4A transgenic mouse model[J]. J Pathol, 2014,233(2):113–123. doi: 10.1002/path.4352.
[16] Han X, Fang Z, Wang H, et al. CUL4A functions as an oncogene in ovarian cancer and is directly regulated by miR-494[J]. Biochem Biophys Res Commun, 2016, 480(4):675–681. doi: 10.1016/j.bbrc.2016.10.114.
[17] Jia L, Yan F, Cao W, et al. Dysregulation of CUL4A and CUL4B Ubiquitin Ligases in Lung Cancer[J]. J Biol Chem, 2017,292(7):2966–2978. doi: 10.1074/jbc.M116.765230.
[18] Ren W, Sun Z, Zeng Q, et al. Aberrant Expression of CUL4A Is Associated with IL‐6/ STAT3 Activation in Colorectal CancerProgression[J]. Arch Med Res, 2016, 47(3):214–222. doi: 10.1016/j.arcmed.2016.07.001.
[19] Hung MS, Chen IC, You L, et al. Knockdown of cullin 4A inhibits growth and increases chemosensitivity in lung cancer cells[J]. J Cell Mol Med, 2016, 20(7):1295–1306. doi: 10.1111/jcmm.12811.
[20] Li X, Xu R, Liu H, et al. CUL4A expression in pediatric osteosarcoma tissues and its eあect on cell growth in osteosarcoma cells[J]. Tumour Biol, 2016, 37(6):8139–8144. doi: 10.1007/s13277–015–4715–1.
[21] Xu Y, Wang Y, Ma G, et al. CUL4A is overexpressed in human pituitary adenomas and regulates pituitary tumor cell proliferation[J]. J Neurooncol, 2014, 116(3):625–632. doi: 10.1007/s11060–013–1349–2.
[22] Wang Y, Ma G, Wang Q, et al. Involvement of CUL4A in regulation of multidrug resistance to P-gp substrate drugs in breast cancercells[J]. Molecules, 2013, 19(1):159–176. doi:10.3390/molecules19010159.
[23] Thirunavukarasou A, Govindarajalu G, Singh P, et al.Cullin 4A and 4B ubiquitin ligases interact with γ‐tubulin and induce its polyubiquitination[J]. Mol Cell Biochem, 2015,401(1/2):219–228. doi: 10.1007/s11010–014–2309–7.
[24] Thirunavukarasou A, Singh P, Govindarajalu G, et al.E3 ubiquitin ligase Cullin4B mediated polyubiquitination of p53 for its degradation[J]. Mol Cell Biochem, 2014, 390(1/2):93–100.doi: 10.1007/s11010–014–1960–3.
[25] Lau AW, Inuzuka H, Fukushima H, et al. Regulation of APC(Cdh1)E3 ligase activity by the Fbw7/cyclin E signaling axis contributes to the tumor suppressor function of Fbw7[J]. Cell Res, 2013,23(7):947–961. doi: 10.1038/cr.2013.67.
