长链非编码RNA肝癌高表达转录本与原发性肝癌关系的研究进展
2017-04-02余斌综述丁佑铭廖晓锋审校
余斌 综述 丁佑铭,廖晓锋 审校
(1. 武汉大学人民医院 肝胆腔镜外科,湖北 武汉 430060;2. 消化系统疾病湖北省重点实验室,湖北 武汉 430060;3. 湖北省襄阳市中心医院 普通外科,湖北 襄阳 441021)
原发性肝癌(以下简称肝癌)是世界最常见的恶性肿瘤之一,其主要组织学亚型为肝细胞癌(hepatocellular carcinoma,HCC),约占70%~90%[1]。截止2012年,全球肝癌发病率已跃居男性常见恶性肿瘤发病率第5位,居女性第9位;其致死率跃居男性肿瘤致死率第2位,居女性第六位[2]。现阶段,肝移植、手术切除、局部消融是治疗早期肝癌的主要手段,但存在着供体缺乏、术后复发率高等诸多问题;此外,由于肝癌早期症状并不明显,患者确诊时多已处于癌症中-晚期,只能选择姑息性治疗,故其整体预后不佳[3]。因此,各国学者不断围绕肝癌潜在的发病机制进行深入研究,以期探寻更为有效的诊断及治疗方法。目前,越来越多的研究证据表明长链非编码RNA(long non-coding RNA,lncRNA)肝癌高表达转录本(highly upregulated in liver cancer,HULC)与肝癌的发生、发展及预后密切相关,并拥有作为早期肝癌诊断标志物及治疗靶点的良好应用前景。
1 lncRNA HULC生物学概述
全基因组分析结果提示人类基因组中仅有不到2%的基因编码蛋白质,约有66%的基因活跃转录为非编码RNA。lncRNA被界定为序列长度>200 nt,缺乏编码蛋白质功能的RNA[4]。随着对于lncRNA各项研究的深入,目前学界普遍认同lncRNA具有多种生物学功能,如转录与翻译调控、表观遗传学调控、细胞周期调节、剪接调节、lncRNA-miRNA或lncRNA-蛋白相互作用等,涉及细胞增值、分化、凋亡、血管生成等众多生物学过程[5-7];此外,lncRNA的失调与人类诸多疾病的发生显著相关,如自身免疫性疾病[8]、心血管系统疾病[9]、神经系统疾病[10],尤其表现在肿瘤学方面[11-12]。
2007年,Panzitt等[13]首次发现HULC基因在肝癌组织中特异性高表达,其转录、加工后可产生一近500nt、含poly-A的长链非编码RNA(lncRNA HULC),主要定位于细胞质核糖体上。HULC基因在灵长类中高度保守,定位于6p24.3,含有1个内含子和2个外显子,其中内含子长度为1152 bp,2个外显子大小分别为182 bp和303 bp,基因上游具有保守的 CpG二核苷酸,可作为甲基化位点参与基因表达调控。后续研究表明,除肝癌外,lncRNA HULC在多种肿瘤组织中同样存在着高表达,且与肿瘤的发生、发展及预后密切相关,如神经胶质瘤[14]、鼻咽部肿瘤[15]、骨肉瘤[16]等。
2 lncRNA HULC与肝癌癌前疾病
肝癌的主要危险因素包括:HBV/HCV感染、饮酒、摄入含黄曲霉素食物等。病毒性肝炎、肝炎后肝硬化、肝癌三者关系密切[17]。
2.1 lncRNA HULC与病毒性肝炎
慢性HBV感染已被广泛证明与肝癌的发生直接相关[18]。Xie等[19]研究发现肝细胞癌患者癌组织中lncRNA HULC的表达水平与其血清HBV阳性水平呈正相关,且具有较高HBV阳性水平的肝癌患者其血清lncRNA HULC检出率更高。
乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBX)作为一种多功能致癌蛋白,可激活各种病毒性或细胞性启动子,在肝癌的发生中起到了重要作用[18,20]。Du等[18]研究证实了HULC基因涉及HBX介导的肝癌发生过程,在HBV相关肝癌的癌组织的中,HBx mRNA水平与lncRNA HULC水平呈正相关,HBX可调节cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)依赖性启动子的转录活性,间接活化HULC启动子以加强HULC基因转录;而过表达的lncRNA HULC能够抑制邻近抑癌基因p18转录子活性,在mRNA和蛋白质两个水平同时下调p18的表达,进而促进肝癌细胞增殖。
此外,Liu等[17]重点研究了HULC基因遗传变异与肝癌易感性的关系,运用病例对照研究猜想并证实了HULC基因启动子区域的rs7763881变异基因型有助于降低乙型肝炎病毒持续携带者发生肝癌的易感性。从另一角度,这一研究发现提示了HULC基因中的单个核苷酸多样性(single nucleotide polymorphisms,SNPs)可能使得已患乙型肝炎病毒慢性感染者罹患肝癌的风险更高。
2.2 lncRNA HULC与肝炎后肝硬化
肝硬化是各种原因所致慢性肝损伤的终末期表现,病理过程漫长,不易发现。慢性病毒性肝炎导致的肝纤维化和肝硬化是肝癌发生的最危险因素。慢性乙型肝炎携带者中每年肝硬化发生率约在2.1%~6.0%[21]。Zhou等[22]研究发现lncRNA可能是促进人肝纤维化形成与进展的关键因素。有超过3600种lncRNA在人星状细胞中表达,lncRNA主要受转化生长因子β(TGF-β)的调节,调控星状细胞分泌细胞外基质等组分,参与纤维化过程。目前的研究重点聚焦于免疫调控细胞,越来越多的研究成果强调了CD+T细胞在肝脏炎症反应和纤维化中具有重要作用。Zhao等[21]研究了HULC基因对调控T细胞分化的影响,其结果表明lncRNA HULC在HBV相关肝硬化组织中高水平表达,其能直接下调抑癌基因p18的表达,增加调节T细胞的数量,提高TGF-β的表达,促进肝纤维化免疫应答过程。
由此可见,lncRNA HULC与病毒性肝炎、肝炎后肝硬化的发展密切相关,其过表达可能增加肝炎、肝硬化患者罹患肝癌的风险。如若加深对lncRNA HULC与肝癌癌前疾病关系的认识,明确lncRNA HULC作为诊断标记物或治疗靶点的价值,将使得预防或延缓肝癌的发生成为可能。
3 lncRNA HULC与肝癌
3.1 lncRNA HULC在肝癌中的表达水平
Panzitt等[13]研究发现在76%的肝细胞癌癌组织标本中,lncRNA HULC的表达水平较正常肝组织平均上调33倍;而在其他肿瘤组织中,例如前列腺癌、星形细胞瘤等,均未见lncRNA HULC明显表达。这提示lncRNA HULC在肝癌组织中的表达具有一定的特异性。此外,原位杂交实验还揭示了lncRNA HULC在肝癌细胞质中特异性高表达,而在肿瘤间质及正常肝细胞中则未测及。Hämmerle等[23]选取60例肝细胞癌癌组织及7例正常肝组织利用微阵列分析发现HULC基因是肝癌组织中除ERBB2假基因外第二高表达的非编码基因;同时运用qRT-PCR 证实了lncRNA HULC在肝癌组织中过表达,其水平约为正常组织中的8倍。大量研究[24-25]均一致证实了lncRNA HULC在肝癌组织中高表达。
3.2 lncRNA HULC在肝癌中的作用机制
lncRNA HULC在肝癌的发生、发展中发挥着重要作用,涉及肝癌细胞的分化、增殖及转移等方面。迄今为止,各国学者围绕其作用机制进行了广泛的研究探讨(图1)。
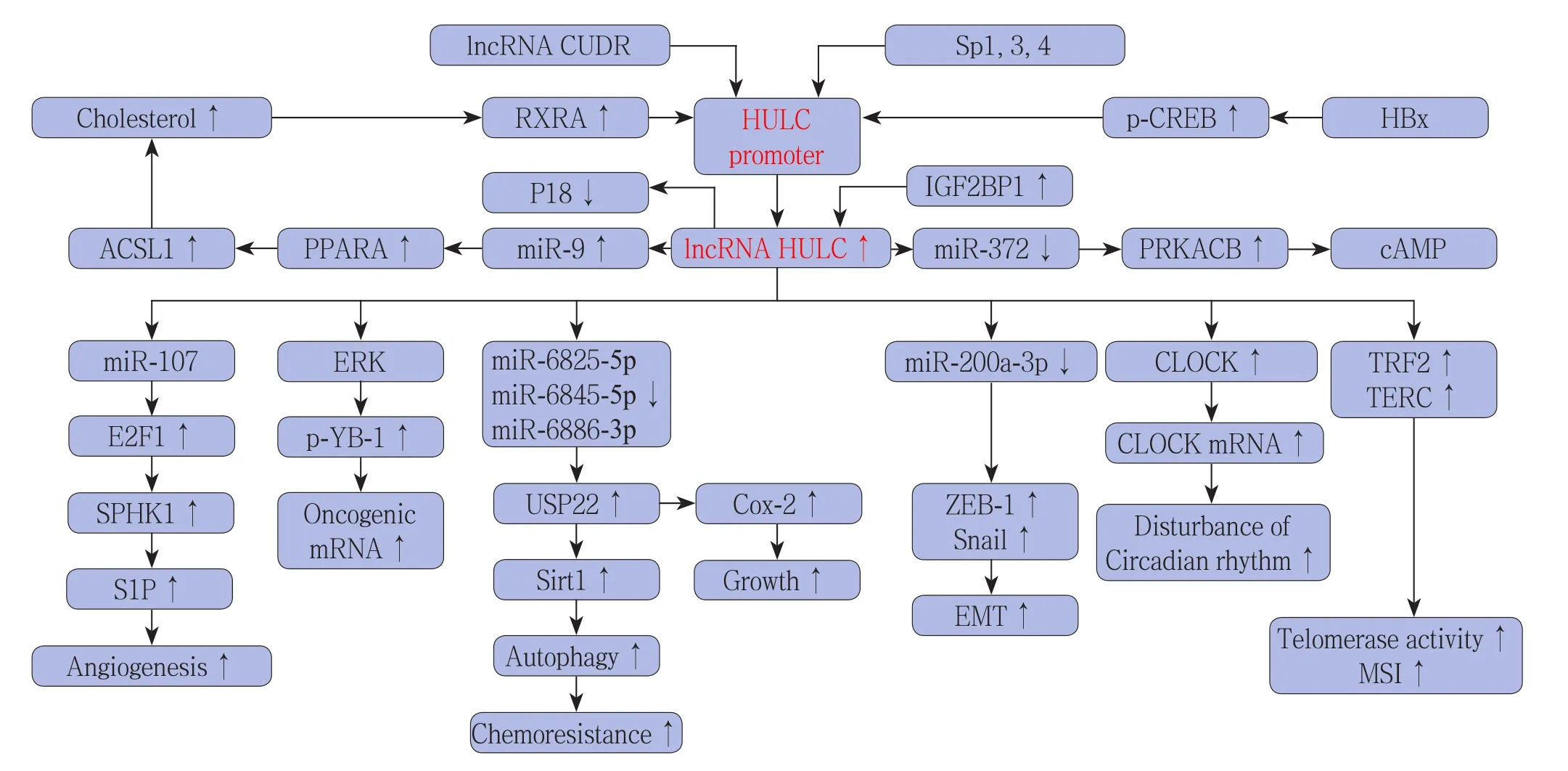
图1 lncRNA HULC在肝癌中的上下游调控机制Figure 1 Up- and down-stream regulatory mechanisms associated with lncRNA HULC in HCC
3.2.1lncRNA HULC表达上调机制Wang等[24]研究发现,lncRNA HULC具有miRNA“海绵”作用,可与miR-372相互作用下调其活性;miR-372的低表达则阻遏了自身对靶基因蛋白激酶A催化亚单位β(protein kinase A catalytic subunit β,PRKACB)的抑制,诱导了CREB的磷酸化;而磷酸化的CREB又可与HULC基因启动子内CREB结合位点特异性结合,维持HULC基因启动子内染色体结构的开放状态,使得肝癌细胞HULC基因转录增加,并形成“正反馈调节”。后来,Wan等[26]研究发现miR-203在肝癌组织中的表达水平较癌周组织下调,且与致癌基因HULC的表达呈负相关。上述研究提示了lncRNA HULC可作为竞争性内源RNA(competitive endogenous RNA,ceRNA)通过抑制miRNA的表达来促进自身水平的上调。
Hämmerle等[23]研究了RNA结合蛋白对lncRNA HULC表达水平的影响,发现类胰岛素生长因子2 mRNA结合蛋白家族(IGF2 mRNA-binding proteins,IGF2BPs)是lncRNA HULC的特异性结合蛋白;IGF2BP1可作为募集CCR4-NOT复合物的衔接蛋白促进HULC贴近CCR4-NOT复合物,启动lncRNA HULC的降解;而肝癌组织中低表达的IGF2BP1则增加了lncRNA HULC的半衰期并使其稳定地高水平表达,提示了HULC基因转录后水平潜在的调控机制。
引人关注的是,Matouk等[27]研究发现lncRNA HULC仅在结直肠癌肝转移患者中高表达,而结直肠癌淋巴转移患者则无,由此提出lncRNA HULC水平的上调或许与肝脏微环境有关。此外,Gandhy等[28]提出lncRNA HULC在肝癌细胞中的高表达受转录因子Sp(specificity protein 1、3、4)的调控,但其具体机制尚未阐明。
3.2.2lncRNA HULC与肝癌细胞的增殖Gui等[29]研究证实了CUDR-HULC信号通路在肝癌干细胞中发挥着积极的作用,长链非编码RNA CUDR(cancer up-regulated drug resistant)可通过抑制HULC基因启动子甲基化来促进胚胎干细胞向肝样细胞分化以及肝样细胞的恶性转化,提示了HULC基因涉及肝癌相关表观遗传学的调控。
脂质代谢紊乱能影响多种细胞生命活动,如增殖、运动及肿瘤发生。肝脏作为脂质代谢的中心,肝癌的发生伴随着脂质代谢的紊乱。Cui等[30]重点研究了lncRNA HULC与肝癌细胞脂质代谢异常的关系,发现60例肝细胞癌癌组织样本中lncRNA HULC水平与长链脂酰CoA合成酶1(Acyl-CoA synthetase long-chain family members 1,ACSL1)及其产物水平呈正相关;lncRNA HULC能诱导miR-9启动子CpG岛甲基化,抑制miR-9的表达,阻遏miR-9对过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha,PPARA)的抑制作用;而高表达的PPARA则促进了ACSL1的反式激活,使得肝癌细胞内脂肪生成加强;此外,ACSL1的胆固醇产物(Cholesterol)又可通过激活转录因子RXRA 上调lncRNA HULC,由此在肝癌细胞中形成HULC/miR-9/PPARA/ACSL1/cholesterol/RXRA/HULC正反馈环路,介导脂质代谢的紊乱,促进肝癌了发生与发展。
在肝细胞中,近10%的基因受生物钟的控制而节律性表达。生物钟基因的表达紊乱涉及肝癌的发生与发展。Cui等[31]重点研究了lncRNA HULC与肝癌细胞生物钟基因的关系,发现在肝细胞癌癌组织中生物钟基因CLOCK高表达,且lncRNA HULC与CLOCK的表达水平呈正相关;lncRNA HULC能够上调肝癌细胞中CLOCK基因及其下游昼夜节律振荡器per和cry的表达水平,显著改变CLOCK基因的表达模式并延长CLOCK基因的周期表达;流式细胞学分析显示lncRNA HULC、CLOCK mRNA共同作用时可使得肝癌细胞S相比例增加。由此证实了lncRNA HULC可通过上调CLOCK的表达水平扰乱肝细胞生理节律(disturbance of circadian rhythm),促进肝癌细胞的增殖。
Wu等[32]研究证实lncRNA HULC与长链非编码RNA肺腺癌转移相关转录本1(metastasisassociated lung adenocarcinoma transcript 1,MALAT1)在肝癌细胞中联合过表达可显著促进肝癌细胞的增殖。深入研究发现,两者的过表达可增强RNA聚合酶-II(RNA pol II)、乙酰基转移酶P 300、癌蛋白CREPT与端粒重复结合因子(telomere repeat-binding factor 2,TRF2)的启动子区域相结合并触发TRF2的过表达、磷酸化和SUMO化修饰(small ubiquitin-related modifier),而TRF2与lncRNA HULC或lncRNA MALAT1所形成的复合物又可替代CST/AAF复合物结合于端粒区,募集端粒保护蛋白(protection of telomeres,POT1)、磷酸化端粒保护蛋白(pPOT1)、核酸外切酶1(exonuclease 1,Exo 1)、异染色质蛋白1-α(heterochromatin protein 1 alpha,HP1α)、核酸外切酶SNM1B,极大地保护和延长端粒。此外,过量的lncRNA HULC可减少端粒酶RNA(telomerase RNA component,TERC)启动子的甲基化,增加TERC表达,使得端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和TERC之间的相互作用加强;最终导致肝癌干细胞中周期相关蛋白(cell cycle related proteins)的激活,以及端粒酶活性(telomerase activity)和微卫星不稳定性(microsatellite instability,MSI)的增加,促进了肝癌细胞的恶性增殖。
此外,Li等[33]还研究发现lncRNA HULC能通过ERK激酶途径促进YB-1蛋白(Y-box binding protein 1,YB-1)的磷酸化,减弱了YB-1与特定致癌基因转录产物mRNA(oncogenic mRNA)的结合,加速其翻译过程,由此促进了肿瘤的形成。值得注意的是,Xiong等[34]致力于肝癌、lncRNA HULC、去泛素化三者关系的研究,其最新研究发现肝癌细胞中高表达的lncRNA HULC能增加去泛素化酶USP22(ubiquitin-specific peptidase 22)的水平,以此减少泛素所介导的环氧合酶2(cyclooxygenase 2,COX-2)蛋白降解,从而促进了肝癌细胞的增殖,提示了“HULC/USP22/COX-2”轴在肝癌中的潜在作用。
3.2.3lncRNA HULC与肝癌细胞的侵袭和转移血管再生(angiogenesis)在肿瘤的发展及转移中发挥着重要作用。据报道Sphingosine kinase/S1P/S1P receptor 信号轴涉及肿瘤形成,促进细胞的存活、增殖、分化并刺激血管再生[35]。Lu等[35]重点研究了lncRNA HULC与SPHK1(sphingosine kinase 1)在肝癌血管生成中的作用,发现SPHK1在肝癌组织中较癌周组织高表达;肝癌组织及肝癌细胞系HepG2中lncRNA HULC水平与SPHK1及其产物S1P水平呈正相关;lncRNA HULC能够基于碱基互补配对发挥“海绵样”作用降低miR-107表达,阻遏其对E2F1的抑制;上调的E2F1与SPHK1启动子区域内E2F1元件相结合,促进SPHK1的转录;SPHK1/S1P/S1P receptor信号轴的激活促进了肝癌的血管生成,增强了肝癌的侵袭能力。
上皮-间质转化(epithelial-mesenchymal transition,EMT)涉及肿瘤细胞的侵袭、转移及耐药性等,在肿瘤的进展中具有重要作用。Zhang等[36]研究发现lncRNA HULC的过表达能够促进肝癌细胞系MHCC97L和HepG2的增殖,并增强肝癌细胞的侵袭能力;此外,肝癌细胞中高表达的lncRNA HULC能够上调EMT相关转录因子Snail的表达水平。Li等[25]深入研究发现在肝细胞癌癌组织中lncRNA HULC的表达水平与miR-200a-3p呈负相关,而与EMT相关转录因子ZEB1、Snail等呈正相关;细胞及动物模型实验进一步提示了lncRNA HULC可作为竞争性内源RNA阻隔miR-200a-3p对其靶基因ZEB-1的抑制,通过上调ZEB-1来介导EMT过程,促进肝癌的侵袭与转移。
3.3 lncRNA HULC在肝癌中的诊疗价值
现阶段,肝细胞癌的总体疗效不佳,基础研究与临床实践之间的巨大鸿沟是导致疗效难以进一步提高的瓶颈。转化医学从肝癌的早期诊断、药物筛选、干预新策略的制定、复发转移的早期预测等方面为肝癌实现从基础研究到临床实践的跨越搭建了重要桥梁[37]。
甲胎蛋白(AFP)是目前临床上诊断早期肝癌所广泛使用的血清标记物,但因其敏感性(39%~65%)与特异性(76%~94%)欠佳[38],时有误诊漏诊,各国学者仍在不断探寻一种敏感性更高、特异性更强的肝癌血清标记物,以期达到早诊断、早治疗,改善预后的目的。Panzitt 等[13]首次在肝细胞癌患者血清中测及lncRNA HULC的存在,提示了lncRNA HULC成为原发性肝癌新型肿瘤标记物的可能。Xie等[19]运用qRT-PCR分别检测20例健康人和30例肝细胞癌患者血浆中lncRNA HULC的表达水平,结果显示肝癌患者组血浆中lncRNA HULC的检出率为63%(19/30),明显高于健康人对照组的10%(2/20)。此外,lncRNA HULC的检出率与Edmondson分级呈正相关,Edmondson分级I~II、II~III、III~IV的血浆检出率分别为14%、62%、100%。随后,Li等[39]也研究证实肝细胞癌患者血浆样本中lncRNA HULC表达水平显著上调,且血浆中lncRNA HULC表达水平能有效预测肝癌的生长和转移,并指出lncRNA HULC联合AFP能够有效提高肝癌诊断正确率。综上所述,lncRNA HULC有希望成为一种新型的血清肿瘤标记物用于原发性肝癌的诊断或预后评估,但现阶段缺乏针对其敏感性、特异性所进行的比较性研究(如lncRNA HULC与AFP、lncRNA HULC与GP73等),故lncRNA HULC的血清学诊断价值有待进一步明确。
此外,研究者还针对lncRNA HULC在肝癌组织中的表达水平与患者临床病理特征及预后的关系进行了探讨。Li等[25]分析38例肝细胞癌样本后发现lncRNA HULC的表达水平与肝癌患者的临床分期、肝内转移及复发有统计学意义,而与诸如年龄、性别、肿瘤大小、肿瘤分化、远处转移等指标无统计学意义;此外,lncRNA HULC相对高表达者(中位生存期17个月)较相对低表达者(中位生存期41个月)有着更差的5年存活率,这些结论提示了lncRNA HULC的表达上调涉及肝癌的发生、发展及预后。Fan等[40]Meta分析结果揭示肝癌患者lncRNA HULC的高表达与较差的无病生存期、肿瘤分级、远处转移等有关,其可作为肝癌的预后评价指标。然而,Hämmerle等[23]却研究发现lncRNA HULC在低分期及低分级的肝癌组织中有着更高的表达水平,但lncRNA HULC的表达水平与年龄、性别、肿瘤大小等无关,指出lncRNA HULC在肿瘤早期进展中具有重要作用。值得注意的是,Yang等[41]还研究发现lncRNA HULC能够减少肝癌的血管侵袭,是肝癌预后的积极因素。而且,单变量及多变量Cox回归分析表明肿瘤组织中lncRNA HULC水平的上调有助于更好的临床结局,包括生存期及无病生存期。不难发现,现阶段对于HULC的表达水平与肝癌患者临床病理特征及预后的关系尚不完全明确,目前主要存在着研究样本量偏小,随访时间不足,患者纳入标准不一致(如治疗干预的影响)等问题,期待后续深入研究予以阐明。
值得关注的是,Xiong等[42]重点研究了lncRNA HULC与肝癌化疗药物耐药性(chemoresistance)两者的关系,其结果揭示lncRNA能通过减弱miR-6825-5p、miR-6845-5p和miR-6886-3p 3种mRNA的表达,增加USP22的表达水平,加强沉默调节蛋白1(silent information regulator 1 protein,Sirt1)去泛素化,引发肝癌细胞的自噬现象,由此增强肝癌细胞对化疗药物的耐药性(图1)。此外,该课题组在发现“HULC/USP22/COX-2”通路促进肝细胞增殖的基础上,还进一步提出猜想:lncRNA HULC所介导的COX-2增加是否与肝癌化疗敏感性相关[34]?这有待研究者的后续研究予以证实。总而言之,该团队的一系列研究成果及猜想有望为增强肝癌化疗敏感性提供新靶点和新思路。
4 结 语
lncRNA HULC与肝癌的发生、发展密切相关,并拥有作为早期肝癌诊断标志物及治疗靶点的良好应用前景。但目前对于lncRNA HULC与肝癌关系的研究尚处于初步阶段,HULC在肝癌及其癌前疾病(如肝炎、肝硬化等)中的生物学功能和作用机制亟待丰富,其作为早期诊断标志物和治疗靶点的应用价值也有待更为深入的研究探讨。可以相信,随着研究思路的不断创新以及研究技术的不断进步,lncRNA HULC与肝癌关系的研究有望得到突破,并为肝癌的诊治提供新策略、开辟新路径。
[1] Torre LA, Siegel RL, Ward EM, et al. Global Cancer Incidence and Mortality Rates and Trends-An Update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1):16–27. doi: 10.1158/1055–9965.EPI–15–0578.
[2] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262
[3] Rich NE, Yopp AC, Singal AG. Medical management of hepatocellular carcinoma[J]. J Oncol Pract, 2017, 13(6):356–364.doi: 10.1200/JOP.2017.022996.
[4] Meseure D, Drak Alsibai K, Nicolas A, et al. Long Noncoding RNAs as New Architects in Cancer Epigenetics, Prognostic Biomarkers, and Potential Therapeutic Targets [J]. Biomed Res Int,2015, 2015:320214. doi: 10.1155/2015/320214.
[5] Shi L, Peng F, Tao Y, et al. Roles of long noncoding RNAs in hepatocellular carcinoma[J]. Virus Res, 2016, 223:131–139. doi:10.1016/j.virusres.2016.06.008.
[6] Li CH, Chen Y. Targeting long non-coding RNAs in cancers:progress and prospects[J]. Int J Biochem Cell Biol, 2013,45(8):1895–1910. doi: 10.1016/j.biocel.2013.05.030.
[7] 何运, 陈攀, 罗嘉, 等. 长链非编码RNA在肝癌中的研究进展[J].中国普通外科杂志, 2016, 25(7):1069–1075. doi:10.3978/j.issn.1005–6947.2016.07.022.He Y, Chen P, Luo J, et al. Long noncoding RNAs in hepatocellular carcinoma:recent research progress[J]. Chinese Journal of General Surgery, 2016, 25(7):1069–1075. doi:10.3978/j.issn.1005–6947.2016.07.022.
[8] Wu GC, Pan HF, Leng RX, et al. Emerging role of long noncoding RNAs in autoimmune diseases[J]. Autoimmun Rev, 2015,14(9):798–805. doi: 10.1016/j.autrev.2015.05.004.
[9] Mazidi M, Penson P, Gluba-Brzozka A, et al. Relationship between long noncoding RNAs and physiological risk factors of cardiovascular disease[J]. J Clin Lipidol, 2017, 11(3):617–623. doi:10.1016/j.jacl.2017.03.009.
[10] Shi C, Zhang L, Qin C. Long non-coding RNAs in brain development, synaptic biology, and Alzheimer's disease[J].Brain Res Bull, 2017, 132:160–169. doi: 10.1016/j.brainresbull.2017.03.010.
[11] Rao AKDM, Rajkumar T, Mani S. Perspectives of long non-coding RNAs in cancer[J]. Mol Biol Rep, 2017, 44(2):203–218. doi:10.1007/s11033–017–4103–6.
[12] Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, doi: 10.1038/onc.2017.184.[Epub ahead of print]
[13] Panzitt K, Tschernatsch MM, Guelly C, et al. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA[J]. Gastroenterology, 2007,132(1):330–342. doi: 10.1053/j.gastro.2006.08.026.
[14] Zhu Y, Zhang X, Qi L, et al. HULC long noncoding RNA silencing suppresses angiogenesis by regulating ESM-1 via the PI3K/Akt/mTOR signaling pathway in human gliomas[J]. Oncotarget, 2016,7(12):14429–14440. doi: 10.18632/oncotarget.7418.
[15] Jiang X, Liu W. Long Noncoding RNA Highly Upregulated in Liver Cancer Activates p53-p21 Pathway and Promotes Nasopharyngeal Carcinoma Cell Growth[J]. DNA Cell Biol, 2017, doi: 10.1089/dna.2017.3686. [Epub ahead of print]
[16] Uzan VR, Lengert Av, Boldrini É, et al. High Expression of HULC Is Associated with Poor Prognosis in Osteosarcoma Patients[J]. PLoS One, 2016, 11(6):e0156774. doi: 10.1371/journal.pone.0156774.
[17] Liu Y, Pan S, Liu L, et al. A genetic variant in long non-coding RNA HULC contributes to risk of HBV-related hepatocellular carcinoma in a Chinese population[J]. PLoS One, 2012, 7(4):e35145. doi:10.1371/journal.pone.0035145.
[18] Du Y, Kong G, You X, et al. Elevation of highly up-regulated in liver cancer (HULC) by hepatitis B virus X protein promotes hepatoma cell proliferation via down-regulating p18[J]. J Biol Chem, 2012, 287(31):26302–26311. doi: 10.1074/jbc.M112.342113.
[19] Xie H, Ma H, Zhou D. Plasma HULC as a promising novel biomarker for the detection of hepatocellular carcinoma[J]. Biomed Res Int, 2013, 2013:136106. doi: 10.1155/2013/136106.
[20] Liu S, Koh SS, Lee CG. Hepatitis B Virus X Protein and Hepatocarcinogenesis[J]. Int J Mol Sci, 2016, 17(6). pii: E940. doi:10.3390/ijms17060940.
[21] Zhao J, Fan Y, Wang K, et al. LncRNA HULC affects the differentiation of Treg in HBV-related liver cirrhosis[J]. Int Immunopharmacol, 2015, 28(2):901–905. doi: 10.1016/j.intimp.2015.04.028.
[22] Zhou C, York SR, Chen JY, et al. Long noncoding RNAs expressed in human hepatic stellate cells form networks with extracellular matrix proteins[J]. Genome Med, 2016, 8(1):31. doi: 10.1186/s13073–016–0285–0.
[23] Hämmerle M, Gutschner T, Uckelmann H, et al. Posttranscriptional destabilization of the liver‐specific long noncoding RNA HULC by the IGF2 mRNA‐binding protein 1 (IGF2BP1)[J]. Hepatology,2013, 58(5):1703–1712. doi: 10.1002/hep.26537.
[24] Wang J, Liu X, Wu H, et al. CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer[J]. Nucleic Acids Res, 2010, 38(16):5366–5383. doi:10.1093/nar/gkq285.
[25] Li SP, Xu HX, Yu Y, et al. LncRNA HULC enhances epithelialmesenchymal transition to promote tumorigenesis and metastasis of hepatocellular carcinoma via the miR-200a-3p/ ZEB1 signaling pathway[J]. Oncotarget, 2016, 7(27):42431–42446. doi: 10.18632/oncotarget.9883.
[26] Wan D, Shen S, Fu S, et al. miR-203 suppresses the proliferation and metastasis of hepatocellular carcinoma by targeting oncogene ADAM9 and oncogenic long non-coding RNA HULC[J].Anticancer Agents Med Chem, 2016, 16(4):414–423. doi: 10.2174/1871520615666150716105955.
[27] Matouk IJ, Abbasi I, Hochberg A, et al. Highly upregulated in liver cancer noncoding RNA is overexpressed in hepatic colorectal metastasis[J]. Eur J Gastroenterol Hepatol, 2009, 21(6):688–692.
[28] Gandhy SU, Imanirad P, Jin UH, et al. Specificity protein (Sp)transcription factors and metformin regulate expression of the long non-coding RNA HULC[J]. Oncotarget, 2015, 6(28):26359–26372.doi: 10.18632/oncotarget.4560.
[29] Gui X, Li H, Li T, et al. Long Noncoding RNA CUDR Regulates HULC and β‐Catenin to Govern Human Liver Stem Cell Malignant Diあerentiatio[J]. Mol Ther, 2015, 23(12):1843–1853. doi: 10.1038/mt.2015.166.
[30] Cui M, Xiao Z, Wang Y, et al. Long noncoding RNA HULC modulates abnormal lipid metabolism in Hepatoma cells through an miR-9–mediated RXRA signaling pathway[J]. Cancer Res, 2015,75(5):846–857. doi: 10.1158/0008–5472.CAN–14–1192.
[31] Cui M, Zheng M, Sun B, et al. A long noncoding RNA perturbs the circadian rhythm of hepatoma cells to facilitate hepatocarcinogenesis[J]. Neoplasia, 2015, 17(1):79–88. doi:10.1016/j.neo.2014.11.004.
[32] Wu M, Lin Z, Li X, et al. HULC cooperates with MALAT1 to aggravate liver cancer stem cells growth through telomere repeat-binding factor 2[J]. Sci Rep, 2016, 6:36045. doi: 10.1038/srep36045.
[33] Li D, Liu X, Zhou J, et al. Long noncoding RNA HULC modulates the phosphorylation of YB-1 through serving as a scaffold of extracellular signal-regulated kinase and YB-1 to enhance hepatocarcinogenesis[J]. Hepatology, 2017, 65(5):1612–1627. doi:10.1002/hep.29010.
[34] Xiong H, Li B, He J, et al. lncRNA HULC promotes the growth of hepatocellular carcinoma cells via stabilizing COX-2 protein[J]. Biochem Biophys Res Commun, 2017, pii: S0006–291X(17)31234–2. doi: 10.1016/j.bbrc.2017.06.103. [Epub ahead of print]
[35] Lu Z, Xiao Z, Liu F, et al. Long non-coding RNA HULC promotes tumor angiogenesis in liver cancer by up-regulating sphingosine kinase 1 (SPHK1)[J]. Oncotarget, 2016, 7(1):241–254. doi:10.18632/oncotarget.6280.
[36] Zhang Y, Li Z, Zhang Y, et al. Molecular mechanism of HEIH and HULC in the proliferation and invasion of hepatoma cells[J]. Int J Clin Exp Med, 2015, 8(8):12956–12962.
[37] 周俭, 肖永胜. 肝癌的转化医学研究——从基础到临床[J]. 中国普通外科杂志, 2016, 25(1):1–5. doi:10.3978/j.issn.1005–6947.2016.01.001.Zhou J, Xiao YS. Translational medical research of hepatocellular carcinoma: from bench to bedside[J]. Chinese Journal of General Surgery, 2016, 25(1):1–5. doi:10.3978/j.issn.1005–6947.2016.01.001.
[38] Abdel-Hamid NM, Shehata DE, Abdel-ghany AA, et al.Serum serotonin as unexpected potential marker for staging of experimental hepatocellular carcinoma[J]. Biomed Pharmacother,2016, 83:407–411. doi: 10.1016/j.biopha.2016.07.005.
[39] Li J, Wang X, Tang J, et al. HULC and Linc00152 Act as Novel Biomarkers in Predicting Diagnosis of Hepatocellular Carcinoma[J]. Cell Physiol Biochem, 2015, 37(2):687–696. doi:10.1159/000430387.
[40] Fan Y H, Wu M J, Jiang Y, et al. Long non-coding RNA HULC as a potential prognostic biomarker in human cancers: a metaanalysis[J]. Oncotarget, 2017, 8(13):21410–21417. doi: 10.18632/oncotarget.15247.
[41] Yang Z, Lu Y, Xu Q, et al. HULC and H19 Played Diあerent Roles in Overall and Disease-Free Survival from Hepatocellular Carcinoma after Curative Hepatectomy: A Preliminary Analysis from Gene Expression Omnibus[J]. Dis Markers, 2015,2015:191029. doi:10.1155/2015/191029.
[42] Xiong H, Ni Z, He J, et al. LncRNA HULC triggers autophagy via stabilizing Sirt1 and attenuates the chemosensitivity of HCC cells[J]. Oncogene, 2017, 36(25):3528–3540. doi: 10.1038/onc.2016.521.
