肝细胞肝癌患者血清microRNAlet-7a水平的变化及意义
2017-04-02陈勇治舒健王俊吕品张红辉
陈勇治,舒健,王俊,吕品,张红辉
(湖南师范大学第一附属医院/ 湖南省人民医院 胆道外科,湖南 长沙 410005)
原发性肝细胞癌(HCC)为我国常见恶性肿瘤之一,发病率高,预后差。尽管近年来医学水平不断提升,但HCC患者远期生存率仍远不及50%[1-2]。多数患者确诊时多已处于中、晚期。因此发现有效的分子生物学诊断指标,做到早期诊断与治疗是改善患者预后的关键。microRNA分子是一类非编码小RNA,具有高度保守性,与多种肿瘤的发生发展关系密切。let-7a作为microRNA分子一员,可通过与c-Myc[3]、HMGA2[4]和RAS[5]等癌基因的3′非编码翻译区结合从而抑制靶基因的转录或翻译,进而抑制肿瘤的生长、浸润、转移等生物学过程。已有研究[6]表明,let-7a表达在HCC中明显下调,与HCC的发生、发展关系密切,有望成为潜在诊断与靶向治疗的分子指标。报道[7]显示,不同疾病状态下患者血清/血浆miRNA存在差异表达,且具有稳定性与组织特异性,这让肿瘤患者血清异常表达的miRNA成新的分子诊断标志物成为可能。关于let-7a在血液中表达水平与HCC的关系如何?本研究采取qRT-PCR测定HCC患者血清let-7a水平,探讨let-7a与HCC患者临床病理因素的关系,并进一步分析其对于HCC的诊断效能,为寻找新的HCC分子诊断指标提供参考。
1 材料与方法
1.1 材料
选择2015年8月—2017年1月于湖南师范大学附属第一医院肝胆外科行手术治疗的60例HCC患者作为观察组,所有患者均于术后病理确诊为HCC,包括女17例,男43例;年龄37~68岁,平均(55.7±14.6)岁。根据相关指南[8]进行肿瘤的TNM分期:其中39例患者为I~II期,21例为III~IV期。选择我院体检科46例正常人血清标本为正常对照组,包括女13例,男33例;年龄34~65岁,平均(53.4±13.1)岁。本研究所有患者均知情同意,并签署了知情同意书,获得医院伦理委员会的批准。
1.2 观察指标
收集患者完整病例资料,包括性别、年龄、HBV感染情况、合并肝硬化、肿瘤直径、肿瘤个数、淋巴结转移情况、TNM分期、病理分级、AFP水平、癌栓形成情况。其中病理分级根据术后病理切片肝癌细胞分化程度分为高、中、低级。癌栓形成的诊断为术前经B超、增强CT等影像学资料发现血管内癌栓形成,经术后病理确诊。淋巴结转移诊断经影像学检查发现肝门、腹膜后等部位淋巴结的存在,术后经病理确诊。
1.3 主要试剂
RNA提取试剂盒来自北京中杉金桥公司。miRNA逆转录试剂盒来自北京康为世纪生物公司。SYBR Green荧光定量PCR试剂盒来自美国的Invitrogen公司。let-7a及内参U6来自美国Proteintech公司。荧光定量PCR仪购自美国Thermo Forma公司。
1.4 实验方法
1.4.1血清样本的收集选择无RNA酶管收集参与研究对象4 mL血液标本,常温条件静置1~1.5 h直到标本全部凝固。接着予以在4000 r/min的转速下进行10 min的离心,予以吸取1.5 mL上清液置入无RNA酶离心管里面,在-80 ℃条件进行保存备后续使用,全部标本保存时间不超过2个月。
1.4.2逆转录根据逆转录试剂盒说明书开展操作。予以建立相应反应体系,其终体积为20 μL:dNTP mix(100 mmol/L)0.2 μL,Multiscribe 逆转 录 酶(50 U/μL)1.0 μL,10× 逆转录缓冲液2 μL,RNA 酶抑制剂(20 U/μL)1 μL,RNase-free水 9.8 μL,混合逆转引物 1 μL 引物,5 μL RNA。予以将上述反应体系轻轻混合均匀,进行较短暂的离心后予以至于冰块上。RT-PCR反应条件:16 ℃,30 min;42 ℃,30 min;85 ℃,5 min;4 ℃保存。
1.4.3qRT-PCR检测miRNAs let-7a的表达按照试剂盒说明书进行操作。予以建立相应反应体系,其终体积为20 μL:2×SYBR Green荧光定量预混液10 μL,引物1 μL,前述扩增好的cDNA(1:20稀释)2 μL,去核酸酶水 7.0 μL。通过RocheLightCyeler480实时荧光定量PCR系统进行检测。反应参数:95℃,10 min;95 ℃,15 s;60 ℃,45 s共40个循环。
1.5 统计学处理
选择SPSS 13.0处理数据,计量资料符合正态分布且方差齐性者采用均数±标准差(±s)表示,两组间比较选择t检验,多组间比较选择方差分析;计数资料选择χ2检验及Fisher确切概率法;采用受试者工作曲线(ROC)比较let-7a及联合AFP对HCC的诊断价值;按α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 HCC患者血清let-7a的表达
采用RT-qPCR检测let-7a的相对表达量,结果显示let-7a在观察组、对照组的相对表达量分别为:0.538±0.106、1.571±0.128,两组间表达水平差异有统计学意义(P<0.05)(图1)。
2.2 血清Let-7a的表达与HCC临床病理因素的关系
HCC患者血清let-7a相对表达量与癌栓形成有关(P<0.05);与性别、年龄、HBV感染、肝硬化、肿瘤直径、肿瘤个数、淋巴结转移、TNM分期、病理分级、AFP水平无关(P>0.05)(表1)。

图1 HCC患者及健康者血清let-7a水平比较Figure 1 Comparison of let-7a levels between HCC patients and healthy subjects
表1 HCC患者血清let-7a相对表达量与临床病理参数的关系(±s)Table 1 Relations of serum let-7a level with pathologic factors in HCC patients (±s)
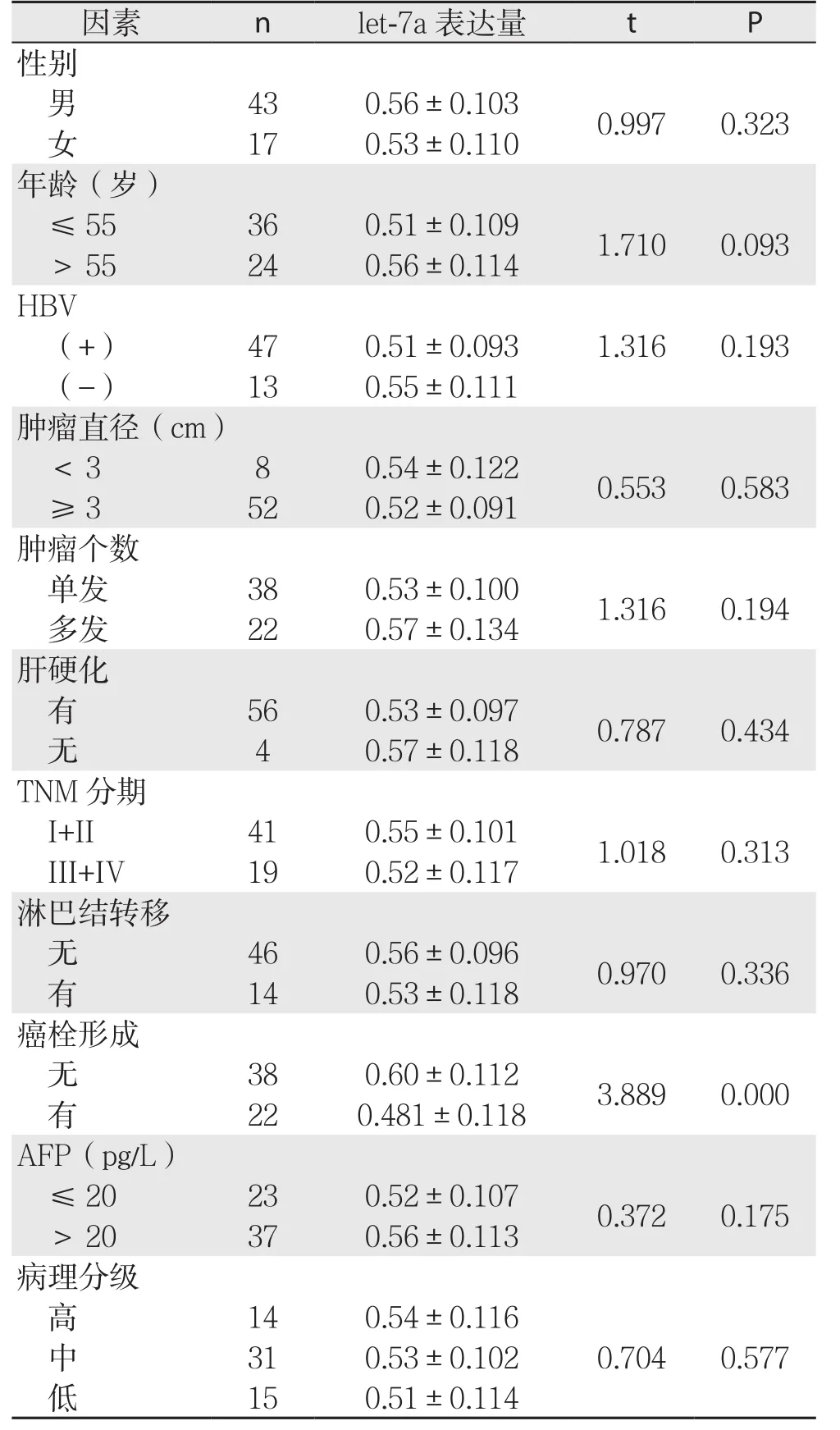
表1 HCC患者血清let-7a相对表达量与临床病理参数的关系(±s)Table 1 Relations of serum let-7a level with pathologic factors in HCC patients (±s)
因素 n l e t-7 a表达量 t P性别男43 0.56±0.103 0.997 0.323女17 0.53±0.110年龄(岁)≤55 36 0.51±0.109 1.710 0.093>55 24 0.56±0.114 H B V(+) 47 0.51±0.093 1.316 0.193(-) 13 0.55±0.111肿瘤直径(c m)<3 8 0.54±0.122 0.553 0.583≥3 52 0.52±0.091肿瘤个数单发 38 0.53±0.100 1.316 0.194多发 22 0.57±0.134肝硬化有56 0.53±0.097 0.787 0.434无4 0.57±0.118 T N M分期I+I I 41 0.55±0.101 1.018 0.313 I I I+I V 19 0.52±0.117淋巴结转移无46 0.56±0.096 0.970 0.336有14 0.53±0.118癌栓形成无38 0.60±0.112 3.889 0.000有22 0.481±0.118 A F P(p g/L)≤20 23 0.52±0.107 0.372 0.175>20 37 0.56±0.113病理分级高14 0.54±0.1160.704 0.577中31 0.53±0.102低15 0.51±0.114
2.3 let-7a及let-7a联合AFP对HCC的诊断效能
以0.529为let-7a的相对表达量的最佳临界值诊断HCC,其灵敏度为79%,特异度为71%,曲线下面积(AUC)为0.77(95% CI=0.624~0.839)。血清A F P诊断H C C灵敏度为75%,特异度为96%,AUC为0.84(95% CI=0.751~0.931);联合检测血清let-7a与AFP诊断HCC,灵敏度为83%,特异性为97%,AUC为0.92(95% CI=0.866~0.987)(图2)。

图2 血清let-7a及AFP诊断HCC的ROC曲线Figure 2 ROC curves of serum let-7a and AFP for diagnosis of HCC
3 讨 论
肿瘤的早期诊断与治疗是改善患者预后的关键。然而,目前临床上大部分肿瘤均缺少特异性与敏感性均很高的理想分子标志,探索肿瘤发生早期的可靠标志物是目前临床与科研中一大热点。外周血分子标志物的测定具有创伤极小,操作简便,可反复多次进行等优点,是较为理想的诊断手段[9]。
近年来肿瘤相关血清/血浆游离核酸作为分子标志物的研究日益受到学者们的重视。随着肿瘤不断的增长其组织常存在局部缺血,表面破溃等情况,进而导致肿瘤细胞的凋亡坏死等,破坏的细胞内所释放的核酸则会入血,进而引起血清核酸水平改变[10]。外周血标本的采集操作简单,创伤极小,易得到患者接受,而血清/血浆游离核酸的测定则可避免肿瘤组织取标本所带来的创伤或并发症。外周血游离核算包括游离DNA、RNA及miRNAs、lncRNAs等非编码RNA等。报道[11]显示,外周血miRNA水平存在肿瘤相关性及组织特异性。而相对于DNA、RNA这类核酸来说,miRNA更为稳定,在多次反复冻融、强碱、强酸、24 h的常温环境等条件下仍可保持稳定,有助于成为血液中的标志物,并有望成为一种更加灵敏、特异、高效、微创的分子标志物并进一步应用于肿瘤的早期诊断及患者预后的评估。
let-7为临床上较早研究的一种miRNA,其序列、表达模式、调控功能均具有高度保守性。目前发现人类成熟的let-7包含10个家族成员,由13个前体序列合成而来,包括:miR202、miR-98、let-7a-1、let-7a-2、let-7a-3、let-7b、let-7c、let-7d、let-7e、let-7f-1、let-7f-2、let-7g、let-7i;其中let-7a-1、let-7a-2、let-7a-3最终加工后生成let-7a。研究[12]显示,let-7与肿瘤的发生发展高度相关,并在其中发挥了抑癌基因的作用。多项研究[13-15]表明在肺癌、结肠癌、霍奇金淋巴瘤等多种恶性肿瘤中均存在let-7表达量的显著下降,说明let-7表达的缺失可能与肿瘤的发生发展密切相关。且有报道[16-17]显示,恢复let-7的正常表达可阻止肿瘤的发生。因而let-7被公认是一种抑癌基因,可经与靶mRNA3′非翻译区(3′UTR)相互结合,从而在影响靶mRNAs进一步的翻译,并影响靶基因的稳定性甚至引发降解过程。报道[18-19]发现,let-7可经与c-Myc、HMGA2、RAS等原癌基因的3′UTR相互结合,进而抑制靶基因的表达后,对肿瘤的发生及发展过程发挥重要作用。伴随研究的逐步深入,let-7在肿瘤发生发展中的作用及其机制报道越来越多,let-7将可能成为肿瘤诊断的新的分子标记物与治疗靶点。有报道[20]显示,HCC组织中存在明显的let-7a的下调,并与HMGA2的表达水平呈负相关;let-7a可通过靶向抑制HMGA2的表达从而抑制肝癌细胞的增殖与浸润。Wang等[21]研究发现,HCC患者肿瘤细胞中存在lin28的高表达,可通过抑制let-7a的下调进一步促进let-7a有关靶基因c-myc的上调,促进细胞的恶性转化与肿瘤侵袭转移。尽管关于let-7与肿瘤的关系研究已广泛开展,但关于let-7a在肝癌血清中的改变情况及与肿瘤临床病例特征的关系等尚未见报道。
本研究采用qRT-qPCR法测定HCC患者与入组健康者外周血let-7a水平发现,HCC患者血清存在明显的let-7a表达下调,较健康者血清水平差异有显著差别,可能为HCC的重要血清分子生物学指标,对无症状的一类早期HCC的诊断存在一定参考价值。进一步对let-7a血清水平与HCC临床病理特征进行统计学分析发现,血清let-7a水平与患者存在肿瘤的癌栓形成具有明显关联。癌栓是指肿瘤生长、浸润、迁移过程中,患者血管、淋巴遭遇癌细胞侵犯,或导致凝血异常、血流动力障碍、血栓形成等病理改变,进一步引起栓子发生,可出现于微循环、淋巴管及大小动静脉。本研究发现癌栓的发生于HCC患者外周血let-7a表达量明显下降,推测可能和let-7a的表达下降后其对肿瘤细胞的增殖侵袭能力的抑制作用减弱,进而导致恶变细胞侵袭、扩散能力增强,影响血液运行后导致了血流动力学障碍,甚至引起癌栓形成,表明血清let-7a水平对于HCC有一定的诊断价值。
报道[6,22]显示,HCC组织中let-7a的表达与肿瘤大小有关,体外实验则表明HCC中人为制造上调的let-7a水平可抑制癌细胞增殖、侵袭及转移等生物学行为。本研究中血清let-7a水平则与性别、年龄、HBV感染、肝硬化、肿瘤直径、肿瘤个数、淋巴结转移、TNM分期、淋巴结转移、病理分级、AFP水平无关,表明血清let-7a水平的改变情况对于肿瘤进展过程的评估存在一定的局限性,当然这可能与本研究样本量过少有关,同时目前关于HCC患者血清let-7a研究尚无报道,其水平变化具体机制也尚不清楚,这些均有待进一步大样本研究进行验证。AFP为目前临床上公认的HCC相关肿瘤标志物,应用非常广泛[23]。本研究中血清AFP对肝细胞肝癌患者的诊断灵敏度为75%,特异度为96%,AUC为0.84,与相关报道[24]结果类似;而联合测定血清let-7a与AFP对HCC的诊断效率,灵敏度为83%,特异性为97%,AUC为0.92,均优于单独检测AFP的诊断价值。提示联合检测血清let-7a与AFP比两个指标单独检测对HCC具有更高的诊断效率,亦提升了AFP作为单一指标检测的诊断效能。
综上,HCC患者血清let-7a水平出现下调,可能成为诊断HCC的新的分子标志物。同时,PCR法技术成熟,操作简便,扩增效率高,具有一定的临床价值。
[1] Abe T, Tashiro H, Kobayashi T, et al. Glasgow Prognostic Score and Prognosis After Hepatectomy for Hepatocellular Carcinoma[J].World J Surg, 2017, 41(7):1860–1870. doi: 10.1007/s00268–017–3909–7.
[2] Taketomi A, Shimada M, Shirabe K, et al. Natural killer cell activity in patients with hepatocellular carcinoma: a new prognostic indicator after hepatectomy[J]. Cancer, 1998, 83(1):58–63.
[3] Yang X, Cai H, Liang Y, et al. Inhibition of c-Myc by let-7b mimic reverses mutidrug resistance in gastric cancer cells[J]. Oncol Rep,2015, 33(4):1723–1730. doi: 10.3892/or.2015.3757.
[4] Liu Q, Liu T, Zheng S, et al. HMGA2 is down-regulated by microRNA let-7 and associated with epithelial-mesenchymal transition in oesophageal squamous cell carcinomas of Kazakhs[J].Histopathology, 2014, 65(3):408–417. doi: 10.1111/his.12401.
[5] Xu C, Sun X, Qin S, et al. Let-7a regulates mammosphere formation capacity through Ras/NF‐κB and Ras/MAPK/ERK pathway in breast cancer stem cells[J]. Cell Cycle, 2015, 14(11):1686–1697.doi: 10.1080/15384101.2015.1030547.
[6] Deng M, Hou J, Hu J, et al. Hepatitis B virus mRNAs functionally sequester let-7a and enhance hepatocellular carcinoma[J]. Cancer Lett, 2016, 383(1):62–72. doi: 10.1016/j.canlet.2016.09.028.
[7] Ge Q, Shen Y, Tian F, et al. Profiling circulating microRNAs in maternal serum and plasma[J]. Mol Med Rep, 2015, 12(3):3323–3330. doi: 10.3892/mmr.2015.3879.
[8] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志, 2011, 16(10):929–946. doi:10.3969/j.issn.1009–0460.2011.10.017.Ministry of Health of the People's Republic of China. Standards of diagnosis and treatment of primary liver cancer (2011edition)[J].Chinese Clinical Oncology, 2011, 16(10):929–946. doi:10.3969/j.issn.1009–0460.2011.10.017.
[9] Binder M, O'Byrne MM, Maurer MJ, et al. Associations between elevated pre-treatment serum cytokines and peripheral blood cellular markers of immunosuppression in patients with lymphoma[J]. Am J Hematol, 92(8):752–758. doi: 10.1002/ajh.24758.
[10] Shi H, He X, Cui W, et al. Locked nucleic acid/DNA chimeric aptamer probe for tumor diagnosis with improved serum stability and extended imaging window in vivo[J]. Anal Chim Acta, 2014,812:138–144. doi: 10.1016/j.aca.2013.12.023.
[11] Fukagawa S, Miyata K, Yotsumoto F, et al. MicroRNA-135a-3p as a promising biomarker and nucleic acid therapeutic agent for ovarian cancer[J]. Cancer Sci, 2017, 108(5):886–896. doi: 10.1111/cas.13210.
[12] Sun X, Qin S, Fan C, et al. Let-7: a regulator of the ERα signaling pathway in human breast tumors and breast cancer stem cells[J].Oncol Rep, 2013, 29(5):2079–2087. doi: 10.3892/or.2013.2330.
[13] Busch B, Bley N, Müller S, et al. The oncogenic triangle of HMGA2, LIN28B and IGF2BP1 antagonizes tumor-suppressive actions of the let-7 family[J]. Nucleic Acids Res, 2016, 44(8):3845–3864. doi: 10.1093/nar/gkw099.
[14] Lee JY, Kim HJ, Yoon NA, et al. Tumor suppressor p53 plays a key role in induction of both tristetraprolin and let-7 in human cancer cells[J]. Nucleic Acids Res, 2013, 41(11):5614–5625. doi: 10.1093/nar/gkt222.
[15] 曹辉, 胡新华, 张强, 等. let-7a对血管平滑肌细胞迁移、增殖功能调控作用的体外研究[J]. 中国普通外科杂志, 2012, 21(12):1525–1530.Cao H, Hu XH, Zhang Q, et al. Regulatory effect of let-7a on migration and proliferation of vascular smooth muscle cells:an in vitro study[J]. Chinese Journal of General Surgery, 2012,21(12):1525–1530.
[16] Albino D, Civenni G, Dallavalle C, et al. Activation of the Lin28/let-7 Axis by Loss of ESE3/EHF Promotes a Tumorigenic and Stem-like Phenotype in Prostate Cancer[J]. Cancer Res, 2016,76(12):3629–3643. doi: 10.1158/0008–5472.CAN–15–2665.
[17] Powers JT, Tsanov KM, Pearson DS, et al. Multiple mechanisms disrupt the let-7 microRNA family in neuroblastoma[J]. Nature,2016, 535(7611):246–251. doi: 10.1038/nature18632.
[18] Yi R, Fuchs E. A miR image of stem cells and their lineages[J].Curr Top in Dev Biol, 2012, 99:175–99. doi: 10.1016/B978–0–12–387038–4.00007–0.
[19] 吴凯, 吴爱国, 马雷, 等. Let-7a对人乳腺癌细胞生长的抑制作用及机制[J]. 中国普通外科杂志, 2010, 19(5):506–510.Wu K, Wu AG, Ma L, et al. The inhibitory eあect and mechanesm of Let-7 a on human breast cancer cell in vitro[J]. Chinese Journal of General Surgery, 2010, 19(5):506–510.
[20] Liu YM, Xia Y, Dai W, et al. Cholesterol-conjugated let-7a mimics:antitumor efficacy on hepatocellular carcinoma in vitro and in a preclinical orthotopic xenograft model of systemic therapy[J]. BMC Cancer, 2014, 14:889. doi: 10.1186/1471–2407–14–889.
[21] Wang YC, Chen YL, Yuan RH, et al. Lin-28B expression promotes transformation and invasion in human hepatocellular carcinoma[J].Carcinogenesis, 2010, 31(9):1516–1522. doi: 10.1093/carcin/bgq107.
[22] 刘明洋, 陈杰, 关健. 局部注射胆固醇包裹let-7a miRNA模拟物下调人3种Ras表达抑制裸鼠皮下肝癌移植瘤的生长和转移[J]. 协和医学杂志, 2015, 6(2):133–139. doi:10.3969/j.issn.1674–9081.2015.02.012.Liu MY, Chen J, Guan J. Local Injections of Cholesterolconjugated let-7a Mimics Inhibit Tumor Growth and Metastasis of Hepatocellular Carcinoma in a Subcutaneous Xenograft Nude Mouse Model by Targeting K-Ras, H-Ras, and N-Ras[J]. Medical Journal of Peking Union Medical College Hospital, 2015, 6(2):133–139. doi:10.3969/j.issn.1674–9081.2015.02.012.
[23] 张力, 米成嵘. 腹部超声、CT及血清甲胎蛋白诊断原发性肝癌的临床疗效比较[J]. 世界华人消化杂志, 2015, 23(1):139–141.Zhang L, Mi CR. Comparative analysis of ultrasound, computed tomography and alpha fetoprotein in diagnosis of primary liver cancer[J]. World Chinese J Digestology, 2015, 23(1):139–141.
[24] 杨颖, 木尼热·马合苏提, 包永江, 等. GP73和AFP单项与联合诊断原发性肝癌的价值[J].中华检验医学杂志, 2012, (11):1034–1037. doi:10.3760/cma.j.issn.1009–9158.2012.11.014.Yang Y, Munire·Mahesuti, Bao YJ, et al. Diagnostic value of Golgi-73 and AFP alone or combination in primary hepatocelluar carcinoma[J]. Chinese Journal of Laboratory Medicine, 2012,(11):1034–1037. doi:10.3760/cma.j.issn.1009–9158.2012.11.014.
