中考化学物质的分离与提纯解题策略
2017-04-01张立锋�オ�
张立锋+�オ�

物质的分离是指将混合物中的各物质通过某种方式分离后各自得到纯净物的过程;而物质的提纯是通过适当的方法把混入某物质里的少量杂质除去,以便获得相对纯净的物质,又称除杂。
一、物质除杂的原则
1.注意事项几个“不”
(1)不能“玉石俱焚”。即所选试剂只与杂质反应,一般不与被提纯的物质反应。但在特殊情况下所选试剂需要和被提纯的物质反应,但最终要转化成被提纯的物质。如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增”“不减”。即不增加新的杂质,不减少被提纯的物质。
(3)不污染环境。即要求所选用的除杂方法,不能产生污染环境的物质。
(4)不能“旧貌换新颜”。即除杂结束前,要恢复被提纯物质的原有状态。
2.除杂方法的几个优化原则
(1)若同时有多种方法能除去杂质,要选择那些简便易行、除杂彻底的方法。
(2)应尽量选择既可除去杂质,又可增加被提纯物质的方法,即“一举两得”。
(3)先考虑物理方法,再考虑化学方法。
二、物质除杂的主要方法
1.物理方法:常见的有溶解法、过滤法、蒸发溶剂法、冷却热饱和溶液法等。
2.化学方法:常见的有沉淀法、气化法、置换法、加热法、转化法等。
三、酸、碱、盐溶液的除杂技巧
1.被提纯物质与杂质所含阳离子相同时,选取与杂质中阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如Na2SO4(NaOH):可选用稀H2SO4为除杂试剂(生成物为
Na2SO4和H2O,达到除杂目的);KCl(K2SO4):可选用BaCl2溶液为除杂试剂(生成物为BaSO4沉淀和KCl,达到除杂目的)。
2.被提纯物质与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂。如NaCl(BaCl2):可选用Na2SO4溶液为除杂试剂(生成物为BaSO4沉淀和NaCl,达到除杂目的);KNO3
(AgNO3):可选用KCl溶液为除杂试剂(生成物为AgCl沉淀和KNO3,达到除杂目的)。
3.被提純物质与杂质所含阴、阳离子都不相同时,选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如NaNO3(CuSO4):可选用Ba(OH)2溶液为除杂试剂\[生成物为Cu(OH)2沉淀和BaSO4沉淀,达到除杂目的)。
四、中考真题解读
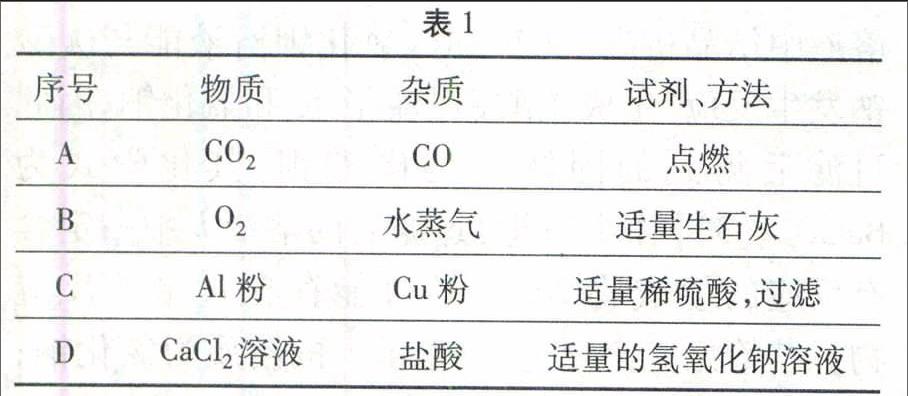
例1除去表1所列各物质中混有的少量杂质,所用试剂或方法正确的是()。
适量的氢氧化钠溶液
解析二氧化碳中混有少量的一氧化碳,虽然一氧化碳能够燃烧,但二氧化碳不支持燃烧,在二氧化碳大量存在的条件下,利用点燃的方法不能使一氧化碳燃烧而被除去,A错误;氧气不与生石灰反应,生石灰能够吸收水蒸气而将混在氧气中的水蒸气除去,B正确;铝粉能与稀硫酸反应,铜不与稀硫酸反应,加入适量的稀硫酸并过滤,除去了主要物质,不能除去杂质,C错误;氯化钙不能与氢氧化钠溶液反应,盐酸能与氢氧化钠溶液反应生成氯化钠和水,用适量的氢氧化钠溶液能够除去氯化钙中混有的少量盐酸,但又引入了氯化钠这种新杂质,D错误。
答案:B。
例2将KCl、MgCl2和BaSO4的固体混合物逐一分离开来,加入的试剂及顺序正确的是
()。
A.水、AgNO3溶液、稀硝酸
B.水、NaOH溶液、稀盐酸
C.水、KOH溶液、稀盐酸
D.水、KOH溶液、稀硫酸
解析BaSO4难溶于水,KCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出BaSO4;然后滴加适量的KOH溶液,MgCl2能与KOH溶液反应生成Mg(OH)2白色沉淀和KCl,再进行过滤,分离出KCl溶液和Ba(OH)2沉淀;最后向Mg(OH)2沉淀中滴加稀盐酸,Mg(OH)2能与稀盐酸反应生成MgCl2和水,故选C。
答案:C。
例3除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加入过量的NaOH溶液,②加入过量的BaCl2溶液,③过滤,④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为(数字序号不能重复使用)。
(2)请写出BaCl2溶液与Na2CO3溶液反应的化学方程式。
(3)上述试剂中的Na2CO3不能用K2CO3代替,请说明原因。
解析(1)加入过量的NaOH溶液可以除去MgCl2;加入过量的BaCl2溶液可以除去Na2SO4;除去MgCl2和Na2SO4不分先后顺序,加入Na2CO3溶液可把CaCl2和过量的BaCl2转化为沉淀,因此Na2CO3溶液要放在BaCl2溶液之后加入;离子沉淀后,再进行过滤;最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为①②⑤③④或②①⑤③④或②⑤①③④。(2)氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠。(3)如果将碳酸钠改为碳酸钾,碳酸钾能和氯化钙、氯化钡反应生成新的杂质氯化钾,违反了除杂原则。
答案(1)①②⑤③④(或②①⑤③④或②⑤①③④)(2)BaCl2+Na2CO3BaCO3↓+2NaCl(3)K2CO3与其他物质反应生成KCl,会引入新的杂质
例4根据不同物质的性质,提纯物质的方法可以有多种。下面呈现的是化学课堂上“物质提纯”的小组竞赛场景。
(1)甲组抽到的题目是“从30 g NaCl和2 g KNO3的混合物中提纯NaCl”(如图1所示)。同学们经研究认为依据两物质的溶解度曲线(图2),可采用如图1物理方法来提纯。
图1图2
上述两固体(填“能”或“不能”)全部溶解,操作m的名称是,蒸发结晶后得到NaCl的质量30 g(填“大于”、“小于”或“等于”)。
甲组一位同学问道:“能否用降温结晶的方法从上述溶液a中析出KNO3,从而达到分离的目的?”请你判断此方法是否可行,并说出理由。
(2)乙组抽到的题目是“从NaCl和Na2CO3的混合物中提纯NaCl”。同学们经过讨论认为利用两物质化学性质的差异,可采用如图3化学方法来提纯。
图3
图3中X的化学式为。由于BaCl2溶液的用量不易控制,会使溶液b的溶质有多种情况,导致蒸发后得到的固体可能不纯。
(3)同学们对乙组方案中溶液b的溶质成分进行探究。
作出猜想猜想一:NaCl、BaCl2
猜想二:NaCl猜想三:。
設计方案经讨论,大家认为只用一种试剂就能作出判断。
表2
实验步骤实验现象实验结论
取少量溶液b于试管中,向其中加入
若看到猜想一正确
若无明显现象猜想二正确
若看到冒出气泡
猜想三正确
各组依据表2设计方案进行了实验,验证了反应后溶质的确有三种情况。
(4)同学们对甲乙两组提纯方法的效果进行了研讨。
反思评价大家认为用物理方法和化学方法都可以实现物质的提纯。用化学方法提纯还要考虑到反应物用量对提纯效果的影响。
拓展提升老师说:“合理选择试剂,用化学方法可以从NaCl和Na2CO3的混合物中提纯NaCl,方法是向混合物中加入过量的,充分反应后,经蒸发结晶就能得到NaCl”。
解析(1)根据两种物质的溶解度曲线可知,20℃时,氯化钠的溶解度为36 g,硝酸钾的溶解度大于13.3 g,因此30 g氯化钠和2 g硝酸钾在100 g水中能全部溶解;根据图示,操作m后可以得到氯化钠固体和溶液,因此该操作为过滤;由于剩余的溶液仍为氯化钠的饱和溶液,溶液中仍有一部分氯化钠,因此蒸发结晶后得到的氯化钠晶体的质量小于30 g;根据溶解度曲线可知,温度降到0℃时,硝酸钾溶液仍达不到饱和,更不能从溶液中结晶析出。(2)加入氯化钡溶液能与碳酸钠发生反应,生成碳酸钡白色沉淀和氯化钠,因此过滤后得到的固体X为碳酸钡,其化学式为
BaCO3。(3)【作出猜想】过滤后的溶液b中一定含有反应的生成物NaCl,还可能存在过量的反应物。若恰好完全反应,则溶液b的溶质为氯化钠;若氯化钡过量,则溶液b的溶质为氯化钠和氯化钡;若碳酸钠过量,则溶液b的溶质为氯化钠和碳酸钠;【设计方案】根据氯化钡和碳酸钠的性质,试剂可以选用稀硫酸,加入稀硫酸后若有白色沉淀生成,说明氯化钡过量,即猜想一正确;加入稀硫酸后若有气泡产生,则证明碳酸钠过量,即猜想三正确;加入稀硫酸后若无明显现象,证明恰好完全反应,即猜想二正确。(4)根据氯化钠和碳酸钠的性质,可以选择稀盐酸,稀盐酸只与碳酸钠反应,且生成物为氯化钠,不会引入新的杂质,同时过量的稀盐酸在蒸发结晶时,氯化氢气体会蒸发出来,从而得到纯净的氯化钠。
答案:(1)能过滤小于不可行,根据溶解度曲线判断,降温过程中无法得到硝酸钾的饱和溶液(2)BaCO3(3)【作出猜想】NaCl、
Na2CO3【设计方案】稀硫酸白色沉淀(4)稀盐酸
(收稿日期:2016-10-15)
