急性脑梗死重组组织型纤溶酶原激活物静脉溶栓后严重出血性转化研究进展
2017-03-31王勤鹰
王勤鹰,詹 青
上海中医药大学附属第七人民医院神经内科,上海 200137
急性脑梗死重组组织型纤溶酶原激活物静脉溶栓后严重出血性转化研究进展
王勤鹰,詹 青
上海中医药大学附属第七人民医院神经内科,上海 200137
严重出血性转化是静脉溶栓治疗最危险的并发症。本文对近年来有关静脉溶栓后严重出血性转化的定义、临床表现、影像学特征以及相关危险因素的研究进展进行综述。对具有严重出血性转化高风险的急性脑梗死患者可以选择低剂量重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rtPA)静脉溶栓治疗,以降低症状性颅内出血的发生风险。
卒中;脑梗死;急性缺血性卒中;溶栓治疗;症状性颅内出血;出血性转化
To cite: WANG QY, ZHAN Q. Advances in severe hemorrhagic transformation after intravenous thrombolysis with recombinant tissue plasminogen activator for acute brain infarction. J Neurol and Neurorehabil, 2017, 13(1):25-31.
在急性脑梗死患者治疗时间窗内给予重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rtPA)静脉溶栓治疗,能够改善患者的远期预后,但同时也增加了出血性转化(hemorrhagic transformation,HT)的发生风险。严重HT是静脉溶栓治疗最严重且最危险的并发症。本文对rtPA静脉溶栓后严重HT的定义、发生率及其相关危险因素的研究进展进行综述。
1 急性脑梗死合并严重HT的定义
急性脑梗死溶栓治疗增加HT风险一直是临床关注的重点。研究发现,rtPA静脉溶栓并不增加无症状性HT,而是显著增加严重HT。ECASSⅠ试验[1]按照头颅计算机体层摄影术(computerized tomography,CT)影像学表现,将HT分为出血性脑梗死(hemorrhagic infarction,HI)和脑实质出血(parenchymal hemorrhage,PH)。在HI中,HI1的定义为治疗后复查头颅CT显示梗死灶边缘微出血且不伴有占位效应,HI2则定义为治疗后复查头颅CT显示出血范围不超出梗死灶且不伴有占位效应。各项临床试验对严重HT的命名及定义见表1。随着对脑梗死后HT研究的增多,已发现严重HT均伴有临床症状的恶化,目前多称为症状性颅内出血(symptomatic intracranial hemorrhage,SICH)。SICH的定义包括确凿的颅内出血证据以及与出血相关的临床症状的恶化,包括意识水平下降、偏瘫加重、美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分较基线值增加甚至死亡。并且,SICH的发生与时间相关。NINDS[2]试验发现接受rtPA静脉溶栓治疗患者的SICH多发生于治疗后36 h内。ECASSⅢ[3]试验发现SICH发生于rtPA静脉溶栓治疗后22~36 h。部分研究在定义SICH时,已对时间范围作出界定。目前,大多数研究将严重HT称为SICH,也有研究称为PH。

表1 各项临床试验对严重出血性转化的命名及定义
2 6项多中心随机对照试验(randomized controlled trial,RCT)[1-5,7]SICH发生率的比较(表2)
6项有关急性脑梗死rtPA静脉溶栓治疗的多中心RCT结果均显示,rtPA静脉溶栓治疗组90 d达到良好预后的比例显著高于安慰剂组。NINDS[2]、ECASSⅠ[1]、ECASSⅡ[4]和ECASSⅢ[3]试验中,
rtPA静脉溶栓治疗组HT发生率高于安慰剂组。6项多中心RCT中,rtPA静脉溶栓治疗组SICH发生率均显著高于安慰剂组。ECASSⅠ[1]试验采用1.1 mg/kg(最高剂量为100 mg)rtPA剂量进行静脉溶栓治疗,其严重HT发生率明显高于其他试验组。目前,0.9 mg/kg(最高剂量为90 mg)是急性脑梗死rtPA静脉溶栓治疗的标准剂量。6项多中心RCT的90 d内死亡率存在差异,其中ECASSⅡ[4]、ATLANTIS[5]和ECASSⅢ[3]试验中rtPA静脉溶栓治疗组的90 d内死亡率较低,ECASSⅠ[1]试验中rtPA静脉溶栓治疗组(rtPA静脉溶栓治疗剂量较高)的90 d内死亡率较高(rtPA静脉溶栓治疗时间窗为0~6 h)。IST-3[7]试验未描述90 d内死亡率;但18个月时rtPA静脉溶栓治疗组的死亡率(35.1%)与安慰剂组(34.9%)相似[8]。
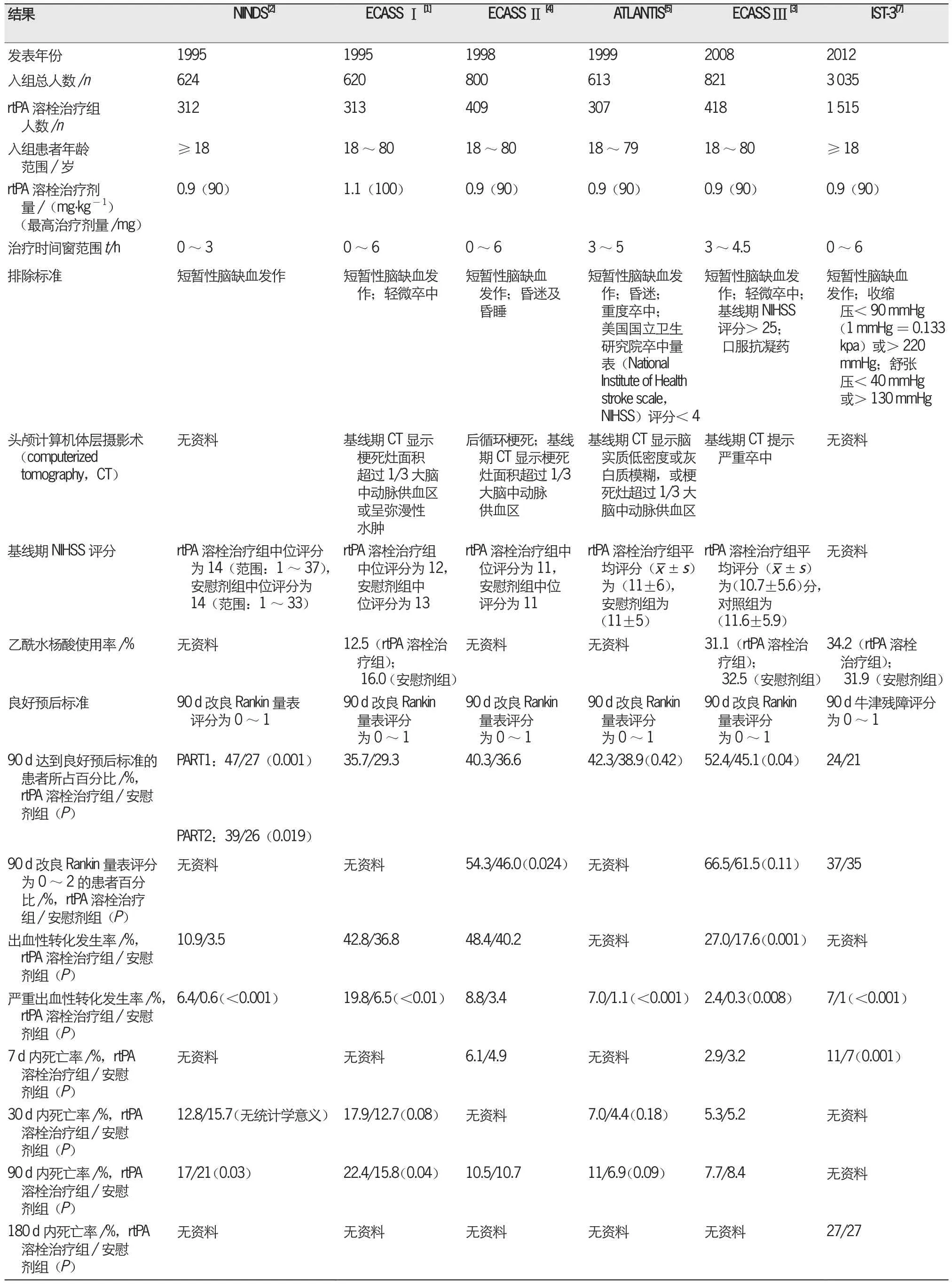
表2 6项有关急性脑梗死重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rtPA)静脉溶栓的多中心随机对照试验(randomized controlled trial,RCT)的结果
3 rtPA静脉溶栓治疗后发生SICH的相关因素分析
急性脑梗死rtPA静脉溶栓治疗可以提高达到90 d良好预后的概率,但同时也会增加严重HT的发生风险[9-10]。基线期CT显示多灶性梗死(面积超过大脑半球的1/3)已被证实会增加静脉溶栓治疗后的SICH发生风险,已被《中国急性缺血性脑卒中诊治指南2014》[11]列为禁忌证。基线期NIHSS评分反映了卒中的严重程度,严重卒中会增加缺血后HT的发生风险,这也是许多静脉溶栓试验将基线期NIHSS评分≥25的患者排除在外的原因。此外,《中国急性缺血性脑卒中诊治指南2014》也将NIHSS评分>25的患者列为3~4.5 h治疗时间窗静脉溶栓相对禁忌证。该指南同时明确指出,静脉溶栓前收缩压必须控制在180 mmHg以下,舒张压控制在110 mmHg以下。目前对静脉溶栓后的血压管理与SICH之间的关系正处于研究阶段[12]。其他因素,如rtPA剂量、年龄、从起病至rtPA溶栓治疗的时间间隔(onset to start of treatment,OTT)、卒中前使用乙酰水杨酸、部分凝血及纤溶相关实验室检查结果、医疗机构治疗经验等与严重HT之间的关系,也正在研究之中。
3.1 低剂量与标准剂量rtPA静脉溶栓治疗后SICH发生率的比较
基于中国和日本急性心肌梗死患者rtPA静脉溶栓治疗剂量低于欧美患者的情况[13-14],有研究对东亚急性脑梗死患者使用低剂量rtPA静脉溶栓治疗进行了探讨。J-ACT[15]试验的研究对象为日本患者。TTT-AIS[16]试验的研究对象为中国台湾患者。ENCHANTED[17]试验属于国际多中心临床RCT,入组患者中63%为亚裔,约43%的研究中心位于中国;研究结果显示,使用低剂量rtPA的患者获益更多,SICH发生率和90 d内死亡率明显下降,但90 d时达到良好预后的患者比例无明显增加。TTT-AIS[16]研究显示,rtPA溶栓治疗剂量超过0.85 mg/kg时,出血风险显著增加。3项急性脑梗死低剂量rtPA静脉溶栓试验的结果见表3。
3.2 治疗时间窗与HT和SICH发生风险的关系
在使用相同治疗剂量的前提下,相较于治疗时间窗为0~3 h的NINDS[2]试验,治疗时间窗为0~6 h的ECASSⅡ[4]试验的HT和SICH发生率均升高,IST-3[7]试验中的SICH发生率也有所增加。ATLANTIS[5]试验结果显示,3~5 h治疗时间窗静脉溶栓治疗不能改善90 d时的预后。对NINDS[2]、ECASSⅡ[4]和ATLANTIS[5]试验共2 037例急性脑梗死患者进行汇总分析,随着OTT的延长,出血发生率逐渐增加;其中,90 min内治疗的HT发生率为0%,而3~6 h治疗的HT发生率为6.9%[10]。
3.3 年龄与严重HT、SICH和PH发生风险的关系
年龄与rtPA静脉溶栓治疗后严重HT的关系,目前仍存有争议。CASES[18]试验中,研究对象的平均年龄为73岁,未见出血明显增多。在一项纳入191例患者的研究中,31例患者的年龄>80岁;研究结果显示,年龄>80岁不增加SICH发生风险,但增加死亡风险。TTT-AIS[16]试验的结果提示,年龄超过70岁会增加出血风险。对NINDS[2]、ENCHANTED[17]和ATLANTIS[5]试验共2 775例急性脑梗死患者进行汇总分析,给予6 h治疗时间窗rtPA静脉溶栓治疗;多因素分析结果显示,PH与年龄相关联(P=0.000 2)[10]。ECASSⅡ[4]试验显示,rtPA静脉溶栓治疗后的PH发生风险与年龄增长有关;<50岁、51~60岁、61~70岁和71~80岁患者的PH发生率分别为0.0%、7.1%、11.1%和19.7%。
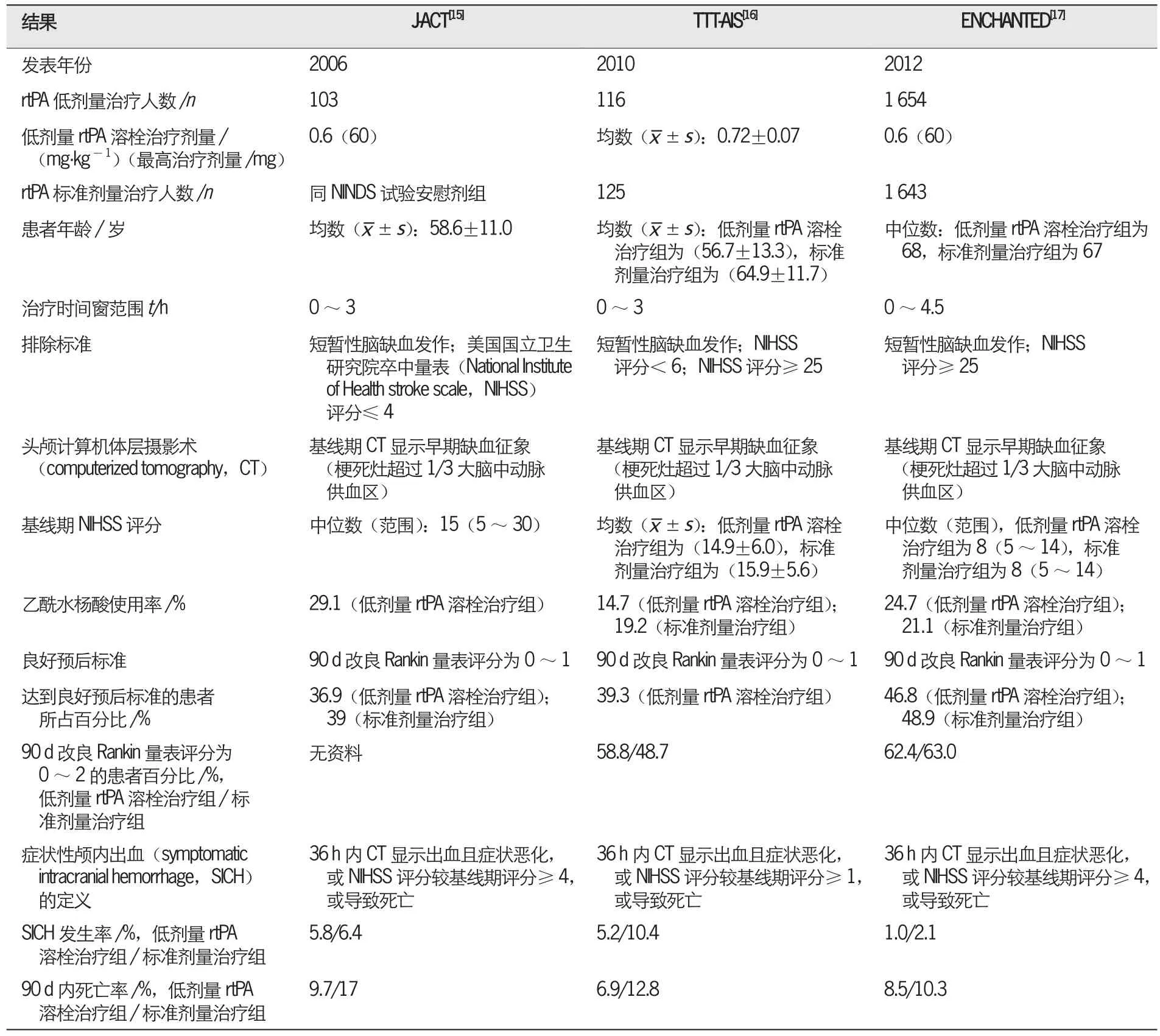
表3 3项急性脑梗死低剂量重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rtPA)静脉溶栓试验的结果
3.4 与HT、PH和SICH发生风险相关的其他因素
有研究对急性脑梗死患者有无乙酰水杨酸使用史与rtPA静脉溶栓治疗后发生严重HT的关系进行了分析。ECASSⅡ[4]试验结果显示,在以往未使用过乙酰水杨酸的患者中,使用乙酰水杨酸可不增加安慰剂组患者的PH发生风险,但却显著增加rtPA静脉溶栓治疗后PH的发生风险(乙酰水杨酸组为24.1%,非乙酰水杨酸组为8.8%)和SICH的发生风险(乙酰水杨酸组为18.9%,非乙酰水杨酸组为6.2%)[9]。TTT-AIS[16]试验结果则显示,乙酰水杨酸与rtPA静脉溶栓治疗后发生SICH无相关性。在一项有关rtPA静脉溶栓治疗急性卒中的多中心调查研究中,单因素分析显示乙酰水杨酸治疗与rtPA静脉溶栓治疗后SICH的发生风险增加有关联,但多因素分析却未显示出相关性[19]。
有研究对凝血及纤溶相关实验室检查结果与rtPA静脉溶栓治疗后严重HT发生风险之间的关系进行了评估。一项研究纳入76例大脑中动脉闭塞的急性脑梗死患者,于3 h内给予trPA静脉溶栓治疗,其中6例患者发生SICH,这些患者的基线期纤溶酶原激活物抑制物1水平较低,而凝血酶激活纤维蛋白溶解抑制物水平均较高(P=0.03)[20]。另一项研究检测了患者基线期及rtPA静脉溶栓治疗后24 h的基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)水平,结果发现MMP-9与SICH相关联(P=0.036)[21]。
SITS-MOST[6]试验共有285家医疗机构参与,其中50%的医疗机构缺乏静脉溶栓经验。与其他试验的结果相比,SITS-MOST[6]试验中的SICH发生率、90 d改良Rankin量表评分为0~2的患者所占比例以及90 d内死亡率均无明显差异。由此提示,医疗机构是否具备静脉溶栓经验与获得良好预后及发生严重HT之间无明显相关性。
4 总 结
综上所述,rtPA静脉溶栓治疗能够增加急性脑梗死患者90 d时达到良好预后标准的概率,同时会增加严重HT的发生风险。如何在确保患者获益的基础上,降低严重HT发生率,一直是临床医师努力的方向。对于临床上预判存在严重HT高风险的患者,可以选择性给予低剂量rtPA静脉溶栓治疗,如能结合凝血及纤溶相关实验室检查以及多种影像学检查,则可以提供更多的预判信息。
[1] Hacke W, Kaste M, Fieschi C, et al. lntravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke. The European Cooperative Acute Stroke Study (ECASS)[J]. JAMA, 1995, 274(13):1017-1025.
[2] Tissue plasminogen activator for acute ischemic stroke. The National lnstitute of Neurological Disorders and Stroke rt-PA Stroke Study Group[J]. N Engl J Med, 1995, 333(24):1581-1587.
[3] Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J]. N Engl J Med, 2008, 359(13):1317-1329.
[4] Hacke W, Kaste M, Fieschi C, et al. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASSll). Second European-Australasian Acute Stroke Study lnvestigators[J]. Lancet, 1998, 352(9136):1245-1251.
[5] Clark WM, Wissman S, Albers GW, et al. Recombinant tissue-type plasminogen activator (Alteplase) for ischemic stroke 3 to 5 hours after symptom onset. The ATLANTlS Study: a randomized controlled trial. Alteplase Thrombolysis for Acute Noninterventional Therapy in lschemic Stroke[J]. JAMA, 1999, 282(21):2019-2026.
[6] Wahlgren N, Ahmed N, Dávalos A, et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe lmplementation of Thrombolysis in Stroke-Monitoring Study (SlTS-MOST): an observational study[J]. Lancet, 2007, 369(9558):275-282.
[7] lST-3 collaborative group, Sandercock P, Wardlaw JM, et al. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke (the third international stroke trial [lST-3]): a randomised controlled trial[J]. Lancet, 2012, 379(9834):2352-2363.
[8] lST-3 collaborative group. Effect of thrombolysis with alteplase within 6 h of acute ischaemic stroke on long-term outcomes (the third lnternational Stroke Trial [lST-3]): 18-month follow-up of a randomised controlled trial[J]. Lancet Neurol, 2013, 12(8):768-776.
[9] Larrue V, von Kummer RR, Müller A, et al. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator: a secondary analysis of the European-Australasian Acute Stroke Study (ECASSll)[J]. Stroke, 2001, 32(2):438-441.
[10] Hacke W, Donnan G, Fieschi C, et al. Association of outcome with early stroketreatment: pooled analysis of ATLANTlS, ECASS, and NlNDS rt-PA stroke trials[J]. Lancet, 2004, 363(9411):768-774.
[11] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4):246-257.
[12] Kellert L, Sykora M, Gumbinger C, et al. Blood pressure variability after intravenous thrombolysis in acute stroke does not predict intracerebral hemorrhage but poor outcome[J]. Cerebrovasc Dis, 2012, 33(2):135-140.
[13] Ueshima S, Matsuo O. The differences in thrombolytic effects of administrated recombinant t-PA between Japanese and Caucasians[J]. Thromb Haemost, 2002, 87(3):544-546.
[14] Ross AM, Gao R, Coyne KS, et al. A randomized trial confirming the efficacy of reduced dose recombinant plasminogen activator in a Chinese myocardial infarction population and demonstrating superiority to usual dose urokinase: The TUCC trial[J]. Am Heart J, 2001, 142(2):244-247.
[15] Yamaguchi T, Mori E, Minematsu K, et al. Alteplase at 0.6 mg/kg for acute ischemic stroke within 3 hours of onset: Japan Alteplase Clinical Trial (J-ACT)[J]. Stroke, 2006, 37(7):1810-1815.
[16] Chao AC, Hsu HY, Chung CP, et al. Outcomes of thrombolytic therapy for acute ischemic stroke in Chinese patients: the Taiwan Thrombolytic Therapy for Acute lschemic Stroke (TTT-AlS) study[J]. Stroke, 2010, 41(5):885-890.
[17] Cronin CA, Shah N, Morovati T, et al. No increased risk of symptomatic intracerebral hemorrhage after thrombolysis in patients with European Cooperative Acute Stroke Study (ECASS) exclusion criteria[J]. Stroke, 2012, 43(6):1684-1686.
[18] Hill MD, Buchan AM; Canadian Alteplase for Stroke Effectiveness Study (CASES) lnvestigators. Thrombolysis for acute ischemic stroke: results of the Canadian Alteplase for Stroke Effectiveness Study[J]. CMAJ, 2005, 172(10):1307-1312.
[19] Tanne D, Kasner SE, Demchuk AM, et al. Markers of increased risk of intracerebral hemorrhage after intravenous recombinant tissue plasminogen activator therapy for acute ischemic stroke in clinical practice: the Multicenter rt-PA Stroke Survey[J]. Circulation, 2002, 105(14):1679-1685.
[20] Ribo M, Montaner J, Molina CA, et al. Admission fibrinolytic profile is associated with symptomatic hemorrhagic transformation in stroke patients treated with tissue plasminogen activator[J]. Stroke, 2004, 35(9):2123-2127.
[21] lnzitari D, Giusti B, Nencini P, et al. MMP9 variation after thrombolysis is associated with hemorrhagic transformation of lesion and death[J]. Stroke, 2013, 44(10):2901-2903.
Advances in severe hemorrhagic transformation after intravenous thrombolysis with recombinant tissue plasminogen activator for acute brain infarction
WANG Qinying, ZHAN Qing
Department of Neurology, Seventh People’s Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200137, China
Severe hemorrhagic transformation is a most dangerous complication during thrombolytic therapy for acute ischemic stroke. This paper summarizes the definition, clinical manifestations, imaging characteristics, and the related risk factors of thrombolysisassociated severe hemorrhagic transformation. In acute ischemic stroke patients with high risk of severe hemorrhagic transformation, thrombolytic therapy with a low dose of recombinant tissue plasminogen activator (rtPA) may reduce the risk of symptomatic intracerebral hemorrhage.
Stroke; Brain infarction; Acute ischemic stroke; Thrombolytic therapy; Symptomatic intracranial hemorrhages; Hemorrhagic transformation
ZHAN Qing
10.12022/jnnr.2017-0003
詹 青
E-MAIL zhanqing@tongji.edu.cn
E-MAIL ADDRESS zhanqing@tongji.edu.cn
CONFLlCT OF lNTEREST: The authors have no conflicts of interest to disclose. Received Jan. 5, 2017; accepted for publication Feb. 25, 2017
Copyright © 2017 by Journal of Neurology and Neurorehabilitation
王勤鹰,詹 青. 急性脑梗死重组组织型纤溶酶原激活物静脉溶栓后严重出血性转化研究进展[J]. 神经病学与神经康复学杂志, 2017, 13(1):25-31.
