利用18S rDNA分子方法分析浒苔绿潮过境期间长牡蛎摄食情况的变化*
2017-03-31王先锋林承刚宋肖跃张海建汝少国杨红生
王先锋 林承刚 许 强 宋肖跃 张海建 汝少国 杨红生①
(1. 中国海洋大学 青岛 266003; 2. 中国科学院海洋生态与环境科学重点实验室(中国科学院海洋研究所) 青岛 266071;3. 海南大学 海口 570228; 4. 日照市渔业通讯管理站 日照 276800)
滤食性海洋双壳贝类在近岸大型底栖生物群体中处于优势地位, 它们通常充当“生态系统工程师”(Joneset al, 1996), 并可以在浮游生产者和底栖生物之间建立重要联系。双壳贝类的食物营养级很广,但对它的了解却较少。生态学家们曾尝试研究出它们全部的食物摄取情况, 但他们面临的最直接挑战就是它们所摄取的食物过于微小, 还有其随时空的变化((Lotsy, 1895; Galtsoff, 1964)。通常判断滤食性贝类的食物成分非常困难, 这是因为传统的显微镜检测所需的样本量较大, 同时还存在着较多胃含物碎片难以鉴别的问题(Fukumoriet al, 2008)。早期有关海洋双壳贝类的食物成分调查表明其食物源中有重要的初级生产者, 例如硅藻和鞭毛藻(Galtsoff, 1964)。大量近期调查研究发现了其食物源也含有次级消费者,例如桡足类, 无脊椎动物幼虫(Davenportet al, 2000;Lehaneet al, 2006)。了解双壳贝类的食物组成对于研究海岸带食物网和生态基础管理等方面至关重要。尤其对判断海洋牧场生态系统将会发生怎样的改变尤其重要(Fukumoriet al, 2008)。
传统分类学将浒苔划分为绿藻门、绿藻纲、石莼目、石莼科、浒苔属(Enteromorpha),但近年来取消了浒苔属, 而将原浒苔属物种合并为石莼属(Ulva)(Hiraokaet al, 2004), 并认为导致绿潮暴发的优势藻类以石莼属为主(Callowet al, 1997; Hiraokaet al, 2004), 因此本研究也将石莼属和浒苔属归为一类。浒苔属和石莼属等大型海洋绿藻大量增殖而导致的海洋生态异常现象, 被称为“绿潮”。绿潮暴发会引发一系列次生灾害, 如藻体腐败散发出难闻气味污染环境, 藻类堆积沉降会引起缺氧和底质腐败, 导致生物死亡。位于日照的平岛海域是重要的海洋牧场,每年大规模浒苔都在此有规律的暴发, 浒苔的出现对当地渔民的劳动生产造成很大干扰。平岛周围自然生长着大量的牡蛎和贻贝这两种重要的经济贝类,其中属长牡蛎(Ostrea gigasThunberg)分布最广、数量最多。长牡蛎属于滤食性贝类, 目前并没有研究表明浒苔碎屑是否可以作为长牡蛎食物源或对长牡蛎食物源产生影响。浒苔的成熟藻体较大, 高可达1m, 因此无法作为长牡蛎的食物源, 但在海风海浪和浒苔自身衰败的作用下会产生浒苔丝状体碎屑, 这些悬浮在水体中的有机物质大小可以为长牡蛎所摄食,并且浒苔的成熟藻体能产生大量的微观繁殖体, 浒苔微观繁殖体作为浒苔生长发育的早期形成产物,主要包括孢子、配子、合子这些无细胞壁保护的裸露单细胞, 在适宜的温盐等条件下, 微观繁殖体 遇到合适附着基就会固着, 进而萌发生长成藻丝体, 固着和萌发是浒苔生长发育的必要阶段(Chapman, 1986;Fletcheret al, 1992; Santeliceset al, 2002)。而微观繁殖体的直径与小型浮游植物相近。考虑到滤食性贝类以水体中浮游生物和有机碎屑等为主要食物(张继红,2008), 水体中浒苔丝状体碎屑和微观繁殖体增加,贝类的食物来源可能发生变化。本研究通过高通量DNA测序技术研究了长牡蛎的真核食物成分, 从长牡蛎的摄食状况角度为预测相关生态风险提供理论依据与数据支持。
1 材料与方法
1.1 样品收集
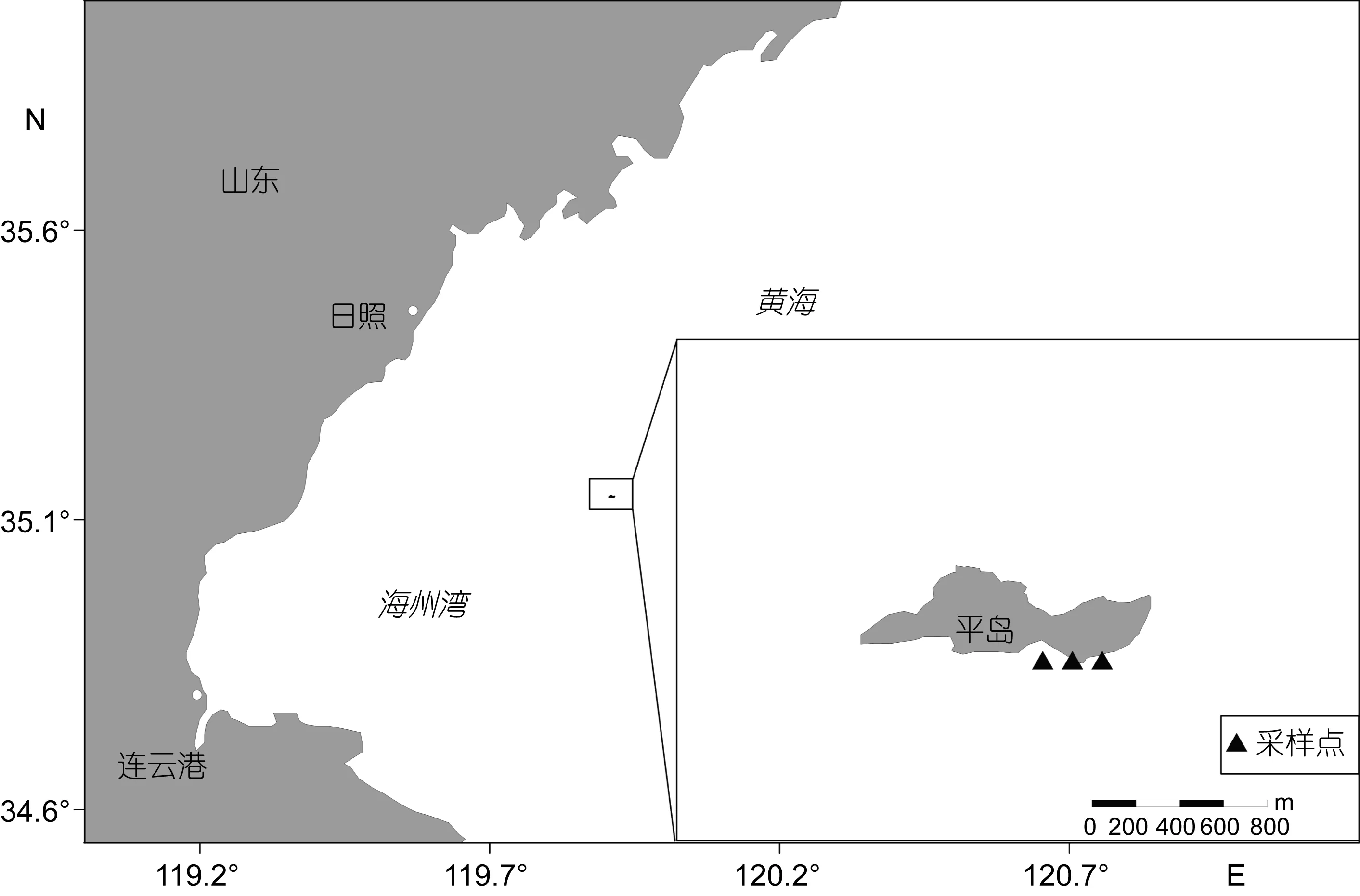
图1 采样站位区域分布图Fig.1 Map of sampling site
1.2 长牡蛎壳高测量
采集长牡蛎后用尺子量取其背腹缘最大距离并记录。
1.3 浮游生物采集
在长牡蛎样品收集区域附近设置3个采集点, 使用浮游植物网和浮游动物网垂直采集浮游生物, 其中浮游植物网网径为76μm, 口径为37cm, 浮游动物网网径为 500μm, 口径为 50cm。采集的浮游生物样品加入甲醛固定带回实验室等待检测。
1.4 胃含物样品
所有采集的长牡蛎都现场解剖, 提取消化道部分, 转移至1.5mL冻存管中并做标号, 将冻存管投于液氮罐中带回实验室等待进一步处理。
1.5 基因组DNA提取
采用CTAB方法对样本的基因组DNA 进行提取(Tel-Zuret al, 1999), 之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量的样品于离心管中, 使用无菌水稀释样品至1ng/μL。
1.6 PCR扩增
以稀释后的基因组 DNA为模板, 使用特异引物扩增18S V4区DNA。通常引物序列为528F (5′-GCGG TAATTCCAGCTCCAA-3′)和 706R (5′-AATCCRAGA ATTTCACCTCT-3′) (Cheunget al, 2010)。使用 New England Biolabs公司的Phusion® High-Fidelity PCRMaster Mix with GC Buffer酶和缓冲液。使用高效和高保真的酶进行 PCR, 能确保扩增效率和准确性(Magočet al, 2011)。最后设置PCR反应体系和程序 (30μL): Phusion Master Mix(2×) 15μL, Primer(2μmol/L) 3μL (6μmol/L), gDNA (1ng/μL) 10μL(5—10ng), H2O 2μL。反应程序: 98ºC 预变性 1min; 30个循环包括(98ºC, 10s; 50ºC, 30s; 72ºC, 30s); 72ºC,5min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测; 根据 PCR产物浓度进行等质量混样, 充分混匀后使用 1×TAE浓度 2%的琼脂糖胶电泳纯化 PCR产物, 选择主带大小在 400—450bp之间的序列, 割胶回收目标条带。产物纯化试剂盒使用的是 Thermo Scientific公司GeneJET胶回收试剂盒。
1.7 文库构建和上机测序
使用Illumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒进行文库的构建, 构建好的文库经过 Qubit 定量和文库检测, 合格后, 使用HiSeq进行上机测序。
1.8 数据分析
测序得到的原始数据(Raw Data), 存在一定比例的干扰数据(Dirty Data), 为了使信息分析的结果更加准确、可靠, 首先对原始数据进行拼接、过滤, 得到有效数据(Clean Data)。
基于有效数据进行OTUs (Operational taxonomic units)聚类和物种分类分析, 根据OTUs聚类结果, 一方面对每个 OTU的代表序列做物种注释, 得到对应的物种信息和基于物种的丰度分布情况。同时, 对OTUs进行丰度、Alpha多样性计算等分析, 以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有 OTUs信息等(Bokulichet al, 2013;Muelleret al, 2014)。另一方面, 通过PCoA和PCA等降维图和样品聚类树进行展示(Backeljauet al,1996; Zhanget al, 2016)。
3) Overcoupled, τ0>τe, the cavity intrinsic loss is lower than the input power.
2 结果
2.1 壳高
每个月份长牡蛎的壳高是不同的但是都在成年长牡蛎范围之内, 其壳高平均为49.16mm, 其中最小的45.0mm, 最大的53.1mm。这四个月的长牡蛎可能的年龄结构变化或者长牡蛎的增长率未知。
2.2 浮游生物丰度
浮游植物(表1)和浮游动物(表2)的结果显示本地浮游动物生物丰度远低于浮游植物。其中硅藻最多的月份是5月, 甲藻最多的月份为7月。浮游植物各个月的丰度分别是5月55561.7cells/m3, 6月13035cells/m3, 7月81927.7cells/m3, 10月62508cells/m3。浮游动物各个月份的丰度分别为 5月 304.7cells/m3, 6月64.77cells/m3, 7月1638.7cells/m3, 10月140.7cells/m3。
2.3 样品丰度及多样性分析
剔除无效样品和消化道内容物中长牡蛎自身的OTU后总共获得53347个有效序列片段,每一个样品中的有效序列片段数量从 2984到10742不等, 平均为4445.58, OTU的数量展示了胃含物中的生物物种丰度情况。
所有样品中总共获得105个OTU, 2016年5月(WH1)有57—80个OTU, 6月(WH2)有38—65个OTU,7月(WH3)有 44—56个 OTU, 10月(WH4)有 45—84个OTU。根据OTUs的数目做稀释曲线和Chao1曲线(图2a, b)显示所有样品都趋向饱和, 如图显示, 所有样品之间的 Shannon多样性指数差异不显著(P>0.05, 图 2c)。这些结果显示浒苔发生前和浒苔发生后长牡蛎胃含物的真核生物丰度差异并不显著,但是胃含物成分不同。
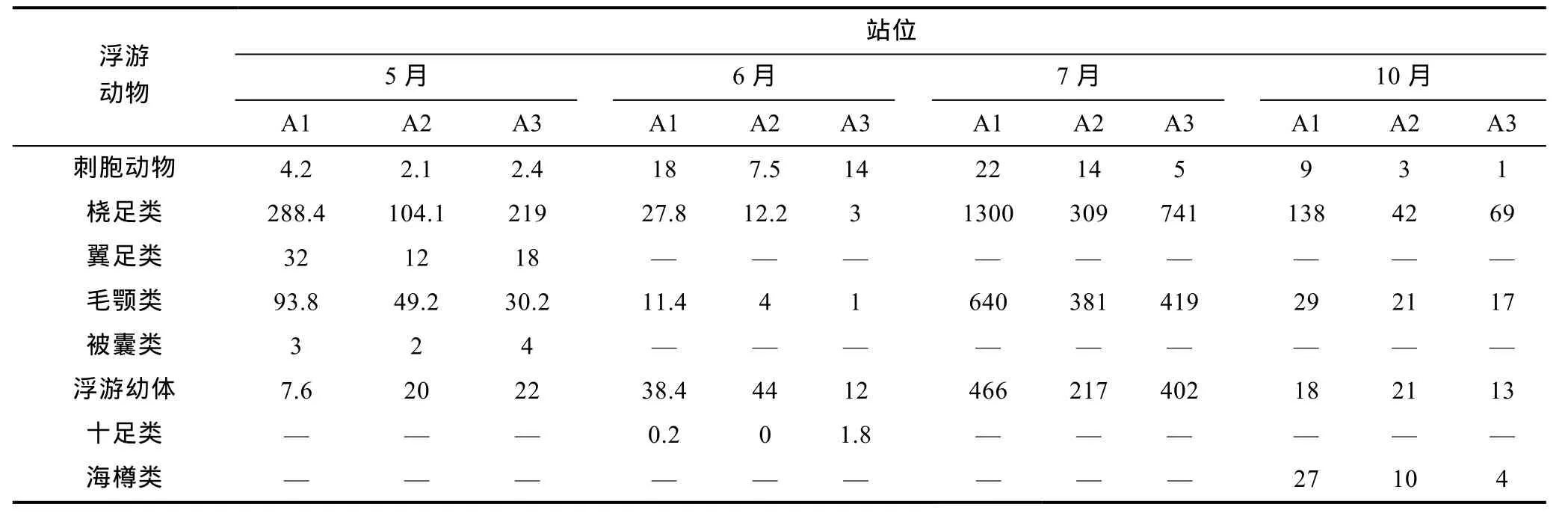
表2 浮游动物丰度(ind/m3)Tab.2 The abundance of zooplankton (ind/m3)
2.4 真核生物成分分析
所有样品中共鉴定出15个门类, WH1样品11个门, WH2样品12个门, WH3样品11个门, WH4样品14个门。每组样品中未鉴别的真核生物比例为5.9%—63.7%。前 10个丰度最高的门类各占总体的99.082%—99.16%, 如图3。各个胃含物样品之间门水平上的丰度差异显著, 其中链形植物门(Streptophyta)是长牡蛎胃含物中整体丰度最高的门类, 最低23.86%, 最高 49.66%, 平均 35.10%, 链型植物是植物中的一大类群, 包括轮藻门(广义上的轮藻)和有胚植物(现存的陆生植物: 苔藓维管植物)两大类。5月(WH1)胃含物占 20%以上的门类有链形植物门和子囊菌门(Ascoaamycota)分别占 32.65%和 26.32%, 占10%以上的门类有绿藻门(Chlorophyta)和囊泡虫门(Protalveolata)分别占14.31%和17.7%。在6月(WH2)胃含物占 20%以上的门类有链形植物门(Streptophyta)为49.66%, 占10%以上的门类是子囊菌门(Ascoaamycota)占18.14%, 7月(WH3)胃含物占20%以上的门类有链形植物门和囊泡虫门(Protalveolata)分别占34.07%和44.72%。10月(WH4)胃含物样品中占20%以上的门类为链形植物门23.89%。所有组样品中除了WH3中囊泡虫门含量最多, 其他3组样品中都是链形植物门含量最多。
结果表明在 OTU水平上样品之间差异明显, 在表3中显示了OTU丰度大于10%的样品组, 如图可以得知丰度大于10%的物种只有5种。4组胃含物样品中的链形植物门(Streptophyta)都大于20%, 表明链形植物门是长牡蛎胃含物中的主要食物成分。
根据前10个丰度最高的属聚类分析发现5月、6月、7月和10月真核生物成分差别明显, 表明胃含物中真核生物成分显著的季节性不同, 有一些成分只能鉴别到纲。如图4, 并没有石莼属成分。WH1中梨属(Pyrus), 四胞藻纲(Trebouxiophyceae)达到最多;WH2样品中座囊菌属(Dothidea)含量都达到所有样品的最高值。WH3样品中共甲藻属(Syndiniales)、菥蓂属(Thlaspi)成分达到最多。WH4样品中沟鞭藻属(Biecheleria)的含量达到最高值。
通过 PCoA(主成分分析)也可以确定样品之间的关系(图5)。PCoA结果显示4组样品之间是不同的,但也有相似之处。根据第一主成分可以看出5月和6月份样品较为接近, 从第二主成分来看7月与其他月份差别最大。

图2 样品稀释曲线(a)、Chao1指数(b)、4组样品的Shanon多样性指数(c)Fig.2 Richness and diversity: a. Sample rarefaction curves. b.Chaos1 curves. c. Shannon-Wiener indices of the four groups
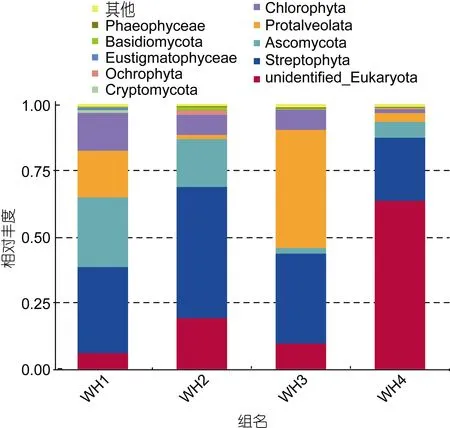
图3 胃含物中10个丰度最高门类相对丰度图Fig.3 Relative abundance of 10 most abundant phyla in stomach content

表3 OUT丰度大于10%的样品Tab.3 The OTUs whose abundance exceeded 10% in single samples
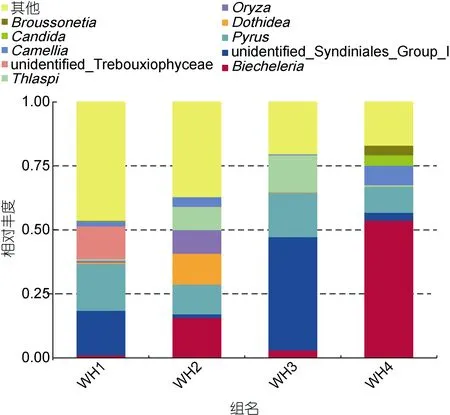
图4 属水平20个丰度最高门类相对丰度图Fig.4 The relative abundance of 20 most abundant genus in stomach content
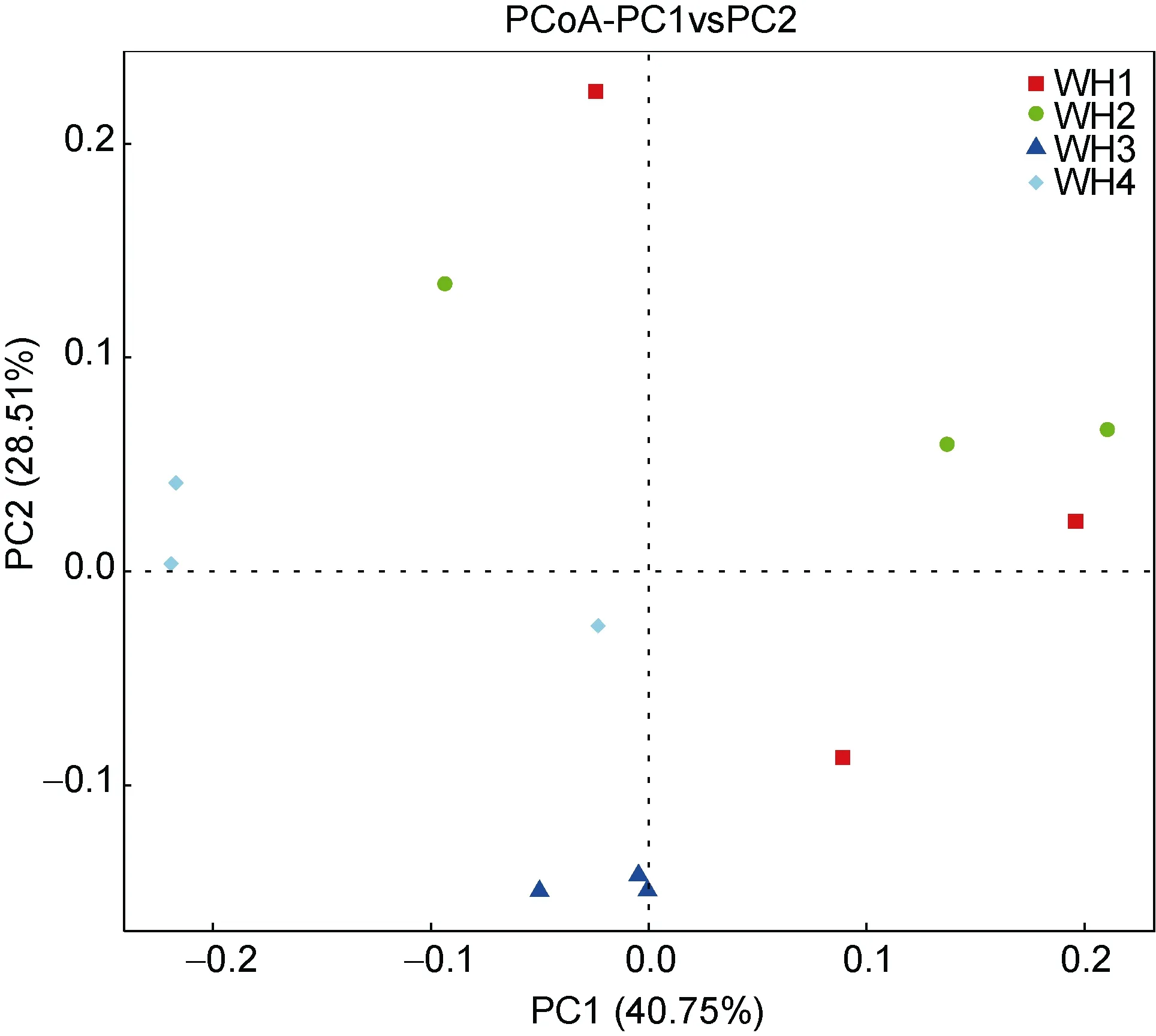
图5 组间PCoA主坐标分析Fig.5 PCoA plots among the groups
3 讨论
长牡蛎属于滤食性贝类, 且食物源较复杂。使用传统的显微镜技术鉴定这个物种的胃含物真核生物成分非常困难。我们使用了高通量DNA序列技术作为研究方法来鉴定长牡蛎胃含物中真核食物成分。目前已有研究通过18S rDNA方法鉴别海参胃含物的真核生物组成(Zhanget al, 2016)。我们共鉴定出15个门类的 105个 OTU, 每组样品的 OTU数量范围从38—84不等, 代表了 11—14个门, 而在属水平共鉴定出105个属, 表明长牡蛎胃含物真核生物成分较复杂, 食物源丰富。我们对石莼发生前后长牡蛎胃含物的研究结果显示并没有石莼属成分。因此表明石莼属不太可能作为长牡蛎的直接食物源。
现已有的关于胃含物的鉴定方法有COI(Lerayet al, 2013; Badeet al, 2014; Brownet al, 2014), ITS(Bachyet al, 2013)和18S rDNA序列分析(Martinet al,2006; Suzukiet al, 2008; Maloyet al, 2009; Riemannet al, 2010)三种。但是COI和ITS扩增片段与18S rDNA扩增相比更长, 且变异度较高, 只适用于摄食水平单一的物种胃含物分析, 由于长牡蛎的摄食成分较复杂因此选用18S rDNA序列分析。使用这种方法可以鉴别到属水平而运用传统的显微镜检查大多只能观察到门水平, 例如硅藻门(Lotsy, 1895); Galtsoff,1964), 因此这种方法更加精确全面, 可以为海洋动物摄食研究提供宝贵经验(Lerayet al, 2013)。但这种方法也有其缺点, 一般食物在体内经过几个小时或者几天就会被完全消化, 因此这种方法只能提供短期的胃含物成分研究, 具有一定偶然性, 而稳定同位素分析和脂肪酸分析等方法可以对长牡蛎几个月内甚至几年内主要的食物来源进行对比分析, 想要研究长期的食物变化还需要结合稳定同位素分析和脂肪酸分析等方法共同分析。
研究结果显示浒苔过境前后 4组不同时间相同地点的胃含物成分有着显著变化。在四组样品中通过18S rDNA分子方法分析长牡蛎的胃含物结果是不同的, 考虑到采样时间跨越春季夏季和秋季三个季节,可能导致胃含物成分的显著不同但不同组之间的生物丰度变化不显著(P>0.05), 胃含物中基本都是初级生产者而未发现次级消费者, 根据我们的检测结果显示长牡蛎主要摄食被子植物和小型浮游植物(如硅藻)这些初级生产者, 这与 Fukumori等(2008)的研究结果有不一致之处。在之前的研究中发现长牡蛎具有广泛的营养可塑性, 因其食物源不止含有初级生产者还包括藤壶类, 甲壳类等次级消费者(Davenportet al, 2000; Lehaneet al, 2006; Fukumoriet al, 2008), 其不适合充当是一个初级生产力的表征。本次研究发现了胃含物中具有很高比例的高等植物, 蓂例如菥属、梨属、稻属, 这种情况在已有的相关研究中并没有提到过, 但并没有检测出浮游动物成分, 这可能与浮游动物丰度较低有关, 根据浮游动物检测结果(表 2)显示浮游动物与浮游植物相比含量显著偏低, 这在某种程度上也说明了长牡蛎的营养可塑性, 表明长牡蛎的食物源不仅仅来源于海洋而且还摄食陆源有机质。由于本次研究地点位于离岸小岛, 最近处距离海岸 42km, 而且附近没有其他河流注入因此这些高等植物不太可能来自大陆, 推测高含量的被子植物可能来自小岛自身的植被, 平岛面积0.148km2, 目前在岛上没有发现种植大量稻属植物和梨属植物, 但岛周围地势险恶无法近距离观察, 不排除有野生稻属植物和梨属植物在此生长。平岛周围海域属于当地公司承保养殖区, 常年有 4—6条渔船停靠或活动在岛附近, 船员会将吃剩的饭菜或变质的食物直接倒入海水中, 经过海流的传播, 这些剩菜剩饭的降解颗粒可能被附近的长牡蛎滤食, 可能会造成一定的污染,推测这也可能是稻属植物可能的来源之一。在岛上有大量军事碉堡等建筑, 并且在岛的最高处流动住有 2—5名士兵, 其生活垃圾都集中处理不会倒入海中,蓂因此不太可能来自岛上垃圾。菥莫属通常是一种野外生长的植物其花粉会随着海风传播到海水中, 其叶子等植物组织也会掉落腐败后随着雨水流入海水中被长牡蛎滤食, 这可能是长牡蛎滤食大量菥蓂属的原因。因此未来使用双壳贝类作为初级生产力的表征时, 应该考虑到长牡蛎的生活史和摄食模式的不同。
有研究表明浒苔的繁殖多以配子形式出现, 每平方厘米单层藻体叶片可以产生 2.84×106—6.62×106个孢子或配子(陈群芳等, 2011)。也有研究显示浒苔的生殖囊释放出的游孢子大小约为(9—12.5)μm×(5.3—6)μm; 配子相对较小, 约(5.8—8.5)μm×(2—2.8)μm (张华伟等, 2011), 孢子或两个配子结合后形成的合子, 合子以成熟藻体为附着基继续发育成一株新的藻体。一般浮游生物可分为六类: 巨型浮游生物, 大于1cm, 如海蜇; 大型浮游生物, 5—10mm, 如大型桡足类、磷虾类; 中型浮游生物, 1—5mm, 如小型水母、桡足类; 小型浮游生物, 50μm—1mm, 如硅藻、蓝藻; 微型浮游生物, 5— 50μm, 如甲藻、金藻;超微型浮游生物, 小于 5μm, 如细菌。因此我们推测浒苔繁殖体的粒径与小型浮游植物和微型浮游植物相当。从浒苔微观繁殖体的体积来看其可以作为长牡蛎的食物源, 由于本研究所使用的浮游植物网的网径为 76μm, 大于一般的浒苔微观繁殖体大小, 因此这可能是采集浮游植物时并没有检测到微观繁殖体的原因, 但是大量浒苔出现在平岛海域后, 长牡蛎的胃含物中也没有检测到石莼属或浒苔属成分, 推测可能有两种可能: (1) 平岛属于浒苔暴发后自南向北漂移的通道区, 并没有浒苔腐败沉降因此没有碎屑产生或产生量极少, 因此长牡蛎无法摄食浒苔。(2)此时的浒苔未到成熟期并没有微观繁殖体产生, 因此长牡蛎并没有摄食。有研究表明黄海绿潮暴发过程中, 石莼属绿藻的微观繁殖体在海水和沉积物中是广泛分布的, 并且生物量不容忽视。Liu等(2010, 2012)将采集到的微观繁殖体带回实验室内重培养, 对长出的幼苗进行计数从而解决了微观繁殖体的定量问题。张华伟等(2011)曾经指出在绿潮繁盛期, 一株飘浮的浒苔藻体可以产生 2.31×107个配子。Wang等(2013)利用荧光定量PCR的方法, 对绿潮暴发期间黄海石莼属绿藻微观繁殖体生物量的时空分布进行了定量研究, 结果发现微观繁殖体的生物量在5月迅速上升, 平均数量为300—105cells/L, 5月中旬达到顶峰,约为 107cells/L。Zhang等(2015)曾指出自由漂浮的浒苔藻体在 5月份生物量急剧攀升, 因为浒苔微观繁殖体的分布与水体中的浒苔藻体生物量呈现明显正相关。
根据本次研究记录平岛浒苔出现至海面上可见浒苔消散的时间为6月11日—7月10日, 此时出现的浒苔比其微观繁殖体数量的顶峰时期晚了将近一个月的时间, 虽然有大量浒苔藻体存在, 可能其微观繁殖体数量已经开始减少。也有研究表明浒苔的配子具有正趋光性, 这趋光性使其更容易在光线较强的海面聚集并在漂浮藻体上附着生长, 浒苔成熟体有大量囊状结构, 这些结构有利于藻体更好地漂浮在水面接受光照(张华伟等, 2011)。而长牡蛎生长在潮间带, 当海水涨潮时长牡蛎生活在水下 3—6m, 本次研究地点长牡蛎生长在中潮间带区, 只有落潮时长牡蛎才会浮出水面并且只有此时才能采集到长牡蛎样品, 浒苔的这种生长特性与长牡蛎生长区在空间上产生一定分隔。因此也说明了水体中有大量浒苔而长牡蛎胃含物中没有浒苔成分的原因。
4 结论
综上所述, 浒苔暴发并不会直接影响长牡蛎的摄食情况, 因此推测浒苔通道区平岛海洋牧场受浒苔危害影响较小, 应该更多关注浒苔漂移后的沉降区域并做好灾害预防工作。使用高通量测序技术可以准确地鉴定胃含物成分但这种方法更多关注的是其短期的摄食情况, 未来研究双壳贝类食物网时应该结合同位素分析和脂肪酸分析等多种分析方法, 这些方法可以关注到贝类的长期摄食情况, 以助于更好地了解双壳贝类食物网结构。由于海州湾大规模浒苔暴发已经呈现常态化, 从长期角度来看可能会影响整个海洋渔业资源环境进而直接或间接对双壳贝类营养成分造成影响, 因此应该全面加强监测浒苔对海洋环境的影响并做好生态风险评估。
张华伟, 马家海, 胡 翔等, 2011. 绿潮漂浮浒苔繁殖特性的研究. 上海海洋大学学报, 20(4): 600—606
张继红, 2008. 滤食性贝类养殖活动对海域生态系统的影响及生态容量评估. 青岛: 中国科学院海洋研究所博士学位论文, 20—25
陈群芳, 何培民, 冯子慧等, 2011. 漂浮绿潮藻浒苔孢子/配子的繁殖过程. 中国水产科学, 18(5): 1069—1076
Bachy C, Dolan J R, López-García Pet al, 2012. Accuracy of protist diversity assessments: morphology compared with cloning and direct pyrosequencing of 18S rRNA genes and ITS regions using the conspicuous tintinnid ciliates as a case study. ISME J, 7(2): 244—255
Backeljau T, De Bruyn L, De Wolf Het al, 1996. Multiple UPGMA and neighbor-joining trees and the performance of some computer packages. Mol Biol Evol, 13(2): 309—313
Bade L M, Balakrishnan C N, Pilgrim E Met al, 2014. A genetic technique to identify the diet of cownose rays,Rhinoptera bonasus: analysis of shellfish prey items from North Carolina and Virginia. Environ Biol Fish, 97(9): 999—1012
Bokulich N A, Mills D A, 2013. Improved selection of internal transcribed spacer-specific primers enables quantitative,ultra-high-throughput profiling of fungal communities. Appl Environ Microbiol, 79(8): 2519—2526
Brown D S, Burger R, Cole Net al, 2014. Dietary competition between the alien Asian Musk Shrew (Suncus murinus) and a re-introduced population of Telfair’s Skink (Leiolopisma telfairii). Mol Ecol, 23(15): 3695—3705
Callow M E, Callow J A, Pickett-Heaps J Det al, 1997. Primary adhesion ofEnteromorpha(chlorophyta, ulvales) propagules:quantitative settlement studies and video microscopy. J Phycol, 33(6): 938—947
Chapman A R O, 1986. Population and Community Ecology of Seaweeds. In: Blaxter J H S, Southward A J eds. Advances in Marine Biology. London: Academic Press, 1—161
Cheung M K, Au C H, Chu K Het al, 2010. Composition and genetic diversity of picoeukaryotes in subtropical coastal waters as revealed by 454 pyrosequencing. ISME J, 4(8):1053—1059
Davenport J, smith R J J W, Packer M, 2000. MusselsMytilus edulis: significant consumers and destroyers of mesozooplankton. Mar Ecol Prog Ser, 198: 131—137
Fletcher R L, Callow M E, 1992. The settlement, attachment and establishment of marine algal spores. British Phycol J, 27(3):303—329
Fukumori K, Oi M, Doi Het al, 2008. Food sources of the pearl oyster in coastal ecosystems of japan: evidence from diet and stable isotope analysis. Estuar, Coastal Shelf Sci, 76(3):704—709
Galtsoff P S, 1964. The American oyster Crassostrea virginica Gmelin. Fish Bull, 64: 1—480
Hiraoka M, Ohno M, Kawaguchi Set al, 2004. Crossing test among floating ulva, thalli forming green tide in japan.Hydrobiologia, 512(1—3): 239—245
Jones C G, Lawton J H, Shachak M, 1996. Organisms as Ecosystem Engineers. In: Samson F B, Knopf F eds.Ecosystem Management. New York, USA: Springer Press,130—147
Lehane C, Davenport J, 2006. A 15-month study of zooplankton ingestion by farmed mussels (Mytilus edulis) in Bantry Bay,Southwest Ireland. Estuar Coastal Shelf Sci, 67(4):645—652
Leray M, Yang J Y, Meyer C Pet al, 2013. A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity: application for characterizing coral reef fish gut contents. Front Zool, 10(1):34
Liu F, Pang S J, Zhao X Bet al, 2012. Quantitative, molecular and growth analyses ofUlvamicroscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Mar Environ Res, 74: 56—63
Liu D Y, Keesing J K, Dong Z Jet al, 2010. Recurrence of the world’s largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensisaquaculture rafts confirmed as nursery for macroalgal blooms. Mar Pollut Bull, 60(9): 1423—1432
Lotsy J P, 1895. The food of the oyster, clam, and ribbed mussel.Rept US Comm Fish, 1893(19): 375
Magoč T, Salzberg S L, 2011. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics,27(21): 2957—2963
Maloy A P, Culloty S C, Slater J W, 2009. Use of PCR-DGGE to investigate the trophic ecology of marine suspension feeding bivalves. Mar Ecol Prog Ser, 381: 109—118
Martin D L, Ross R M, Quetin L Bet al, 2006. Molecular approach (PCR-DGGE) to diet analysis in young Antarctic krillEuphausia superba. Mar Ecol Prog Ser, 319: 155—165
Mueller R C, Paula F S, Mirza B Set al, 2014. Links between plant and fungal communities across a deforestation chronosequence in the Amazon rainforest. ISME J, 8(7):1548—1550
Riemann L, Alfredsson H, Hansen M Met al, 2010. Qualitative assessment of the diet of European eel larvae in the Sargasso Sea resolved by DNA barcoding. Biol Lett, 6(6): 819—822
Santelices B, Aedo D, Hoffmann A, 2002. Banks of microscopic forms and survival to darkness of propagules and microscopic stages of macroalgae. Revista Chilena de Historia Natural, 75: 547—555
Suzuki N, Hoshino K, Murakami Ket al, 2008. Molecular diet analysis of phyllosoma larvae of the Japanese spiny lobsterPanulirus japonicus(Decapoda: Crustacea). Mar Biotechnol,10(1): 49—55
Tel-Zur N, Abbo S, Myslabodski Det al, 1999. Modified CTAB procedure for DNA isolation from epiphytic cacti of the genera Hylocereus and Selenicereus (Cactaceae). Plant Mol Biol Rep, 17(3): 249—254
Wang R J, Wang Y, Zhou Jet al, 2013. Algicidal activity ofUlva pertusaandUlva proliferaonProrocentrum donghaienseunder laboratory conditions. African J Microbiol Res, 7(34):4389—4396
Zhang Q C, Liu Q, Yu R Cet al, 2015. Application of a fluorescencein situhybridization (FISH) method to study green tides in the Yellow Sea. Estuar Coast Shelf Sci, 163:112—119
Zhang H Y, Xu Q, Zhao Yet al, 2016. Sea cucumber(Apostichopusjaponicus) eukaryotic food source composition determined by 18S rDNA barcoding. Mar Biol,163: 153
