花生组分对常压等离子体降解黄曲霉毒素B1的影响
2017-03-30任翠荣肖军霞王世清姜文利
任翠荣,肖军霞,王世清,姜文利,张 岩,刘 真
(青岛农业大学食品科学与工程学院,山东青岛 266109)
花生组分对常压等离子体降解黄曲霉毒素B1的影响
任翠荣,肖军霞,王世清,姜文利,张 岩,刘 真
(青岛农业大学食品科学与工程学院,山东青岛 266109)
采用常压等离子体技术处理黄曲霉毒素B1(AFB1),探究花生中的水分、蛋白质、脂肪酸、白藜芦醇、VE等组分对常压等离子体降解AFB1的影响。结果表明:纯乙腈体系中的AFB1在170 V等离子处理100 s时的降解率为62.5%,分别加入6%的水分、25%的花生蛋白、4 mg/100 g的白藜芦醇、40 mg/100 g的VE、脂肪酸(含油酸、亚油酸和棕榈酸)以及多组分混合物后,AFB1的降解率分别为72.25%、51.6%、60.12%、52.63%、58.3%和51.08%。与纯乙腈体系相比,添加水分后,AFB1的降解率升高9.75%,而添加其它组分后,AFB1的降解率都有所降低。因此,利用常压等离子技术降解AFB1时,花生组分对降解率有不同程度的影响,这对实际应用有一定的参考价值。
常压等离子体;花生组分;黄曲霉毒素B1;降解率
花生是我国油料中的优势出口产品,年出口总量居世界第一位,占世界市场份额的35%[1]。花生营养丰富,每100 g花生中含水分6 g,蛋白质25 g,油酸35 g,亚油酸45 g,棕榈酸12 g,白藜芦醇4 mg,VE40 mg[2]。但是,花生出口还存在比较严重的问题,主要是由于花生及其制品的黄曲霉毒素(Aflatoxins,AFT)含量有时超标,AFT含量是关键质量安全检验指标,且限量要求越来越严格,我国规定花生及制品中黄曲霉毒素B1(Aflatoxin Bl,AFBl)含量不得超过20 μg/kg[3-4]。欧盟规定花生及制品中AFB1含量不得超过2 μg/kg,AFT总量不得超过4 μg/kg[5]。AFT是由黄曲霉和寄生曲霉所产生的一种次生代谢物,依据其化学结构的不同,产生的衍生物有20余种,其中最常见的有AFB1、黄曲霉毒素B2(AflatoxinB2,AFB2)、黄曲霉毒素G1(Aflatoxin Gl,AFG1)、黄曲霉毒素G2(Aflatoxin G2,AFG2)、黄曲霉毒素Ml(Aflatoxin M1,AFM1)五种[6],其中AFB1毒性最强,被世界卫生组织(WHO)列为一级致癌物[7-9]。因此,AFB1的降解研究越来越受到关注。
国内外学者对AFT的脱除方法进行了大量研究,目前降解AFB1的常用方法有物理法、化学法和生物法[10-11],但大部分方法存在反应机制可逆、有机溶剂残留、工艺复杂难以推广等问题,这些都限制了其在实际生产中的应用[12-13]。本课题组自2007年以来,采用低压等离子体技术处理AFB1,取得了初步的成效。张岩等研究发现,120 W的减压等离子体处理乙腈中AFB1时,其降解率达99.8%[14],且降解率均随等离子体处理功率的增大而增加。李玉鹏等利用低压等离子体技术有效降解农产品中的AFB1,但比纯水或纯乙腈中的AFB1的降解率低[15]。这说明减压等离子体对溶剂体系和农产品中的AFB1均具有降解作用。近些年出现的常压等离子体技术发展势头逐渐胜过了传统的低压等离子体技术,因为前者无需使用真空设备,且能够处理大面积物件,所以更适合实际生产线。
本研究采用的常压等离子体是通过电晕放电、辉光放电、介质阻挡放电等产生,其气体温度接近或略高于室温,在不影响热敏物质的基础上可以高效杀菌[16]。由于其设备投资少,能够连续化生产,又可以节省资源,环保无公害,所以大气压低温等离子体在材料表面改性、生物医学、臭氧生成和杀菌消毒等领域有着广泛应用[17-19]。但是,等离子体在降解花生AFB1的过程中,花生的各种组分可能会影响降解过程。本研究利用常压等离子体降解AFB1,探究花生组分中水分、蛋白质、油酸、亚油酸、棕榈酸等对AFB1降解率的影响,以期为等离子体处理技术在实际中的应用提供理论支撑。清洗器:德国艾尔玛公司。
1.3 实验装置
实验装置,由中国科学院等离子体物理研究所制作,该装置由氩气瓶、超净工作台、等离子体发生器等部分组成,见图1。
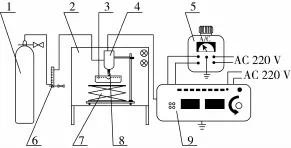
图1 常压等离子体装置图
1 材料与方法
1.1 材料与试剂
AFB1:美国Sigma公司;乙腈(色谱纯):德国默克公司;花生蛋白质粉:辽宁虹螺健康食品有限公司;油酸:天津巴斯夫化工有限公司;亚油酸:天津市光复精细化工研究所;棕榈酸:天津博迪化工股份有限公司;白藜芦醇:上海麦克林生化科技有限公司;VE:上海鹤善实业有限公司。
1.2 仪器与设备
常压等离子体:中国科学院等离子体物理研究所;0.22 μm针筒式滤膜过滤器:天津市津腾实验设备有限公司;一次性无菌注射器:侯马市康福莱医疗器械有限公司;Agilent 1100型HPLC液相色谱仪:美国Agilent公司;Elmasonic S900H通用型超声波
1.4 实验方法
1.4.1 常压等离子体处理电压对不同花生组分中AFB1降解率的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,分别与一定量的水、花生蛋白、油酸、亚油酸、棕榈酸、白藜芦醇、VE以及多组分混合物(水、花生蛋白、油酸、亚油酸、棕榈酸、白藜芦醇和VE的混合物)混合均匀,控制水分含量为6%、花生蛋白含量为25%、油酸含量为35%、亚油酸含量为45%、棕榈酸含量为12%、白藜芦醇含量为4 mg/100 g、VE含量为40 mg/100 g,置于常压等离子体上进行处理,电压分别设定为150、155、160、165和170 V,放电时间为100 s,同时设纯乙腈体系作为对照组。
1.4.2 花生组分含量对AFB1降解率的影响
1.4.2.1 水分含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的水分混合均匀,控制水分含量分别为3%、6%、9%、12%,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.2 花生蛋白含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的花生蛋白混合均匀,控制花生蛋白含量分别为10%、20%、30%、40%,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.3 油酸含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的油酸混合均匀,控制油酸含量分别为10%、20%、30%、40%,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.4 亚油酸含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的亚油酸混合均匀,控制亚油酸含量分别为15%、30%、45%、60%,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.5 棕榈酸含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的棕榈酸混合均匀,控制棕榈酸含量分别为6%、12%、18%、24%,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.6 白藜芦醇含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的白藜芦醇混合均匀,控制白藜芦醇含量分别为2、4、6、8 mg/100 g,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.4.2.7 VE含量对常压等离子体降解AFB1的影响
用乙腈配制成浓度为10 mg/L的AFB1溶液,取5 mL AFB1溶液与不同含量的VE混合均匀,控制VE含量分别为20、40、60、80 mg/100 g,置于170 V常压等离子体上处理100 s后,测定AFB1降解率。
1.5 样品检测器前处理
取2 g未经常压等离子体和经过常压等离子体处理的样品于离心管中,用适量石油醚分数次溶解,再用10 mL乙腈—水溶液(60∶40,V/V)萃取,4 000 r/min离心5 min,吸取乙腈—水层于第二个离心管中,将原离心管中样品再用乙腈—水萃取一次,合并乙腈—水溶液于第二个离心管中,用20 mL三氯甲烷萃取两次,合并三氯甲烷,氮吹浓缩至干,分别加入2 mL乙腈溶液溶解,过有机相滤膜后,用高效液相色谱仪进行测定。
1.6 AFB1含量的测试方法
1.6.1 HPLC法的色谱条件
用Agilent液相系统进行测定。色谱柱为Waters Symmetry-C18(4.6 mm×250 mm,粒度5 μm);柱温为30℃;流动相为V(乙腈)∶V(水)=30∶70;流速为1 mL/min;进样量为20 μL;检测器为紫外检测器;激发波长为365 nm;发射波长为440 nm。
1.6.2 AFB1降解率的计算
AFB1降解率计算公式为:

1.7 数据分析
2 结果与分析
2.1 常压等离子体处理电压对不同花生组分中AFB1降解率的影响
2.1.1 常压等离子体处理电压对水分、花生蛋白、白藜芦醇、VE中AFB1降解率的影响
常压等离子体处理电压对水分、花生蛋白、白藜芦醇、VE中AFB1降解率的影响见图2。由图2可知,含有水分的体系中AFB1的降解效果要比纯乙腈体系中的好。在170 V、100 s的处理条件下,水体系中AFB1的降解率为72.25%,与纯乙腈体系相比,AFB1的降解率增加9.75%,这说明添加水分有利于AFB1的降解。原因可能有两方面:一是水分与常压等离子体发生了相互作用,产生了更多能够促使AFB1降解的游离基,如氢离子等[20];二是水分与AFB1结合,破坏了氢键,从而减少分子间的引力,增大分子间的距离,促进了等离子体与AFB1发生作用。

图2 含有水分、花生蛋白、白藜芦醇和VE的体系中AFB1的降解曲线
添加花生蛋白后,170 V下进行100 s的处理时,AFB1的降解率为51.6%。含有花生蛋白的体系中AFB1的降解率要比纯乙腈体系中的低。这是因为在等离子体产生的过程中,由于辉光放电,可放出大量紫外线,紫外线可以破坏蛋白质的结构[21],即在本实验条件下,花生蛋白发生了变性,与常压等离子体释放的活性粒子结合,干扰了活性粒子与AFB1之间的相互作用,使得AFB1的降解率低于纯乙腈体系中AFB1的降解率。
添加白藜芦醇后,在170 V、100 s的处理条件下,AFB1的降解率为60.12%。与纯乙腈体系相比,含有白藜芦醇的体系中AFB1的降解效果较差,但随着电压的增加,两者的降解效果逐渐接近。原因是白藜芦醇是一种抗氧化剂,可清除常压等离子体释放的部分活性粒子,阻碍更多的活性粒子与AFB1结合,从而抑制了AFB1的降解,但是由于花生中白藜芦醇的含量很少,随着处理电压的增加,喷出的等离子体能量、密度升高,白藜芦醇与活性粒子的作用变小,即含有白藜芦醇的乙腈体系与纯乙腈体系的降解效果逐渐一致。
添加VE后,170 V下进行100 s的处理时,AFB1的降解率为52.63%。含有VE的乙腈体系中AFB1的降解效果要比纯乙腈体系中的差。推测原因可能为VE具有清除自由基的作用,常压等离子体释放的部分带电粒子被清除,阻碍了AFB1与带电粒子的结合。
2.1.2 常压等离子体处理电压对脂肪酸、多组分混合物中AFB1降解率的影响
常压等离子体处理电压对脂肪酸、多组分混合物中AFB1降解率的影响见图3。由图3可知,添加亚油酸或添加油酸在同一处理电压下对AFB1降解率的影响基本一致,差异不显著(P>0.05)。与纯乙腈体系相比,含有油酸或亚油酸的乙腈体系中AFB1的降解率都有所下降。原因可能是油酸和亚油酸都属于不饱和脂肪酸,经常压等离子体处理后,在部分活性粒子的冲击下,发生了氧化反应,导致活性粒子与AFB1的接触密度变小。添加棕榈酸后,AFB1的降解率随着处理电压的增大而增加,与纯乙腈体系相比,AFB1的降解率减少10%左右,差异显著(P<0.05)。原因可能是棕榈酸为饱和脂肪酸,性质较稳定,含AFB1的乙腈体系中添加棕榈酸后,会导致AFB1与活性粒子的接触面积减少,从而引起降解率的降低。同时添加油酸、亚油酸、棕榈酸三种脂肪酸后,在170 V、100 s的处理条件下,AFB1的降解率为58.3%;随着处理电压的增加,AFB1的降解率不断增大,且其降解曲线与纯乙腈体系交叉,交点之前,含有三种混合脂肪酸的体系中AFB1的降解率较高,交点之后,纯乙腈体系中AFB1的降解率略高,差异不显著(P>0.05)。
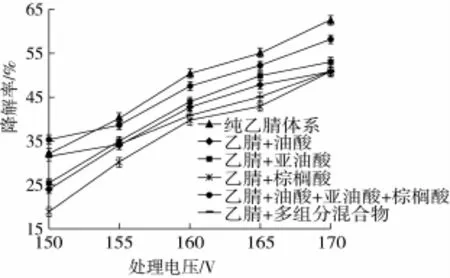
图3 含有脂肪酸、多组分混合物的体系中AFB1的降解曲线
添加多组分混合物后,在170 V下进行100 s的处理时,AFB1的降解率为51.08%。含有多组分混合物的体系中AFB1的降解率要比纯乙腈体系中的降解率低,但两者在150 V时的降解率几乎相等。原因可能是处理电压较低时,常压等离子体释放的带电粒子较少,很难与复杂体系中各组分发生相互作用,只用于AFB1的降解。随着处理电压的增大,带电粒子运动速度加快,喷出的等离子体密度升高,活性粒子会与复杂的组分发生各种反应,干扰了AFB1与活性粒子的结合,使得AFB1的降解率减少[22]。刘真等人利用低压等离子体降解含有蛋白质、脂肪酸、VE的复杂体系中的AFB1时,在100~300 W的功率下处理4 min,发现其降解效果比纯乙腈体系降解率高,两者在处理功率为300 W的条件下降解率几乎相等[23]。与上述报道相比,本研究中复杂体系与纯乙腈体系中AFB1的降解率不仅没有随着处理电压的增大而接近,差距反而逐渐增大,这可能是由于本实验的复杂体系中还添加了水分、白藜芦醇等物质,这些物质在常压等离子体降解多组分混合物体系中的AFB1时发挥了主导作用。
2.2 花生组分含量对AFB1降解率的影响
2.2.1 水分含量对常压等离子体降解AFB1的影响水分添加量对常压等离子体降解AFB1的影响见图4。图4显示,水分含量越高,AFB1的降解率越大,降解效果越显著(P<0.05)。这表明,水分参与了常压等离子体降解AFB1的过程,水分含量的增加有利于AFB1降解率的提升,这与Hooshmand H等人用γ射线对小麦、大豆中AFB1进行降解研究时得到的结果一致[24]。

图4 不同水分含量下AFB1的降解率
2.2.2 花生蛋白含量对常压等离子体降解AFB1的影响
花生蛋白添加量对常压等离子体降解AFB1的影响见图5。图5显示,在170 V、100 s的处理条件下,随着花生蛋白含量的升高,AFB1的降解率逐渐降低。该现象说明花生蛋白对AFB1的降解具有抑制作用,且花生蛋白的含量越高,抑制作用越明显。原因可能是花生蛋白的含量越高,使得AFB1接触到的等离子体能量密度越小,AFB1的降解率就会降低。结果表明,花生蛋白含量对AFB1的降解率有显著影响。

图5 不同花生蛋白含量下AFB1的降解率
2.2.3 脂肪酸含量对常压等离子体降解AFB1的影响
脂肪酸添加量对常压等离子体降解AFB1的影响见图6~图8。图6显示,随着油酸含量的增加,AFB1的降解率不断减少,油酸含量对AFB1的降解率有显著性影响(P<0.05)。原因可能是在常压等离子体处理的电压一定时,喷出的等离子体能量一定,随着油酸含量的增大,更多的等离子能量用于油酸的氧化,只有少部分用于AFB1的降解,导致AFB1的降解率降低。图7显示,随着亚油酸含量的增加,AFB1的降解率不断减少,亚油酸含量对AFB1的降解率有显著性影响(P<0.05)。由于亚油酸与油酸的性质相近,所以推测原因可能是因为较多的等离子体能量用于亚油酸的氧化,导致AFB1降解率减少。图8显示,棕榈酸含量越高,AFB1的降解率越低。棕榈酸含量对AFB1的降解率有显著影响(P<0.05),随着棕榈酸含量的提高,AFB1与常压等离子体释放的带电粒子之间的相互作用减弱,AFB1的降解受到抑制。

图6 不同油酸含量下AFB1的降解率

图7 不同亚油酸含量下AFB1的降解率

图8 不同棕榈酸含量下AFB1的降解率
2.2.4 白藜芦醇含量对常压等离子体降解AFB1的影响
白藜芦醇添加量对常压等离子体降解AFB1的影响见图9。图9显示,随着白藜芦醇添加量的增大,AFB1的降解率逐渐减小,白藜芦醇的含量显著影响AFB1的降解率(P<0.05)。原因可能是白藜芦醇具有良好的清除自由基的作用,清除能力随其浓度的增加而升高,即白藜芦醇含量越高,清除常压等离子体释放的带电粒子的能力越强,AFB1的降解率越低[25]。

图9 不同白藜芦醇含量下AFB1的降解率
2.2.5 VE含量对常压等离子体降解AFB1的影响
常压等离子体对含有VE的体系中的AFB1进行降解处理,实验结果见图10。图10显示,随着VE含量的增加,AFB1的降解率逐渐降低(P<0.05),这说明VE的含量越高,对AFB1降解的抑制作用越大。

图10 不同VE含量下AFB1的降解率
3 结论
本研究考察了花生组分中水分、花生蛋白、花生油脂、白藜芦醇等对AFB1降解效果的影响,运用高效液相色谱仪分析AFB1的降解率。结果显示:纯乙腈体系中的AFB1在170 V等离子处理100 s时的降解率为62.5%,分别加入6%的水分、25%的花生蛋白、4 mg/100 g的白藜芦醇、40 mg/100 g的VE、脂肪酸后,AFB1的降解率分别为72.25%、51.6%、60.12%、52.63%和58.3%。与纯乙腈体系相比,添加水分后,AFB1的降解率升高9.75%,而添加其它组分后,AFB1的降解率都有所降低。加入多组分混合物后,在155~170 V下处理100 s时,含有多组分混合物的体系中AFB1的降解率要比纯乙腈体系中的降解率低,两者在150 V时的降解率几乎相等。因此,花生组分会对常压等离子体降解黄曲霉毒素B1产生影响,这为实际应用提供了参考依据。
[1]中华人民共和国商务部.出口花生质量安全预警分析报告[R].2009.
[2]容小翔.吃花生的宜与忌[J].山东食品科技,2003(9):42.
[3]GB 2761—2011,食品安全国家标准:食品中真菌毒素限量[S].
[4]胡东青,庞国兴,张治宇,等.出口花生黄曲霉毒素污染的预防与控制[J].花生学报,2011,40(1):36-38.
[5]段淑芬,胡文广,戴良香.花生黄曲霉毒素国家标准与绿色贸易壁垒[J].中国农学通报,2006(6):95-98.
[6]杨惠芬,李明元,沈文.食品卫生理化检验标准手册[M].北京:中国标准出版社,1997:274.
[7]丁小霞,李培武,白艺珍,等.中国花生黄曲霉毒素风险评估中膳食暴露非参数概率评估方法[J].中国油料作物学,2011,33(4):402-408.
[8]李培武,张道宏,杨扬,等.粮油制品中黄曲霉毒素脱毒研究进展[J].中国油料作物学报,2010,32(2):315-319.
[9]Liu R,Chang M,Jin Q,et al.Degradation of aflatoxin B1 in aqueous medium through UV irradiation[J].European Food Research and Technology,2011,233(6):1007-1012.
[10]Chen Y C,Liao C D,Lin H Y,et al.Survey of aflatoxin contamination in peanut products in Taiwan from 1997 to 2011[J].Journal of Food and Drug Analysis,2013,21(3):247-252.
[11]王辰龙.花生油中黄曲霉毒素B1的降解及其安全性评价[D].合肥:安徽农业大学,2014.
[12]Alencar E R D,Faroni L R D,Soare s N F F,et al.Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J].Journal of the Science of Food and Agriulture,2012,92(4):899-905.
[13]Piva G,Galvano F,Pietri A,et al.Detoxification methods of aflatoxins[J].Nutrition Research,1995,15(5):767-776.
[14]张岩,王安妮,肖军霞,等.低温射频等离子体降解乙腈中黄曲霉毒素B1的效果与途径分析[J].中国粮油学报,2015,30(2):80-85.
[15]李玉鹏,王世清,肖军霞,等.低温射频等离子体降解农产品中黄曲霉毒素效果的研究[J].粮油食品科技,2014,22(5):54-57.
[16]Heinlin J,Isbary G,Stolz W,et al.Plasma applications in medicine with a special focus on Dermatology[J].Journal of the European A-cademy of Dermatology and Venereology,2011,25(1):1-11.
[17]Roth J.Potential industrial applications of the one atmosphere uniform glow discharge plasma operating in ambient air[J].Physics of Plasma,2005,12(5):057103.
[18]王新新,李成榕.大气压氮气介质阻挡均匀放电[J].高电压技术,2011,37(6):1405-1415.
[19]郑培超,王金梅,胡章芳,等.大气压微等离子体射流对聚酰亚胺薄膜的表面改性[J].高电压技术,2010,36(6):1542-1546.
[20]张振山.紫外光照射和γ射线辐照对大豆中黄曲霉毒素B1降解的比较研究[J].现代食品科技,2014,30(9):217-221.
[21]孙潇,张月婷,张花利,等.等离子体在食品杀菌中的研究现状与展望[J].保鲜与加工,2010,10(6):46-50.
[22]刘文正,严伟,郝宇翀,等.大气压射流等离子体放电特性及其灭菌效果[J].强激光与离子束,2010,22(12):2984-2988.
[23]刘真,王世清,肖军霞,等.花生中的物质成分对低温射频等离子体降解黄曲霉毒素B1的影响[J].食品科学,2016,37(21):219-223.
[24]Hooshmand H,Klopfenstein C F.Effects of gamma irradiation on mycotoxin disappearance and amino acid contents of corn,wheat,and soybeans with different moisture contents[J].Plant Foods for Human Nutrition,1995,47(3):227-238.
[25]刘光贤,祝水兰,周巾英,等.花生白藜芦醇体外抗氧化活性研究[J].中国农机化学报,2014,35(6):163-165.
Effect of peanut components on the degradation of aflatoxin B1treated by atmospheric pressure plasma
REN Cui-rong,XIAO Jun-xia,WANG Shi-qing,JIANG Wen-li,ZHANG Yan,LIU Zhen
(College of Food Science and Engineering,Qingdao Agricultural University,Qingdao Shandong 266109)
The effect of peanut moisture,protein,fatty acid,resveratrol and vitamin E on the degradation of AFB1treated by atmospheric pressure plasma was explored.The results showed that the degradation rate of AFB1reached to 62.5%in pure acetonitrile system by plasma of 170 V for 100 s.Then after adding 6%water,25%peanut protein,4 mg/100 g resveratrol,40 mg/100 g vitamin E,fatty acid(oleic acid,linoleic acid and palmitic acid)and multicomponent mixtures,the degradation rate of AFB1were 72.25%,51.6%,60.12%,52.63%,58.3%and 51.08%,respectively.Compared with the pure acetonitrile system,the degradation rate of AFB1increased by 9.75%after adding water,while the degradation rates of AFB1decreased after adding other components.Therefore peanut components have effect on the degradation rate of AFB1,and have a guiding role in practical application.
atmospheric pressure plasma;peanut components;aflatoxin B1;degradation rate
S 565.2
A
1007-7561(2017)02-0028-06
2016-08-25
国家自然科学基金资助项目(31271963)
任翠荣,1992年出生,女,硕士研究生.
王世清,1961年出生,男,教授.
