以“结构”为主线 让知识“串珠成链”
2017-03-30刘树载
刘树载


复杂的事物都是由许许多多小部分构成的,化学基本概念与基本理论同样如此.“双基”知识零碎,但在整个中学化学教材中占有极其重要的地位,历年高考中均占较大比重.若能紧紧抓住“结构”这一主线,深刻理解其涵义,实现以点带面,纲举目张,可提高分析问题和解决实际问题的能力.
一、原子结构
例1 中国神舟十一号载人飞船于2016年10月17日7时30分发射.在这次载人航天任务中,中国航天员创造了在轨时间33天的最长纪录,为建造载人空间站做好准备.据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( ).
解析 元素相同而质量数不同则为同一元素中的不同核素,它们互为同位素.42He只有2个质子,核外只有一个电子层,只有2个电子;32He只有1个中子;42He的最外层电子数为2,但并不是金属,而是稀有气体.故只有B说法正确.
点评 原子是由居于原子中心带正电荷的原子核和核外带负电荷的电子构成的.原子核由质子和中子构成.所以构成原子的基本粒子是质子、中子和核外电子.质量数(A)=质子数(Z)+中子数(N).
二、分子结构
例2 下列的叙述中不正确的是( ).
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是,具有极性键且分子构型不对称、键角小于180°的非直线型结构
D.非极性分子中,各原子间都应以非极性键结合
解析 不同种原子间形成的共价为极性键.比较HF、HCl、HBr、HI分子中H—X极性键强弱,取决于卤素原子,若非金属性越强、键的极性越强,A是对的.以极性键结合的双原子分子,一定是极性分子,但以极性键结合成的多原子分子,也可能是非极性分子.如CO2分子中,两个C=O键(极性键)是对称排列的,两键的极性互相抵消,所以CO2是非极性分子,B错.判断其是否是极性分子的根据是必有极性键且电荷分布不对称.A2B型如H2O、H2S等,AB2型如CO2、CS2等,CO2、CS2为直线型,键角1800,电荷分布对称为非极性分子,C正确.多原子分子,其电荷分布对称,这样的非极性分子中可以含有极性键,D错.故答案为B、D.
点评 判断键的极性标准是分子中所形成的共价键是不是由同种元素形成的.判断分子是否有极性的标准是分子内正负电荷重心是否重合.若分子中正、负电荷重心重合,该分子一定是非极性分子;否则,是极性分子.而正负电荷重心是否重合,又与分子空间构型等因素有关.因此,分子空间构型和分子内正、负电荷的分布是判断分子是否有极性的依据.
三、晶体结构
例3 下列说法正确的是( ).
A.碘单质的升华过程中,只需克服分子间作用力
B.NH4Cl属于离子化合物,该物质中只存在离子键
C.在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D.金刚石和足球烯(C60)均为原子晶体
解析 碘单质为分子晶体,升华时克服分子间作用力,A正确;NH4Cl中既有离子键又有共价键,B错误;SiO2是原子晶体,由原子构成,C错误;足球烯(C60)为分子晶体,D错误.答案为 A.
点评 离子晶体的晶格质点是阴、阳离子,质点间的作用力是离子键.原子晶体的晶格质点是原子,质点间的作用力是共价键.分子晶體的晶格质点是分子,质点间的作用为分子间作用力,即范德华力.金属晶体的晶格质点是金属阳离子和自由电子,质点间的作用力是金属键.离子晶体的熔点较高,常在数百至1千余度.原子晶体熔点很高,常在一千度至几千度.分子晶体熔点低,常在数百度以下至很低温度.金属晶体多数熔点高,但也有相当低的.
四、电解质结构
例4 下列叙述正确的是( ).
A.NaCl溶液在电流作用下电离成Na+和Cl-
B.溶于水后能电离出H+离子的化合物都是酸
C.BaSO4难溶于水,但BaSO4属于强电解质
D.CO2溶于水中能部分电离,但CO2不是电解质
解析 本题主要考查电解质的概念.电离是指电解质在溶液中离解成自由移动离子的过程,不需电流作用,A错.能电离出H+离子的化合物还包括酸式盐,如KHSO4K++H++SO42-,B错.BaSO4难溶于水,但并不绝对不溶,极少量溶于水的BaSO4是完全电离的,且熔融状态下BaSO4完全电离,C正确.CO2溶于水后,存在电离平衡:CO2+H2OH2CO3H++HCO3-,可见所电离出的离子不是由CO2提供,故CO2是非解质,D正确.答案为C、D.
点评 电解质与非电解质、强电解质与弱电解质等概念,容易混淆,应加以仔细辨析,明确其外延.电解质溶液属于混合体系.因电解质溶液能够发生电离、水解等反应,使得溶液中存在着多种形式的微粒,微粒的浓度也因此而变化.
五、元素周期表结构
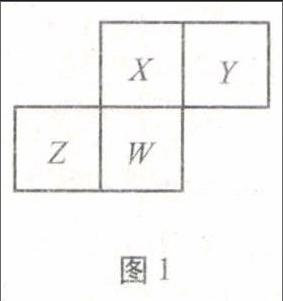
图1例5 短周期元素X、Y、Z、W在元素周期表中的相对位置如图1所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( ).
A.原子半径:Z>W>X>Y
B.元素X、Y、Z、W的最高化合价分别与其主族序数相等
C.最简单气态氢化物的热稳定性:X>Z>W
D.最高价氧化物对应水化物的酸性:X>Z>W
解析 W原子的质子数是其最外层电子数的三倍,所以W是P元素;根据X、Y、Z与W的相对位置,可知X、Y、Z分别是N、O、Si;同周期从左到右半径减小、同主族从上到下半径增大,原子半径:Z>W>X>Y,故A正确;O元素最高化合价分别与其主族序数不相等,故B错误;最简单气态氢化物的热稳定性:X>W>Z,故C错误;最高价氧化物对应水化物的酸性:X>W>Z,故D错误.
答案:A
点评 元素周期表是学习化学的重要工具,必须在理解基础上加以掌握.元素周期表中共有18个纵行,16个族;主族的序数=最外层电子数=该元素的最高化合价数.7个横行即7个周期,周期序数=电子层数;每一周期都是以碱金属元素开始到卤素,最后以稀有气体元素结束.
六、分散系结构
例6 下列溶液不具有丁达尔现象的是( ).
A.C17H35COONa溶液 B.珂罗酊
C.I2的CCl4溶液D.蛋白质溶液
解析 从字面看来,四种选项似乎都称溶液,但需注意:解题不能“望文生意”,不抓住原理、规律而盲目猜测.具有丁达尔现象是胶体的特征,C17H35COONa虽然不是高分子化合物,但分散质微粒也已达到胶体范围,所以工业上油脂经它化反应后加入大量NaCl,发生盐析,从而达到分离目的,A有丁达尔现象;凡是高分子化合物形成的溶液由于分散质微粒大小已达到胶体范围,故实际属胶体;珂罗酊是胶棉(硝酸纤维素酯)的乙醇——乙醚溶液,B、D有丁达尔现象.I2属于小分子,其CCl4溶液应名付其实,没有丁达尔现象.答案为C.
点评 分散系是指由一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物.分散系中分散成粒子的物质叫做分散质;另一种物质叫分散剂.根据分散质微粒的大小,分散系可分为溶液、胶体和浊液(悬浊液和乳浊液).图2
七、原电池结构
例7 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( ).
A.锌片上有气泡,铜片溶解
B.Zn片发生还原反应
C.电子都是从铜片经外电路流向锌片
D.该装置至少有两种形式的能量转换
解析 鋅为负极,铜为正极,正极上生成氢气,故A错误;锌为负极,发生氧化反应,故B错误;电子从锌极经外电路流向铜极,故C错误;该装置存在电能、化学能与电能与光能的转化,故D正确.
答案:D
点评 借助于化学能直接转变为电能的装置.化学电池的主要部分是电解质溶液,和浸在溶液中的正极和负极,使用时将两极用导线接通,就有电流产生,因而获得电能.命题的热点在于原电池(或电解池)的电极名称判断、电极反应式的书写.
八、电解池结构
例8 用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图3所示(电极材料为石墨).
下列有关叙述不正确的是( ).
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO2-3-2e-+H2OSO42-+2H+
D.电解过程中阴极区碱性明显增强
解析 A项,Na+移向阴极区,SO2-3移向阳极区,所以a极为阴极,应接电源负极,故A正确;B项,阴极区放电离子为氢离子生成氢气,阴极电极反应式为2H2O+2e-H2↑+2OH-,A口出来的是氢气,b极应接电源正极,阳极电极反应式为SO2-3-2e-+H2OSO2-4+2H+,所以A口放出的物质是氢气,从C口流出的是浓度较大的硫酸,故B错误;C项,b为阳极,SO2-3在阳极失去电子变成SO42-,阳极电极反应式为SO2-3-2e-+H2OSO2-4+2H+,故C正确;D项,在阴极区,由于H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)增大,生成NaOH,碱性增强,故D正确.
答案:B
点评 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解.借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置叫做电解池或电解槽.分析电解过程的思维程序为:(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极;(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-);(3)排出阴、阳两极的放电顺序.阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+.阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子.
