右侧入路联合反向染色法处理肝尾状叶肝癌破裂出血1例并文献复习
2017-03-29陈海敏刘贵疆袁荣发方路梁博吴鹏王超
陈海敏,刘贵疆,袁荣发,方路,梁博,吴鹏,王超
(1.南昌大学第二附属医院 肝胆胰外科,江西 南昌 330006;2.江西省永修县人民医院 普通外科,江西 永修 330300)
尾状叶位于肝脏背侧,位置深,显露困难,且被下腔静脉、第一肝门、第二肝门、第三肝门所包绕,单独行全尾状叶切除难度极大[1-3],一度被视为是肝脏外科手术的禁区[4]。目前,在单独行全尾状叶切除手术入路的选择上,国内外应用较多的是左右联合入路进行全尾状叶切除,单纯经右侧入路联合反向染色法完整切除全尾状叶文献报道较少。本文报告1例单纯经右侧入路联合反向染色法完整切除自发性破裂出血的全尾状叶肿瘤,并结合复习相关文献,探讨单纯经右侧入路联合反向染色法处理肝尾状叶肝癌破裂出血的安全性及可行性。
1 资料与方法
1.1 一般资料
患者 男,42岁。因突发中上腹及剑突下胀痛6 d,于2016年4月6日入院。外院上腹部CT报告肝尾状叶占位并出血,当地医院给予输血及对症治疗。稳定后转入我院,入院体检:血压115/75 mmHg(1 mmHg=0.133 kPa),心率88次/min,中上腹腹肌稍紧,有压痛、无反跳痛,余无明显异常。
1.2 术前检查
肝功能:ALT 30.19 U/L,AST 24.96 U/L;AFP 2.1 ng/mL;乙肝:HBsAg(+)。肝脏储备功能:ICGR15 6.2%。上腹部CT平扫+增强扫描报告:肝尾状叶占位并周围包裹性、胆囊窝、肝脾周高密影,考虑肿瘤卒中并血肿可能;肝硬化。下腔静脉CTV报告:下腔静脉上段受压、变窄;肝脏尾状叶区可见团块状低密度影,大小约5.0cm×5.5cm,肝门、胆囊窝区可见团块状低密度影,考虑为尾状叶区占位性病变伴肿瘤出血(图1A-C)。利用3D人体可视化软件,对肝脏、下腔静脉、门静脉、肝静脉、肝动脉及尾状叶肿瘤进行三维重建(图1D-E)。术前检查无明显手术禁忌证,根据术前综合评估,拟行经右侧入路联合反向染色法全尾状叶切除手术。
1.3 手术治疗与术后诊断
完善术前准备后在全麻下行手术治疗,具体步骤如下:⑴ 取右侧上腹部区反L型切口,探查腹腔,见肝脏呈肝硬化改变,第一肝门及胆囊窝处血肿覆盖,切开小网膜囊见大量血肿,配合术中超声,可见肿瘤位于尾状叶,大小约5.0cm×6.0cm,部分与下腔静脉粘连。余肝脏及腹腔其它脏器未见明显异常。⑵ 常规游离肝脏,切除胆囊。解剖肝门,在第一肝门、左右肝蒂、第二肝门、肝上、下下腔静脉预置入阻断带,将进入尾状叶的门静脉、胆管、肝动脉分支结扎、离断。⑶ 尾状叶切除。助手用右手从右侧将肝脏向上、向左后方旋转,保持尾状叶和下腔静脉之间的紧张度,左手持镊子对肝短静脉周围组织向上轻挡、牵拉。从下直至肝静脉根部顺次结扎、切断右侧肝短静脉,向上轻抬尾状突部,暴露左侧肝短静脉,从下至上靠近肝脏侧结扎、离断左侧肝短静脉,较粗肝短静脉予5-0 Prolene线进行缝合。在超声引导下穿刺门静脉右后支并用亚甲蓝对肝右后叶进行染色,并结合超声画面,调整注射亚甲蓝速度。用电刀对其染色边界进行标记,并根据Arantius管、肝后下腔静脉、肝静脉根部、肝门板、染色边界进行全尾状叶的离断,近肝中、左静脉共干处肿瘤与下腔静脉之间的粘连,利用超声刀结合吸引器进行组织分离,尤其注意在此处有一较粗的肝短静脉注入尾状叶,需妥善处理。手术时间360 min,入肝血流、出肝血流、下腔静脉未进行阻断,术中失血量约400mL,术中输入红细胞悬液2 U,血浆400mL。术后第3天TBIL 19.32 μmol/L、AST 24.49 U/L、ALT 67.92 U/L,术后住院12 d,无并发症。术后病理报告:肝尾状叶粗梁型肝细胞癌,中分化;切缘未见癌组织累及;结节性肝硬化;送检淋巴结,均未见癌组织转移。术后采用门诊和电话进行随访,术后6个月复查:AFP 1.7 ng/mL,上腹部CT未见肿瘤复发(图2)。

图1 术前影像学检查示肝尾状叶肿瘤伴破裂出血 A-C:下腔静脉CTV(绿色箭头示肿瘤,红色箭头示肿瘤破裂出血);D-E:肝脏3D重建(黄色区域代表肝尾状叶肿瘤)Figure 1 Preoperative imaging examinations showing caudate lobe tumor with spontaneous rupture A–C: CTV images of the inferior vena cava (green arrow showing the tumor,and red arrow showing the rupture of the tumor); D–E: Three-dimension reconstruction of the liver (yellow area representing the caudate lobe tumor)
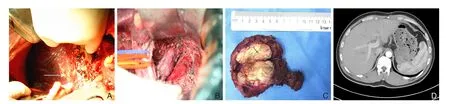
图2 右侧入路联合反向染色法完整切除破裂出血的肝尾状叶肿瘤 A:染色后的肝右后叶与尾状叶右侧边界(箭头表示);B:完整切除尾状叶后右侧观;C:完整切除的尾状叶;D:术后6个月复查CTFigure 2 Resection of the caudate lobe with spontaneous tumor rupture via right-side approach combined with reverse staining A: Right border of caudate lobe to the right posterior lobe of liver after staining (shown by the arrow); B: Right side view after complete caudate lobe resection; C: Completely resected caudate lobe; D: CT image at 6 months after surgery
2 讨论并文献复习
经右侧入路单独行全尾状叶切除报道并不多见,且单纯右侧入路完整切除尾状叶非常困难[5-7],此患者还伴有尾状叶肿瘤破裂出血,临床更为罕见[4,8-11]。因尾状叶血管解剖的复杂性,TACE治疗临床效果不理想[12-13],手术切除是目前最有效的治疗方法[14-15]。尾状叶手术切除分为前入路、左侧入路、右侧入路和左右联合入路[16]。联合半肝切除对于患者术后肝功能及恢复有较大影响,前入路法在术中会增加出血量[2],且对肝脏也有一定的损伤[5]。
本例患者术前肝功能Child-Pugh分级为B级,且存在肝硬化及尾状叶破裂出血,大范围的肝切对术后肝功能存在不利影响,单独尾状叶切除对于本例患者术后肝功能及恢复意义较大[17]。而术前影像学资料及肝脏3D成像显示尾状叶肿瘤较大,与下腔静脉形成包绕并伴有破裂出血;结合术中探查,可见尾状叶与下腔静脉左侧存在较重粘连,周围血肿覆盖较多,从左侧入路切除肝尾状叶视野不佳及操作空间受限,容易造成不可预估的大出血及止血困难,同时也易撕裂肝短静脉和下腔静脉,而从右侧入路能较好的避免上述问题。
通过本例手术,笔者有以下体会:第一,术前对肝脏储备功能进行严格的评估,分析影像学资料及进行肝脏三维重建,盲目手术会使手术风险、术后并发症发生率增加。术前增强CT和下腔静脉CTV能明确肿瘤周围血管及出血情况并可了解尾状叶肿瘤的可切除性。尾状叶位于第一、第二、第三肝门之间,面临的血管较为复杂,且肝动脉、肝静脉和门静脉都可能存在变异[18-19];而建立肝脏三维重建可从多个角度直观地显示肝动脉、门静脉和肝静脉的解剖结构,同时可以预估手术方式与剩余肝体积之间的关系,为肝肿瘤切除的安全性和可行性提供有价值的影像学资料[20-21]。尾状叶手术与肝脏其他位置手术不同,解剖的复杂性增加了手术难度及风险,这就决定了对手术医师资历及经验的较高要求。第二,在肿瘤生长于肝尾状叶且存在破裂出血的情况下,术中应仔细探查肿瘤的出血、位置、与周围组织的粘连情况,可结合术中B超综合评估,选择合适的手术入路。本例患者术中B超、术中探查与术前影像学分析一致,术中需注意:⑴ 控制出入肝血流。解剖性分离入肝、出肝血流,肝上、下下腔静脉,并分别置入预阻断带,以备必要时可有效的控制出血。⑵ 尾状叶左侧肿瘤破裂出血形成血肿使得左侧入路操作视野模糊,反复翻转、挤压左侧肝脏易使肿瘤再次出血,而右侧入路法能较好的避免其问题。在分离过程中需特别注意对肝短静脉的处理和肿瘤与下腔静脉粘连处的分离(妥善处理肝短静脉,靠近肝脏侧离断,较粗的肝短静脉需要用Prolene线进行精细缝合。在近肝中、左静脉共干处存在1支较粗的肝短静脉注入尾状叶,往往在操作空间受限和粘连重的情况下易被忽视,而造成严重的大出血;分离肿瘤与下腔静脉粘连处时,配合使用能量平台和超声刀,如出现出血情况,利用Prolene线在阻断肝上、下下腔静脉的前提下进行妥善缝合)。⑶ 尾状叶右界和右肝之间并没有明显解剖标识,笔者尝试利用反向染色法确定尾状叶右界。有学者[22]提出以“彭氏线”区分,但右侧入路时,这条线较难确定[10]。在术中尝试利用术中B超定位,确定门静脉右后支的位置,并在已离断进入尾状叶的门静脉分支后,注入亚甲蓝,并结合超声画面,控制好注射染料速度,通过对肝右后叶染色,能明显区分尾状叶的右侧边界。本例染色也存在一些不足,染料注入不足使得肝右后叶染色较浅,但术中可以辨识。因此笔者认为术中采取B超定位下穿刺门静脉右后支行肝右后叶染色界定尾状叶右缘是可行的方法,值得进一步总结。⑷ 术前及术后对肝脏周围及腹腔用43 ℃的蒸馏水进行反复冲洗,减少肿瘤种植腹腔的可能[23-24]。
总之,肝尾状叶肿瘤自发性破裂出血最有效的方法是手术治疗,而采用何种手术方式决定着患者术后恢复、肝功能、肿瘤复发等,术前应充分进行肝脏储备功能评估、影像学检查与分析及肝脏三维重建,把握安全肝切范围和手术方式。肝硬化患者,应尽量保留更多的肝组织[25]。单独经右侧入路联合反向染色法处理肝尾状叶肿瘤破裂出血是安全可行的,手术安全性评估和合适的手术方式是手术成功的关键。
[1]Yang JH,Gu J,Dong P,et al.Isolated complete caudate lobectomy for hepatic tumor of the anterior transhepatic approach: surgical approaches and perioperative outcomes[J].World J Surg Oncol,2013,11:197.doi: 10.1186/1477–7819–11–197.
[2]Ahanatha Pillai S,Sathyanesan J,Perumal S,et al.Isolated caudate lobe resection: technical challenges[J].Ann Gastroenterol,2013,26(2):150–155.
[3]余水平,何松青,袁晟光,等.尾状叶巨大海绵状血管瘤的外科处理[J].中国普通外科志,2014,23(1):33–36.doi: 10.7659/j.issn.1005–6947.2014.01.007.Yu SP,He SQ,Yuan CG,et al.Surgical management of giant cavernous hemangioma of caudate lobe of liver[J].Chinese Journal of General Surgery,2014,23(1):33–36.doi: 10.7659/j.issn.1005–6947.2014.01.007.
[4]Sun LH,Han HQ,Wang PZ,et al.Emergency caudate lobectomy for ruptured hepatocellular carcinoma with multiple primary cancers[J].World J Gastroenterol,201,19(3):418–421.doi:10.3748/wjg.v19.i3.418.
[5]温增庆,严以群,杨甲梅,等.肝尾叶切除治疗尾叶肝癌: 附11例报告[J].中国普通外科杂志,2007,16(3):203–205.Wen ZQ,Yan YQ,Yang JM,et al.Caudate lobectomy for liver cancer in candafe lobe:a report of 11 cases[J].Chinese Journal of General Surgery,2007,16(3):203–205.
[6]王许安,刘颖斌,全志伟,等.临床解剖结构在肝尾状叶切除术中的重要性[J].中国实用外科杂志,2014,34(8):720–723.doi:10.7504/CJPS.ISSN1005–2208.2014.08.14.Wang XA,Liu YB,Quan ZW,et al.Importance of surgical anatomy in the resection of caudate lobe[J].Chinese Journal of Practical Surgery,2014,34(8):720–723.doi: 10.7504/CJPS.ISSN1005–2208.2014.08.14.
[7]林辉,杨远,林川,等.肝尾状叶良性肿瘤的手术疗效[J].中华消化外科杂志,2015,14(2):106–109.doi:10.3760/cma.j.issn.1673–9752.2015.02.005.Lin H,Yang Y,Lin C,et al.Surgical efficacy of benign tumor of liver in the caudate lobe[J].Chinese Journal of Digestive Surgery,2015,14(2):106–109.doi:10.3760/cma.j.issn.1673–9752.2015.02.005.
[8]Nakao A,Matsuda T,Koguchi K,et al.Spontaneous rupture of hepatocellular carcinoma of the caudate lobe[J].Anticancer Res,2000,20(3B):2223–2227.
[9]Hong DF,Liu YB,Peng SY,et al.Management of hepatocellular carcinoma rupture in the caudate lobe[J].World J Gastroenterol,2015,21(26):8163–8169.doi: 10.3748/wjg.v21.i26.8163.
[10]彭淑牖,冯雪冬,刘颖斌,等.肝尾状叶原发性肝细胞肝癌的外科治疗[J].中华外科杂志,2005,43(1):49–52.doi:10.3760/j:issn:0529–5815.2005.01.015.Peng SY,Feng XD,Liu YB,et al.Surgical treatment of hepatocellular carcinoma originating from caudate lobe[J].Chinese Journal of Surgery,2005,43(1):49–52.doi:10.3760/j:issn:0529–5815.2005.01.015.
[11]洪德飞,刘颖斌,彭淑牖,等.肝尾状叶肝细胞性肝癌破裂出血的处理经验[J].中华普通外科杂志,2014,29(6):481–482.doi:10.3760/cma.j.issn.1007–631X.2014.06.025.Hong DF,Liu YB,Peng SY,et al.Experience in treatment of spontaneous rupture of hepatocellular carcinoma in hepatic caudate lobe[J].Zhong Hua Pu Tong Wai Ke Za Zhi,2014,29(6):481–482.doi:10.3760/cma.j.issn.1007–631X.2014.06.025.
[12]Miyayama S,Matsui O,Kameyama T,et al.Angiographic anatomy of arterial branches to the caudate lobe of the liver with special reference to its effect on transarterial embolization of hepatocellular carcinoma[J].Rinsho Hoshasen,1990,35(3):353–359.
[13]Tian G,Chen Q,Guo Y,et al.Surgical strategy for isolated caudate lobectomy: experience with 16 cases[J].HPB Surg,2014,2014:983684.doi: 10.1155/2014/983684.
[14]Dong J,Li W,Zeng Q,et al.CT-Guided Percutaneous Step-by-Step Radiofrequency Ablation for the Treatment of Carcinoma in the Caudate Lobe[J].Medicine (Baltimore),2015,94(39):e1594.doi:10.1097/MD.0000000000001594.
[15]Asahara T,Dohi K,Katayama K.Isolated caudate lobectomy for hepatocellular carcinomad--A left-sided approach[J].Asian J Surg,2000,23:15–122.
[16]Chaib E,Ribeiro MA Jr,Silva Fde S,et al.Surgical approach for hepatic caudate lobectomy: Review of 401 cases[J].J Am Coll Surg,2007,204(1):118–127.
[17]Ochiai T,Ishii H,Toma A,et al.Modified high dorsal procedure for performing isolated anatomic total caudate lobectomy (with video)[J].World J Surg Oncol,2016,14:132.doi: 10.1186/s12957–016–0896–3.
[18]Takayasu K,Okuda K.Anatomy of the liver.In: Imaging in liver disease[M].Oxford,England: Oxford University Press,1997:1–45.
[19]Atri M,Bret PM,Fraser-Hill MA.Intrahepatic portal venous variations: prevalence with US[J].Radiology,1992,184(1):157–158.
[20]Atasoy C,Akyar S.Multidetector CT: contributions in liver imaging[J].Eur J Radiol,2004,52(1):2–17.
[21]朱云峰,李建生,马金良,等.三维重建技术在肝门部胆管癌术前评估中的价值[J].中国普通外科杂志,2016,25(2):175–180.doi:10.3978/j.issn.1005–6947.2016.02.003.Zhu YF,Li JS,Ma JL,et al.Value of three-dimensional reconstruction in preoperative assessment of hilar cholangiocarcinoma[J].Chinese Journal of General Surgery,2016,25(2):175–180.doi:10.3978/j.issn.1005–6947.2016.02.003.
[22]彭淑牖,钱浩然,许斌,等.肝脏尾状叶病变的手术治疗[J].临床外科杂志,2009,17(9):581–583.doi:10.3969/j.issn.1005–6483.2009.09.002.Peng SY,Qian HR,Xu B,et al.Surgical treatment of the caudate lobe diseases[J].Journal of Clinical Surgery,2009,17(9):581–583.doi:10.3969/j.issn.1005–6483.2009.09.002.
[23]陈美玲,柏红,许里.蒸馏水与生理盐水对腹腔肿瘤脱落细胞清除效果的比较[J].中国肿瘤外科杂志,2012,4(6):381–382.doi:10.3969/j.issn.1674–4136.2012.06.022.Chen ML,Bai H,Xu L.Comparison of effects on exfoliated tumor cell removal between peritoneal irrigation with distilled water and normal saline[J].Chinese Journal of Surgical Oncology,2012,4(6):381–382.doi:10.3969/j.issn.1674–4136.2012.06.022.
[24]任辉,张弘.无瘤技术在胃肠道肿瘤根治术中的应用[J].中国普通外科杂志,2009,18(4):392–394.Ren H,Zhang H.Application of tumor-free technique for radical resection of gastrointestinal tunors[J].Chinese Journal of General Surgery,2009,18(4):392–394.
[25]Dai WD,Huang JS,Hu JX.Isolated caudate lobe resection for huge hepatocellular carcinoma (10cm or greater in diameter)[J].Am Surg,2014,80(2):159–165.
