肝细胞腺瘤的诊断与治疗:附1例报告并文献复习
2017-03-29洪育蒲熊星铖郭闻一余佳赵亮王卫星
洪育蒲,熊星铖,郭闻一,余佳,赵亮,王卫星
(武汉大学人民医院 普通外科,湖北 武汉 430060)
肝细胞腺瘤(hepatocellular adenoma,HCA)是一种少见的肝脏实质性良性肿瘤。HCA由于生长缓慢,在疾病早期常无明显自觉症状,多在体检或肝脏手术时发现,也可因肿块巨大导致压迫症状而就诊[1]。由于本病发病率低,缺乏典型的临床表现,又无特异性血清学指标,依靠影像学检查可辅助诊断,但仍有较高的误诊率[2]。现报道我院近期收治的1例巨大HCA,回顾国内外相关文献资料,探讨HCA的病因、临床特点、影像学表现、鉴别诊断及治疗方式。
1 病例报告
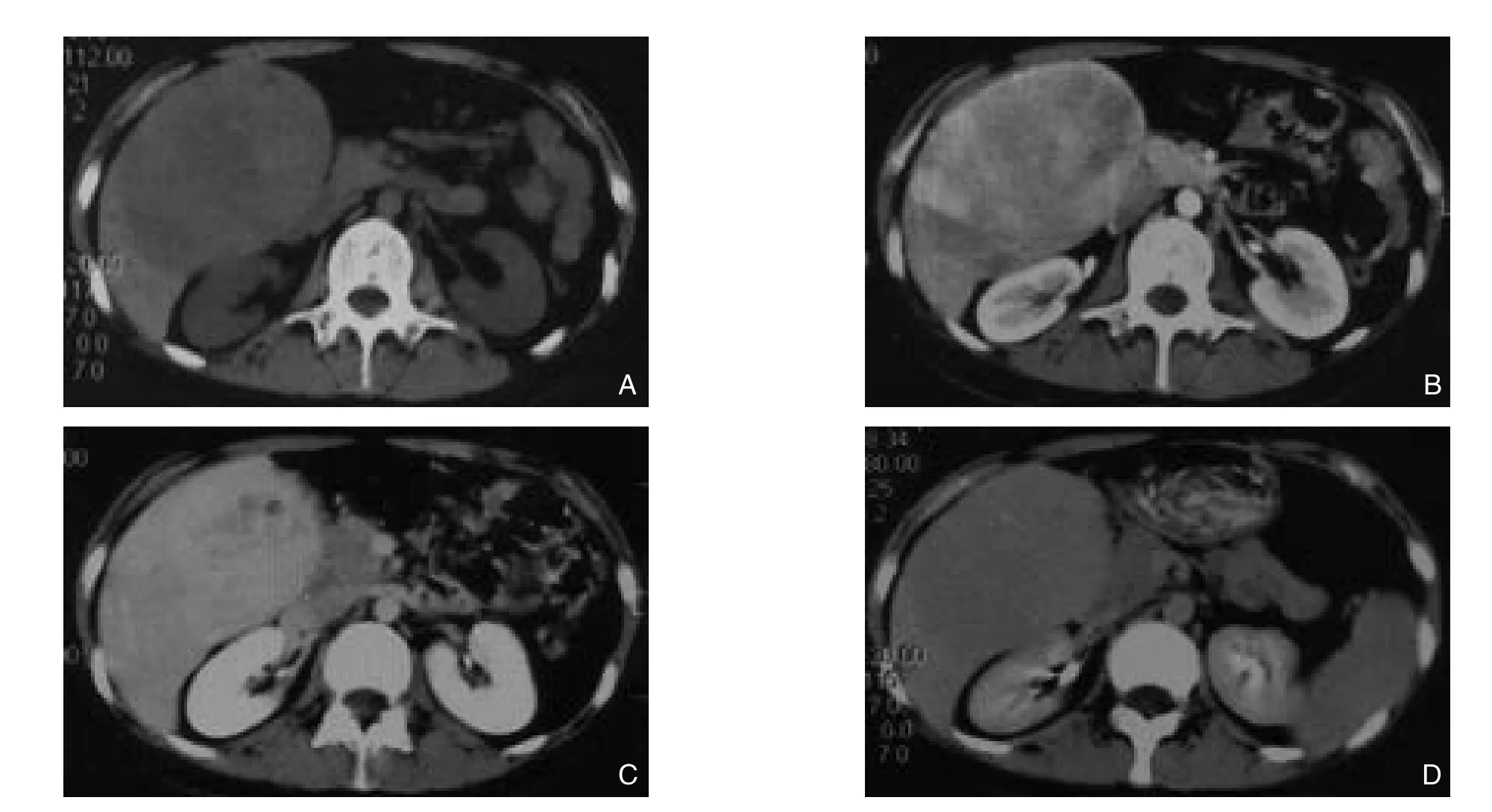
图1 腹部CT A:CT平扫,肝右叶见类圆形低密度肿块影,边界清楚;B:动脉期,肿块明显不均匀强化;C:门静脉期,肿块进一步强化;D:延迟期,肿块密度大致均匀,较周围肝实质呈稍低密度影Figure 1 Abdominal CT scan images A: Plain scan showing round-like low density mass with clear margins in the right hepatic lobe;B: Uneven enhancement in the mass during arterial phase; C: Further enhancement of the mass during portal phase; D: The density of the mass becoming relatively even but slightly lower than surrounding liver parenchyma during delayed phase
患者 女,17岁。因“体检发现腹部肿物1周”入院。入院前10 d患者无明显诱因出现腹泻稀水样大便,伴恶心干呕,在外院治愈,无纳差、黄疸、腹痛、腹胀、发热等症状。外院腹部B超和CT显示右侧腹腔内占位性病变(图1)。既往身体健康,无肝脏疾病及糖尿病等病史,无激素治疗史。入院后体格检查:右上腹部可触及一质地中等包块,边界触不清,无触痛,余未见异常。我院术前实验室检查:肝功能评级为Child A级,乙肝及丙肝阴性,肿瘤标志物AFP,CA125,CA19-9及CEA均阴性,血清γ-谷氨酰转移酶700.00 U/L。MRI检查示肝右叶10.1cm×8.5cm×12.7cm巨大肿块,考虑肿瘤性病变,间质瘤可能(图2)。入院后4 d在全麻下行剖腹探查、肝脏V及部分VIII段切除,大体标本见包块大小16cm×11cm×5cm,包膜完整,切面间褐黄色,质软。病理诊断为肝右叶HCA(图3)。术后10 d出院,随访2个月,患者恢复良好,复查肿瘤标志物、腹部CT未见异常。

图2 腹部MRI A:T1WI轴位;B:T2WI轴位;C:增强T1WI轴位(肝右叶一大小约为10.1cm×8.5cm×12.7cm肿块,边界清楚,T1WI和T2WI呈等信号,其内信号欠均匀);D:T2WI冠状位;E:增强T1WI冠状位(邻近十二指肠胰头,右肾受压)Figure 2 Abdominal MRI images A: T1WI axial view; B: T2WI axial view; C: Enhanced T1WI axial view (a mass in the right liver with size of 10.1cm×8.5cm×12.7cm and clear margins; T1WI and T2WI showing equisignal indensity, and mixed signal intensity in the mass);D: T2WI coronal view; E: Enhanced T1WI coronal view (adjacent to duodenum and pancreatic head, and compression of the right kidney)
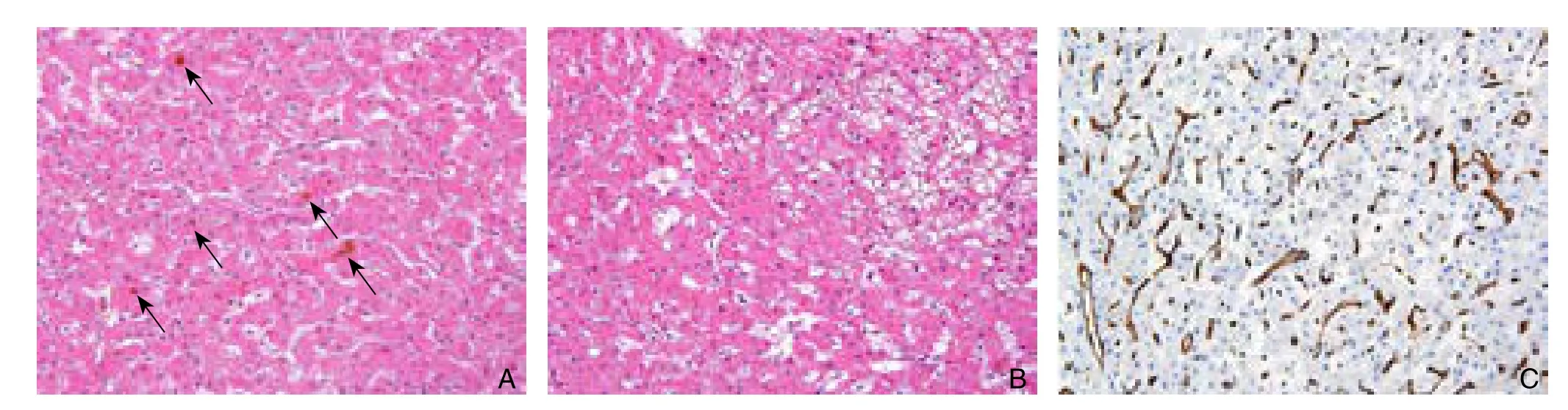
图3 病理组织学表现 A:肿瘤组织内无正常肝小叶结构及门管区,瘤细胞呈梁索状排列,无肝细胞索样放射状结构,核无明显异型性,未见核分裂像,可见毛细胆管内胆汁淤积(箭头)(HE×200); B:可见细胞水肿,气球样变(HE×200);C:免疫组化CD34染色示瘤组织内丰富的微血管(DAB×200)Figure 3 Histopathologic findings A: No normal hepatic lobule and portal area in the tumor tissue, funicular-like arrangement of the tumor cells without the radial pattern of hepatic cords, absence of mitotic figures, and cholestasis in the bile capillaries (shown arrows)(HE×200); B: Presence of cellular swelling and ballooning degeneration (HE×200); C: Immunohistochemical staining for CD34 showing abundant microvessels in the tumor (DAB×200)
2 文献回顾与讨论
2.1 HCA病因与基因分型
目前,关于HCA的发病原因尚不清楚。在欧美国家,HCA多发生于长期服用口服避孕药的育龄期年轻女性[3],男性和儿童中较为罕见,且绝经妇女极少发生HCA。在亚洲人群中,文献[4]报道的HCA女性发病者中多无口服避孕药史,且无明显性别差异。本例HCA患者为年轻女性,无口服避孕药史,与文献报道相符。还有研究[5]表明,体内雄激素或雌激素水平过高,都可增加发生HCA的风险。I型和III型糖原贮积症(glycogen storage diseases,GSD)均可导致糖原分解受损,肝细胞内糖原沉积过多,是HCA的易患因素[6]。I型GSD较III型GSD更易患HCA,且GSD患者中发生HCA的男性多于女性[7]。此外,肥胖及糖尿病、胰岛素抵抗和高脂血症等代谢性疾病也是HCA的易患因素[8]。另外,苯巴比妥、卡马西平及丙戊酸钠等抗癫痫药物的使用,可造成广泛性肝损伤,导致HCA的发生[9]。有小部分HCA来源于胚胎时期与正常肝组织几乎完全隔离的孤立的肝胚胎细胞团,多见于婴幼儿病例。
根据基因型/表型的特点,可将HCA分为4种不同的分子亚型[10-11],即HNF1A失活型腺瘤(hepatocyte nuclear factor 1α inactivated HCA,H-HCA)、β-catenin激活型腺瘤(β-catenin activated HCA,β-HCA)、炎症型腺瘤(inflammatory HCA,IHCA)及未分类型腺瘤(unclassified adenomas)。H-HCA是一组同源性肿瘤,占35%~40%,最常见于女性,与3型青少年发育期糖尿病有关,其组织学特征为显著的肝细胞脂肪变性,细胞无异型性,无炎症细胞浸润,无肝窦扩张充血。β-HCA多见于男性,占10%~15%,与雄激素治疗或GSD有关,多为单发结节,典型的组织学特征为细胞核异型性和腺泡状结构,常无脂肪变性和炎性细胞浸润,有时难与高分化肝细胞癌鉴别,并有恶性转化倾向[12]。IHCA几乎仅见于口服避孕药的年轻女性,占40%~50%,组织学特征包括炎性细胞浸润、肝窦扩张、紫癜、动脉增厚,可见胆道反应。未分类型腺瘤所占比例少于10%,无基因突变或炎性浸润,常作为排除诊断。
2.2 临床表现
HCA可发生于肝脏的任何部位,但以肝右叶多见,约70%~80%的患者为单发结节[13],多发性腺瘤一般认为与长期口服避孕药、I型GSD及肥胖有关[8]。本例HCA为肝右叶的孤立肿块。HCA属于良性肿瘤,生长缓慢,无特征性症状,临床表现随肿瘤发生部位、大小及有无并发症而不同。部分患者是在腹部影像学检查或手术探查时偶然发现。肿瘤较大时可发现上腹部包块,多无压痛。随肿瘤逐渐增大而压迫邻近脏器时可出现上腹部隐痛不适、进食饱胀、恶心等症状[14],甚至可因肿瘤压迫肝内胆道系统而出现黄疸。本例患者是因腹泻伴恶心干呕行腹部影像学检查而发现腹腔肿物。
HCA有破裂出血和癌变倾向。部分患者可并发瘤体内出血,表现为右上腹疼痛,伴发热、右上腹压痛等。一旦肿瘤破裂导致腹腔内出血时,表现为突发性上腹剧痛,伴恶心、呕吐、腹肌紧张等症状,严重时可导致失血性休克。HCA自发性破裂出血的发生率在20%~40%[15]。目前认为口服避孕药、妊娠、腺瘤>5cm、瘤内血管病变及腺瘤呈外生性生长等为出血危险因素[15]。HCA的癌变发生率在4%~10%,主要见于β-catenin基因突变的腺瘤,长期使用外源性雄激素治疗、男性患者、I型GSD与腺瘤>5cm等均是HCA癌变的危险因素[16]。
本病实验室检查多无异常发现,巨大腺瘤导致胆汁淤积可有血清γ-谷氨酰转移酶、碱性磷酸酶或总胆红素升高,肝脂肪变者可有转氨酶水平升高,C-反应蛋白、血清淀粉样蛋白A、纤维蛋白原升高多见于IHCA,血清AFP升高应高度怀疑是否发生癌变[7,13]。本例患者术前血清γ-谷氨酰转移酶700.00 U/L,考虑肿瘤较大导致胆汁淤积,并在组织病理检查中得到证实。
2.3 诊断与鉴别诊断
若发现患者有右上腹缓慢增大的包块,具有以上症状及体征,可考虑本病。若女性患者长期口服避孕药或男性患者有类固醇类激素治疗史出现上述临床症状时,则更应该考虑本病的可能。由于本病缺乏特异性临床表现,生化检查如肝功能多为正常或表现为轻度γ-谷氨酸转移酶或碱性磷酸酶升高,AFP阴性,通常难以早期发现。因此影像学检查对HCA的术前诊断有重要作用。本病CT平扫一般表现为略低密度或等密度类圆形占位性病变,边界清楚有包膜,瘤内陈旧性出血及坏死区为不规则更低密度影,合并新鲜出血时呈高密度影。CT增强扫描在动脉期即出现明显强化,而出血坏死区无强化,门静脉期强化减退,延迟期病灶呈等密度或稍低密度[17]。这与HCA主要由瘤周肝动脉供血及造影剂的排泄较慢有关。如果肿瘤发生明显脂肪变,则CT 平扫及增强扫描均表现为低密度病灶。HCA的MRI表现具有多样性,与其基因分型及病理学类型密切相关[18-19]。T1WI多呈等信号或稍高信号,T2WI多呈稍高信号或等信号。MRI增强扫描后动脉期呈明显强化或不均匀强化,门静脉期可持续强化或强化减退,延迟期多呈等信号或低信号。假包膜或包膜在延迟期出现强化。病理学特点为:肿瘤边界清楚有包膜,其内无正常肝小叶结构及门管区,瘤细胞与正常肝细胞相似,体积稍大,呈梁索状或片状排列,无肝细胞索样放射状结构,肿瘤细胞呈多角形,界限清楚,核圆形,大小比较一致,核无明显异型性。本例患者组织病理学改变与此基本符合。
HCA需与肝细胞癌、肝局灶性结节性增生、肝海绵状血管瘤及肝转移瘤等进行鉴别[17,20]。⑴ 肝细胞癌:多有肝硬化、慢性肝炎病史,一般情况较差,肝功能指标异常,AFP较高,CT平扫呈低密度,癌灶内见不规则更低密度区,CT增强扫描动脉期呈快速不均匀强化,静脉期造影剂迅速消退,为“快进快出”表现。病理表现与分化程度相关,癌细胞排列成不规则的梁索状或呈腺泡样结构,细胞体积明显增大,具有异型性,癌梁索间可见毛细血管扩张。⑵ 肝局灶性结节增生:一般无肝炎病史,临床表现与HCA相似。CT平扫为等密度或稍低密度,增强扫描的动脉期强化明显,而瘢痕组织不强化,静脉期呈等密度,延迟期呈略低密度,而中心瘢痕组织在延迟期明显强化。在T1WI上呈均匀等信号或稍低信号,T2WI上呈均匀等信号或稍高信号,中央瘢痕组织T1WI呈低信号,在T2WI及PDWI呈高信号,MRI增强扫描强化模式与CT增强相似。典型的病理表现为肿块边界清楚无包膜,有特征性的中央星形瘢痕伴放射样纤维分隔,可有明显的小胆管增生和炎性细胞浸润。⑶ 肝海绵状血管瘤:CT平扫低密度,动脉期病灶由周边强化,静脉期强化向中心扩展,延迟期为等密度,呈典型的“快进慢出”表现。T1WI多呈均匀的低信号,T2WI为高信号,呈“灯泡征”。病理检查瘤内可见大小不等血窦,血窦明显扩张淤血,可有血栓形成,瘤周肝组织内可有肝索萎缩或消失。⑷ 肝转移瘤:多有原发病史,常为多发。CT平扫呈低密度,增强扫描动脉期边缘可出现环状或结节状强化,门静脉期呈均匀或不均匀增强,延迟期强化减退,典型者表现为“牛眼征”。T1WI多为低信号,T2WI多为高信号,有的瘤灶中央可见T1WI低信号、T2WI高信号的小圆形,成为“靶征”。
2.4 治疗方式
由于HCA术前难以确诊,且肿瘤有自发破裂、出血甚至恶变的倾向,国内多主张对于肝脏占位性病变怀疑HCA者,只要无手术禁忌证,应积极手术探查,大多数病例可得到手术完全切除[21-22]。根据肿瘤数目、大小及位置等具体情况而采取相应的肝切除术[23]。由于肿瘤未被完整切除时术后易复发,因此主张一并切除肿瘤周围部分正常肝组织,并在术后定期随访和复查[24]。在腹腔镜下行肝切除具有创伤小、术后恢复快,住院时间短等优势,有临床研究[25]表明,直径<10cm的非出血性孤立性HCA行腹腔镜手术安全可行。本例患者术前影像学检查提示肝脏肿块>10cm,且患者有压迫症状,予以剖腹探查并完整切除肿瘤,患者术后恢复良好。肿瘤破裂出血时,如条件许可,可急诊手术一期切除肿瘤。如患者血流动力学不稳定而不能耐受全麻手术或肿瘤的解剖位置有切除困难者,可先行选择性动脉栓塞止血,待二期手术切除[26]。对于无法切除的巨大腺瘤者或弥漫多发性HCA可行肝动脉结扎术或肝动脉栓塞术,可抑制肿瘤的生长,减少出血风险,若有条件可行肝移植手术[27]。选择性肝动脉栓塞术还可用于缩小较大的肿瘤的体积,降低手术操作难度,减少手术风险,为手术完整切除提供条件。另外,也有研究[28]单独应用血管栓塞治疗HCA,可抑制肿瘤生长,甚至出现消退。射频消融术单独应用于直径<4cm的孤立性HCA也取得较好效果[29]。但两者的安全性与有效性尚待更多临床研究进一步证实。
综上所述,HCA是一种临床少见的良性肿瘤,无特异性临床表现,可并发破裂出血甚至癌变,依靠术前CT和MRI增强扫描能提高本病诊断率。积极的手术切除是HCA有效的治疗方式,且预后良好,术后应重视定期随访与复查。
[1] Dong Y, Zhu Z, Wang WP, et al. Ultrasound features of hepatocellular adenoma and the additional value of contrastenhanced ultrasound[J]. Hepatobiliary Pancreat Dis Int, 2016,15(1):48–54.
[2] Liau SS, Qureshi MS, Praseedom R, et al. Molecular pathogenesis of hepatic adenomas and its implications for surgical management[J]. J Gastrointest Surg, 2013, 17(10):1869–1882. doi:10.1007/s11605–013-2274–6.
[3] Dhingra S, Fiel MI. Update on the new classification of hepatic adenomas: clinical, molecular, and pathologic characteristics[J].Arch Pathol Lab Med, 2014, 138(8):1090–1097. doi: 10.5858/arpa.2013–0183-RA.
[4] Lin H, van Den Esschert J, Liu C, et al. Systematic review of hepatocellular adenoma in China and other regions[J]. J Gastroenterol Hepatol, 2011, 26(1):28–35. doi: 10.1111/j.1440–1746.2010.06502.x.
[5] Pais-Costa SR, Lima OA, Soares AF.Giant hepatic adenoma associated with anabolic-androgenic steroid abuse: case report[J].Arq Bras Cir Dig, 2012,25(3):180–182.
[6] Oterdoom LH, Verweij KE, Biermann K, et al. Hepatocellular Adenomas and Carcinoma in Asymptomatic, Non-Cirrhotic Type III Glycogen Storage Disease[J]. J Gastrointestin Liver Dis, 2015,24(4):515–518. doi: 10.15403/jgld.2014.1121.244.had.
[7] Vijay A, Elaffandi A, Khalaf H. Hepatocellular adenoma: an update[J]. World J Hepatol, 2015, 7(25):2603–2609. doi: 10.4254/wjh.v7.i25.2603.
[8] Bioulac-Sage P, Taouji S, Possenti L, et al. Hepatocellular adenoma subtypes: the impact of overweight and obesity[J]. Liver Int, 2012,32(8):1217–1221. doi: 10.1111/j.1478–3231.2012.02786.x.
[9] Lee PU, Roberts LR, Kaiya JK, et al. Hepatic adenomas associated with anti-epileptic drugs: a case series and imaging review[J].Abdom Imaging, 2010, 35(2):208–211. doi: 10.1007/s00261–009-9500–4.
[10] 张丽华, 徐佳佳. 肝细胞腺瘤的分子分型及临床意义[J]. 中华病理学杂志, 2014, 43(6):428–430. doi: 10.3760/cma.j.issn.0529–5807.2014.06.020.Zhang LH, Xu JJ. Molecular classification of hepatocellular adenoma and its clinical significance[J].Chinese Journal of Pathology, 2014, 43(6):428–430. doi: 10.3760/cma.j.issn.0529–5807.2014.06.020.
[11] Blanc JF, Frulio N, Chiche L, et al. Hepatocellular adenoma management: call for shared guidelines and multidisciplinary approach[J]. Clin Res Hepatol Gastroenterol,2015, 39(2):180–187.doi: 10.1016/j.clinre.2014.10.003.
[12] Fonseca S, Hoton D, Dardenne S, et al. Histological and immunohistochemical revision of hepatocellular adenomas:a learning experience[J]. Int J Hepatol, 2013:398308. doi:10.1155/2013/398308.
[13] Dokmak S, Paradis V, Vilgrain V, et al.A single-center surgical experience of 122 patients with single and multiple hepatocellular adenomas[J]. Gastroenterology, 2009, 137(5):1698–1705. doi:10.1053/j.gastro.2009.07.061.
[14] Dokmak S, Cauchy F, Belghiti J. Resection, transplantation and local regional therapies for liver adenomas[J]. Expert Rev Gastroenterol Hepatol, 2014, 8(7):803–810. doi: 10.1586/17474124.2014.917957.
[15] Bieze M, Phoa SS, Verheij J, et al. Risk factors for bleeding in hepatocellular adenoma[J]. Br J Surg, 2014, 101(7):847–855. doi:10.1002/bjs.9493.
[16] Stoot JH, Coelen RJ, De Jong MC, et al. Malignant transformation of hepatocellular adenomas into hepatocellular carcinomas: a systematic review including more than 1600 adenoma cases[J].HPB (Oxford), 2010, 12(8):509–522. doi: 10.1111/j.1477–2574.2010.00222.x.
[17] Marrero JA, Ahn J, Rajender Reddy K, et al. ACG clinical guideline: the diagnosis and management of focal liver lesions[J].Am J Gastroenterol, 2014, 109(9):1328–1347. doi: 10.1038/ajg.2014.213.
[18] Mcinnes MD, Hibbert RM, Inacio JR, et al. Focal Nodular Hyperplasia and Hepatocellular Adenoma: Accuracy of Gadoxetic Acid-enhanced MR Imaging--A Systematic Review[J]. Radiology,2015, 277(2):413–423. doi: 10.1148/radiol.2015142986.
[19] Grazioli L, Olivetti L, Mazza G, et al. MR Imaging of Hepatocellular Adenomas and Differential Diagnosis Dilemma[J].Int J Hepatol, 2013:374170. doi: 10.1155/2013/374170.
[20] Colombo M.Diagnosis of liver nodules within and outside screening programs[J]. Ann Hepatol, 2015,14(3):304–309.
[21] 邓雪松, 倪勇, 王成友, 等. 肝细胞腺瘤诊断与外科治疗的体会[J]. 肝胆外科杂志, 2014, 22(3):196–199.Deng XS, Ni Y, Wang CY, et al. Clinical experience in diagnosis and surgical treatment of hepatocelluar adenoma[J]. Journal of Hepatobiliary Surgery, 2014, 22(3):196–199.
[22] 杨维良, 张东伟, 张好刚, 等. 肝细胞腺瘤47例的诊断与外科治疗[J]. 中华普通外科杂志, 2011, 26(10):849–852. doi: 10.3760/cma.j.issn.1007–631X.2011.10.016.Yang WL, Zhang DW, Zhang HG, et al. Diagnosis and surgical treatment of hepatocellular adenoma[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2011, 26(10):849–852. doi: 10.3760/cma.j.issn.1007–631X.2011.10.016.
[23] Agrawal S, Agarwal S, Arnason T, et al. Management of Hepatocellular Adenoma: Recent Advances[J]. Clin Gastroenterol Hepatol, 2015, 13(7):1221–1230. doi: 10.1016/j.cgh.2014.05.023.
[24] 李权林, 彭勇, 李敬东. 肝腺瘤手术后再发原发性肝细胞癌1例[J].中国普通外科杂志, 2011, 20(2):215–216.Li QL, Peng Y, Li JD. Primary hepatocellular carcinoma after surgery for hepatic adenoma: a report of one case[J]. Chinese Journal of General Surgery, 2011, 20(2):215–216.
[25] De'angelis N, Memeo R, Calderaro J, et al.Open and laparoscopic resection of hepatocellular adenoma: trends over 23 years at a specialist hepatobiliary unit[J]. HPB (Oxford), 2014, 16(9):783–788. doi: 10.1111/hpb.12257.
[26] Huurman VA, Schaapherder AF. Management of ruptured hepatocellular adenoma[J]. Dig Surg, 2010, 27(1):56–60. doi:10.1159/000268427.
[27] Karkar AM, Tang LH, Kashikar ND, et al.Management of hepatocellular adenoma: comparison of resection, embolization and observation[J]. HPB (Oxford), 2013, 15(3):235–243. doi: 10.1111/j.1477–2574.2012.00584.x.
[28] Deodhar A, Brody LA, Covey AM, et al. Bland embolization in the treatment of hepatic adenomas: preliminary experience[J]. J Vasc Interv Radiol, 2011, 22(6):795–799. doi: 10.1016/j.jvir.2011.02.027.
[29] Van Vledder MG, Van Aalten SM, Terkivatan T, et al.Safety and efficacy of radiofrequency ablation for hepatocellular adenoma[J].J Vasc Interv Radiol, 2011, 22(6):787–793. doi: 10.1016/j.jvir.2011.02.024.
