超声引导下经皮射频消融与腹腔镜肝切除术治疗原发性小肝癌的对比研究
2017-03-29徐治军许戈良马金良荚卫东葛勇胜潘婷婷
徐治军,许戈良,马金良,荚卫东,葛勇胜,潘婷婷
(安徽医科大学附属省立医院 肝脏外科/肝胆胰外科安徽省重点实验室,安徽 合肥 230001)
近年来,原发性小肝癌发病率不断增加,成为我国主要的癌症相关死亡原因之一。随着影像学的发展,原发性小肝癌的诊断率逐年上升,为早期临床干预创造了条件[1]。但由于肝癌多发生在慢性肝炎、肝硬化基础上,多数患者确诊时伴有不同程度的肝功能损伤,肝功能储备能力较差,因此肝癌的治疗既要彻底去除病灶,又要最大程度地减小创伤[2-3],因此,微创手术治疗小肝癌得到了广泛应用,其中超声引导下经皮射频消融和腹腔镜肝切除术治疗原发性小肝癌的疗效得到认可。本文拟通过回顾性研究,比较超声引导下经皮射频消融与腹腔镜肝切除术治疗原发性小肝癌患者的临床疗效及预后。
1 资料与方法
1.1 一般资料
选取2012年1月—2015年6月在肝脏外科接受超声引导下经皮射频消融治疗或腹腔镜肝切除术治疗的65例原发性小肝癌患者作为研究对象。其中男52例,女13例;年龄36~85岁,平均(55.11±11.40)岁。所有患者术前均签署知情同意书。纳入标准:⑴ 经术前穿刺或术后病理学检查证实为肝细胞性肝癌;⑵ 肿瘤最大直径≤3.0cm,肿瘤数目≤2个,影像学检查未发现血管侵犯及肝外转移,未发现周围脏器侵犯;⑶ 初次诊断为原发性肝癌,未行其他治疗,未同时合并其他脏器恶性肿瘤;⑷ 肝功能为Child-Pugh A级或B级。排除标准:⑴ 近期有上消化道出血病史或顽固性腹水者;⑵ 心肺或其他系统严重功能障碍,不能耐受手术者;⑶ 因病情中转开腹手术者。所有患者接受超声引导下经皮射频消融术或者腹腔镜肝切除术,其中,消融组35例,男27例,女性8例;腔镜组30例,男25例,女5例。
1.2 方法
1.2.1消融组 取平卧位或右背部垫高位,常规消毒铺巾,局部浸润麻醉或联合静脉麻醉后在超声穿刺探头引导下将射频消融针准确地导入肿瘤中央,设定适当的射频电压和时间,确定无误后开始消融治疗。因射频消融单针单点最大有效范围约3~5cm,为达到根治目的,消融范围要求超过肿瘤边缘1cm左右。所以,对肿瘤直径≤2cm的病灶采用一点两处消融方法,直径>2cm的病灶采用多点多针消融方法。若治疗后复查B超提示肿瘤完全消融,改凝固模式,烧灼针道,防止针道出血,结束操作。若肿瘤消融不全,则继续消融治疗。术后肿瘤在B超下呈高回声改变,范围超过术前肿瘤边缘。
1.2.2腔镜组 术前准备同消融组。全麻后脐下切开1cm切口,穿刺气腹针建立气腹后,经此穿刺置入1cm的Trocar,放置腹腔镜镜头探查腹腔。根据肿瘤的具体位置,确定其他操作Trocar位置,放置腹腔镜器械,用超声刀离断肝脏周围韧带,充分游离肝脏。在距肿瘤2cm肝表面处用电刀确定切除线,用超声刀行肝段切除或肝叶切除。遇到较大血管,用钛夹夹闭,肝断面渗血予以双极电凝止血。置入标本袋,将肿瘤放入标本袋内。拔除脐下腹腔镜器械,延长切口,将标本袋连同肿瘤完整取出。腔镜组具体手术方式可分为腹腔镜精准肝段切除术(15例),腹腔镜解剖型肝叶切除术(13例),腹腔镜精准肝段切除+胆囊切除术(2例)。
1.3 术后随访
消融组术后1个月门诊复查常规B超、上腹部增强CT或超声造影检查及血清肿瘤标志物,判断肿瘤是否消融完全及评价治疗效果。增强CT提示消融病灶无强化,超声造影提示病灶无造影剂充填,判断为肿瘤完全消融。若肿瘤消融不全,则再次入院行射频消融治疗。以后每3~6个月行常规B超及血清肿瘤标志物检查。若常规B超提示可疑病灶或血清肿瘤标志物再次短期升高,则进一步完善增强CT、MR或超声造影检查,明确诊断。若原射频消融病灶增大或病灶边缘出现新发肿瘤,定义为局部复发;若肝内其他部位出现新发肿瘤,定义为远处复发。腔镜组术后随访方法同消融组。若手术切缘出现新发肿瘤,则为局部复发;若肝内其他部位出现新发肿瘤,则为远处复发。随访截止日期为2016年6月30日或患者随访过程中发生死亡、失访。
1.4 统计学处理
资料使用SPSS 17.0统计分析软件,计量资料用均数±标准差(±s)表示,两组间计量资料比较使用t检验,计数资料使用χ2检验,生存分析采用Kaplan-Meier法,并用Log-rank法比较组间差异,多因素分析采用Cox比例风险回归模型。P<0.05判断为差异有统计学意义。
2 结 果
2.1 两组患者一般资料的比较
两组患者在年龄、性别、乙肝并(或)丙肝感染情况、肝功能Child-Pugh分级、病灶直径、术前血清AFP水平、肿瘤分化程度等一般资料上比较,差异无统计学意义(均P>0.05),具有可比性(表1)。
2.2 两组术中指标及术后情况的比较
两组患者手术均顺利完成,围手术期无如急性肝功能衰竭,术中或术后大出血等严重并发症。消融组手术时间为(53.89±16.25)min,术中出血量(7.29±2.80)mL;腔镜组手术时间为(128.57±39.12)min,术中出血量(115.33±68.77)mL。消融组在手术时间与术中出血量明显优于腔镜组,差异均有统计学意义(均P<0.05)。消融组和腔镜组术后住院时间分别为(1.86±0.81)d、(5.50±1.55)d;住院总费用分别为(1.73±0.87)万元、(2.23±0.15)万元;两组术后住院时间、总费用比较,差异均有统计学意义(均P<0.05)。消融组术后并发症包括胸腔积液2例,发热3例。腔镜组术后并发症包括胸腔积液4例,肺部感染1例,发热3例。消融组和腔镜组并发症总发生率分别为14%和27%。两组术后肝功能(ALT、AST、TBIL、PT)的变化及并发症的发生率差异均无统计学意义(均P>0.05)(表2)。
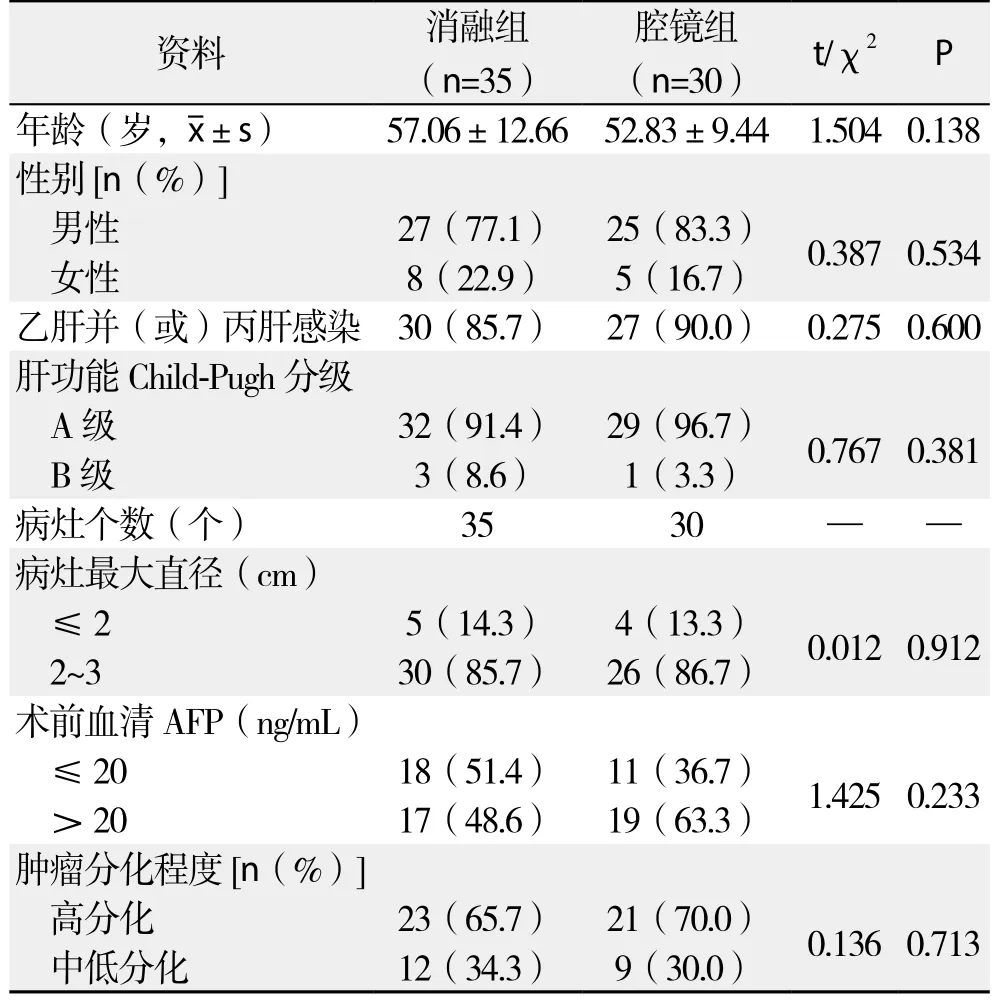
表1 两组患者一般资料的比较Table 1 Comparison of the general data between the two groups
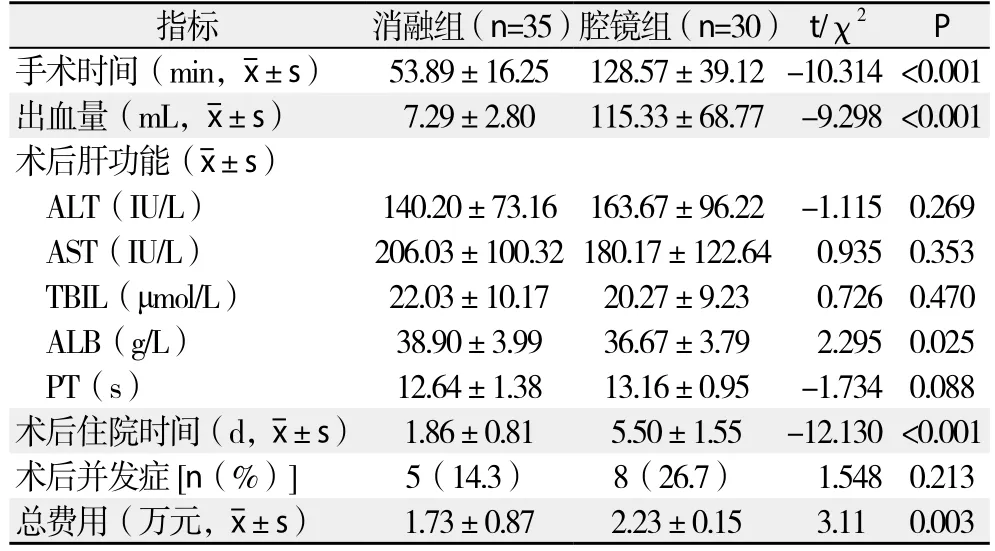
表2 两组术中指标及术后情况的比较Table 2 Comparison of the intraoperative variables and postoperative conditions between the two groups
2.3 两组病灶根治和复发情况
术后1个月门诊复查,消融组35例患者中1例患者肝癌病灶局部残留,根治率97%;腔镜组30例患者共30个病灶,无肿瘤残留,根治率100.0%;两组根治率比较,差异无统计学意义(P=0.351)。到随访结束,消融组18例复发,其中包括12例局部复发,5例远处复发,1例网膜转移。腔镜组12例复发,7例局部复发,3例远处复发,1例网膜转移,1例骨转移。消融组和腔镜组复发率分别为51.4%和40.0%,两组比较差异无统计学意义(P=0.357)(表3)。
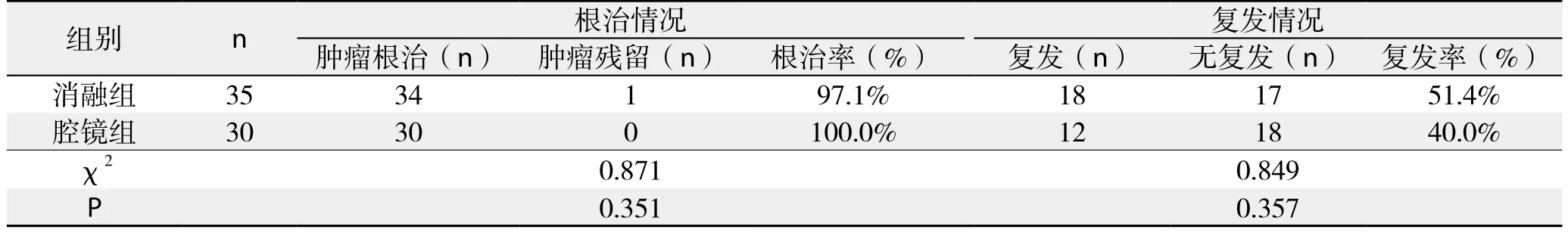
表3 两组根治和复发情况比较Table 3 The radical rates and recurrence rates of the two groups
2.4 两组患者生存分析比较
患者平均随访时间为28.1(28.3~50.5)个月。消融组平均生存时间43.5个月(95% CI= 34.9~52.1个月);腔镜组平均生存时间46.5个月(95% CI=38.6~54.4个月)。消融组和腔镜组1、2、3年无瘤生存率分别为74.3%、62.9%、37.1%和76.7%、66.7%、40.0%;1、2、3年总生存率分别为85.7%、82.9%、77.1%和86.7%、83.3%、80.0%。使用Log-rank检验,比较两组1、2、3年无瘤生存率,差异无统计学意义(χ2=2.922,P=0.087);比较1、2、3年总生存率,差异无统计学意义(χ2=0.193,P=0.660)(图1)。单因素分析表明,肝癌患者的总生存率与AFP是否≥20 ng/mL、肿瘤是否多发、血管有无侵犯有关(均P<0.05);肝癌患者的无瘤生存率与肿瘤是否多发、血管有无侵犯、包膜是否完整有关(均P<0.05)(表4)。多因素分析表明,AFP≥20 ng/mL、肿瘤多发、血管侵犯是影响肝癌患者总生存率的独立危险因素,而肿瘤包膜不完整、血管侵犯、肿瘤多发是影响无瘤生存率的独立危险因素(均P<0.05)(表5)。
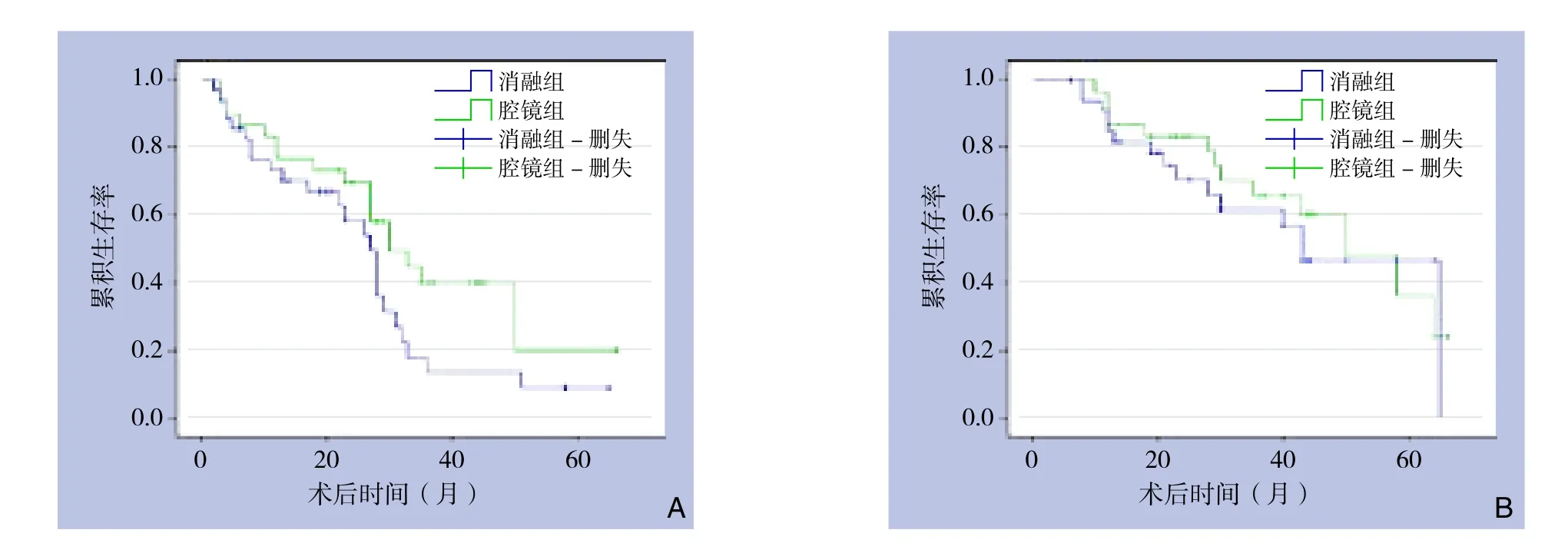
图1 两组患者生存率比较 A:无瘤生存曲线;B:总生存曲线Figure 1 Comparison of postoperative survival rates between the two groups A: Disease-free survival curves; B: Overall survival curves
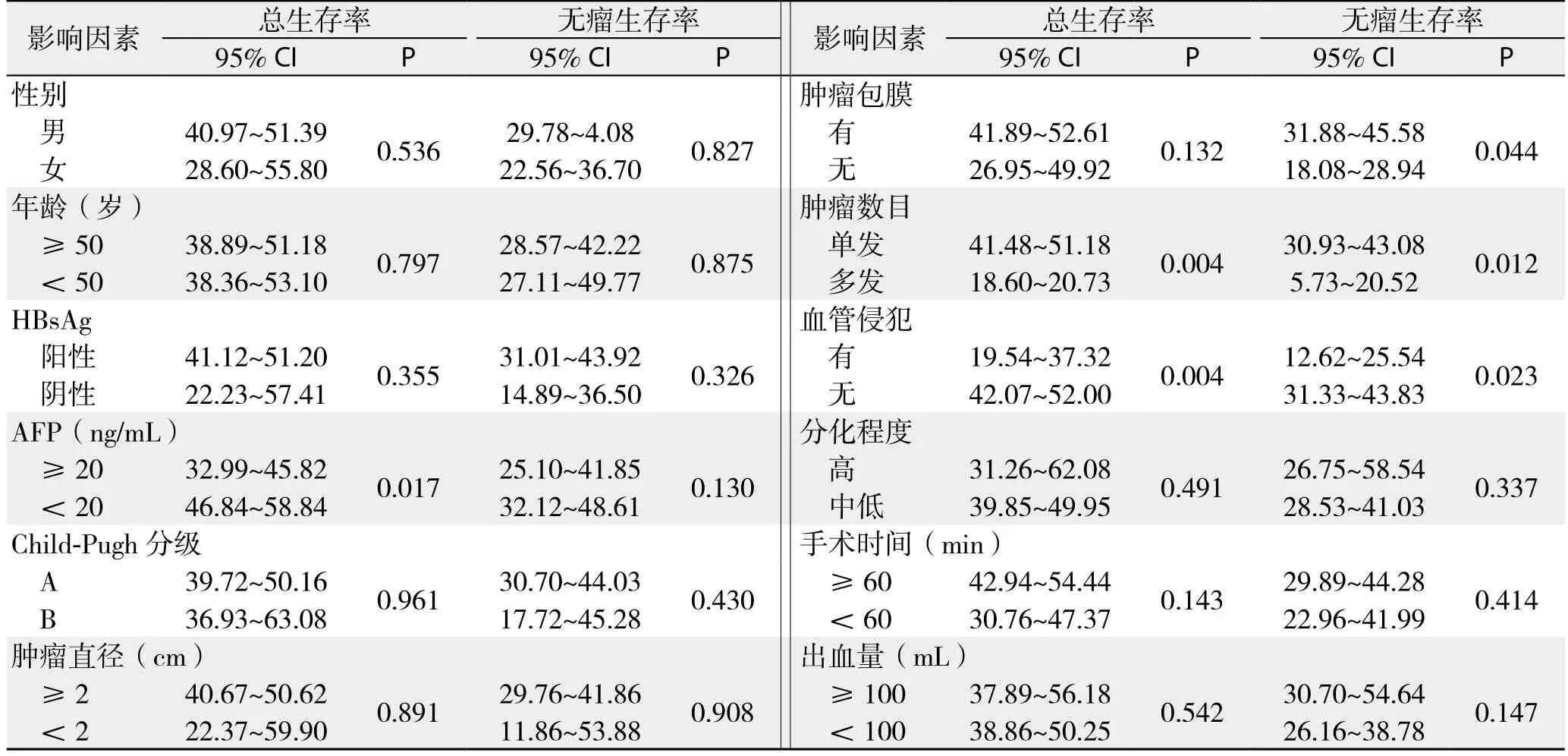
表4 影响小肝癌患者预后因素的单变量分析Table 4 Univariate analysis of factors for prognosis of patients with small primary liver cancer
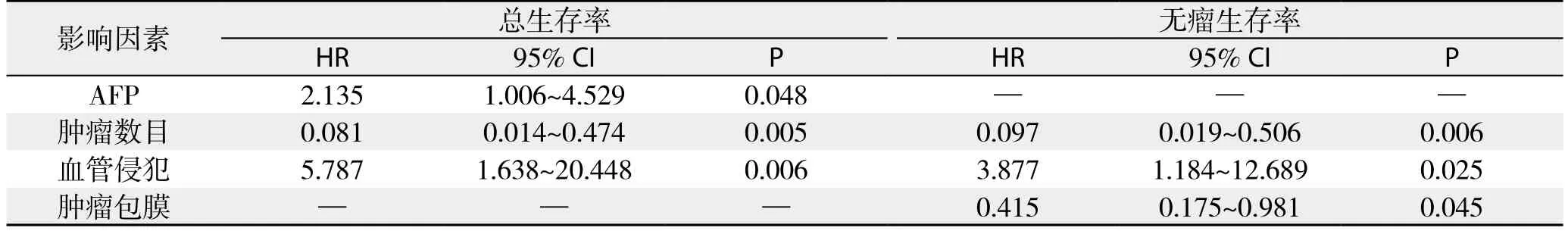
表5 影响小肝癌患者预后因素的多变量分析Table 5 Multivariate analysis of factors for prognosis of patients with small primary liver cancer
3 讨 论
目前,肝脏外科的特点是精准、微创、有效[4-5]。随着射频消融技术和腹腔镜技术的不断完善,超声引导下经皮射频消融和腹腔镜肝切除术已成为原发性小肝癌公认的两种微创治疗方法。相比于传统开腹肝切除术,腹腔镜肝切除术不仅具有微创、出血少、恢复快等优点,而且还能获得与开腹肝切除术相近的总生存率和无瘤生存率[6]。同时肝癌的非手术治疗,如超声引导下经皮射频消融,已成为临床应用最多的局部治疗方法。研究[7-9]表明,射频消融治疗直径≤5cm的单发肝癌,其疗效与开腹手术切除相一致,可达到根治性治疗,其操作方便、重复性强、对肝功能损伤小。但是,腹腔镜肝切除术与超声引导下经皮射频消融治疗原发性小肝癌(直径≤3cm)疗效的比较鲜有报道。
射频消融依赖于电极针高频交流电,导致组织摩擦加热,使局部组织温度达60~100℃,肿瘤组织及周围实质组织发生凝固性坏死,从而毁损一定范围的病灶达到根治目的,射频消融单次最大毁损范围约3~5cm[10]。近年来,射频消融治疗原发性小肝癌的疗效已经得到公认。对于单发直径≤5cm或直径≤3cm数目≤3个肝癌,射频消融与手术切除术相比,1、2、3年生存率和复发率无显著差异;对于直径≤3cm肝癌,射频消融疗效优于手术切除[11-12]。本研究中,两组1、2、3年无瘤生存率和总生存率比较差异均无统计学意义,与文献报道一致。说明原发性小肝癌超声引导下经皮射频消融可以获得与腹腔镜肝切除相媲美的疗效。
另外,我们在临床实践中发现,肿瘤位于肝脏表面或近血管,较容易行腹腔镜肝切除术。因为射频消融在近血管的肿瘤治疗过程中,穿刺操作及微波高热都可能增加血管损伤的风险;而位于肝脏表面的肿瘤,为避免损伤周围脏器,进针时要与周围脏器保持一定距离,容易造成针道偏离,进针准确性下降,可能导致肿瘤局部残留,故此时采用腹腔镜肝切除具有良好的可视性,较为有效和安全[13-14]。然而肿瘤位于肝实质中央时,行肝切除手术常需破坏更多正常肝组织,加重肝功能损伤,此时射频消融比腹腔镜肝切除术更微创、有效,可作为首选治疗方法[15]。但应用射频消融治疗近血管或肝脏表面的肿瘤是否安全有效的研究观点不尽相同。有文献[16]指出,对于临近大血管的肿瘤,由于血流量大,可以带走血管周围大量热量,避免血管壁受到剧烈热损伤,只要准确控制针尖位置及消融范围,射频消融对近血管的肿瘤同样是一种安全、有效的方法;而对于肝脏表面的病灶,有文献[17]报道,可以借助人工胸水或腹水的方法解决超声显影不清楚及术中损伤临近脏器的问题。
本研究中射频消融组35例患者中有1例局部残留患者可能与病灶位于近膈顶部,手术过程中进针难度大,准确性差,导致消融没有达到根治标准。该患者再次入院行腹腔镜辅助射频消融,术后复查肿瘤无残留。可见腹腔镜辅助射频消融由于良好的可视性,以及结合了腹腔镜技术和消融技术的优点,不仅可以术中及时发现出血或胆瘘等并发症,而且通过组织游离与隔离使特殊位置的肿瘤,如邻近胆囊、尾状叶肿瘤,实现肝癌的一次性完全消融[18-19]。但也有文献[20]报道,单用经皮超声引导下射频消融治疗特殊位置的肝癌也能取得不错的效果,可见射频消融治疗小肝癌的疗效不一定受肿瘤位置的影响。
综上所述,超声引导下经皮射频消融治疗原发性小肝癌安全可行,与腹腔镜肝切除术疗效相似,但其创伤更小、手术时间短、术中出血量少、术后住院时间短、花费低等优点,可作为原发性小肝癌治疗方式之一。随着射频消融技术的发展,使得特殊位置的肝癌实现一次性完全消融,可部分替代手术切除,但其疗效仍需进一步研究。
[1] 吴秀栓, 李建生, 许戈良, 等. 超声造影对早期肝细胞癌的诊断价值[J]. 肝胆外科杂志, 2011, 19(4):261–264. doi: 10.3969/j.issn.1006–4761.2011.04.008.Wu XS, Li JS, Xu GL, et al. The clinical value of contrast-enhanced ultrasonography in diagnosing primary hepatocellular carcinoma[J].Journal of Hepatobiliary Surgery, 2011, 19(4):261–264. doi:10.3969/j.issn.1006–4761.2011.04.008.
[2] 王艳红. 肝癌的综合治疗之我见[J]. 中华临床医师杂志杂志: 电子版, 2015, 9(19):3488–3493. doi: 10.3877/cma.j.issn.1674–0785.2015.19.002.Wang YH. Comprehensive treatment of liver cancer[J]. Chinese Journal of Clinicians: Electronic Edition, 2015, 9(19):3488–3493.doi: 10.3877/cma.j.issn.1674–0785.2015.19.002.
[3] 董家鸿, 杨世忠. 精准肝切除的技术特征与临床应用[J]. 中国实用外科杂志, 2010, 30(8):638–640.Dong JH, Yang SZ. Technical characteristics and clinical application of precision liver resection[J]. Chinese Journal of Practical Surgery,2010, 30(8):638–640.
[4] 荚卫东. 精准肝切除治疗肝细胞癌关键技术[J]. 中国普通外科杂志, 2014, 23(1):1–5. doi: 10.7659/j.issn.1005–6947.2014.01.001.Jia WD. Key techniques in precise hepatectomy for hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2014, 23(1):1–5.doi: 10.7659/j.issn.1005–6947.2014.01.001.
[5] 许戈良. 精细肝脏外科的发展[J]. 国际外科学杂志, 2008,35(2):73–75.doi: 10.3760/cma.j.issn.1673–4203.2008.02.001.Xu GL. Development of precise liver surgery[J]. International Journal of Surgery, 2008, 35(2):73–75.doi: 10.3760/cma.j.issn.1673–4203.2008.02.001.
[6] Cheung TT, Poon RT, Yuen WK, et al. Long-term survival analysis of pure laparoscopic versus open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: a single-center experience[J]. Ann Surg, 2013, 257(3):506–511. doi: 10.1097/SLA.0b013e31827b947a.
[7] 彭振维, 徐立, 陈敏山, 等. 原位射频消融与手术治疗小肝癌对比研究[J]. 中国实用外科杂志, 2008, 28(8):633–636.Peng ZW, Xu L, Chen MS, et al. Percutaneous radiofrequency ablation and surgical resection for small hepatocellular carcinoma:a comparative study[J]. Chinese Journal of Practical Surgery, 2008,28(8):633–636.
[8] 周铁, 仇毓东, 孔文韬, 等. 小肝癌射频消融与手术切除的疗效分析[J]. 肝胆外科杂志, 2007, 15(6):424–427. doi: 10.3969/j.issn.1006–4761.2007.06.010.Zhou T, Qiu TD, Kong WT, et al. Comparing the effect of radiofrequency ablation and surgical resection for the treatment of small hepatocellular[J]. Journal of Hepatobiliary Surgery, 2007,15(6):424–427. doi: 10.3969/j.issn.1006–4761.2007.06.010.
[9] 曾鹏, 周乐杜, 王栋, 等. 射频消融治疗小肝癌疗效及预后因素分析[J]. 中国普通外科杂志, 2014, 23(7):904–909. doi: 10.7659/j.issn.1005–6947.2014.07.008.Zeng P, Zhou LD, Wang D, et al. Radiofrequency ablation for small hepatocellular carcinoma: efficacy and prognostic factors[J].Chinese Journal of General Surgery, 2014, 23(7):904–909. doi:10.7659/j.issn.1005–6947.2014.07.008.
[10] 葛勇胜, 马金良, 荚卫东, 等. 射频消融治疗肝癌的近期疗效评价(附38例报告)[J]. 肝胆外科杂志, 2010, 18(4):265–267. doi:10.3969/j.issn.1006–4761.2010.04.009.Ge SY, Ma JL, Jia WD, et al. The short-term effect observation of liver cancer with radio-frequency ablation (report of 38 cases)[J]. Journal of Hepatobiliary Surgery, 2010, 18(4):265–267. doi:10.3969/j.issn.1006–4761.2010.04.009.
[11] 陈敏山, 李锦清, 梁惠宏, 等. 经皮射频消融与手术切除治疗小肝癌的疗效比较[J]. 中华医学杂志, 2005, 85(2):80–83. doi: 10.3760/j:issn:0376–2491.2005.02.003.Chen MS, Li JQ, Liang HH, et al. Comparison of effects of percutaneous radiofrequency ablation and surgical resection on small hepatocellular carcinoma[J]. National Medical Journal of China,2005, 85(2):80–83. doi: 10.3760/j:issn:0376–2491.2005.02.003.
[12] Lai C, Jin RA, Liang X, et al. Comparison of laparoscopic hepatectomy, percutaneous radiofrequency ablation and open hepatectomy in the treatment of small hepatocellular carcinoma[J].Journal of Zhejiang University Science B: Biomedicine &Biotechnology, 2016, 17(3):236–246.
[13] Mulier S, Ni Y, Jamart J, et al. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contributing factors[J]. Ann Surg, 2005, 242(2):158–171.
[14] 杨涛, 杜锡林, 谭凯, 等. 腹腔镜辅助下微波固化术治疗特殊部位肝癌的临床体会[J]. 现代肿瘤医学, 2014, 22(11):2636–2638. doi:10.3969/j.issn.1672–4992.2014.11.35.Yang T, Du XL, Tan K, et al. Clinical experience of laparoscopic microwave coagulation in treatment for special site liver cancer[J].Journal of Modern Oncology, 2014, 22(11):2636–2638. doi:10.3969/j.issn.1672–4992.2014.11.35
[15] Zhang YJ, Chen MS. Role of radiofrequency ablation in the treatment of small hepatocellular carcinoma[J]. World J Hepatol,2010, 2(4):146–150. doi: 10.4254/wjh.v2.i4.146.
[16] 马宽生, 黄建生, 丁钧, 等. 12例肝内邻近大血管肿瘤的射频消融治疗报道[J]. 重庆医学, 2005, 34(11):1681–1682. doi: 10.3969/j.issn.1671–8348.2005.11.040.Ma KS, Huang JS, Ding J, et al. Treatment of Liver Tumor nearby Major Vessel with Radiofrequency Ablation-12 cases reports[J].Chongqing Medical Journal, 2005, 34(11):1681–1682. doi: 10.3969/j.issn.1671–8348.2005.11.040.
[17] Zhang M, Liang P, Cheng ZG, et al. Efficacy and safety of artificial ascites in assisting percutaneous microwave ablation of hepatic tumours adjacent to the gastrointestinal tract[J]. Int J Hyperthermia,2014, 30(2):134–141. doi: 10.3109/02656736.2014.891765.
[18] Simo KA, Sereika SE, Newton KN, et al. Laparoscopic-assisted microwave ablation for hepatocellular carcinoma: safety and efficacy in comparison with radiofrequency ablation[J]. J Surg Oncol, 2011, 104(7):822–829. doi: 10.1002/jso.21933.
[19] 马仁, 王文跃, 彭维朝, 等. 腹腔镜下射频消融治疗肝细胞肝癌[J].中华普通外科杂志, 2011, 26(11):943–946. doi: 10.3760/cma.j.issn.1007–631X.2011.11.018.Ma R, Wang WY, Peng WC, et al. Laparoscopic radiofrequency ablation for the treatment of hepatocellular carcinoma[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2011, 26(11):943–946. doi: 10.3760/cma.j.issn.1007–631X.2011.11.018.
[20] Hyun D, Cho SK, Shin SW, et al. Treatment of Small Hepatocellular Carcinoma (≤2cm) in the Caudate Lobe with Sequential Transcatheter Arterial Chemoembolization and Radiofrequency Ablation [J]. Cardiovasc Intervent Radiol, 2016, 39(7):1015–1022.doi: 10.1007/s00270–016-1314–5.
