实时超声导航下解剖性肝段切除在原发性肝癌治疗中的应用及疗效分析
2017-03-29周超毅马金良荚卫东余继海张传海刘文斌李国芹
周超毅,马金良,荚卫东,余继海,张传海,刘文斌,李国芹
(安徽医科大学附属省立医院 肝脏外科/肝胆胰外科安徽省重点实验室,安徽 合肥 230001)
原发性肝细胞癌(hepatocellular carcinoma,HCC,简称肝癌)现已成为世界上最常见的恶性肿瘤之一,位列世界癌症死亡原因的第3位,而在我国恶性肿瘤病死率中位居第二,在主要的几大癌症中,例如胃癌、肺癌、肝癌等中,肝癌的5年生存率最低,仅为5%~6%[1-2]。而目前肝切除术仍是作为治疗肝癌的首选方案和最有效的方法[3]。随着科学技术的不断发展,肝切除技术也在不断更新与完善,对手术的要求也从过去片面的强调彻底清除病灶转向“最小创伤侵袭、最大脏器保护和最佳康复效果”的多维度综合考量,由传统经验外科模式向现代精准外科模式转变[4]。本研究对超声导航下的解剖性肝段切除和非解剖性肝段切除的患者各30例的手术所用时间、出血量、输血率、肝门阻断率、并发症发生率及术后肝癌的复发率、存活率等临床资料进行对比观察、随访,探讨超声导航下的解剖性肝段切除在肝癌治疗中的应用价值,取得效果,报告如下。
1 资料与方法
1.1 一般资料
统计2014年6月—2015年6月安徽医科大学附属安徽省立医院原发性肝癌患者的临床资料共60例,术前增强CT、MRI等影像学上提示肝癌,肿瘤单发,包膜完整且无血管、脉管、肝内、远处转移;术后病理确诊为原发性肝细胞癌,无血管侵犯、脉管癌栓、淋巴侵犯。术前完善心电图、胸片、心、肺功能、B超等,确认心、肺功能正常并掌握肝脏解剖、血管及胆管变异及其与肿瘤的毗邻关系,对患者肝脏及全身情况进行精确评估,明确无手术禁忌,胆红素及血清蛋白水平等均处于正常范围,若肝功能受损者应先行保肝治疗,达到术前肝功能Child-Pugh评级为A/B级。其中采用术中超声引导下的解剖性肝段切除患者30例,其中男22例,女8例;年龄44~70岁,平均年龄(54.97±12.66)岁;肿瘤直径分布3~9.5cm,平均直径(5.27±1.61)cm;肿瘤位于肝SIV段2例,SV段9例,SVI段11例,SVII段5例,SVIII段3例。非解剖性肝段切除患者30例,其中男20例,女10例;年龄24~77岁,平均年龄(56.13±8.41)岁;肿瘤直径2~10.5cm,平均直径(5.45±2.60)cm;肿瘤位于肝SIV段3例,SV段9例,SVI段8例,SVII段6例,SVIII段4例。两组患者的术前指标:性别、年龄、肿瘤直径、术前AFP、是否合并肝硬化等临床资料差异均无统计学意义(均P>0.05);而在切除肝段分布上,两组间差异也无统计学意义(Fisher精确概率法,P=0.919),故两组患者术前一般资料具有可比性(表1)。
1.2 方法
1.2.1手术方法 ⑴ 术中实时超声导航的解剖性肝段切除:常规术前准备后,取平卧位,麻醉成功后取右侧肋缘下斜切口或反“L”型切口,切断肝圆韧带、镰状韧带、冠状韧带、左右三角韧带,充分游离肝脏,显露肝十二指肠韧带和Winslow孔,行Pringle法肝十二指肠韧带预置第一肝门阻断带,以备术中出血控制不满意行第一肝门阻断。肝脏游离成功后,术中使用术中彩超探头,定位肿瘤的位置,局限于预定切除的肝段后,从第二肝门根部自上而下进行扫描探查,明确肝静脉及其分支和走行,从第一肝门探查供应肿瘤血管的门静脉及分支和走行,明确肿瘤与门静脉、肝静脉的立体关系,并和术前影像结果进行精确对比,确定染色的门静脉分支的直径和进针角度。选择20 G穿刺针(自制),在术中超声引导下实行穿刺染色,首先向选定的门静脉注入稀释肝素5 mL,达到抗凝作用,后注入美兰(亚甲蓝注射液,江苏济川制药有限公司,江苏省泰兴市大庆西路宝塔湾)4~6 mL,注射亚甲蓝后可见肝脏表面清晰染色,沿染色区域标记切除线。在术中超声引导下沿标记线用超声刀联合钳夹法切除标记肝段,往往残肝创面可显露出染色的肝静脉的侧壁,可验证自己的染色结果。创面血管、胆管结扎缝扎,缝合肝创面,仔细检查腹腔内无出血及漏胆,清点器械敷料无误后,生理盐水冲洗腹腔,置引流管,逐层缝合关闭切口,行常规术后处理(图1)。⑵ 非解剖性肝段切除:常规术前准备,取平卧位麻醉成功后,取右侧肋缘下斜切口或反“L”型切口,游离周边韧带,充分游离肝脏,暴露病灶位置,行Pringle法预行血流阻断,以防止术中出血控制不满意而行第一肝门阻断,电刀确定切除线,切除范围超过肿瘤边缘2cm,超声刀联合钳夹切除肿瘤,创面血管、胆管结扎缝扎,缝合肝创面,仔细检查腹腔内无出血及漏胆,清点器械敷料无误后,生理盐水冲洗腹腔,置引流管,逐层缝合关闭切口,行常规术后处理。
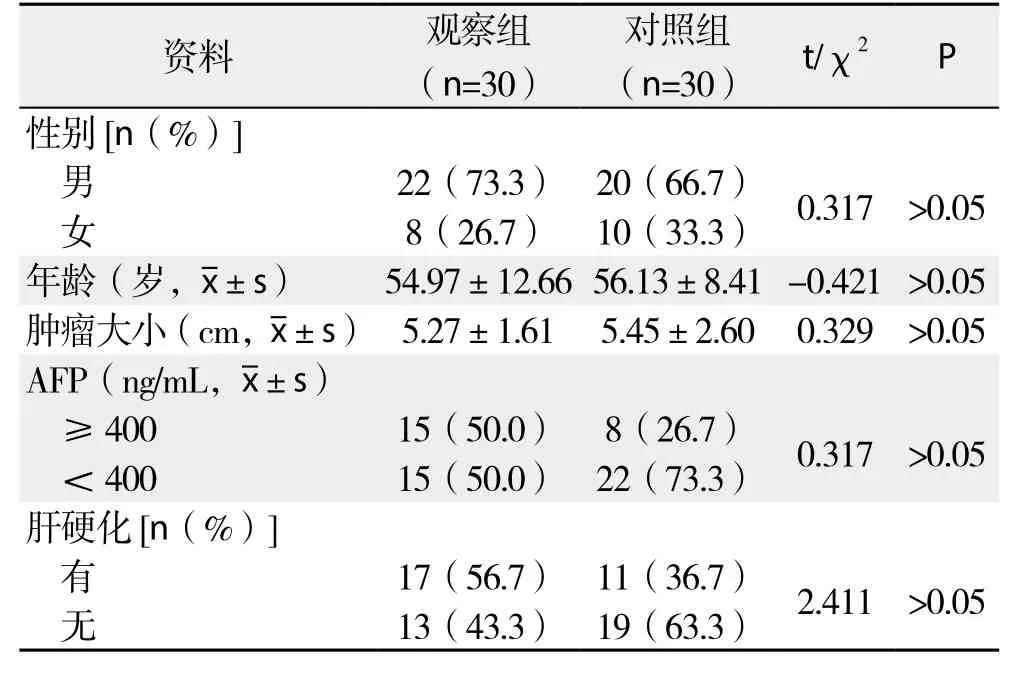
表1 观察组与对照组一般情况比较Table 1 Comparison of the general data between observation group and control group

图1 实时超声导航解剖性肝段切除 A:向选定门静脉注入亚甲蓝;B:术中彩超探头定位染色门静脉及确定进针角度;C:染色区域标记切除线;D:术中切除过程中染色的门静脉侧壁显露;E:切除后断面;F:手术切除标本Figure 1 Anatomic segmental hepatic resection under real-time ultrasound navigation A: Injection of methylene blue into the selected portal vein; B: Intraoperative location for the stained portal vein by ultrasound probe and ascertaining the puncture angle; C: Drawing the resection line along the stained area; D: Exposure of the side wall of the stained portal vein during surgical resection; E: Cutting surface after resection; F: Surgical specimen
1.2.2术后处理 两组患者给予行常规术后处理方法,给予行保肝、营养支持对症处理,鼓励患者术后第1天试饮水,第2天开始进流质,积极处理术后并发症。
1.2.3随访内容 术后1个月我科门诊随访,之后术后前6个月,每1个月随访1次,以后每3个月随访1次,随访至2016年6月底。随访的方式采用电话、邮件、门诊复查等。术后对两组患者定期行肿瘤标志物(AFP),肝功能指标,腹部B超,必要时行增强CT、MRI等检查。
1.2.4随访指标 比较肝癌患者应用超声导航的解剖性肝段切除与非解剖性肝段切除的预后结果,主要指标为两组手术所用时间、术中出血量、输血率、第一肝门阻断率、术后并发症发生率、术后肿瘤1年复发率、1年存活率。
1.3 统计学处理
应用SPSS 17.0软件进行统计学分析,两组计量资料使用t检验,分类资料使用χ2检验,必要时应用秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组手术相关指标比较
观察组较对照组手术时间有所延长[153.5(133.75~170.00)min vs. 128.5(103.75~150.00)min,P<0.05];两组术中出血量差异无统计学意义[175.0(100.00~200.00)mL vs.200.00(100.00~300.00)mL,P>0.05];观察组的输血率[10.0%(3/30)vs. 36.7%(11/30),P<0.05]及肝门阻断率[16.7%(5/30)vs. 40.0%(12/30),P<0.05]均低于对照组(表2)。
2.2 并发症处理及两组并发症发生率比较
观察组患者术后出现并发症4例,其中胸腔积液2例,胸腔积液合并中等量以上腹水2例;对照组患者术后出现并发症10例,其中胆瘘1例,胸腔积液5例,胸腔积液合并中等量以上腹水4例,均支持利尿或穿刺引流后痊愈。两组并发症发生率比较,差异无统计学意义[13.3%(4/30)vs.33.3%(10/30),P>0.05]。两组均无术后大出血、肝肾功能衰竭等发生,无围手术期死亡病例(表2)。
2.3 两组1年复发率及存活率比较
观察组的1年复发率16.7%(5/30)低于对照组的43.3%(13/30);观察组1年存活率80.0%(24/30)高于对照组的53.3%(16/30);两项指标组间比较,差异均有统计学意义(P<0.05)(表2)。
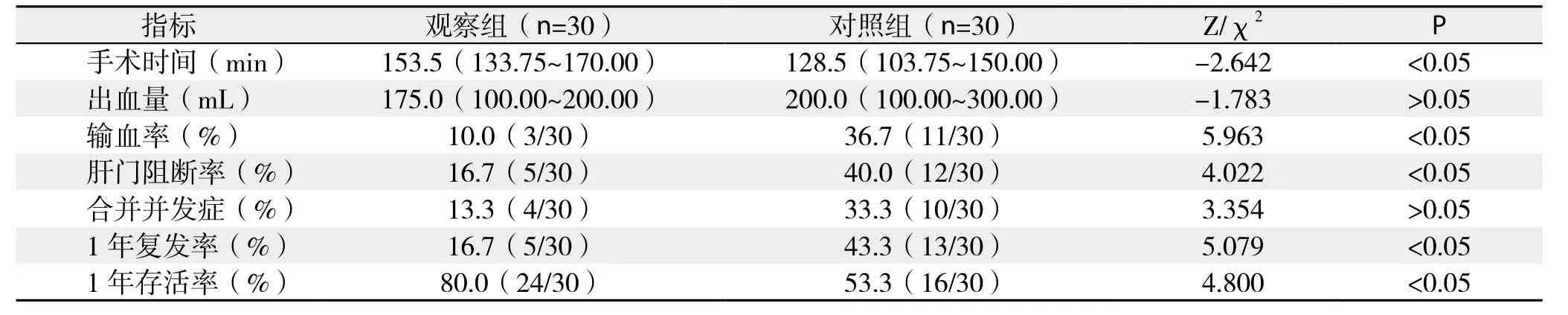
表2 观察组与对照组相关临床指标比较Table 2 Comparison of the main clinical variables between observation group and control group
3 讨 论
原发性肝细胞癌是世界上最常见的恶性肿瘤之一[5-6],而肝切除术目前仍作为治疗肝脏肿瘤的首选和最有效的方法。如何从手术方式、切除的角度出发,加以改进,从而降低肝癌的复发率和转移率,为此次研究的目的。肝切除术分为解剖性肝段切除和非解剖性肝切除[7],非解剖性肝段切除也称为肝脏部分切除术,是传统手术切除方式,其核心内容是减少切缘距离,尽量保留功能性残余的肝实质,有利于下一步抗复发和复发后综合治疗的施行[8-9]。虽然可能保存较多的肝脏实质,可是部分肝组织血运差,造成术后肝脏坏死及感染,反而增加了肝脏的负担,术中离断的过程中也可能造成血管或胆管的损伤,势必延长肝门阻断时间,不利于术后患者的恢复。
另一种是以肝段为本的解剖性肝切除术,又分为以下3种[10]:⑴ 表面解剖标志联合术中超声检查。此方法是以表面解剖和通过术中超声追踪肝静脉和门静脉分支,然后决定肝段切除的范围,再在肝表面以电灼画出需要切除的肝段界线,沿界线进行切除,近几年随着腹腔镜手术的飞速发展,外科医师也已经尝试在全腹腔镜下行解剖性肝切除术[11]。⑵ 预先控制肝血管蒂的肝段切除。此方法要求外科医生解剖第一肝门门静脉、肝动脉和胆管的左右分支,控制血管蒂然后再进行切除,不足之处是肝脏离断过程中肝实质缺血界线远不如肝脏表面缺血界线。⑶ 术中超声引导下门静脉穿刺注射显色剂术。本次研究所采用的方法,该方法最早是由日本学者Makuuchi等[12]应用于肝切除术,依据每一待切除肝段是由单独1支门静脉供血,术中超声定位引导下穿刺肿瘤所在肝段门静脉分支,注入4~6 mL的亚甲篮,肝脏表面呈着色区,显示出肝断面的界线,沿着色界进行切除,从而达到解剖性切除的目的[13]。该治疗方案的优势在于它符合肿瘤根治的原则,解剖性肝段切除一并切除了肿瘤及可能存在的转移灶,降低了术后复发率[14];规则的肝段切除,通过相对无血管界面,无Glisson蒂,减少术中出血;切除过程中不破坏大血管或者胆管,从而降低了术后并发症的发生率[15];而且大部分肝癌患者都伴有严重的肝硬化,规则的切除可保留尽可能多的肝脏组织,减少术后肝衰竭的发生[16];最后还可大大降低手术操作过程中对肿瘤的挤压造成的肿瘤细胞脱落以及肝癌播散和远处转移[17]。本研究的另一特色是术中应用超声导航,在治疗过程中发挥作用:⑴ 能够发现术前影像学如增强CT等检查所漏诊的病变,提高疗效[18];⑵ 能够进行准确定位,明确病变的部位、范围以及与周围血管的解剖关系,为术式选择提供依据,既可最大限度地保存肝组织或不影响血液回流,又可避免切除的不彻底;⑶ 准确地定位出切除范围,划定切除界限,尤其是肿瘤、至少保证切缘距肿瘤边缘>1cm才能达到根治性切除标准;⑷ 手术结束时检查手术效果,确认有无残留肿瘤病变等。
有研究[19-20]表明,与非解剖性肝切除术相比,解剖性肝段切除对治疗肝癌效果更加明显,大大降低了患者术后复发率、手术并发症发生率,提高了患者长期生存率、无瘤生存率,预后效果更好。本研究表明超声导航下解剖性肝段切除组手术时间相对于非解剖性肝段切除组有所延长,可能由于术中彩超的应用及染色操作有关;虽然理论上解剖性肝段切除因精细操作出血量应较少,但可能因为手术时间的延长,总体上,解剖性肝段切除组和非解剖性肝段切除组术中出血量差异无统计学意义;而在输血率方面,可能由于研究中对输血指征把握有偏差,不够精确,临床资料例数较少,导致解剖性肝段切除组与非解剖性肝段切除组在输血率方面有所差异;解剖性肝段切除组行规则的肝段切除,通过相对无血管界面,无Glisson蒂,所以肝门阻断率低于非解剖性肝段切除组,这对于减少肝脏的缺血再灌注损伤有着积极的意义[21-23]。两组术后并发症发生率差异无统计学意义。在复发率方面,我们可以看到解剖性肝段切除组肿瘤一年复发率低于非解剖性肝段切除组,肝癌多中心发生,癌细胞通过门静脉系统在肝内形成的微转移灶致使主瘤周围形成术前影像学及术中无法发现的微小癌病灶,超声导航的解剖性规则切除可将肝段内可能存在的微小病灶一并切除,与非解剖性切除相比,患者获得了更好的预后效果[24],超声导航下的解剖性肝段切除对于减少肿瘤复发、转移有着积极的作用,存活率也大大提高,不足之处是可能因为样本量太少,基数太小,所以导致本次研究数据上有一定偏差。
近些年来,精细肝脏外科理念[25-26]在肝脏外科的诊断治疗中的重要性不断提高,精准的解剖性肝切除可以在保证切缘阴性、剩余肝体积的情况下完整切除肿瘤,提高了治疗的有效性和手术安全性[27]。综上所述,术中超声导航下的解剖性肝段切除与非解剖性肝段切除相比,在肝癌治疗中的疗效更加明显,解剖性肝段切除的应用对治疗肝癌有着积极的作用,对于减少肝癌患者的术后复发及转移有一定临床意义。
[1] 汤钊猷. 开展肝癌转移复发研究的意义与途径[J]. 中华普通外科杂志, 2006, 21(11):761. doi: 10.3760/j.issn:1007–631X.2006.11.001.Tang ZQ. Significance and approach of conducting investigation of liver cancer recurrence of metastasis[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2006, 21(11):761. doi: 10.3760/j.issn:1007–631X.2006.11.001.
[2] 王新青, 卜阳, 于松宁, 等. 精准肝切除治疗原发性肝癌近期疗效的Meta分析[J]. 中国普通外科杂志, 2016, 25(1):57–67. doi:10.3978/j.issn.1005–6947.2016.01.010.Wang XQ, Bo Y, Yu SN, et al. Short-term efficacy of precise hepatectomy for primary liver cancer: a Meta-analysis[J]. Chinese Journal of General Surgery, 2016, 25(1):57–67. doi: 10.3978/j.issn.1005–6947.2016.01.010.
[3] Jarufe N, Figueroa E, Muñoz C, et al. Anatomic hepatectomy as a definitive treatment for hepatolithiasis: a cohort study[J].HPB (Oxford), 2012, 14(9):604–610. doi: 10.1111/j.1477–2574.2012.00488.x.
[4] 董家鸿, 黄志强. 精准肝切除——21世纪肝脏外科新理念[J].中华外科杂志, 2009, 47(21):1601–1605. doi:10.3760/cma.j.issn.0529–5815.2009.21.001.Dong JH, Huang ZQ. Precise liver resection——new concept of liver surgery in 21st century[J]. Chinese Journal of Surgery, 2009,47(21):1601–1605. doi:10.3760/cma.j.issn.0529–5815.2009.21.001.
[5] 汪晋, 马金良. 肝癌预后相关影响因素[J]. 中国普通外科杂志,2015, 24(2):270–274. doi: 10.3978/j.issn.1005–6947.2015.02.022.Wang J, Ma JL. Prognostic factors in liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(2):270–274. doi: 10.3978/j.issn.1005–6947.2015.02.022.
[6] 潘婷婷, 许戈良. 缺氧诱导因子2与肝癌的研究进展[J].中国普通外科杂志, 2015, 24(1):100–104. doi: 10.3978/j.issn.1005–6947.2015.01.019.Pan TT, Xu GL. Role of hypoxia inducible factor 2 in hepatocellular carcinoma: recent advances[J]. Chinese Journal of General Surgery,2015, 24(1):100–104. doi: 10.3978/j.issn.1005–6947.2015.01.019.
[7] Chen J, Huang K, Wu J, et al. Survival after anatomic resection versus nonanatomic resection for hepatocellular carcinoma: a metaanalysis[J]. Dig Dis Sci, 2011, 56(6):1626–1633. doi: 10.1007/s10620–010-1482–0.
[8] 吴孟超. 肝癌外科治疗的近期进展[J]. 中国普外基础与临床杂志, 2006, 13(2):125–128. doi: 10.3969/j.issn.1007–9424.2006.02.001.Wu MC. Current Development on Surgical Treatment of Liver Cancer[J]. Chinese Journal of Bases and Clinics in General Surgery,2006, 13(2):125–128. doi: 10.3969/j.issn.1007–9424.2006.02.001.
[9] 贾长库, 王石坚, 陈有科, 等. 解剖性右肝三段切除治疗右肝巨大或多发性肝癌[J]. 中国普通外科杂志, 2015, 24(7):939–944. doi:10.3978/j.issn.1005–6947.2015.07.005.Jia CK, Wang SJ, Chen YK, et al. Anatomic right trisegmentectomy for huge or multifocal right hepatic hepatocellular carcinoma[J].Chinese Journal of General Surgery, 2015, 24(7):939–944. doi:10.3978/j.issn.1005–6947.2015.07.005.
[10] 王鹏飞, 董家鸿. 解剖性肝切除术的研究进展[J]. 中华消化外科杂志, 2014, 13(3):234–236. doi:10.3760/cma.j.issn.1673–9752.2014.03.019.Wang PF, Dong JH. Progress in the research of anatomic segmental hepatectomy[J]. Chinese Journal of Digestive Surgery 2014,13(3):234–236. doi:10.3760/cma.j.issn.1673–9752.2014.03.019.
[11] Tian J, Li JW, Chen J, et al. The safety and feasibility of reoperation for the treatment of hepatolithiasis by laparoscopic approach[J].Surg Endosc, 2013, 27(4):1315–1520. doi: 10.1007/s00464–012-2606–8.
[12] Makuuchi M, Hasegawa H, Yamazaki S. Ultrasonically guided subsegmentectomy[J]. Surg Gynecol Obstet, 1985, 161(4):346–350.
[13] Ochiai T, Sonoyama T, Kikuchi S, et al. Anatomic wide hepatectomy for treatment of hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2007, 133(8):563–569.
[14] Hasegawa K, Kokudo N, Imamura H, et al. Prognostic impact of anatomic resection for hepatocellular carcinoma[J]. Ann Surg, 2005,242(2):252–259.
[15] 刘允怡, 余俊豪. 肝段为本的肝切除手术[J]. 中华普通外科杂志,2003, 18(2):123–125.doi: 10.3760/j.issn:1007–631X.2003.02.023.Liu YY, Yu JH. Segment-based liver resection[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2003, 18(2):123–125.doi: 10.3760/j.issn:1007–631X.2003.02.023.
[16] Curro G, Bartolotta M, Barbera A, et al. Ultrasound-guided radiofrequency-assisted segmental liver resection: a new technique[J]. Ann Surg, 2009, 250(2):229–233. doi: 10.1097/SLA.0b013e3181b0c38a.
[17] 熊奇如, 耿小平. 前入路肝切除技术探讨[J]. 肝胆外科杂志,2001, 9(5):327–329. doi:10.3969/j.issn.1006–4761.2001.05.004.Xiong QR, Geng XP. Study of skill of anterior approach for hepatic resection[J]. Journal of Hepatobiliary Surgery, 2001, 9(5):327–329.doi:10.3969/j.issn.1006–4761.2001.05.004.
[18] Hanazaki K, Kajikawa S, Shimozawa N, et al. Perioperative blood transfusion and survival following curative hepatic resection for hepatocellular carcinoma[J]. Hepatogastroenterology, 2005,52(62):524–529.
[19] Cho YB, Lee KU, Lee HW, et al. Anatomic versus nonanatomic resection for small single hepatocellular carcinomas[J].Hepatogastroenterology, 2007, 54(78):1766–1769.
[20] Jing-Dong L, Yun-Hong T, Kanduri HK, et al. Prognosis in patients with small hepatocellular carcinoma: a meta-analysis[J].Hepatogastroenterology, 2011, 58(110/111):1708–1712. doi:10.5754/hge11123.
[21] 夏锋, 王曙光, 别平, 等. Pringle法导致的肝脏缺血再灌注损伤对肝癌肝切除患者预后的影响[J]. 中华消化外科杂志, 2009,8(2):103–106. doi:10.3760/cma.j.issn.1673–9752.2009.02.010.Xia F, Wang SG, Bie P, et al. Influence of hepatic ischemiareperfusion injury induced by Pringle maneuver on the prognosis of hepatocellular carcinoma patients after hepatectomy[J]. Chinese Journal of Digestive Surgery, 2009, 8(2):103–106. doi:10.3760/cma.j.issn.1673–9752.2009.02.010.
[22] 李伟男, 彭慈军, 舒德军. 肝脏缺血再灌注损伤的研究进展[J].世界华人消化杂志, 2015, 23(22):3554–3559. doi:10.11569/wcjd.v23.i22.3554.Li WN, Peng CJ, Shu DJ. Progress in research of liver ischemiareperfusion injury[J]. World Chinese Journal of Digestology, 2015,23(22):3554–3559. doi:10.11569/wcjd.v23.i22.3554.
[23] 关连越, 付佩尧, 李巍. 肝脏缺血再灌注损伤机制的研究进展[J].中国实验诊断学, 2015, 19(9):1602–1605.Guan LY, Fu PY, Li W. Research progress in mechanism of hepatic ischemia/reperfusion injury[J]. Chinese Journal of Laboratory Diagnosis, 2015, 19(9):1602–1605.
[24] Makuuchi M, Takayama T, Kosuge T, et al. The value of ultrasonography for hepatic surgery[J]. Hepatogastroenterology,1991, 38(1):64–70.
[25] Dong J, Yang S, Zeng J, Precision in liver surgery[J]. Semin Liver Dis, 2013, 33(3):189–203. doi: 10.1055/s-0033–1351781.
[26] 贾长库, 翁杰, 陈有科,等. 以解剖性肝切除为基础的精准肝切除治疗肝胆恶性肿瘤[J]. 中国普通外科杂志, 2013, 22(1):109–112.doi: 10.7659/j.issn.1005–6947.2013.01.025.Jia CK, Weng J, Chen YK, et al. Anatomic hepatectomy as basis for precise hepatectomy in the treatment of malignant hepatobiliary tumors[J]. Chinese Journal of General Surgery, 2013, 22(1):109–112. doi: 10.7659/j.issn.1005–6947.2013.01.025.
[27] 荚卫东. 精准肝切除治疗肝细胞癌关键技术[J]. 中国普通外科杂志, 2014, 23(1):1–5. doi:10.7659/j.issn.1005–6947.2014.01.001.Jia WD. Key techniques in precise hepatectomy for hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2014, 23(1):1–5.doi:10.7659/j.issn.1005–6947.2014.01.001.
