中和反应的考查
2017-03-29贺正炎
贺正炎


中和反应是酸与碱互相交换成分,生成盐和水的反应,它是复分解反应的特例,近年来各地中考中频频出现这类问题,现小结如下,供同学们学习时参考。
一、含义
例1(2016·烟台)逻辑推理是一种重要的化学思维方法,以下推理正确的是()。
A.酸碱中和反应有水生成,有水生成的反应一定是酸碱中和反应
B.氧化物中含有氧元素,含氧元素的化合物一定是氧化物
C.碱的溶液能使无色酚酞溶液变红,能使无色酚酞溶液变红的一定是碱的溶液
D.化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化
研析与解答:中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,酸碱中和反应有水生成。但有水生成的反应不一定是酸碱中和反应,某些金属氧化物与酸反应、某些非金属氧化物与碱反应都能生成水,这些都不属于中和反应,如CO2+2NaOH=NazCO3+H2O,氧化物是只含有两种元素且其中一种元素是氧元素的化合物,可见氧化物中一定含有氧元素,但含氧元素的化合物不一定是氧化物,如Na2CO3碱的溶液能使无色酚酞溶液变红,但能使无色酚酞溶液变红的不一定是碱的溶液,也可能是碳酸钠等盐溶液,化学变化的实质是分子分成原子,原子再重新组合成新分子,化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化。
答案:D
二、探究
例2(2016·邵阳)某化学兴趣小组利用稀盐酸和氢氧化钠溶液来探究中和反应的规律时,某溶液的pH随时间的变化如图1所示,则a点所示溶液中的溶质是()。
A.HCI
NaOH
B.NaCl
C.NaCl
NaOH
D.NaCl HCl
研析与解析:图象中溶液pH的变化是从大于7逐渐减小到小于7,图中a点所示溶液的pH大于7,溶液显碱性,说明氢氧化钠过量,所得溶液中的溶质为NaOH和NaCI。
答案:C
三、应用
例3(2016·泉州)中和反应在生活、生产中有广泛的应用,下列做法不是利用中和反应原理的是()。
A.用熟石灰改良酸性土壤
B.用含氢氧化镁的药物治疗胃酸过多
C.用盐酸除去铁锈
D.用氨水(NH3·H2O)处理工厂排出的硫酸
研析与解答:用熟石灰改良酸性土壤,熟石灰与酸反应生成盐和水,属于中和反应,用含氢氧化镁的药物治疗胃酸过多,氢氧化镁与盐酸反应生成氯化镁和水,属于中和反应,用稀盐酸除铁锈,铁锈的主要成分是氧化铁,该反应是金属氧化物与酸反应生成盐和水,不属于中和反应,用氨水(NH3·H2O)处理工厂排出的硫酸,稀氨水属于碱,与硫酸反应生成盐和水,是酸和碱的反应,利用了中和反应原理。
答案:C
例4(2016·湘潭)往硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液直至过量,根据实验绘制如图2所示曲线,下列说法正确的是()。
A.a至b段有蓝色沉淀生成
B.d点溶质种类为三种
C.c至d段,溶液pH不断减少
D.c点所含的溶质种类最少
研析与解析:向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程中氢氧化钠先和硫酸反应,然后和硫酸铜反应,a至b段是氢氧化钠中和硫酸的反应,没有蓝色沉淀生成,d点时氢氧化钠过量,此时对应溶液中的溶质有硫酸钠、氢氧化钠,溶质种类为两种,c至d段,溶液中氢氧化钠逐渐增多,碱性增强,pH变大,c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠。溶质种类最少。
答案:D
你學合了吗
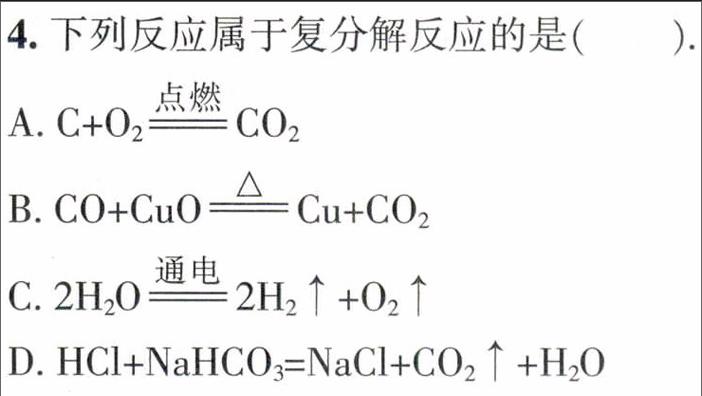
1.下列说法正确的是()。
A.分子可以直接构成物质,则溶质都以分子形式分散到溶剂中形成溶液
B.中和反应生成盐和水,则生成盐和水的反应都是中和反应
C.铵盐能与碱反应生成氨气,则硫酸铵不能与熟石灰混合施用
D.一氧化碳、二氧化碳的组成元素相同,则一氧化碳、二氧化碳的化学性质相同
2.在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图示能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是()。
3.将质量为50g溶质质量分数为20%的氢氧化钾溶液和质量为50g溶质质量分数为20%的稀硫酸混合,所得溶液的pH()。
A.小于7
B.等于7
C.大于7
D.不确定
