沙苑子对运动大鼠海马GAD67、GABA-T、SSADH酶基因表达的调控研究
2017-03-29刘志刚聂玉芝
刘志刚,聂玉芝,刘 琴
(1.玉溪师范学院 体育学院,云南 玉溪 653100;2.北京市第66中学,北京 100053;3.玉溪师范学院 资环学院,云南 玉溪 653100)
沙苑子对运动大鼠海马GAD67、GABA-T、SSADH酶基因表达的调控研究
刘志刚1,聂玉芝2,刘 琴3
(1.玉溪师范学院 体育学院,云南 玉溪 653100;2.北京市第66中学,北京 100053;3.玉溪师范学院 资环学院,云南 玉溪 653100)
目的:研究沙苑子对运动大鼠海马Glu和GABA代谢相关的酶GAD67、GABA-T、SSADH基因表达的影响。方法:SD大鼠随机分为安静组(Control group),一般训练组(training control group,TC group),强化训练组(intensive training group,IT group),沙苑子干预强化训练组(SAC intervention and intensive training group,SACIT group)。第7周末取材,分离大鼠海马组织,研磨后以Trizol抽提RNA,经RT-PCR后产物以1%琼脂糖凝胶电泳。凝胶分析系统扫描各电泳条带并定量。各组数据进行单因素方差分析,以S-N-K检验并计算效应量Cohen’s d值。结果:GAD67: IT group极显著高于其他三组(P<0.01,P<0.01,P<0.01);TC和SACIT group极显著高于Control group(P<0.01,P<0.01);GABA-T:IT group极显著低于其他三组(P<0.01,P<0.01,P<0.01);SSADH: IT group 极显著低于其他三组(P<0.01,P<0.01,P<0.01),SACIT group极显著低于 TC group(P<0.01)。结论:1)运动能够极显著提高大鼠海马GAD67表达的同时降低GABA-T和SSADH的表达,促进了中枢抑制且与运动强度相关。2)沙苑子能极显著降低运动大鼠海马GAD67的表达而提高GABA-T和SSADH的表达,减少中枢Glu向GABA转化,使大鼠海马整体兴奋性上升,有效对抗大强度运动产生的中枢抑制和中枢疲劳。3)沙苑子对大鼠海马GAD67、GABA-T和SSADH的调控作用可能与它突出的谷氨酸含量、显著的抗氧化能力以及改善脑缺氧的作用有关。4)支持以巴甫洛夫为代表的对运动性疲劳的“保护性抑制”学说,但并不完全支持该学说所主张的运动性疲劳的“是一种主动而不是被动的过程”。
沙苑子;海马;基因调控;中枢疲劳
沙苑子(semen astragali complanati,SAC)是豆科黄芪属植物扁茎黄芪(astragatus complanatus)的种子。化学分析表明[1-2],沙苑子含有三萜和黄酮类等生物活性物质,具有抗疲劳、增强免疫和保肝的作用。已有的研究表明[3],兴奋、抑制性氨基酸类神经递质在脑内代谢失衡是导致运动性中枢疲劳的重要因素。海马回主要负责短期的学习和记忆,与运动技能的形成密切相关。海马神经元电生理活动受运动强度的影响而产生不同变化,运动疲劳可明显改变大鼠海马CA1区神经元的自发和诱发放电活动,并可导致海马回出现长时程抑制(long-term depression,LTD),使其学习和记忆能力降低[4]。本实验通过研究运动大鼠海马部位与谷氨酸(glutamic acid,Glu)和γ-氨基丁酸(γ- aminobutyric acid,GABA)代谢相关的酶—谷氨酸脱羧酶(glutamate decarboxylase,GAD)、γ-氨基丁酸转氨酶(GABA transaminase,GABA-T)、琥珀酸半醛脱氢酶(Succinic semialdehyde dehydrogenase,SSADH)mRNA表达的变化,研究沙苑子对运动大鼠中枢疲劳的影响和对氨基酸类神经递质的调节作用。
1 材料与仪器
1.1 材料
选用3月龄SPF(Specific pathogen Free,SPF)级SD(Sprague-Dawley)雄性健康大鼠48只,体重210 g~230 g。购自陕西省中医药研究所动物饲养中心(动物合格证:陕医动字第08-005号),同时购入国家标准啮齿类动物饲料喂养,自由饮水、摄食。饲养温度20℃~25℃,环境相对湿度40%~60%,噪声≤50 dB,自然光照明。沙苑子购自陕西省恒心堂制药有限公司,为商品药物颗粒制剂,辅料为蔗糖、糊精(成分配比为:60%沙苑子浸膏:蔗糖:糊精 = 1:3:3,辅料仅起填充、粘合和赋形作用)。
1.2 主要仪器
德国Hettich MIKRO 22R冷冻离心机;天津泰斯特DK-98-1A恒温水浴锅;德国Sartorius BP-310S电子天平;杭州段氏DSPT-202型大鼠跑台;上海申安LDZX-30KBS高压灭菌锅;广东科龙BCD-272电冰箱;德国Eppendorf微量移液器;日立U-3900紫外分光光度计;苏州净安泰SW-CJ-2FD超净工作台;美国Stratgene Mx3000P PCR仪;北京六一厂DYCP-31E电泳仪;英国剑桥UVItec凝胶分析系统。
2 动物训练方案
2.1 动物分组
SD大鼠随机分为4组,每组12只。安静组(Control group),不给予任何训练;一般训练组(training control group,TC group),先进行5周适应性训练后再进行2周一般性训练;强化训练组(intensive training group,IT group),先进行5周适应性训练后再进行2周强化训练;沙苑子干预强化训练组(SAC intervention and intensive training group,SACIT group),先进行5周适应训练后再进行2周强化训练,同时喂服沙苑子。
2.2 运动模型

表1 实验动物运动方案
采用Benford运动模型,略有改动。适应环境2 d后开始按计划训练,以强度递增的方式在水平放置的跑台上运动,零坡度。每天18:00-18:30为固定训练时间。从训练第1周起开始,每周递增速度依次为15 m/min→22 m/min→27 m/min→31 m/min→35 m/min。每次训练持续20 min,每周训练5 d,持续5周。第5周后按下列方案训练:
一般训练:第6、7周(每周7 d),大鼠以35 m/min速度,在水平跑台上训练20 min。
强化训练:第6、7周(每周7 d),大鼠以35 m/min速度,在水平跑台上训练30 min。
造模共持续7周,于第7周末取材。
2.3 给药方案:按照实验动物与人用药量的换算关系以及参考文献[5],确定SACIT group大鼠每日固定的时间(9:00-9:30)按1.8 g/kg的给药剂量,以2 mL生理盐水溶解后经口腔灌胃。其余组喂服等量生理盐水,每天一次。
2.4 取材和测试
实验动物按照运动方案完成全部训练后,于第7周末按照SACIT group、IT group、TC group、Control group的顺序依次取材。大鼠用乙醚麻醉,离断颈椎处死,开颅取出完整大脑,分离大脑海马组织,以预冷的生理盐水冲洗残余血液,滤纸吸干。
3 测试步骤
采用半定量RT-PCR技术测定大鼠海马GAD67、GABA-T、SSADH基因表达变化。
3.1 总RNA的提取
从大鼠海马分离少许新鲜组织,称重后立即投入液氮中进行研磨,并按1mL Trizol/100 mg组织加入Trizol匀浆并抽提RNA。
1)按照1mL Trizol/100 mg组织的配比加入Trizol,室温下震摇5~10 min,充分裂解;
2)按照体积1 : 5的比例在Trizol中加入氯仿,室温下剧摇15 s,静置5 min;
3)4℃离心15 min,12 000 rpm;
4)吸上清于另一个Eppendorf管中(只留管中少量沉淀),加入0.8 mL异丙醇混匀,静置10 min;
5)4℃离心15 min,12 000 rpm;
6)用1 mL 75%乙醇洗涤沉淀;
7)4℃离心10 min,10 000 rpm,弃上清。沉淀RNA,并风干10 min(不宜太干燥,否则RNA不易溶解,溶解的RNA OD260:OD280=1.8-2.0)
8)以50 μL DEPC水溶解RNA后加入20 μL RNasin,于-20℃保存。
采用甲醛变性凝胶电泳鉴定RNA是否降解,紫外分光法鉴定RNA的纯度及对RNA进行定量。取1 μL总RNA加入4 μL样本缓冲液,加1 μL的溴化乙锭(ethidium bromide,EB)后,于65℃变性10 min,以1%琼脂糖凝胶(含18%的甲醛)于45℃恒温电泳4 h,观察28S、18S和5S三条带是否清晰,有无降解,以及是否存在DNA污染。取1 μL RNA样品溶于99 μL DEPC处理的双蒸水中,紫外分光法测定吸光度值。纯净的RNA其 A260/A280=1.8-2.0,若该比值低于1.8,说明RNA被蛋白质或酚污染,需重新抽提。同时此法可以对RNA进行定量,1个A260单位相当于40 μg/mL RNA。
3.2 RT-PCR
按试剂盒说明操作合成cDNA第一链,然后将RNA反转录为cDNA。
1)冰盒内,将10 μL RNA,1 μL随机聚体引物,1 μL H2O加入0.5 mL离心管,在70℃反应5 min;
2)冰盒内,加4 μL 5×缓冲液,1 μL RNasin,2 μL dNTP(10 mM),25℃反应5 min;
3)加1 μL逆转录酶AMV,25℃反应10 min;
4)42℃温水浴60 min;
5)70℃10 min反应终止;所得cDNA可用于PCR扩增。
PCR扩增按试剂盒说明操作。取cDNA 10 μL作为模板,50 pM上、下游引物各1 μL,2×MasterMix反应体系12.5 μL,最后以无菌双蒸水补至25 μL,并混匀。加石蜡油50 μL覆盖。先95℃预变性5 min,然后94℃变性 60 s,55℃~60℃变性60 s,72℃变性60 s,28个循环后,72℃延伸300 s。
GAD67、GABA-T、SSADH和β-actin的cDNA序列由Genbank获取。
GAD67、GABA-T、SSADH和内参照β-actin基因引物序列设计如表2所示:

表2 引物序列
3.3 电泳定量结果
RT-PCR产物经1%琼脂糖凝胶电泳后在波长256 nm紫外灯下观察并拍照。用UVI凝胶图像分析系统对PCR产物电泳条带进行光密度分析,通过GAD67/β-actin、GABA-T/β-actin和SSADH/β-actin的OD比值对这三种基因的mRNA表达作相对定量(图1、图2、图3、表3)。
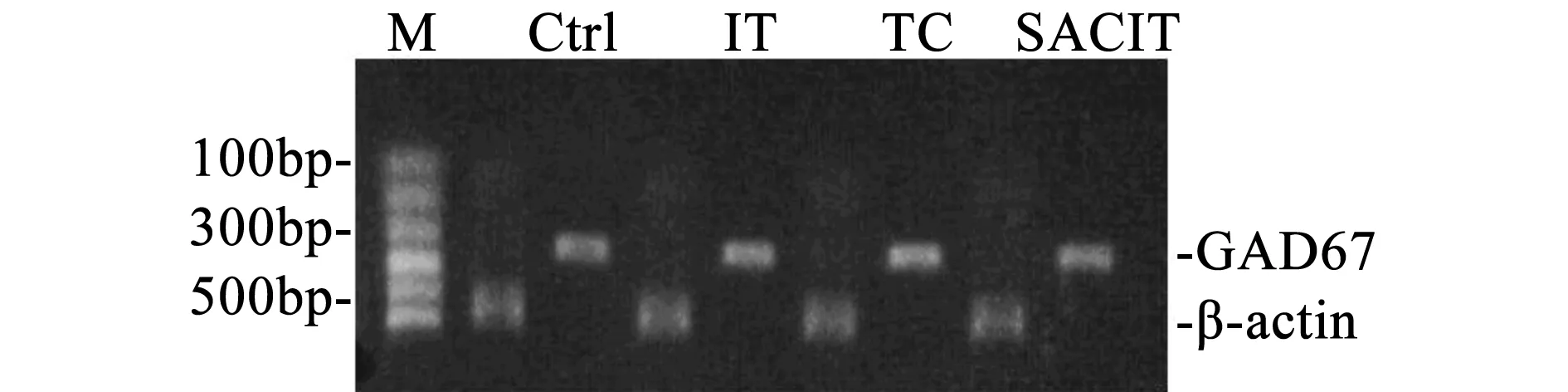
图1 各组大鼠海马GAD67 mRNA表达情况
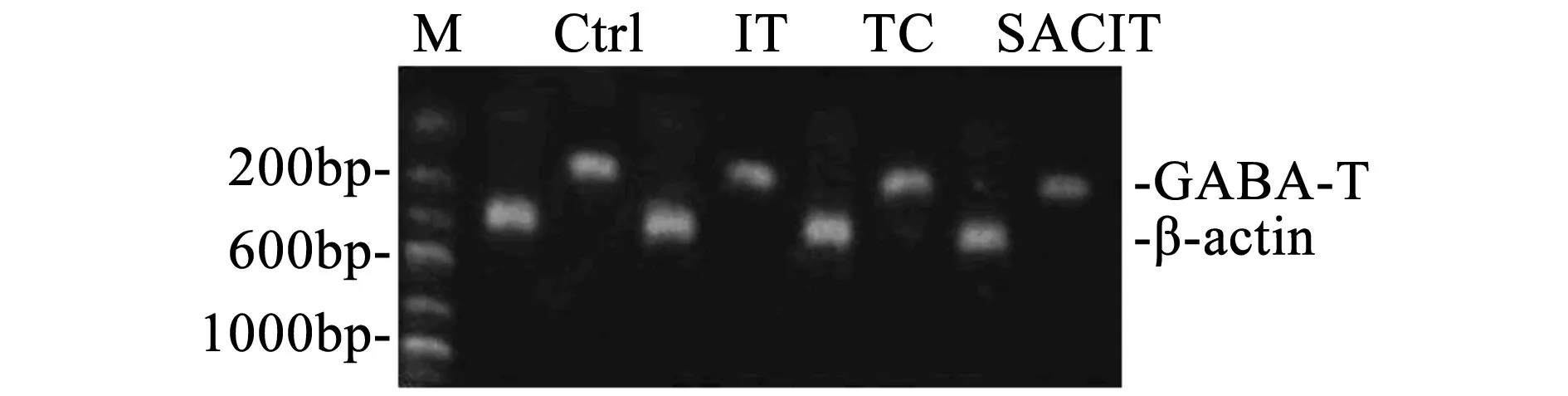
图2 各组大鼠海马GABA-T mRNA表达情况
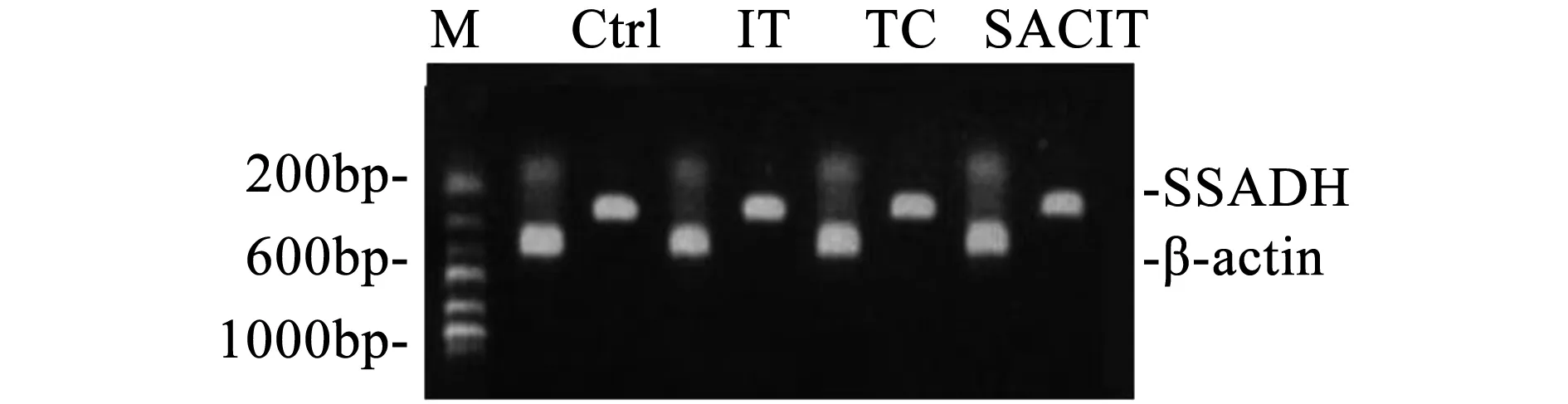
图3 各组大鼠海马SSADH mRNA表达情况

基因/组别Controlgroup♠TCgroup♣ITgroup♥SACITgroup♦GAD67mRNA1.14±0.02♥1.25±0.03♥♠1.39±0.071.28±0.02♥♠GABA-TmRNA0.98±0.04♥0.97±0.02♥0.94±0.010.97±0.01♥SSADHmRNA0.97±0.01♥0.98±0.02♥0.93±0.020.96±0.01♣♥
注:和IT group比,P<0.01;和Control group比,P<0.01;和TC group比,P<0.01。
结果如表3所示,GAD67: IT group极显著高于其他三组(P<0.01,P<0.01,P<0.01。Cohen’d=0.92/0.79/0.73);TC和SACIT group极显著高于Control group(P<0.01,P<0.01。Cohen’d=0.91/0.96);GABA-T:IT group极显著低于其他三组(P<0.01,P<0.01,P<0.01。Cohen’d=0.57/0.69/0.83);SSADH: IT group 极显著低于其他三组(P<0.01,P<0.01,P<0.01。Cohen’d=0.78/0.78/0.69),SACIT group极显著低于 TC group(P<0.01,Cohen’d=0.53)。
按照Cohen的标准,d值越大t检验的结果越可靠。通常把d值小于0.2时认为具有很小的效应量,即t检验结果可靠性较低;而d值在0.5附近具有中等效应量;d值大于0.8时具有大的效应量,即t检验结果具有比较大的可靠性。
4 讨 论
众多研究显示氨基酸类神经递质参与介导了运动疲劳导致的海马兴奋性变化。Glu是中枢内兴奋性最强的氨基酸递质,而GABA则是抑制性最显著的氨基酸递质。Glu/GABA比值可反映大脑的兴奋状态和水平。运动导致大鼠海马Glu/GABA比值降低,使大鼠海马神经元突触后抑制增强,兴奋性下降,可发展为中枢疲劳[6]。Glu与GABA的代谢存在如图4所示的关系。由图4可以看出,如果运动中GAD活性增高而GABA-T与SSADH活性下降,则会导致GABA生成增多而氧化减弱,致使GABA在中枢堆积。

图4 Clu与GABA代谢关系
海马回作为支配运动技能形成的中枢结构和记忆环路,其兴奋水平的变化直接影响到运动技能的完成。运动导致海马GABA增多和Glu减少,Glu/GABA比值降低是运动性中枢疲劳的重要原因[7-8]。对实验数据的分析显示,沙苑子则可以有效对抗和延缓运动性中枢疲劳的发生和发展,具有明显的抗疲劳的作用。
GAD有GAD65和GAD67两种亚型,前者主要存在于神经末梢,通常以脱辅基酶的形式存在,因而不太活跃;后者主要存在于神经元胞体内,以结合辅基的形式存在,十分活跃。因此选择GAD67作为观测指标更灵敏[9]。如表3所示,GAD67在大鼠海马的表达随着运动强度增加而上调,经沙苑子干预后,SACIT group显著低于对照组IT group(P<0.01),说明在大强度运动时沙苑子可以抑制GAD67在大鼠海马中的高表达。
实验数据如表3显示,GABA-T在大鼠海马中的表达随着运动强度的增加而降低,IT group均显著低于其他三组(P<0.01,P<0.01,P<0.01)。经沙苑子干预后,SACIT group显著高于对照组IT group(P<0.01)。这说明沙苑子可以显著促进运动大鼠GABA-T表达上调,加强GABA的氧化过程,减少GABA在中枢的堆积,因而显示出沙苑子的抗运动性中枢疲劳作用。SSADH基因在各组大鼠海马的表达情况也出现了类似的结果。运动导致SSADH 基因表达下调,且与运动强度呈正相关。表3显示SACIT group显著高于TC group(P<0.01),说明沙苑子干预可以显著遏制运动导致的SSADH基因表达下调。由于GAD67、GABA-T和SSADH是Glu和GABA在大脑中代谢平衡的关键酶,且由于Glu和GABA难以通过血脑屏障而主要在脑细胞内代谢,因此以上实验结果提示:第一,运动会导致大鼠海马GAD67表达上调而GABA-T和SSADH表达下调,且与运动强度有明显的相关性。第二,对实验数据的分析可知,沙苑子可以显著下调运动中大鼠海马GAD67表达和上调GABA-T与SSADH表达的作用,有效抑制和延缓Glu/GABA比值的下降,使大鼠海马维持较高水平的兴奋性而表现出抗疲劳的作用。第三,根据运动性疲劳的“保护性抑制”学说[10],具有兴奋性的Glu在运动中代谢为抑制性的GABA,加强了中枢抑制并发展为运动性疲劳,避免机体在运动中产生过度“损耗”,是一种负反馈调节,可以看做是机体在运动中产生的一种自我保护。
我们前期的研究发现[11-12,13,15],力竭训练使大鼠血清天冬氨酸氨基转移酶(aspartate transaminase,AST)和尿素氮(blood usea nitrogen,BUN)显著升高,严重损害其肝肾功能。沙苑子对运动大鼠海马GAD67、GABA-T和SSADH的调控作用可能与其补益肝肾的作用有关。从中医的角度看,沙苑子性温味甘,有温补肝肾、固精、缩尿、明目的作用。而肾主骨、藏精、生髓,为先天之本、元气所在,是“侧力”产生的源泉。肝藏血,主疏泄,若疏泄失调则可导致身体机能下降,降低运动能力,促使疲劳出现[14]。沙苑子补肾、固精、益肝的作用亦被现代医学所证实。黄崇刚等用沙苑子干预醋酸棉酚和环磷酰胺所致的大鼠生精障碍模型后发现,沙苑子提取物能明显增加大鼠的精子数和精子活动率,降低畸形率并提高其精囊腺指数[16-17]。孙利兵等[18]的研究证实沙苑子黄酮对四氯化碳所致的小鼠肝损伤有明显的保护和抗脂质过氧化作用。王文心[19]的研究认为沙苑子可以明显改善抑郁症小鼠的抑郁状态,有明显的抗抑郁作用。而抑郁症与大脑突触间隙的神经递质代谢失调密切相关。
沙苑子对大鼠海马GAD67、GABA-T和SSADH的调控作用还可能与它的氨基酸含量和构成有关。沙苑子含有14种氨基酸,其中以Glu含量最高,达到68%[1,20]。我们推测沙苑子突出的Glu含量可能与其抗中枢疲劳的作用存在一定关联。虽然正常情况下外周血中的Glu并不能通过血脑屏障,但由于大脑是耗氧量很大且高度依赖氧的器官,运动时血流重新分配导致脑组织缺血、缺氧,引起NO升高、pH值下降、胞内Ca2+浓度升高并通过蛋白激酶、蛋白磷酸酶、Rho激酶调控构成血脑屏障的咬合蛋白、ZO-1蛋白、ZO-2蛋白、闭锁蛋白-5构象变化,使拉链结构遭到破坏,引起血脑屏障通透性增大[21-22],在此基础上可能会有部分Glu进入脑内并影响大脑的兴奋状态。
运动时的脑缺血缺氧还会使有氧代谢受阻,诱导NO产生增多,后者可抑制GABA-T活性,使GABA堆积增多。沙苑子多酚不仅具有很强的抗氧化能力,改善脑血流恢复时产生的缺血再灌注损伤,而且还可以改善脑的缺氧状态,而缺氧正是抑制GABA-T表达的因素之一。[6,23]
5 结 论
1)运动显著提高大鼠海马GAD67表达的同时降低GABA-T和SSADH的表达,促进了中枢抑制且与运动强度相关。2)沙苑子能显著降低运动大鼠海马GAD67的表达而提高GABA-T和SSADH的表达,减少中枢Glu向GABA转化,使大鼠海马整体兴奋性上升,有效对抗大强度运动产生的中枢抑制和中枢疲劳。3)沙苑子对大鼠海马GAD67、GABA-T和SSADH的调控作用可能与它突出的谷氨酸含量、显著的抗氧化能力以及改善脑缺氧的作用有关。4)支持以巴甫洛夫为代表的对运动性疲劳的“保护性抑制”学说,但并不完全支持该学说所主张的运动性疲劳的“是一种主动而不是被动的过程”。
[1]李洪娟.沙苑子的化学成分研究[J].时珍国医国药, 2011, 22(3): 545-546.
[2]范学辉,张清安,田呈瑞.沙苑子的生理功能评价研究进展[J].安徽农业科学, 2015, 43(36): 4-6.
[3]刘占东,吴岩珏,王得新,等.慢性运动性中枢疲劳大鼠海马5-羟色胺及血清氨基酸的相关研究[J].中国临床神经科学, 2015(3): 274-279.
[4]刘晓莉,陈艳芬,朱成才,乔德才.运动疲劳大鼠可能通过海马抑制及蛋白表达增多降低学习记忆功能[J].天津体育学院学报, 2013, 28(1): 8-11.
[5]吴培云,吴鸿飞,方方,等.沙苑子化学成分研究[J].安徽中医药大学学报, 2014, 3(3): 91-94.
[6]聂玉芝.沙苑子对运动训练大鼠脑组织中氨基酸类神经递质及相关基因表达影响的研究[D].西安:陕西师范大学, 2005: 41-48.
[7]陈佩杰,董静梅.过度运动激活中性粒细胞产生的活性氧对淋巴细胞损伤及干预研究[J].体育科学, 2011, 31(1): 29-38.
[8]全明辉,陈佩杰,庄洁,等.上海市儿童青少年步行活动水平——基于加速度传感器的调查研究[J].体育科学, 2014,34(5): 51-55.
[9]刘芳利,罗彬,孙敬武,等.噪声暴露对大鼠反应阈及听皮层谷氨酸脱羧酶表达的影响[J].听力学及言语疾病杂志, 2014, 22(3): 268-271.
[10]邓树勋,陈佩杰,乔德才.运动生理学导论[M].北京:北京体育大学出版社, 2007:323-340.
[11]Zhigang Liu,Yun Liu,Zhengying Xiong,etal.Total soy saponins improve the antioxidant capacity of the myocardium andexercise ability in exhausted rats [J].Journal of sport and health science, 2015, 4(4): 1-6.
[12]刘志刚,唐文坤,徐广艳,等.大豆皂甙对运动力竭大鼠肝脏自由基代谢的影响[J].云南师范大学学报, 2015, 35(2): 67-72.
[13]Zhigang Liu,Ruixin Nie,Yun Liu,etal.The effects of total soy saponins on free radicals in the quadriceps femoris,serum testosterone,LDH,and BUN of exhausted rats[J].Journal of sport and health science, 2016, 5(1): 1-6.
[14]杨瑾.沙苑子的生物学效应及其作为运动补剂的应用前景[J].现代中药研究与实践, 2015, 29(1): 84-86.
[15]刘志刚,熊正英,刘琴,等.大豆总皂甙对运动力竭大鼠肾脏自由基代谢的影响[J].云南师范大学学报:自然科学版, 2016, 36(4): 1-6.
[16]黄崇刚,李恒华,梅小利,等.沙苑子补肾固精的作用研究[J].中国实验方剂学杂志, 2011, 17(1): 123-126.
[17]陈勤,陈逸青,曹炎贵.沙苑子总黄酮对酗酒模型小鼠生精功能和损伤的影响[J].中国药理通讯, 2013, 30(4): 31.
[18]孙利兵,王尉平,顾振纶,等.沙苑子黄酮及表没食子儿茶素没食子酸酯对小鼠慢性肝损伤的保护作用[J].解剖学杂志, 2009, 32(3): 408-410.
[19]王文心.补阳药沙苑子对小鼠抑郁模型的研究[J].中医临床研究, 2016, 8(3): 20-21.
[20]杨瑾.沙苑子对运动性疲劳大鼠脑组织5-羟色胺及其相关酶基因表达影响的实验研究[D].西安:陕西师范大学, 2005: 1-17.
[21]郭平,周其全.咬合蛋白在血脑屏障通透性改变中的作用[J].国际脑血管病杂志, 2010, 18(6): 466-470.
[22]徐露,张太君.冰片联合灯盏花素对缺氧复氧损伤血脑屏障通透性的影响[J].中国中医药信息杂志, 2016, 23(2):76-78.
[23]张清安,范学辉,张志琪,等.沙苑子酚类提取物的抗氧化能力研究[J].天然产物研究与开发, 2012, 24(7): 955-958.
Regulation and control effects of semen astragali complanati on GAD67, GABA-T and SSADH gene expression in the hippocampus of exercised rats
LIU Zhi-gang1,NIE Yu-zhi2,LIU Qin3
(1.Inst.ofPE,YuxiNormalUniversity,Yuxi653100;2.BeijingNo. 66MiddleSchool,Beijing100053;3.SchoolofResourcesandEnvironment,YuxiNormalUniversity,Yuxi653100,China)
Objective: Study on the regulation and control effects of semen astragali complanati (SAC) on GAD67, GABA-T and SSADH gene expression in the hippocampus of exercised rats.Methods: SD rats randomly divided into 4 groups: a control group; training control group (TC group); intensive training group (IT group); SAC intervention and intensive training group(SACIT group). The rat’s hippocampus tissue was isolated after 7 weeks training. The tissue homogenate was prepared and extracted with Trizol. After RT-PCR, the products were separated by 1% agarose gel electrophoresis. Gel analysis system scans the electrophoresis bands and carries out quantitative analysis. All data of each group are tested by S-N-K of one way ANOVA.Results: GAD67: IT group significantly enhanced than the other three groups (P<0.01,P<0.01,P<0.01, TC and SACIT group significantly enhanced than Control group (P<0.01,P<0.01);GABA-T: IT group significantly decreased than the other three groups (P<0.01,P<0.01,P<0.01); SSADH: IT group significantly decreased than the other three groups (P<0.01,P<0.01,P<0.01), and SACIT group significantly decreased than TC group (P<0.01).Conclusions:1) exercise significantly enhanced GAD67while decreased GABA-T and SSADH expression in the hippocampus of exercised rats. 2) SAC can significantly decrease GAD67while enhance GABA-T and SSADH expression in the hippocampus of exercised rats. So SAC can resist Glu convert to GABA and improve the excitability of the hippocampus and delay the central fatigue in exercised rats. 3) The regulation effect of semen astragali complanati on GAD67, GABA-T and SSADH in hippocampus of exercised rats may be related to its Glu content, anti-oxidant capacity and the effect of improving cerebral anoxia. 4)This study support for Pavlov's theory of "protective inhibition of sports fatigue", but does not fully support the theory that "sports fatigue is an active rather than a passive process".
semen astragali complanati; hippocampus; gene regulation and control; central fatigue
2016-11-07
国家自然科学基金项目(编号:51568066)。
刘志刚(1977- ),男,河北石家庄人,硕士,讲师,研究方向运动生化与营养。
G804.7
A
1009-9840(2017)01-0053-06
