心肌缺血-致命性心动过缓血清代谢特征分析
2017-03-28吴嘉燕王典孔璟王星星于晓军
吴嘉燕,王典,孔璟,王星星,于晓军
(汕头大学医学院法医学教研室,广东汕头 515041)
心肌缺血-致命性心动过缓血清代谢特征分析
吴嘉燕,王典,孔璟,王星星,于晓军
(汕头大学医学院法医学教研室,广东汕头 515041)
目的探讨心肌缺血-致命性心动过缓大鼠血清代谢特征。方法制作心肌缺血-心动过缓-死亡(myocardial ischemia-bradycardia-sudden cardiac death,MI-B-SCD)大鼠模型,以假手术组为对照组,应用气相色谱质谱联用仪检测死后血清代谢谱,结合代谢组学策略分析血清代谢特征。结果MI-B-SCD大鼠血清代谢轮廓与对照差异显著。与假手术组相比,MI-B-SCD大鼠血清赖氨酸、鸟氨酸、嘌呤、丝氨酸、丙氨酸、尿素、乳酸含量明显升高;琥珀酸、棕榈酸、酮己二酸、甘油醛、己烯二酸、辛二酸含量明显下降,其中多种差异代谢物之间存在相关性。结论MI-B-SCD大鼠血清代谢显著改变,赖氨酸与嘌呤有较高的诊断MI-B-SCD价值,可望为心源性猝死的法医鉴定及临床防治提供参考。
法医病理学;心肌缺血;心动过缓;血清;代谢
心源性猝死(sudden cardiac death,SCD)是潜在的心脏疾病突然发作或恶化导致的突然而意外的死亡[1]。我国SCD发生率为41.84/10万,年死亡人数约54.4万人[2]。其中,心肌缺血所致的SCD最常见。目前,对于SCD的研究多集中于心肌缺血快速型心律失常[3],对其所致的缓慢性心律失常,特别是致死性心动过缓研究甚少。Gaul等[4]研究发现,在既往有心血管事件的患者中,尽管发生率低于室性心动过速(ventricular tachycardia,VT)或室性纤维性颤动(ventricular tachycardia/fibrillation,VF),严重心动过缓发生SCD的风险明显高于VT和VF。因此,研究心动过缓的相关机制对防治SCD具有重要意义。本研究拟在建立心肌缺血-致命缓慢性心律失常大鼠模型的基础上,应用气相色谱-质谱联用(GC-MS)技术,结合代谢组学策略,分析其血清代谢轮廓,探讨心肌缺血-致命性心动过缓代谢机制,寻找相关标记物,为法医学相关死因鉴定及临床上SCD的防治提供依据。
1 材料与方法
1.1 实验动物与主要试剂
实验动物:成年Sprague-Dawley(SD)大鼠(12~ 16周龄,体质量250~400 g,均为雄性),由汕头大学医学院实验动物中心提供。
主要试剂:甲醇(色谱纯,上海安谱实验科技股份有限公司)、正亮氨酸(美国SIGMA-ALDRICH公司)、甲氧胺(纯度98%,美国SIGMA-ALDRICH公司)、吡啶(色谱纯,上海阿拉丁生化科技股份有限公司)、二氯甲烷(色谱纯,上海阿拉丁生化科技股份有限公司)、三甲基氯硅烷(TMCS,美国SIGMA-ALDRICH公司)、三氟乙酰胺(MTBSTFA,美国REGIS TECHNOLOGIES公司)。
1.2 心肌缺血-致命性心动过缓-心源性猝死大鼠模型
心肌缺血模型根据常规冠状动脉结扎术[5]建立,其简要步骤如下:大鼠造模前禁食12 h,称重、3%戊巴比妥钠生理盐水溶液(30mg/kg)腹腔注射麻醉,成功后,应用BL-420E+生物机能实验系统(成都泰盟科技有限公司)监测Ⅱ导联心电。气管插管后,通过ALC-V8动物呼吸机(上海奥尔科特生物科技有限公司)人工通气(呼吸频率1∶1,潮气量12mL)。开胸,暴露心脏,撕破心包,挤出心脏,迅速结扎冠状动脉前降支后还纳心脏,观察心电变化70min。心电图(ECG)显示心肌缺血,并快速发生心动过缓-死亡大鼠归为心肌缺血-心动过缓-心源性猝死(myocardial ischemiabradycardia-sudden cardiac death,MI-B-SCD)组。另设置假手术组作为对照,该组大鼠在开胸后,缝合针只穿过大鼠左冠状动脉不作结扎,观察70min后,用弯钩按压胸廓,挤出心脏处死。大鼠死亡或处死后取腹腔静脉血,以离心半径10cm,3000r/min,离心5min后,分离血清,-80℃保存待测。
依据参考文献[6]诊断心动过缓,利用生物机能实验系统软件统计大鼠术后至发生心动过缓的时长、术后VT、VF、室性早搏(ventricular premature beat,VPB)累计时长、术前以及术后的心率(heart rate,HR),采用t检验对比组内及组间心肌缺血前后、MI-B-SCD组与假手术组术后心率,实验组术后心率若有显著下降,则可诊断为心动过缓。根据指南[7],结合VT、VF、VPB累计时长计算心律失常评分,利用t检验对比实验组与假手术组间差异,作为心动过缓诊断的辅助证明。
1.3 血清的GC-MS检测
取100 μL血清加入800 μL甲醇、100 μL超纯水,漩涡震荡1 min,以离心半径10 cm,10 000 r/min,离心10 min(4℃);取200 μL上清液至GC管,加入20 μL 0.5 mmol/L正亮氨酸(0.1 mmol/L HCl),氮气吹干,加入20 μL二氯甲烷,继续吹干;加入30 μL甲氧胺/吡啶(15 mg甲氧胺/mL吡啶),密闭,室温(20℃)震荡16h,肟化;加入30μL MTBSTFA(含1% TMCS),密闭,漩涡1 min,20℃震荡1 h,衍生化,取1μL上机检测。
采用GC-MS系统(7890A GC系统与5975C单相四极杆MSD联用,美国Agilent公司)采集数据,DB-5MS色谱柱(30m×250μm,0.25μm,5%苯交联、95%二甲基聚硅氧烷,美国Agilent公司)。GC-MS色谱条件:进样口温度230℃,脉冲无分流,柱初始温度为60℃,保持2min,以8℃/min程序升温至285℃,保持10min,柱流量为1.0mL/min,载气为高纯氦气。质谱条件:接口温度为290℃,电离方式为标准EI源(70eV),离子源温度为230℃,选择质荷比(m/z)范围为50~600。
1.4 数据分析
GC-MS数据由ChemStation软件进行记录和导出,转化为CDF类型文件,通过R语言生成数据矩阵,并导出为Excel格式;把表格导入SIMCA-P软件,进行偏最小二乘法-判别分析(partial least squares-discriminate analysis,PLS-DA)建模,生成得分散点图,判断总体代谢轮廓的差异,并获得变量重要性投影值(variable importance in the projection,VIP),VIP大于0.75者考虑为差异显著。同时,计算此模型X矩阵差异(R2X)、Y矩阵差异(R2Y)及预测模型差异(Q2)用于评价模型解释率,这3个参数变化范围为0~1,越接近1表示模型越好;置换验证得到所解释的模型差异(R2)截距及所预测的模型差异(Q2)截距用以评判模型是否过拟合。
应用美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)谱库2.0对每一谱峰所属代谢物进行定性。用内标(正亮氨酸)对峰面积进行归一化处理,获得代谢物的相对含量,计算MI-B-SCD组与假手术组的变化倍数。应用SPSS 17.0进行t检验、Pearson相关系数(r)检验,检验水准α= 0.05。利用MedCalc绘制受试者工作特征(receiver operating characteristic,ROC)曲线并利用此软件计算出判断点及ROC曲线下面积(area under ROC curve,AUC),分析差异显著代谢的诊断价值,判断点同时可作为诊断临界点;利用多因素降维(multifactor dimensionality reduction,MDR)软件进行层次聚类分析,筛选具有较高诊断价值的代谢物及其组合。差异代谢物根据数据库MBRole(http://csbg.cnb.csic.es/mbrole/)、KEGG(http://www.genome.jp/kegg/pathway.html),分析相关代谢通路。
2 结果
2.1 心肌缺血致命性心动过缓心电图特征
本研究制作了40只冠状动脉结扎-心肌缺血模型大鼠,其中6只(15%)结扎后3min内发生心动过缓,且无发生或仅出现阵发性VT或VF,直接死亡,定义为MI-B-SCD组,纳入本研究;11只发生VT和VF,其余23只缺血70 min内未发生死亡(伴有阵发性VT或VF及房室传导阻滞),根据本研究目标,将后两者排除。另外,成功制备假手术组大鼠6只。
结扎术后,MI-B-SCD组大鼠ECG出现QRS波群增宽,提示心肌缺血,且在结扎后3min内,心率均有20%~50%的下降(前后对比P<0.05),直至死亡。假手术组大鼠术后ECG改变不明显,出现偶发室性早搏(ventricular premature beat,VPB),穿针后心率均无明显变化(P>0.05)(图1及表1)。
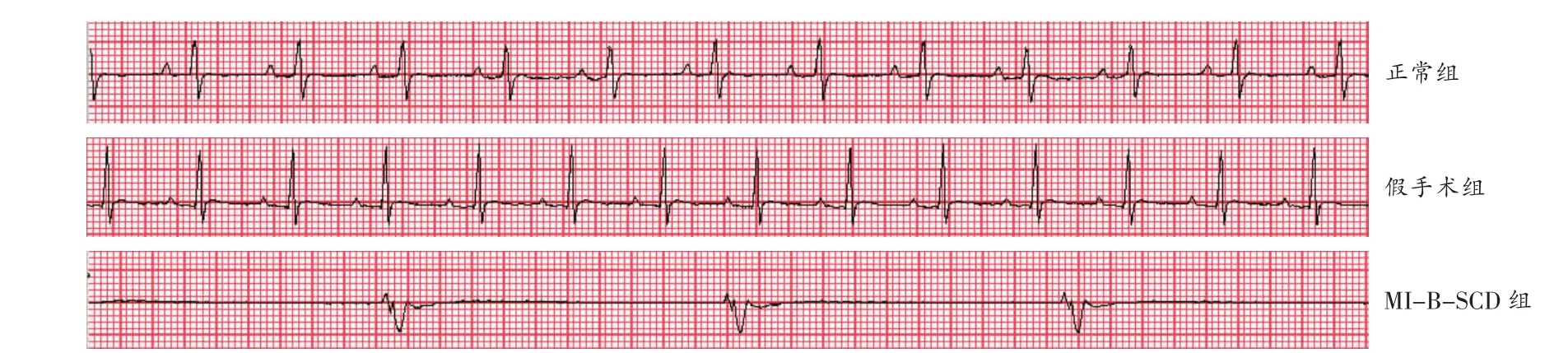
图1 MI-B-SCD组及假手术组大鼠心电图

表1 MI-B-SCD组及假手术组大鼠心电图特征以及死亡原因
MI-B-SCD组术后VPB、VT、VF、VT+VF累计时长分别为(13.07±28.86)、(3.55±4.84)、(3.04±7.43)、(6.58±8.65)s,心律失常评分为1.50±1.05,术后HR为(211.00±28.51)次/min;假手术组术后VPB、VT、VF、VT+VF累计时长分别为(0.06±0.13)、(0.52±1.27)、0、(0.52±1.27)s,心律失常评分为0.50±0.84,术后HR为(342.83±18.71)次/min,两组间术后HR差异有统计学意义(P<0.05),术后VPB、VT、VF累计时长以及心律失常评分差异无统计学意义(P>0.05)。
2.2 MI-B-SCD组大鼠血清代谢轮廓分析
PLS-DA模型显示MI-B-SCD组的代谢轮廓明显分开,该模型的R2X、R2Y及Q2值分别为0.712、0.783、0.497,经过200次置换验证得到R2、Q2截距分别为0.573、-0.140,提示PLS-DA模型未过拟合(图2)。在PLS-DA得分散点图中,每一个点代表该份血清的总体代谢特征,图2提示MI-B-SCD大鼠血清代谢轮廓与假手术组差异显著。
2.3 MI-B-SCD大鼠血清差异代谢物及代谢路径分析
本研究发现,多维模式6种代谢物VIP值>0.75,包括丙氨酸、甘油醛、酮己二酸、尿素、乳酸、琥珀酸;单维模式中,通过t检验,发现7种代谢物相对含量之间的差异存在统计学意义(P<0.05),包括赖氨酸、嘌呤、辛二酸、棕榈酸、鸟氨酸、己稀二酸、丝氨酸(表2)。根据数据库MBRole、KEGG,这些差异代谢物提示心肌缺血致命性心动过缓时被扰动的代谢通路包括,糖酵解、自由脂肪酸β-氧化、嘌呤核苷酸代谢、柠檬酸循环、氰基氨基酸代谢和尿素循环。

图2 MI-B-SCD及假手术组血清代谢轮廓分析
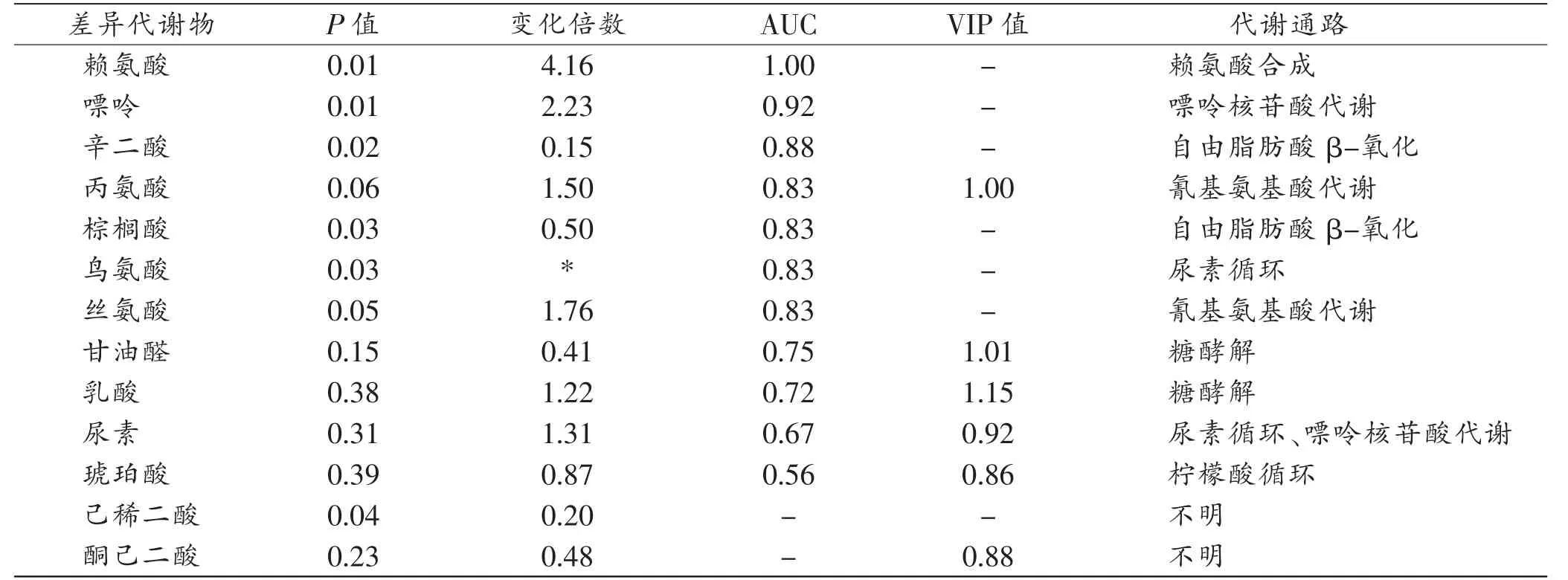
表2 MI-B-SCD组与假手术组血清差异显著代谢物
2.4 差异代谢物的交互分析
为了进一步整体分析代谢物交互关系,本研究应用SPSS 16.0软件计算各差异代谢物之间的Pearson相关系数。表3显示尿素与乳酸、尿素与丝氨酸、丝氨酸、丙氨酸与棕榈酸、甘油醛与酮己二酸、甘油醛与己稀二酸、辛二酸与己稀二酸、赖氨酸与嘌呤之间均存在强相关关系(r≥0.8),其他则均为中度相关关系(0.8>r>0.5)。这些结果提示了MI-B-SCD血清代谢的系统性改变。
2.5 差异代谢物的诊断价值分析
本研究通过分析差异代谢物,发现赖氨酸及嘌呤AUC均大于0. 9;鸟氨酸、乳酸、丙氨酸、丝氨酸、辛二酸、棕榈酸和甘油醛在0.7~0.9(表2),提示其均具有较高的诊断MI-B-SCD的价值。
另外,本研究应用MDR分析各代谢物聚类情况,以此判断代谢物在区分MI-B-SCD大鼠与假手术组的贡献。首先根据ROC分析得到判断点,利用判断点,生成分类列表,导入MDR软件,得到层次聚类图(图3A),可见辛二酸、鸟氨酸、棕榈酸、甘油醛及丝氨酸属于一大类,其中辛二酸与鸟氨酸、甘油醛与丝氨酸位于同一级分支,对区分MI-B-SCD大鼠具有相同价值;以此类推,嘌呤、尿素和赖氨酸、琥珀酸、乳酸和丙氨酸对心动过缓的区别及假手术的诊断均具有相同价值。其中,辛二酸与鸟氨酸、甘油醛与丝氨酸、尿素与赖氨酸均在最高级分支上,提示其共同具有最高的诊断价值。

表3 特异性代谢物相关性分析(相关系数)
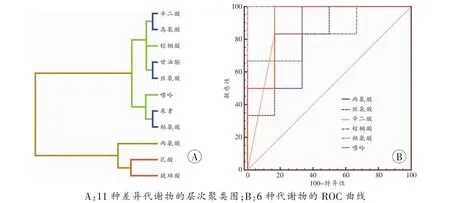
图3 差异代谢物的诊断潜能分析
3 讨论
心肌缺血后代谢将首先受到影响,并可导致一系列严重的后果,包括离子平衡的破坏,氧化应激、心律失常以及心源性猝死[8]。心律失常是心肌缺血最主要、最严重的并发症,缓慢心律失常是其中重要的类型。从整体上了解心肌缺血-缓慢性心律失常代谢轮廓对探讨相关发病机制,寻找SCD诊断或鉴定标记物以及治疗靶点有重要的意义。
本研究选择血清为检测对象考虑如下:(1)血清是体内代谢物存储库,其中的代谢改变反映了一种疾病或病理生理状态下机体总体的代谢特征;(2)血清数据易于临床转化;(3)可为下一步心肌相关研究提供方向。
本研究发现MI-B-SCD组大鼠血清代谢轮廓与假手术组差异显著(图2)。(1)氧化供能底物,包括两种脂肪酸(辛二酸及棕榈酸)均有所下降,该结果与前期类似的研究[9,10]不一致。心肌主要供能物质是自由脂肪酸(free fatty acid,FFA),次要的供能物质是葡萄糖、酮体等,在心肌缺血-心动过缓的情况下,由于“保氧原则”,心肌会偏向于糖类作为供能物质[11]。但Folmes等[12]的研究提示在轻度缺血的情况下,心肌主要供能物质仍然为自由脂肪酸。笔者认为,MI-BSCD大鼠,由于缺血时间短,心脏仍处于一种轻度缺血状态,心肌的主要供能物质仍为脂肪酸。因此,导致其消耗增多,其血清中的含量下降。(2)糖酵解中间产物甘油醛含量下降,终产物乳酸的含量升高,这与前期多项研究[13-15]结果一致。基于“保氧原则”,心肌在缺氧条件下,偏向于耗氧量更少的无氧氧化,即糖酵解增强而糖的有氧氧化受抑制,而柠檬酸循环中间产物琥珀酸含量下降则为后者的结果。此外,在缺氧-心动过缓的条件下,ATP合成少,分解增加[16],导致AMP增加,最终致血清中嘌呤含量升高。(3)丙氨酸含量明显升高,与Yamamoto等[17]的研究结果一致。前期另一项研究[18]发现,离体心肌在低流量缺血条件下,丙氨酸主要来源于丙酮酸。这与心肌缺血-心动过缓时无氧酵解增强,乳酸脱氢酶活性相对不足,造成作为底物的丙酮酸过剩的事实相吻合。此外,丙氨酸是蛋白分解的重要产物,其含量升高也提示在心肌缺血-心动过缓时心肌蛋白分解加强,功能受损。(4)鸟氨酸及尿素含量明显升高。该结果提示,心肌缺血致心动过缓时尿素循环活跃,更多的氨基酸通过无毒性的尿素实现转氨基,可能是心肌的一种保护机制。Shukla等[19]的研究证实了此推论,研究发现,在辐射诱导心动过缓的小鼠模型中,辐射前注射精氨酸加重心动过缓及心肌损害的程度,辐射后注射则逆转心动过缓,保护心肌。其原因是辐射前注射精氨酸会增强一氧化氮合酶(nitric oxide synthase,NOS)活性,导致一氧化氮的合成过度及心肌损伤。辐射后注射精氨酸,则有助于提高精氨酸酶的活性,减少精氨酸往NOS途径的代谢,增加其流向尿素循环的代谢。Nahavandi等的[20]研究也证实了抑制NOS活性可校正心动过缓。此外,赖氨酸已被证实对心脏损伤有保护作用。因此,心肌缺血-心动过缓大鼠血清赖氨酸含量明显升高亦可能是一种保护机制。总体上,在缺血-心动过缓的情况下,供能底物消耗增加,糖无氧氧化加强,精氨酸偏向于流向尿素循环,导致尿素和鸟氨酸的积累,起心肌保护作用的赖氨酸明显升高,即呈心肌能量代谢障碍、蛋白分解加强,转氨活跃、心肌保护等病理生理改变。
在差异代谢物的诊断潜能方面,赖氨酸与嘌呤表现出诊断MI-B-SCD较大的潜能,体现为较大的AUC值及较高的特异性与敏感性,而且,在层次聚类图中处于最高级。此外,鸟氨酸、乳酸、丙氨酸、丝氨酸、辛二酸、棕榈酸和甘油醛也具有一定的诊断潜能。这些差异代谢物将为下一步大样本筛选、确认提供重要的方向。这些结果有望为法医病理学死因鉴定及临床转化提供重要的参考。
[1]Mann DL,Zipes DP,Libby P,et al.Braunwald’s Heart Disease:A Textbook of Cardiovascular Medicine[M].10th edition.Canada:Elsevier,2015.
[2]Hua W,Zhang LF,Wu YF,et al.Incidence of sudden cardiac death in China:analysis of 4 regional populations[J].J Am Coll Cardiol,2009,54(12):1110-1118.
[3]Deyell MW,Krahn AD,Goldberger JJ.Sudden cardiac death risk stratification[J].Circ Res,2015,116(12):1907-1918.
[4]Gaul GB,Gruska M,Titscher G,et al.Prediction of survival after out-of-hospital cardiac arrest:results of a community-based study in Vienna[J].Resuscitation,1996,32(3):169-176.
[5]Gao Y,Gao J,Chen C,et al.Cardioprotective effect of polydatin on ventricular remodeling after myocardial infarction in coronary artery ligation rats[J]. Planta Med,2015,81(7):568-577.
[6]Maia RC,Sousa LE,Santos RA,et al.Time-course effects of aerobic exercise training on cardiovascular and renal parameters in 2K1C renovascular hypertensive rats[J].Braz J Med Biol Res,2015,48(11):1010-1022.
[7]Curtis MJ,Walker MJ.Quantification of arrhythmias usingscoringsystems:anexaminationofseven scores in anin vivomodel of regional myocardial ischaemia[J].Cardiovasc Res,1988,22(9):656-665.
[8]Laborde CM,Mourino-Alvarez L,Posada-Ayala M,et al.Plasma metabolomics reveals a potential panel of biomarkers for early diagnosis in acute coronary syndrome[J].Metabolomics,2014,10(3):414-424.
[9]Kang SM,Park JC,Shin MJ,et al.1H nuclear magnetic resonance based metabolic urinary profiling of patients with ischemic heart failure[J].Clin Biochem,2011,44(4):293-299.
[10]Sack MN,Rader TA,Park S,et al.Fatty acid oxidation enzyme gene expression is downregulated in the failing heart[J].Circulation,1996,94(11):2837-2842.
[11]Abdurrachim D,Luiken JJ,Nicolay K,et al.Good and bad consequences of altered fatty acid metabolism in heart failure:evidence from mouse models[J]. Cardiovasc Res,2015,106(2):194-205.
[12]Folmes CD,Sowah D,Clanachan AS,et al.High rates of residual fatty acid oxidation during mild ischemia decrease cardiac work and efficiency[J].J Mol Cell Cardiol,2009,47(1):142-148.
[13]Sabatine MS,Liu E,Morrow DA,et al.Metabolomic identification of novel biomarkers of myocardial ischemia[J].Circulation,2005,112(25):3868-3875.
[14]Rimachi R,Bruzzi DCF,Orellano-Jimenez C,et al. Lactate/pyruvate ratio as a marker of tissue hypoxia in circulatory and septic shock[J].Anaesth Intensive Care,2012,40(3):427-432.
[15]Lazzeri C,Valente S,Chiostri M,et al.Lactate in the acute phase of ST-elevation myocardial infarction treated with mechanical revascularization:a singlecenter experience[J].Am J Emerg Med,2012,30(1):92-96.
[16]Lloyd HG,Deussen A,Wuppermann H,et al.The transmethylation pathway as a source for adenosine in the isolated guinea-pig heart[J].Biochem J,1988,252(2):489-494.
[17]Yamamoto M,Lee JD,Shimizu H,et al.Evaluation of post-ischemic myocardial metabolism by1H-magnetic resonance spectroscopy in the rabbit heart[J]. Jpn Circ J,1994,58(9):707-712.
[18]Zhao P,Storey CJ,Babcock EE,et al.1H NMR detection of lactate and alanine in perfused rat hearts during global and low pressure ischemia[J].Magn Reson Med,1995,33(1):53-60.
[19]Shukla J,Khan NM,Thakur VS,et al.L-arginine mitigates radiation-induced early changes in cardiac dysfunction:the role of inflammatory pathways[J].Radiat Res,2011,176(2):158-169.
[20]Nahavandi A,Dehpour AR,Mani AR,et al.The role of nitric oxide in bradycardia of rats with obstructive cholestasis[J].Eur J Pharmacol,2001,411(1-2):135-141.
Metabolic Characteristics of Lethal Bradycardia Induced by Myocardial Ischemia
WU Jia-yan,WANG Dian,KONG Jing,WANG Xing-xing,YU Xiao-jun
(Department of Forensic Pathology,Medical College,Shantou University,Shantou 515041,China)
ObjectiveTo explore the metabolic characteristics of lethal bradycardia induced by myocardial ischemia in rat’s serum.MethodsA rat myocardial ischemia-bradycardia-sudden cardiac death(MI-BSCD)model was established,which was compared with the sham-operation group.The metabolic profile of postmortem serum was analyzed by gas chromatography-mass spectrometry(GC-MS),coupled with the analysis of serum metabolic characteristics using metabolomics strategies.ResultsThe serum metabolic profiles were significantly different between the MI-B-SCD rats and the control rats.Compared to the control rats,the MI-B-SCD rats had significantly higher levels of lysine,ornithine,purine,serine,alanine, urea and lactic acid;and significantly lower levels of succinate,hexadecanoic acid,2-ketoadipic acid, glyceraldehyde,hexendioic acid and octanedioic acid in the serum.There were some correlations among different metabolites.ConclusionThere is obvious metabolic alterations in the serum of MI-B-SCD rat. Both lysine and purine have a high value in diagnosing MI-B-SCD.The results are expected to provide references for forensic and clinical applications of prevention and control of sudden cardiac death.
forensic pathology;myocardial ischemia;bradycardia;serum;metabolic
DF795.1
A
10.3969/j.issn.1004-5619.2017.01.003
1004-5619(2017)01-0011-06
2016-04-28)
(本文编辑:邹冬华)
广东省自然科学基金资助项目(2015A030313437);广东省科技创新资助项目(2013KJCX0076)
吴嘉燕(1990—),女,硕士研究生,主要从事法医病理学研究;E-mail:184086295@qq.com
王典,男,副研究员,主要从事心源性猝死代谢组学研究;E-mail:g_dwang@stu.edu.cn
