高效液相色谱-电感耦合等离子体质谱法分析经牛黄解毒片暴露后大鼠血清中砷形态
2017-03-28陈绍占刘丽萍杜宏举金鹏飞周天慧
陈绍占,刘丽萍,2,杜宏举,金鹏飞,周天慧
(1.北京市疾病预防控制中心,北京 100013;2.首都医科大学公共卫生学院,北京 100069;3.北京医院,北京 100730)
高效液相色谱-电感耦合等离子体质谱法分析经牛黄解毒片暴露后大鼠血清中砷形态
陈绍占1,刘丽萍1,2,杜宏举1,金鹏飞3,周天慧1
(1.北京市疾病预防控制中心,北京 100013;2.首都医科大学公共卫生学院,北京 100069;3.北京医院,北京 100730)
采用高效液相色谱-电感耦合等离子体质谱联用技术测定经牛黄解毒片暴露后大鼠血清中的砷形态。以乙腈为提取剂,采用60 ℃水浴超声提取法对血清样品进行前处理,提取液以13 000 r/min离心10 min,上清液过0.45 μm滤膜。采用Dionex IonPac AS19分析柱(250 mm×4 mm×10 μm),以20 mmol/L碳酸铵(pH 9.7)-3%甲醇溶液作为流动相,分析经牛黄解毒片暴露后大鼠血清中的砷形态。结果表明,AsB、DMA(Ⅴ)、As(Ⅲ)、MMA(Ⅴ)和As(Ⅴ)的检出限分别为0.05、0.05、0.08、0.10和0.10 μg/L;线性相关系数(R2)大于0.999;加标回收率在86.3%~109.2%之间,相对标准偏差RSD小于5%。通过对经牛黄解毒片暴露后大鼠血清中砷形态的分析发现,DMA(Ⅴ)和U1为主要的砷形态,另外含有少量的AsB和U2。该方法灵敏度高、提取效率好,实现了多种已知和未知砷形态的同时分离,可为研究牛黄解毒片在大鼠血液中的代谢提供技术支持。
高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS);牛黄解毒片;血清;砷形态
牛黄解毒片为常用中成药,具有明显的解热、抗炎以及镇痛、镇静、抗惊厥等作用,对引发各种炎症的多种致病微生物有较强的抑制作用。牛黄解毒片由牛黄、黄芩、雄黄、石膏、大黄、桔梗、冰片、甘草等药材组成[1],其中雄黄为含砷矿物质,主要成分是二硫化二砷,属不可溶性砷,无毒性,但其杂质中可能含有毒性较大的可溶性三氧化二砷和五氧化二砷。近年来,牛黄解毒片所致不良反应引起了人们的重视。
超量摄入砷或长期少量摄入砷至体内蓄积到一定量均可引起中毒。砷一旦摄入,就会被人体吸收并分布到全身各处,然后迅速由尿排出。已有研究表明,健康志愿者一次吃3片牛黄解毒片,一日2次,7日后尿中排泄的总砷含量低于摄入剂量的1%[2]。砷的代谢取决于摄入的砷形态,如三价砷会代谢成甲基化的砷形态,而有一些砷形态则保持不变。另一项研究表明,摄入单片牛黄解毒片后,人尿中可检出一甲基砷酸[MMA(Ⅴ)]和二甲基砷酸[DMA(Ⅴ)][3]。常规临床监测以测定尿砷为主,这是由于砷在血液中的清除率非常快(<1 h)[4-5]。尿液中砷形态的分析方法已有大量研究[6-10],但可用于全血、血清或血浆中砷形态分析的方法则较少[11-14]。
在人血中已检出的砷形态包括:砷甜菜碱(AsB)、一甲基砷酸[MMA(Ⅴ)]、二甲基砷酸[DMA(Ⅴ)]、三价砷[As(Ⅲ)]和五价砷[As(Ⅴ)][12, 15-17]。血液中砷代谢产物的测定有助于理解补充叶酸在人体内对砷代谢和消除的影响[18]。Pi 等[19]研究了血液中各种砷形态和氧化应激水平之间的关系,得出氧化应激水平和血液中MMA(Ⅴ)与无机砷的比例有关,而不是与砷的浓度有关。尽管发表的相关研究有限,但有报道认为血砷测定是连续砷暴露的一个有用的指标[20]。
本工作拟采用高效液相色谱-电感耦合等离子体质谱联用技术分析经牛黄解毒片暴露后大鼠血清中的砷形态,通过优化前处理过程提高提取效率,希望为探究砷化合物在动物体内的代谢提供技术支持。
1 实验部分
1.1 仪器与试剂
1260型高效液相色谱仪,7700x型电感耦合等离子体质谱仪:美国Agilent公司产品;Dionex IonPac AS19 阴离子交换柱(250 mm×4 mm×10 μm)及保护柱:美国Thermo公司产品;Milliplus 2150 超纯水处理系统:美国Millipore公司产品;数控超声清洗器:昆山市超声仪器有限公司产品;干燥箱:德国MMM集团产品;高速离心机:美国Beckman公司产品;N-EVAP氮吹仪:美国Organomation公司产品。
超纯水:电阻率18.2 MΩ·cm,由Millipore超纯水仪制备;(NH4)2CO3、NH3·H2O、NaCl、H2O2(30%):均为优级纯;乙腈、甲醇:北京迪马科技有限公司产品;硝酸:纯度65%,德国Merck公司产品;亚砷酸根离子As(Ⅲ)(GBW 08666)、砷酸根离子As(Ⅴ)(GBW 08667) 、一甲基砷MMA(Ⅴ)(GBW 08668)、二甲基砷DMA(Ⅴ)(GBW 08669)、砷甜菜碱AsB(GBW 08670)等砷标准物质:均由中国计量科学研究院提供;用于总砷含量测定的环境校准标准溶液:美国Agilent公司产品。
1.2 样品的采集和保存
将经牛黄解毒片暴露30天后的大鼠注射麻药,取10 mL腹主动脉血于离心管中,以5 000 r/min离心10 min,取血清,储存于-20 ℃,待分析。
1.3 样品前处理
1.3.1 总砷测定前处理方法 取0.5 mL放置至室温的血清样品于15 mL聚丙烯离心管中,加入4.5 mL 1%硝酸,混匀后采用ICP-MS测定,同时制备空白溶液。
1.3.2 砷形态测定前处理方法 取0.2 mL放置至室温的血清样品于1.5 mL聚丙烯离心管中,加入0.4 mL乙腈,涡旋30 s,采用超声提取法提取,于60 ℃超声1.5 h,然后以13 000 r/min离心10 min,取上清液,氮气吹干,用超纯水复溶至0.6 mL,同时制备空白溶液,采用HPLC-ICP-MS测定。上机后,向提取液中加入1%过氧化氢,于60 ℃干燥箱中加热1 h,然后进行HPLC-ICP-MS测定。
1.4 分析方法
1.4.1 总砷含量测定 选取同位素75As,以72Ge(1 mg/L)为内标元素,在线加入内标溶液,ICP-MS主要参数列于表1。将标准系列工作液分别注入电感耦合等离子体质谱仪中,测定相应的信号响应值,以标准工作液的浓度为横坐标,以响应值-离子每秒计数值(cps)为纵坐标,绘制标准曲线。ICP-MS测定总砷含量时的标准曲线浓度为0、0.5、1、5、10、50、100、300、500 μg/L,可根据待测样品中砷的实际含量适当调整。本实验测定血清中总砷含量采用的浓度为0、0.5、1、5、10、50 μg/L,样品浓度与质谱信号强度成正比。

表1 ICP-MS主要参数Table 1 Main parameters of ICP-MS
注:a为测定总砷含量时的参数;b为测定砷形态时的参数;未注明的为通用参数
1.4.2 砷形态测定条件 色谱条件:选取Dionex IonPac AS19柱(250 mm×4 mm×10 μm)作为分析柱;以20 mmol/L碳酸铵(pH 9.7)-3%甲醇溶液为流动相,流速1.0 mL/min,等度洗脱,进样量25 μL。
质谱条件:采用具有同心雾化器的电感耦合等离子体质谱仪(具碰撞反应池)进行检测;选取同位素75As,以标准模式进行测定。
2 结果与讨论
2.1 仪器检测模式的选择
实验考察了标准模式和氦模式下5种砷形态化合物的检出限,结果列于表2。结果显示:在标准模式,AsB、DMA(Ⅴ)、As(Ⅲ)、MMA(Ⅴ)和As(Ⅴ)的检出限分别为0.10、0.10、0.10、0.15、0.15 μg/L;在氦模下分别为0.20、0.20、0.20、0.25、0.25 μg/L。可见,标准模式下的检出限均较低。
实验还考察了两种模式对40Ar35Cl+、75As检测信号的影响。分别配制不同质量浓度的氯离子溶液(含5 μg/L 5种砷形态的混合标准溶液),上机进行色谱分析。在标准模式下,当氯离子浓度大于或等于600 mg/L时,在6.44 min出现ArCl干扰峰,示于图1a。结果显示,此峰不干扰待测的5种砷形态化合物的测定,可以忽略。在氦模式下,当氯离子浓度为600 mg/L时,在6.44 min处未出现ArCl干扰峰,结果示于图1b。综上,本实验选择标准模式进行砷形态化合物的检测。

表2 在标准模式和氦模式下,5种砷形态化合物的检出限Table 2 Detection limits of five arsenic species under standard mode and He gas mode
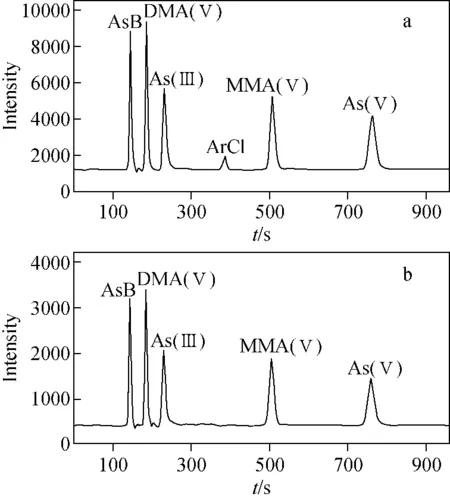
图1 标准模式(a)和氦气模式(b)下,氯离子浓度为600 mg/L时,5种砷形态化合物的色谱图Fig.1 Chromatograms of five arsenic species containing 600 mg/L chlorine ion under standard mode (a) and He gas mode (b)
2.2 流动相中甲醇浓度的优化
据报道,有机溶剂作为基体改进剂可以提高第一电离能在9~11 eV的元素的电离效率,尤其是对于As(9.79 eV)和Se(9.75 eV)[21-23]。在HPLC-ICP-MS技术中,甲醇已多次被用于增强砷形态的信号强度[24-25]。因此,本实验在流动相中加入甲醇,并对添加浓度进行优化。
分别配制含有0%、1%、2%、3%、4%和5%甲醇的流动相,对5种砷形态混合标准溶液(10 μg/L)进行洗脱,考察甲醇浓度对5种砷形态化合物的信号强度(用积分面积表示)和保留时间的影响。结果表明,当流动相中甲醇浓度为4%时,砷信号强度达到最高值;当超过这一浓度时,砷信号强度开始下降,结果示于图2。实验另表明,AsB和DMA(Ⅴ)的保留时间几乎没有变化;As(Ⅲ)、MMA(Ⅴ)和As(Ⅴ)的保留时间随甲醇浓度的增大而逐渐增大。通过在线观察,发现分析柱的压力也随甲醇浓度的增大而增大。
虽然甲醇对As信号强度具有增敏作用,但容易在采样锥和截取锥上产生碳蓄积,长时间碳蓄积会造成锥孔堵塞。综合考虑信号强度、分析时间、仪器损害等方面的因素,选择3%甲醇作为增敏剂。此时,AsB、DMA(Ⅴ)、As(Ⅲ)、MMA(Ⅴ)和As(Ⅴ)的检出限分别为0.05、0.05、0.08、0.10和0.10 μg/L。
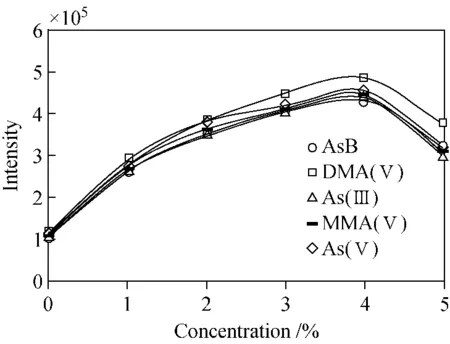
图2 流动相中甲醇浓度对5种砷形态化合物信号强度的影响Fig.2 Effect of methanol concentration in mobile phase on signal intensity of arsenic species
2.3 血清中砷形态的定性
在血清中,除了检测出AsB和DMA(Ⅴ),还有两种未知砷化物,其色谱图示于图3。未知砷化物1(U1)出现在As(Ⅲ)出峰位置附近,此峰的保留时间为4.3 min,而As(Ⅲ)的保留时间为3.9 min,基本可以确认此峰不是As(Ⅲ)。未知砷化物2(U2)的保留时间为8.0 min。为了进一步确认未知化合物,向血清提取液中加入与U1峰面积相当的As(Ⅲ)标准溶液,同时参考文献[26]的方法对未加标的血清提取液进行氧化实验。
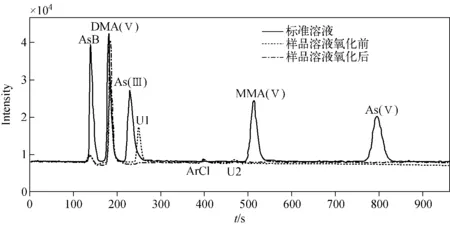
图3 5种砷形态混合标准溶液及血清中砷形态氧化前后对比色谱图Fig.3 Chromatogram of five arsenic species standard solution, sample solution before and after oxidation
经多次试验表明,As(Ⅲ)和U1化合物的保留时间有明显差异,部分产生了重叠。氧化实验结果显示,氧化后U1峰和U2峰消失,氧化后DMA(Ⅴ)的峰面积与氧化前DMA(Ⅴ)的峰面积和U1峰面积的总和相吻合,同时未检出As(Ⅴ),结果示于图3和表2。由此可推断,U1化合物可能为DMA(Ⅲ),U2化合物尚不能确定。因此,可采用DMA(Ⅴ)氧化前后浓度的变化值作为U1浓度值。
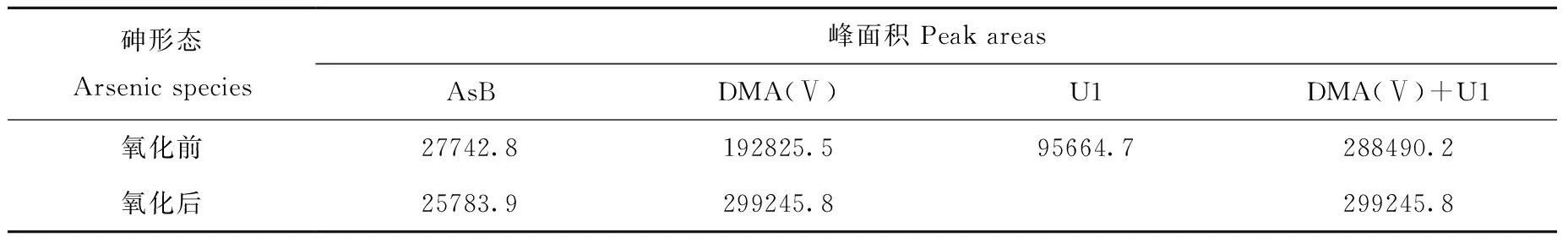
表3 血清中各砷形态氧化前后的峰面积Table 3 Peak areas of arsenic species in blood serum before oxidation and after oxidation
2.4 前处理方法的优化
2.4.1 提取剂的选择 选择一份经牛黄解毒片暴露30天后的大鼠血清样品进行前处理优化试验,通过ICP-MS测定其总砷含量为43.02 μg/L,以提取后各砷形态含量的总和与总砷含量的比值为提取效率考察该提取方法的能力。
文献中多采用水稀释[13]、甲醇[27]或乙腈[13]沉淀蛋白后,离心过膜上机测定的方法。1%硝酸作为一种提取剂常用于大米中砷形态的提取。因此,本实验采用直接离心的方法分别考察了水、甲醇、乙腈和1%硝酸作为提取剂对血清中砷形态提取效果的影响,结果示于图4。结果显示,不同提取剂的提取效率为:1%硝酸(75.7%)>乙腈(9.3%)>甲醇(8.5%)>水(7.7%)。但1%硝酸作为提取剂时,在五价砷出峰位置出现了几个杂峰,导致五价砷不能准确定量。水和1%硝酸沉淀蛋白能力弱,不能有效除去蛋白,会导致蛋白在分析柱上积累而造成堵塞。而甲醇和乙腈具有很强的沉淀蛋白能力,乙腈的提取效率要高于甲醇的提取效率。综合考虑,选择乙腈作为沉淀剂和提取剂为宜。但按照文献中直接离心的处理方法,砷形态的测定结果只占总砷含量的10%左右。因此,需要进一步通过优化前处理条件来提高砷形态的提取效率。
2.4.2 提取方法的选择 以乙腈为提取剂,对提取方法进行优化选择。本实验分别采用直接离心、60 ℃加热提取1 h和60 ℃水浴超声提取1 h对血清中砷形态进行提取,结果示于图5。结果显示,不同提取方法的提取效率为:水浴超声提取>加热提取>直接离心。因此,选择水浴超声提取作为本实验的提取方法。
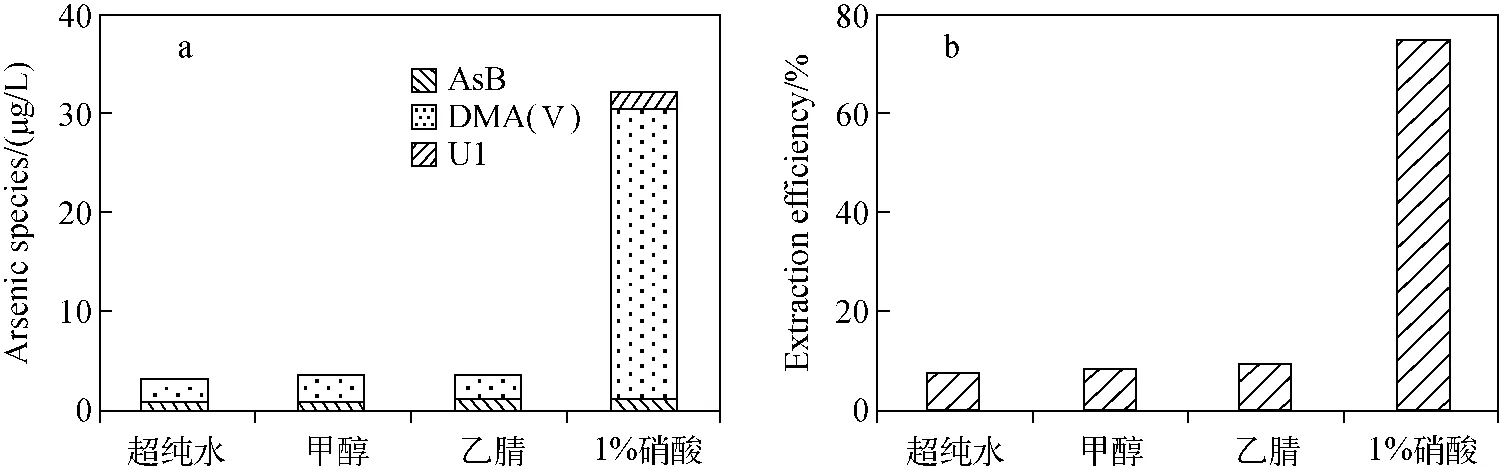
注:a.各砷形态含量;b.提取效率图4 不同提取剂对血清中砷形态的提取效果Fig.4 Effect of different extractants on the extraction of arsenic species in serum
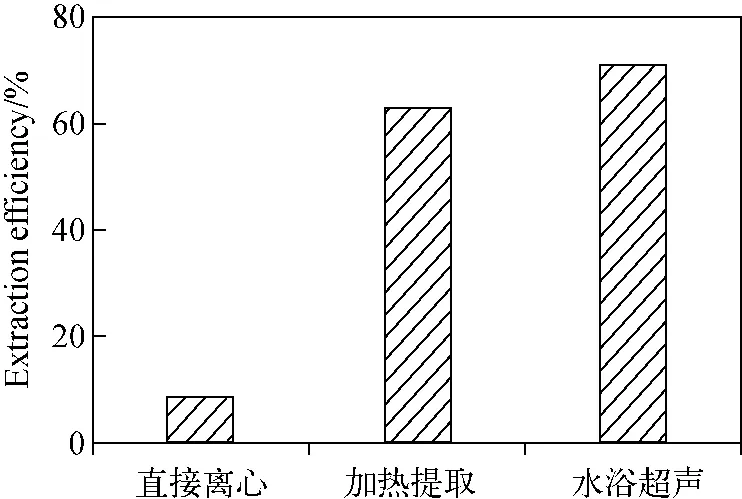
图5 不同提取方法对血清中砷形态的提取效果Fig.5 Effect of different extraction methods on the extraction of arsenic species in serum
2.4.3 提取温度和提取时间的优化 将水浴超声提取时间设为30 min,对提取温度进行优化,结果示于图6。结果显示,提取效率随提取温度的升高而提高。当提取温度为60 ℃或者更高时,提取效率基本保持不变;但提取温度为60 ℃时,U1的测定值达到最大值;提取温度高于60 ℃时,U1的测定值开始下降,DMA(Ⅴ)的测定值升高。这说明提取温度高于60 ℃时,部分U1可能转化为DMA(Ⅴ)。因此,本实验选择的提取温度为60 ℃。
将水浴超声提取温度设为60 ℃,对提取时间进行优化,结果示于图7。结果表明,提取时间为90 min时,提取效率最佳,同时U1的浓度也相对较高。
提取条件最佳时,提取效率约为73.4%。因此,推测一部分砷形态随蛋白沉淀被带走,于是对血清沉淀蛋白中的砷进行考察。将沉淀的蛋白转移至10 mL小烧杯中,加入2 mL硝酸和1 mL过氧化氢,于电热板上进行消解,消解完成后赶酸至近干,用2 mL超纯水复溶,同时做全程空白,采用ICP-MS测定消解液的总砷含量。结果显示,沉淀的蛋白中总砷含量占血清中总砷含量的19.8%。沉淀的蛋白中总砷含量与提取的总砷形态含量之和占血清中总砷含量的93.2%,这与之前的推断相吻合。
2.5 方法的线性范围及检出限
分别配制0.5、1、5、10、50、100、200、300 μg/L 5种砷形态混合标准系列,在优化的实验条件下进行分析,在0.5~300 μg/L 范围内,相关系数(R2) 均大于0.999,结果列于表4。采用逐级稀释法,将待测物的信噪比(S/N)大于或等于3时的浓度确定为该化合物的检出限。AsB、DMA(Ⅴ)、As(Ⅲ)、MMA(Ⅴ)和As(Ⅴ)的检出限分别为0.05、0.05、0.08、0.10和0.10 μg/L。

注:a.各砷形态含量;b.提取效率图6 提取温度对血清中砷形态提取效果的影响Fig.6 Effect of different extraction temperatures on the extraction of arsenic species in serum
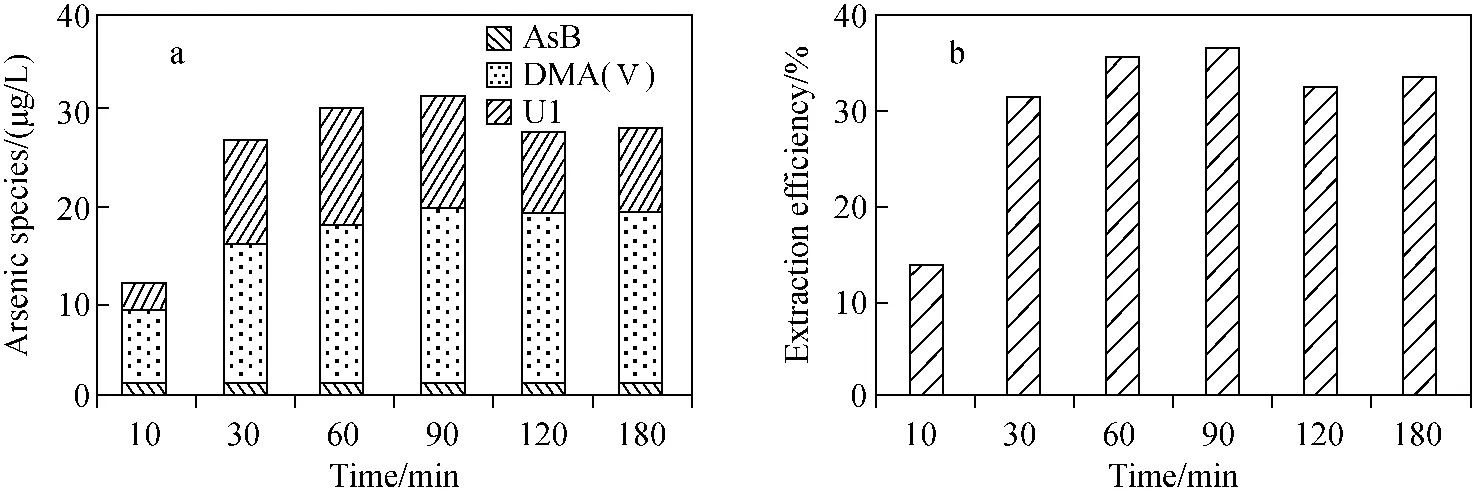
注:a.各砷形态含量;b.提取效率图7 提取时间对血清中砷形态提取效果的影响Fig.7 Effect of different extraction times on the extraction of arsenic species in serum
表4 方法的线性范围及检出限
Table 4 Linear ranges and limit of detections of the method
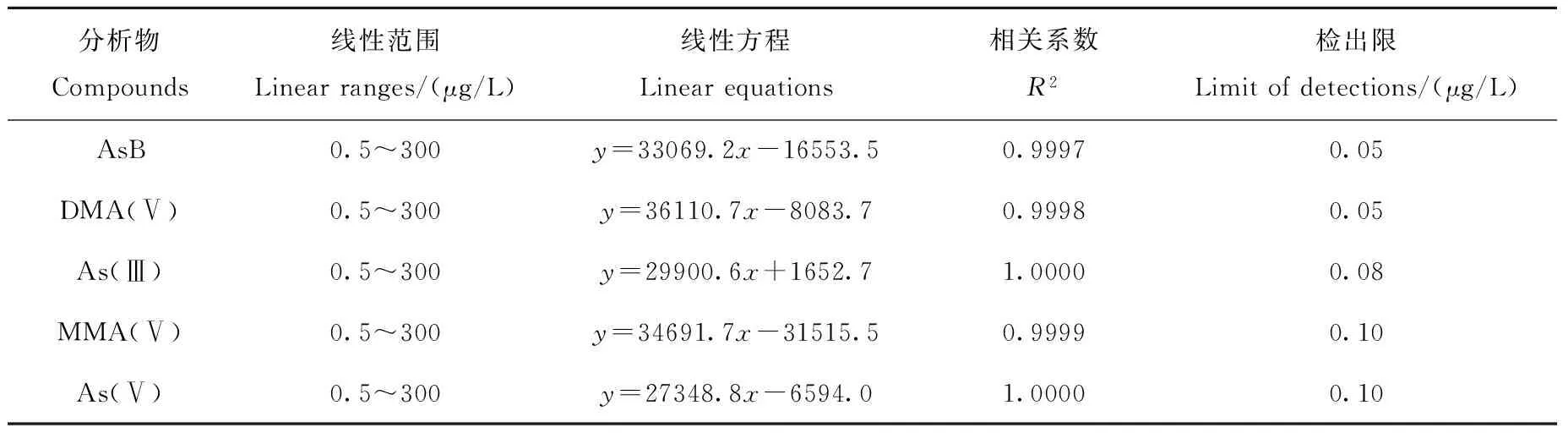
分析物Compounds线性范围Linearranges/(μg/L)线性方程Linearequations相关系数R2检出限Limitofdetections/(μg/L)AsB0.5~300y=33069.2x-16553.50.99970.05DMA(Ⅴ)0.5~300y=36110.7x-8083.70.99980.05As(Ⅲ)0.5~300y=29900.6x+1652.71.00000.08MMA(Ⅴ)0.5~300y=34691.7x-31515.50.99990.10As(Ⅴ)0.5~300y=27348.8x-6594.01.00000.10
2.6 方法的准确性及重复性
以加标回收率实验考察方法的准确性,以精密度实验考察重复性。加标实验结果显示,在前处理过程中,有一部分As(Ⅲ)转化成As(Ⅴ),但As(Ⅲ)和As(Ⅴ)的总量保持不变。因此,以无机砷(包含三价砷和五价砷,简称iAs)、AsB、DMA(Ⅴ)、MMA(Ⅴ)对实验的精密度和加标回收率进行考察。向血清样品中分别加入3个质量浓度水平的AsB、As(Ⅲ)、DMA(Ⅴ)、MMA(Ⅴ)、As(Ⅴ)5种砷形态混合标准溶液,制备成6个模拟样品,进行回收率和精密度实验,结果列于表5。AsB、DMA(Ⅴ)、MMA(Ⅴ)、无机砷的加标回收率在86.3%~109.2%之间,相对标准偏差RSD小于5%。
2.7 血清样品中砷形态分析
在优化的实验条件下,分析经牛黄解毒片暴露30天后8个大鼠血清中砷形态,结果列于表6。可见,在经牛黄解毒片暴露30天后的大鼠血清中检测出AsB、DMA(Ⅴ)、U1和U2,未检出其他砷形态。所测血清样品中AsB、DMA(Ⅴ)和U1的含量范围分别为1.65~2.02、10.4~31.8和4.77~13.0 μg/L;提取效率在62.7%~69.5%之间。样品Y8中砷形态氧化前后对照图示于图8。
为了探究大鼠血清中AsB的来源,分别对牛黄解毒片和饲养大鼠饲料中的砷形态进行分析。测定结果显示,牛黄解毒片中砷形态主要为As(Ⅲ)和As(Ⅴ),含量分别为189.7 mg/kg和53.1 mg/kg。饲料中检出少量的砷形态,包括AsB、DMA(Ⅴ)、As(Ⅲ)和As(Ⅴ),含量分别为0.056、0.006、0.029和0.045 mg/kg。由此可知,大鼠血清中AsB可能来源于饲料。
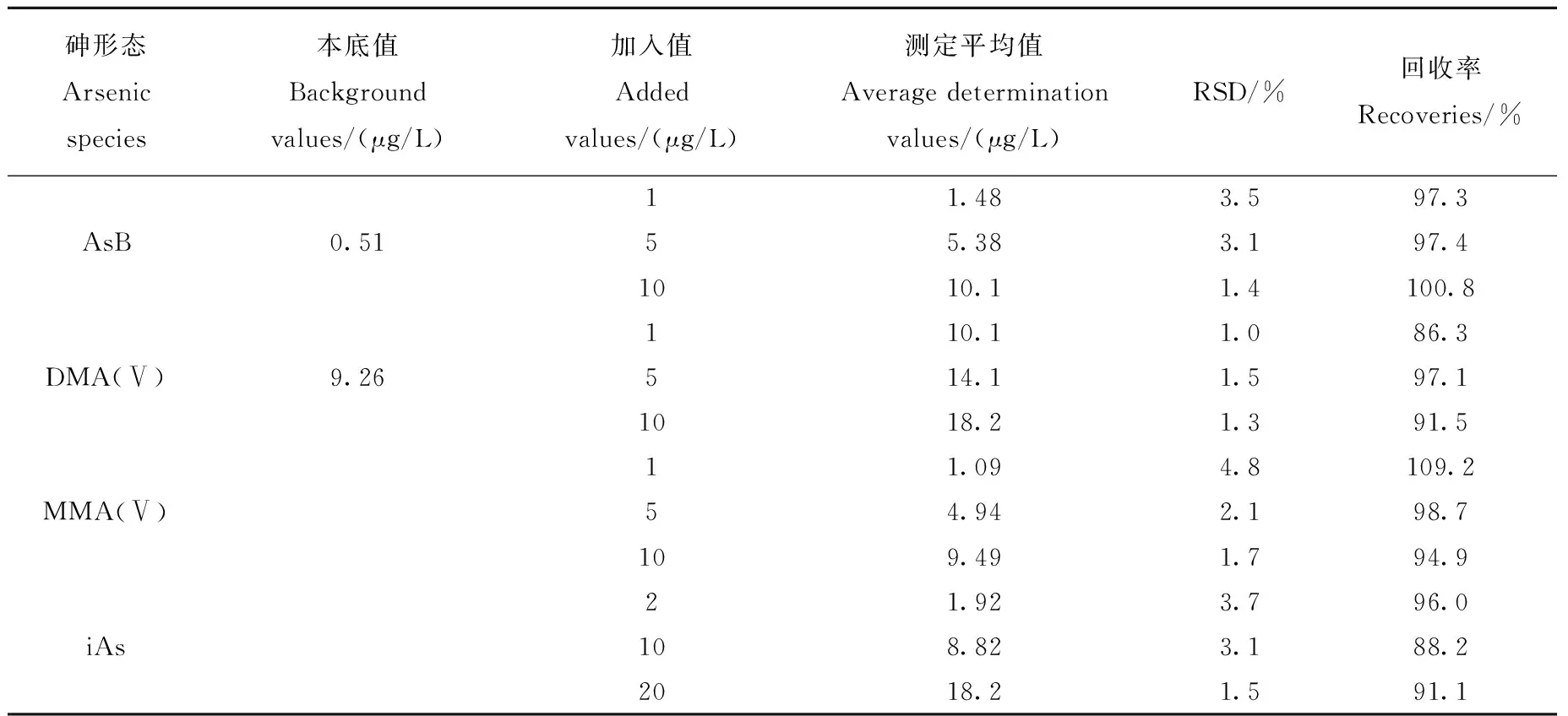
表5 方法的精密度和加标回收率(n=6)Table 5 Precisions and standard addition recoveries of the method (n=6)
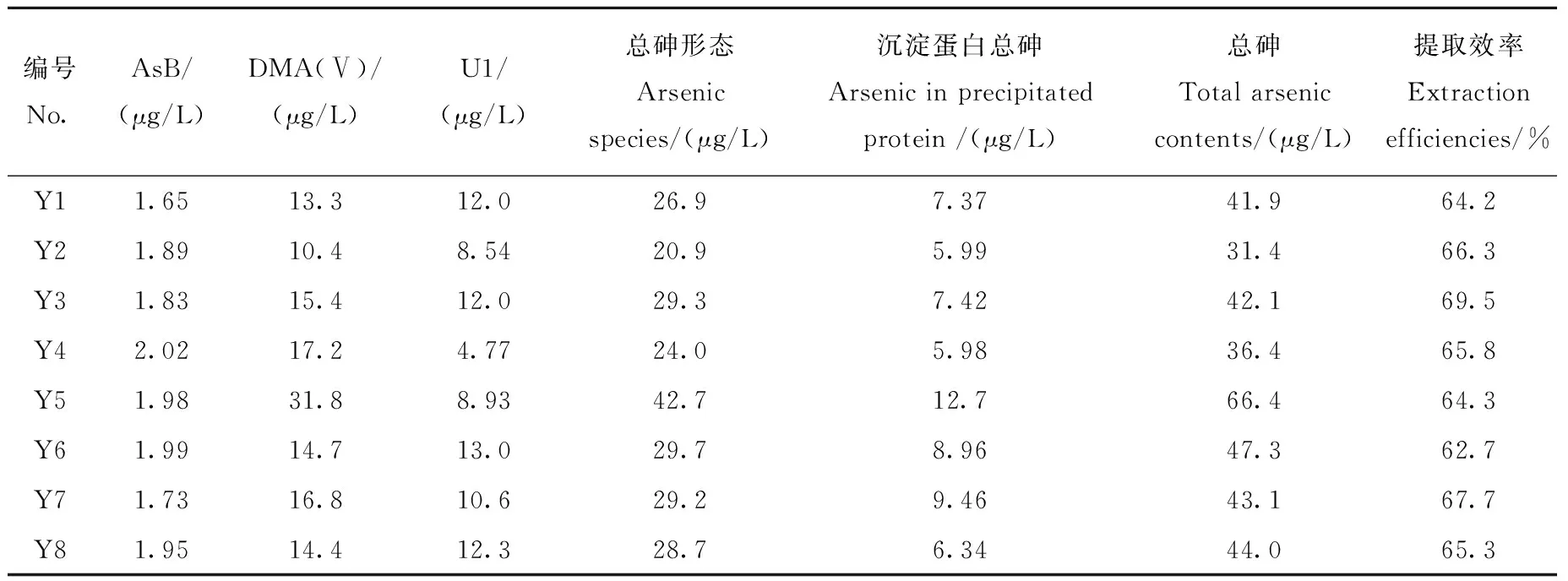
表6 大鼠血清中砷形态Table 6 Arsenic species in rat serum
注:沉淀蛋白总砷为蛋白沉淀中总砷折算成血清中砷的含量
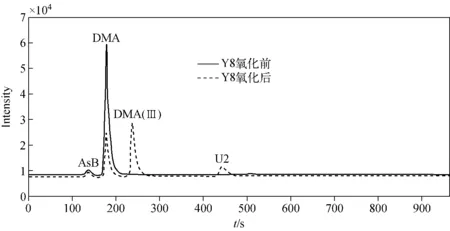
图8 样品Y8中砷形态氧化前后对照图Fig.8 Chromatogram of arsenic species in Y8 sample before and after oxidation
3 结论
本实验采用高效液相色谱-电感耦合等离子体质谱联用技术对经牛黄解毒片暴露后大鼠血清中的砷形态进行了初步研究。通过优化的色谱、质谱和前处理等条件,分析了血清中砷形态。结果显示,经牛黄解毒片暴露后大鼠血清中检出AsB、DMA(Ⅴ)、U1和U2,其中DMA(Ⅴ)和U1为经牛黄解毒片暴露后主要的代谢产物,少量的AsB来源于饲料,此结果可为进一步探究牛黄解毒片在生物体内的代谢研究提供技术支持。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:化学工业出版社,2005:387.
[2] 铁步荣,乔旺忠,马忠明,等. 人服用含雄黄中成药后尿中砷含量的动态研究[J]. 中国中药杂志,1992,17(5):285-288.
TIE Burong, QIAO Wangzhong, MA Zhongming, et al. Dynamic investigation of the arsenic content in the urine after taking containing realgar proprietary Chinese medicine[J]. China Journal of Chinese Materia Medica, 1992, 17(5): 285-288(in Chinese).
[3] KOCH I, SYLVESTER S, LAI W M, et al. Bioaccessibility and excretion of arsenic in Niu Huang Jie Du Pian pills[J]. Toxicology and Applied Pharmacology, 2007, 222(3): 357-364.
[4] ATSDR B. Toxicological profile for Arsenic (update). U.S. department of health and human services[C]. Public Health Service, Atlanta, GA. 2007.
[5] CORNELIS R, CARUSO J A, CREWS H, et al. Handbook of elemental speciation[M]. Handbook of Elemental Speciation II-Species in the Environment, Food, Medicine and Occupational Health, 2005: 94-106.
[6] ZHENG J, KOSMUS W, PICHLER-SEMMELROCK F, et al. Arsenic speciation in human urine reference materials using high-performance liquid chromatography with inductively coupled plasma mass spectrometric detection[J]. Journal of Trace Elements in Medicine and Biology, 1999, 13(3): 150-156.
[7] SHRAIM A, XING C, SONG L, et al. Arsenic speciation in the urine and hair of individuals exposed to airborne arsenic through coal-burning in Guizhou, PR China[J]. Toxicology Letters, 2003, 137(1/2): 35-48.
[8] SOLEO L, LOVREGLIO P, IAVICOLI S, et al. Significance of urinary arsenic speciation in assessment of seafood ingestion as the main source of organic and inorganic arsenic in a population resident near a coastal area[J]. Chemosphere, 2008, 73(73): 291-299.
[9] BRIMA E I, HARIS P I, JENKINS R O, et al. Understanding arsenic metabolism through a comparative study of arsenic levels in the urine, hair and fingernails of healthy volunteers from three unexposed ethnic groups in the United Kingdom[J]. Toxicology and Applied Pharmacology, 2006, 216(1): 122-130.
[10]CHEN B, HU B, HE M, et al. Synthesis of mixed coating with multi-functional groups for in-tube hollow fiber solid phase microextraction-high performance liquid chromatography-inductively coupled plasma mass spectrometry speciation of arsenic in human urine[J]. Journal of Chromatography A, 2012, 1 227(5): 19-28.
[11]TODOROV T I, EJNIK J W, MULLICK F G, et al. Arsenic speciation in urine and blood reference materials[J]. Microchimica Acta, 2005, 151(3/4): 263-268.
[12]HALL M, GAMBLE M, SLAVKOVICH V, et al. Determinants of Arsenic metabolism: blood arsenic metabolites,plasma folate,cobalamin,and homocysteine concentrations in maternal-newborn pairs[J]. Environmental Health Perspectives, 2007, (10): 1 503-1 509.
[13]ITO K, GOESSLER W, WELS B, et al. An interlaboratory study of arsenic speciation analysis of whole blood[J]. Journal of Analytical Atomic Spectrometry, 2011, 26(9): 1 740-1 745.
[14]ZHANG X, CORNELIS R, KIMPE J D, et al. Arsenic speciation in serum of uraemic patients based on liquid chromatography with hydride generation atomic absorption spectrometry and on-line UV photo-oxidation digestion[J]. Analytica Chimica Acta, 1996, 319(1/2): 177-185.
[15]YAMAUCHI H, TAKAHASHI K, MASHIKO M, et al. Intake of different chemical species of dietary arsenic by the Japanese, and their blood and urinary arsenic levels[J]. Applied Organometallic Chemistry, 1992, 6(4): 383-388.
[16]YOSHINO Y, YUAN B, MIYASHITA S I, et al. Speciation of arsenic trioxide metabolites in blood cells and plasma of a patient with acute promyelocytic leukemia[J]. Analytical and Bioanalytical Chemistry, 2008, 393(2): 689-697.
[17]MANDAL B K, OGRA Y, ANZAI K, et al. Speciation of arsenic in biological samples[J]. Toxicology and Applied Pharmacology, 2004, 198(3): 307-318.
[18]GAMBLE M V, LIU X, SLAVKOVICH V, et al. Folic acid supplementation lowers blood arsenic[J]. American Journal of Clinical Nutrition, 2007, 86(4): 1 202-1 209.
[19]PI J, YAMAUCHI H, KUMAGAI Y, et al. Evidence for induction of oxidative stress caused by chronic exposure of chinese residents to Arsenic contained in drinking water[J]. Environmental Health Perspectives, 2002, 110(4): 331-336.
[20]WU M M, CHIOU H Y, WANG T W, et al. Association of blood arsenic levels with increased reactive oxidants and decreased antioxidant capacity in a human population of northeastern Taiwan[J]. Environmental Health Perspectives, 2001, 109(10): 1 011-1 017.
[21]ALLAIN P, JAUNAULT L, MAURAS Y, et al. Signal enhancement of elements due to the presence of carbon-containing compounds in inductively coupled plasma mass spectrometry[J]. Analytical Chemistry, 1991, 63(14): 1 497-1 498.
[22]LARSEN E H, STÜRUP S. Carbon-enhanced inductively coupled plasma mass spectrometric detection of arsenic and selenium and its application to arsenic speciation[J]. Journal of Analytical Atomic Spectrometry, 1994, 9(10): 1 099-1 105.
[23]HU Z, HU S, GAO S, et al. Volatile organic solvent-induced signal enhancements in inductively coupled plasma-mass spectrometry: a case study of methanol and acetone[J]. Spectrochimica Acta Part B Atomic Spectroscopy, 2004, 59(9): 1 463-1 470.
[24]JACKSON B P, BERTSCH P M. Determination of arsenic speciation in poultry wastes by IC-ICP-MS[J]. Environmental Science and Technology, 2001, 35(24): 4 868-4 873.
[25]WANG P, ZHAO G, JING T. High performance liquid chromatography inductively coupled plasma mass spectrometry based method for the determination of organic arsenic feed additives and speciation of anionic arsenics in animal feed[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5 263-5 270.
[26]陈绍占,杜振霞,刘丽萍,等. 高效液相色谱-电感耦合等离子质谱法分析雄黄在大鼠脏器中代谢的砷形态[J]. 分析化学,2014,42(3):349-354.
CHEN Shaozhan, DU Zhenxia, LIU Liping, et al. Analysis of arsenic metabolites of realgar in rat viscera by HPLC-ICP-MS[J]. Chinese Journal of Analytical Chemistry, 2014, 42(3): 349-354(in Chinese).
[27]ZHANG Y, QIANG S, JING S, et al. Liquid chromatography-hydride generation-atomic fluorescence spectrometry determination of arsenic species in dog plasma and its application to a pharmacokinetic study after oral administration of Realgar and Niu Huang Jie Du Pian[J]. Journal of Chromatography B, 2013, 917-918(5): 93-99.
Arsenic Species in Rat Serum after Oral Administration of Niuhuang Jiedu Tablet by HPLC-ICP-MS
CHEN Shao-zhan1, LIU Li-ping1,2, DU Hong-ju1, JIN Peng-fei3, ZHOU Tian-hui1
(1.BeijingCenterforDiseasePreventionandControl,Beijing100013,China;2.SchoolofPublicHealth,CapitalMedicalUniversity,Beijing100069,China;3.BeijingHospital,Beijing100730,China)
The preliminary study of arsenic species in rat serum after oral administration of Niuhuang Jiedu tablet was established by high performance liquid chromatography coupled with inductively coupled plasma mass spectrometry (HPLC-ICP-MS). With acetonitrile as extraction agent, water bath ultrasonic extraction at 60 ℃ was used as the pretreatment of serum samples. The extracting solution was separated by centrifugation at 13 000 r/min for 10 min, then filtered through 0.45 μm membrane. 20 mmol/L (NH4)2CO3(pH 9.7) and 3% methanol were used as mobile phase, and Dionex IonPac AS19 (250 mm×4 mm×10 μm) was used as analytical column for analysis of arsenic species in rat serum after oral administration of Niuhuang Jiedu tablet. Experimental results show that the detection limits of AsB, DMA(Ⅴ), As(Ⅲ), MMA(Ⅴ) and As(Ⅴ) are 0.05, 0.05, 0.08, 0.10 and 0.10 μg/L, respectively. The linear coefficients (R2) are more than 0.999, the recoveries are between 86.3% and 109.2% with the relative standard deviation less than 5%. The preliminary study found that DMA(Ⅴ) and U1 are the main arsenic species in rat serum after oral administration of Niuhuang Jiedu tablet, and a small amount of AsB and U2 are also detected in rat serum. The method is sensitive and high extraction efficiency, which can realize the simultaneous separation of various known and unknown arsenic forms, and provide technical support for the metabolic study of arsenic in rat blood.
high performance liquid chromatography coupled with inductively coupled plasma mass spectrometry (HPLC-ICP-MS); Niuhuang Jiedu tablet; serum; arsenic species
2016-06-13;
2016-10-17
国家自然科学基金青年课题(81308216)资助
陈绍占(1987—),男(汉族),河北邯郸人,硕士研究生,从事无机元素分析及形态研究。E-mail: csz1987buct@163.com
刘丽萍(1965—),女(汉族),北京人,教授,从事元素及形态分析研究。E-mail: llp9312@163.com
O657.63
A
1004-2997(2017)02-0177-10
10.7538/zpxb.2016.0089
