Ⅱ型糖尿病患者与健康男性血清中19种微量元素含量对比
2017-03-28蒋学慧田亚平马庆伟郭广宏
熊 婵,蒋学慧,田亚平,马庆伟,郭广宏
(1.天津大学精密仪器与光电子工程学院,天津 300072;2.Institution of Chemistry, Karl-Franzens University Graz, Graz A-8010;3.解放军总医院生化科,北京 100853;4.毅新博创(北京)生物科技有限公司,北京 102206)
Ⅱ型糖尿病患者与健康男性血清中19种微量元素含量对比
熊 婵1,2,蒋学慧1,田亚平3,马庆伟4,郭广宏3
(1.天津大学精密仪器与光电子工程学院,天津 300072;2.Institution of Chemistry, Karl-Franzens University Graz, Graz A-8010;3.解放军总医院生化科,北京 100853;4.毅新博创(北京)生物科技有限公司,北京 102206)
微量元素代谢在糖尿病患者中可能发生了改变,这些元素在糖尿病发病机制和发展中起特定的作用。本工作研究了年龄区间50~60岁男性Ⅱ型糖尿病患者(95例)与健康人对照组(91例)的血清微量元素含量的差异。采用微波消解法对血清中19种微量元素进行前处理,稀释25倍,选择电感耦合等离子体质谱法(ICP-MS)进行检测。该方法的检测限、精密度和重复性良好,符合血清微量元素的检测要求。相比于对照组,糖尿病患者血清中锰、钴、铜、钡和铅元素的含量相对较高,钒、锌、砷、锑和钨元素的含量相对较低,而铬、铁、镍、硒、钼、镉、锡、汞和铊元素的含量在糖尿病患者和健康对照组中无显著统计学差异。结果表明,与糖尿病密切相关的10种微量元素在年龄区间50~60岁男性糖尿病患者与健康人之间存在显著统计学差异。该结论可为进一步研究与微量元素缺乏或者过量相关的糖尿病发病机制和发展过程提供数据支持。
微量元素;糖尿病;血清;电感耦合等离子体质谱(ICP-MS)
糖尿病是一种慢性病,当胰腺不能产生足够的胰岛素或者人体无法有效地利用所产生的胰岛素时,就会出现糖尿病[1]。2012年,全球由糖尿病直接导致死亡的有150万例;2014年,18岁以上成年人中有9%患有糖尿病;世界卫生组织预测,到2030年,糖尿病将成为人类第7个主要死因[2]。
微量元素对人体的健康至关重要,并具有不同的代谢特点和功能[3]。微量元素参与组织、细胞和亚细胞的功能结构,其中包括体液和细胞机制的免疫调控、神经传导、肌肉收缩、膜电位法则、线粒体活性和酶的反应。如,铬、锰、铁、钴、锌、硒、铜、钼是参与人体生化反应的微量元素;砷、镉、汞、铊、铅是过量时对人体有毒的微量元素;钒、镍、锡、锑、钨、钡是潜在的人体必需微量元素。研究表明,在糖尿病患者中微量元素的代谢发生了改变,这些元素可能在糖尿病发病机制和发展中起着特定的作用[4-6]。目前普遍认同的观点是,微量元素的变化可能源于长期不受控制的高血糖状态,也可能是某些微量元素参与了葡萄糖稳态的调节过程[7]。
血液中微量元素分析是疾病诊断和环境、职业健康研究的生物监测手段[8]。但由于血液中微量元素的含量很低(ng/L~μg/L级别),而且人体血液的基质复杂,给检测过程带来了很多不确定的因素。过去有许多关于糖尿病患者微量元素的研究,但值得注意的是,类似的研究手段得到的结果差别较大[9]。因此,建立一种稳定高效的血清微量元素检测方法,研究糖尿病患者的微量元素分布,有助于了解与微量元素相关的糖尿病发病机制。
本研究拟测定50~60岁男性糖尿病患者和健康人血清中钒、铬、锰、铁、钴、镍、铜、锌、砷、硒、钼、镉、锡、锑、钡、钨、汞、铊、铅等19种微量元素含量,以获得有关糖尿病患者与健康人微量元素分布的差异,为进一步阐述与微量元素相关的糖尿病发病机制提供数据支持。
1 实验部分
1.1 仪器及工作参数
Agilent 8800 ICP-QQQ仪器:美国Agilent公司产品,配有SPS4自动进样器,基本参数设置列于表1。
由于碰撞反应池对减少干扰、提高元素检测限有明显的帮助。因此,对于钒、铬、锰、铁、钴、镍、铜和锌元素,采用氦气模式;对于硒元素,采用氢气模式;对于砷元素,采用氧气模式;其余元素均采用标准模式。
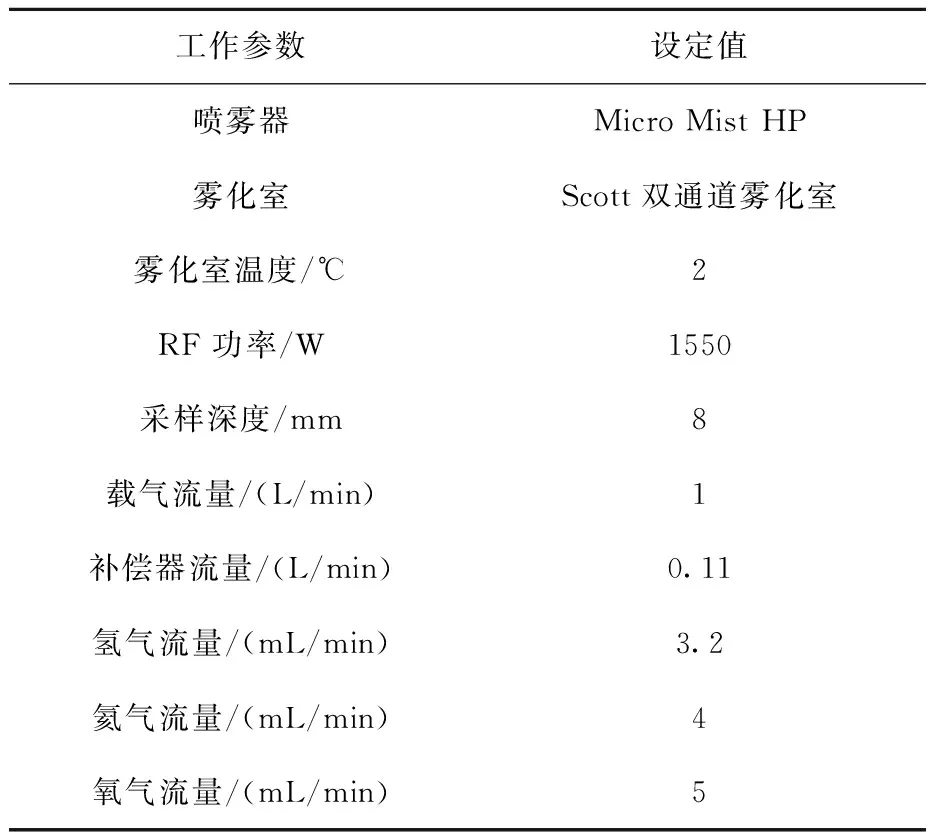
表1 ICP-MS参数设置Table 1 Instrumental settings of ICP-MS
1.2 主要材料与试剂
钒、铬、锰、铁、钴、镍、铜、锌、砷、硒、钼、镉、锡、锑、钡、钨、汞、铊和铅单标液(1 000 mg/L):美国Rosa公司产品;ICP multi-element standard solution VI混标液:德国Merck公司产品;1640a天然水(含17种元素标定值):美国NIST公司产品; ClinChek®-Control, Serum Level I标准物质(含17种元素标定值):德国Recipe公司产品;实验用超纯水:由Milli-Q超纯水仪制备;硝酸(Rotipuran®,浓度≥65%):德国Roth公司产品,使用时经低沸点蒸馏进行纯化。
1.3 实验对象
95例Ⅱ型糖尿病患者和91例健康志愿者:从中国人民解放军总医院生化科招募,年龄分布于50~60岁之间,均为男性。所有参与者采血前都没有摄入维生素和矿物质补充剂。采集的血液经30 min凝血后,放入离心机以3 000 r/min离心,然后将上层血清分装在1.5 mL离心管内,于-80 ℃保存。血清样本的使用和检测经中国人民解放军总医院医学伦理委员会审核批准,符合医学伦理的标准和规定。
1.4 样品准备与分析
取400 μL血清,加入2 mL硝酸、1 mL内标和1 mL超纯水,放入微波消解装置中,于250 ℃、4 MPa条件下消解30 min,消解后的溶液转移至聚丙烯试管中,定容至10 mL。
测试过程中所用的空白试剂、标准曲线、标准物质和内部质控品都按照同样的步骤配制。样品准备过程中所使用的聚丙烯试管均采用10%硝酸浸泡过夜,并用超纯水清洗3遍,待用;消解所用的石英管用5 mL纯硝酸于250 ℃,4 MPa条件下消解20 min,然后用超纯水清洗3遍,待用。
1.5 样品测定
标准曲线用单标液混合进行配制,对于血液中含量较高的元素,如铁、铜、锌、硒、钡,7点标准曲线的浓度分别为1、2、5、10、50、100、200 μg/L;对于血液中含量较低的元素,7点标准曲线的浓度分别为0.01、0.02、0.05、0.1、0.5、1、2 μg/L。选择铟、锗、镥、铑4种元素作为内标,内标元素在检测溶液中的最终浓度为10 μg/L。
1.6 统计分析
采用安捷伦质谱工作站软件进行定量分析,Excel软件进行数据统计分析。
2 结果与讨论
2.1 仪器检出限和准确度
本实验测定了19种元素的7点标准溶液,得到各元素的相关系数和背景等效浓度(BEC),检测限由4次重复消解空白的平均值加上3倍标准偏差计算得到。为了检测标准曲线的准确性,采用NIST 1640a天然水作为标准物质,其标定元素的含量范围、方法的检测限及相对标准偏差(RSD)列于表2。
由表2可知,19种微量元素的相关系数均在0.999 1以上;方法的检测限较低(稀释倍数25),其中,钴、镉、锡、锑、钨、铊和铅元素低于0.01 μg/L,钒、铬、锰、砷、硒、钼、钡和汞元素低于0.1 μg/L,铁、镍、铜和锌元素低于1 μg/L;对于背景等效浓度,铬、铁、镍和铜元素低于0.1 μg/L,其余元素均低于0.01 μg/L。结果表明,各元素均有较好的抑制背景干扰能力;本方法对标准物质(天然水)的检测结果良好,锰、铁、锌、硒、镉、钡、铊和铅元素的测量值均在天然水的标定范围内;钒、钴、铜、砷和钼元素的RSD小于5%,铬、镍、锑元素的RSD小于10%。

表2 相关系数,检测限,背景等效浓度和标准水检测值Table 2 Correlation coefficients, detection limits, background equivalent concentrations and results of reference water
注:√表示检测值处于标准品标定值范围之内
2.2 标准物质和内部质控品
标准物质的参考平均值、参考范围和测量的标准物质浓度,以及内部质控品的测量平均值和批间变异系数列于表3。
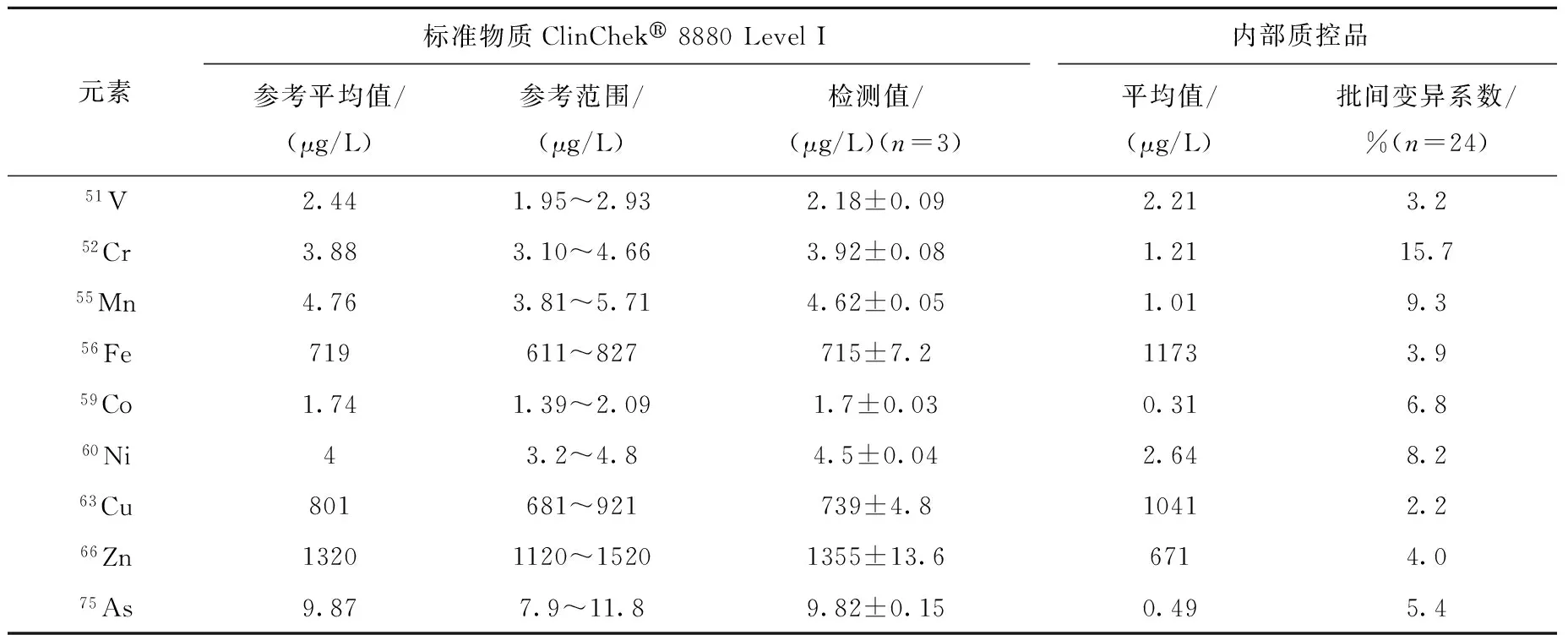
表3 标准物质和内部质控品Table 3 Reference material and in-house control material
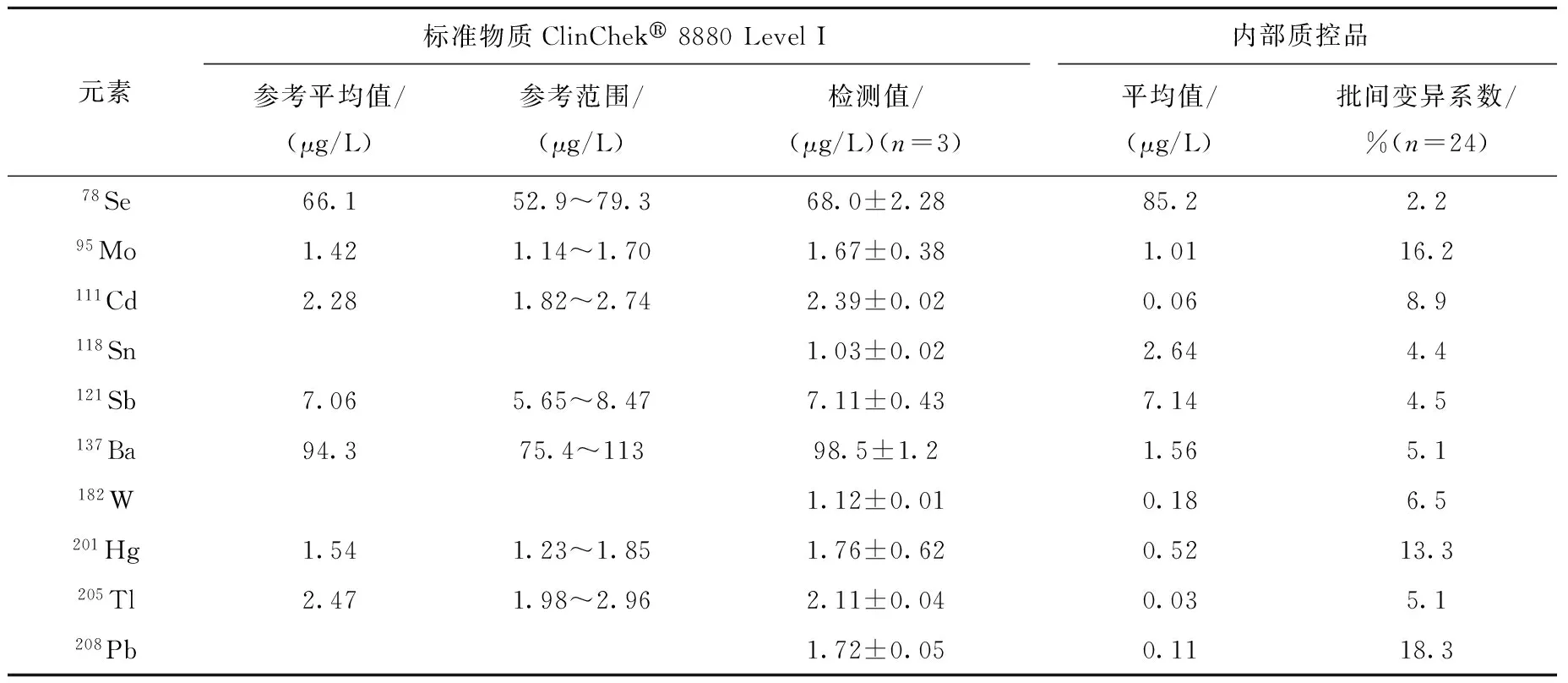
续表
分别在一个月内的8天测量内部质控品,每次测量3个重复样品,批间变异系数(VC)由24个重复样品的标准偏差/平均值计算得到。除锡、钨、铅元素在标准物质中没有参考值外,其余所有元素的测量结果均在参考范围内,说明该方法的测量精度良好。对于内部质控品,除铬、钼、汞和铅4种元素(铬15.7%,钼16.2%,汞13.3%,铅18.3%)外,其余元素的VC均小于10%,表明该方法具有良好的稳定性。
2.3 样品分析
根据以上仪器条件和检测方法,分别对糖尿病患者(n=95)和志愿者(n=91)的血清样本进行19种微量元素的测量,结果列于表4。
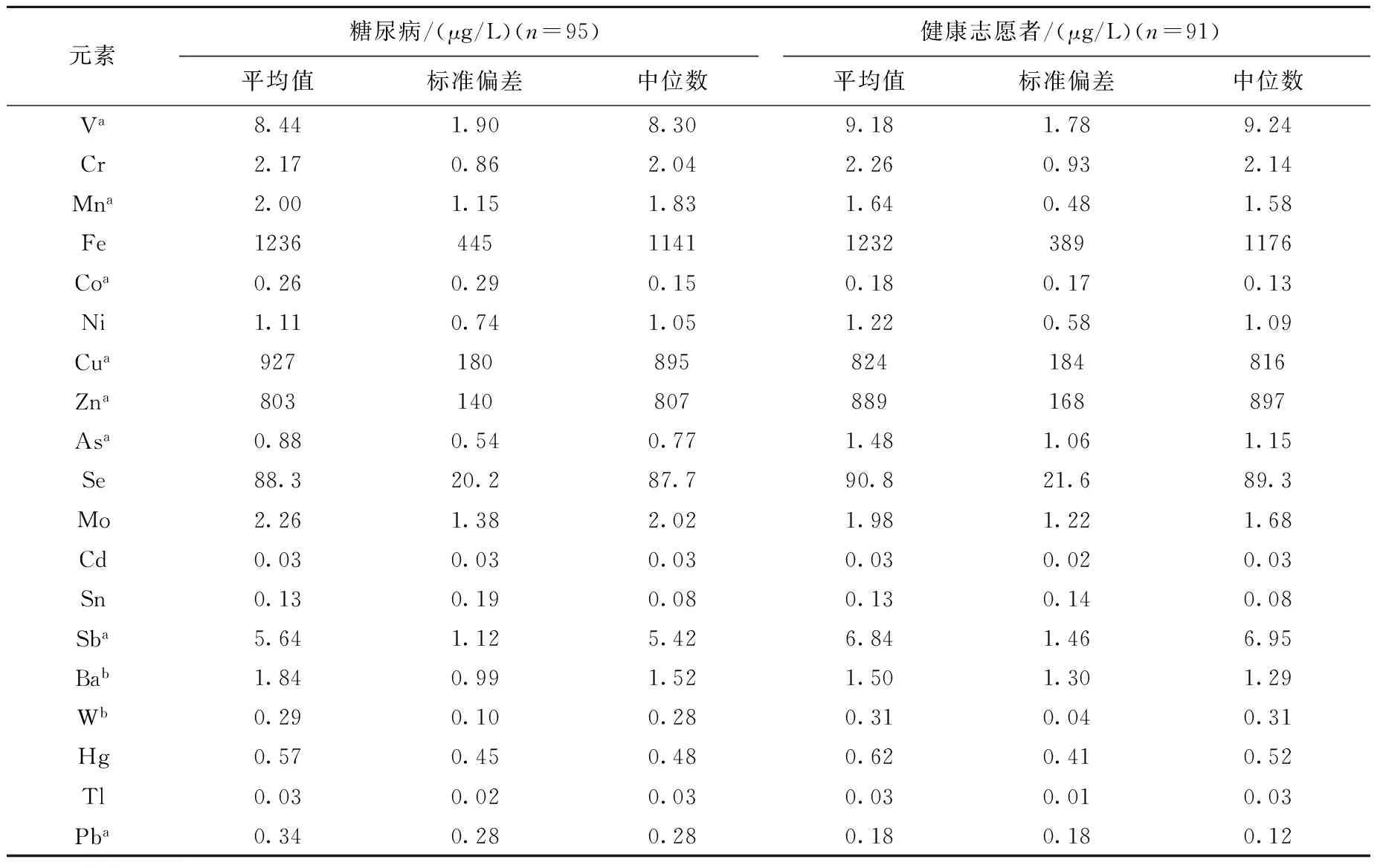
表4 糖尿病患者和健康志愿者的微量元素含量Table 4 Trace elements concentrations of diabetes and healthy controls
注:a表示p<0.01;b表示p<0.05
相比于对照组,糖尿病患者血清中锰、钴、铜、钡和铅元素的含量相对较高;钒、锌、砷、锑和钨元素的含量相对较低;而铬、铁、镍、硒、钼、镉、锡、汞和铊元素在对照组和糖尿病患者中的含量无显著统计学差异。
本研究发现,锰、钴、铜、钡和铅等元素的含量在糖尿病人中较高。Nicoloff等[10]发现,锰是葡萄糖激酶的激活剂,直接影响葡萄糖的生成,锰可以直接作用于胰腺,促使胰岛素分泌,还可以激活丙酸酮羧化酶及其他与糖代谢有关的酶。Ward等[11]研究表明,糖尿病患者的钴和钡元素含量高于对照组;Kazi等[12]观察到铜含量在糖尿病患者中较高。铜具有类似胰岛素的性质,能够促进脂肪的生成[13]。过量摄入铜会增加糖尿病患者的并发症风险,如大血管病变、微血管病变、高胆固醇症和高血压症都与铜的积累有关。研究人员还发现,铅在糖尿病患者的不同生物样本中(如血液、血清和头发)均比对照组含量高[14-16]。
本研究发现,钒、锌、砷、锑和钨等元素的含量在糖尿病患者中较低。Chen等[7]发现,糖尿病患者中的钒含量低于对照组,与本实验的结果一致。钒能够影响糖代谢的各个方面,包括葡萄糖转运、糖酵解、葡萄糖氧化和糖原合成[18]。钒具有类似胰岛素的作用,并能增加组织对胰岛素的敏感性,口服钒酸钠能降糖。Ekin等[19]观察到锌在糖尿病患者中含量较低。锌在葡萄糖代谢中起重要的作用,锌作为细胞内的辅酶因子,可能参与蛋白质、脂质和糖的代谢过程[20]。锌有助于肌肉和脂肪细胞对葡萄糖的利用率,直接参与糖的氧化功能,锌也能协助葡萄糖在细胞膜上的转运。Kuo等[21]研究结果支持了长期砷暴露与糖尿病之间的关系。砷元素会影响胰岛素受体和葡萄糖转运功能,氧化苯砷、三价砷形成稳定的循环硫代亚砷酸盐配合邻位或成对的硫基细胞蛋白质,该化合物显示出抑制脂肪细胞葡萄糖转运的能力。
另外,研究结果还显示,铁、镍、硒、钼、镉、锡、汞和铊元素的含量在对照组和糖尿病患者中无显著统计学差异。Forte等[9]发现,糖尿病患者和健康对照组之间血液中的铁浓度并没有显著统计学差异,糖尿病人的血汞略高于健康人,但不明显。铁可能导致氧化损伤的发生和发展,也可能对血糖控制产生负面作用。Serdar等[14]观察到硒在糖尿病患者和健康人之间不存在显著统计学差异。硒具有类似胰岛素作用,缺硒是胰岛素损害的原因之一,补硒可显著提高血清胰岛素水平。Zima等[22]观察到铬含量在糖尿病患者和健康人之间不存在显著统计学差异。铬是葡萄糖耐量因子的重要活性成分,长期缺铬可引起糖尿病糖耐量降低,胰腺分泌胰岛素能力减弱[23]。Ward等[11]研究结果表明,糖尿病患者中镍和锡元素的含量与健康人不存在显著统计学差异。镍具有诱导高血糖症,增加肝脏糖酵解和胰高血糖素释放,减少葡萄糖的外周利用率,并诱导糖异生的能力[24]。Kuo等[25]观察到镉含量在糖尿病患者和健康人之间不存在显著统计学差异。镉可能是某些类型糖尿病发展的因素之一,镉和高血糖症存在协同作用以导致肾损伤的可能性[26]。Flores等[27]发现,糖尿病患者的钼元素含量高于健康人,但不存在显著统计学差异。钼至少是3个重要酶系统中的重要组成部分,即黄嘌呤氧化酶、醛氧化酶和亚硫酸盐氧化酶,这些酶系统已被证明在碳水化合物代谢和铁的利用功能中发挥关键作用。Moon等[15]观察到汞含量在糖尿病患者和健康人之间不存在显著统计学差异。汞可以通过多种途径改变胰岛β细胞的功能,引起血糖升高[28]。
近年来,微量元素代谢与糖尿病的密切关系已经引起人们的广泛关注,多达15种微量元素可能参与糖尿病的代谢过程。本研究结果显示,有10种微量元素在糖尿病患者和健康志愿者之间表现出显著统计学差异。对比本研究结果与近年来关于糖尿病患者微量元素的研究,发现多数元素都与文献结果一致,但以往不同文献之间仍存在研究手段类似,而结果相反的情况。因此,在下一步的工作中,应当从抽样方法、饮食习惯、居住环境、血糖控制情况、临床并发症、遗传学、患者年龄和性别等方面进行分析,并在设计糖尿病患者与健康人对比实验时,进一步控制抽样条件,以得到糖尿病患者与健康人之间血液微量元素差异性结论。
3 结论
本研究在Agilent 8800 ICP-MS仪器平台上建立了一种检出限低、准确度高、精密度好、操作简便的血清微量元素检测方法,对95例糖尿病患者和91例健康人血清中19种微量元素进行检测。通过对检测结果的分析发现,相比于对照组,糖尿病患者血清中锰、钴、铜、钡和铅元素的含量相对较高,钒、锌、砷、锑和钨元素的含量相对较低,铬、铁、镍、硒、钼、镉、锡、汞和铊元素的含量在对照组和糖尿病患者之间无显著统计学差异。结果表明,与糖尿病密切相关的10种微量元素在年龄区间50~60岁男性糖尿病患者与健康人之间存在显著统计学差异,这一结论有助于了解与微量元素缺乏或者过量相关的糖尿病发病机制,可为进一步阐述与微量元素相关的糖尿病发病机制和发展过程提供数据支持,并为利用微量元素预防和控制糖尿病提供理论基础。
致谢:感谢格拉茨大学分析化学系提供的仪器平台,试剂及标准物质支持。
[1] ALBERTI K G M M, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus. Provisional report of a WHO consultation[J]. Diabetic Medicine, 1998, 15(7): 539-553.
[2] MATHERS C D, LONCAR D. Projections of global mortality and burden of disease from 2002 to 2030[J]. Plos Med, 2006, 3(11): e442.
[3] MATSUMURA M, NAKASHIMA A, TOFUKU Y. Electrolyte disorders following massive insulin overdose in a patient with Type 2 diabetes[J]. Internal Medicine, 2000, 39(1): 55-57.
[4] BADRAN M, MORSY R, SOLIMAN H, et al. Assessment of trace elements levels in patients with Type 2 diabetes using multivariate statistical analysis[J]. Journal of Trace Elements in Medicine and Biology, 2016, 33: 114-119.
[5] FATANI S H, SALEH S A K, ADLY H M, et al. Trace element alterations in the hair of diabetic and obese women[J]. Biological Trace Element Research, 2016: 1-8.
[6] KHAN F A, AL JAMEIL N, ARJUMAND S, et al. Comparative study of serum copper, iron, magnesium, and zinc in Type 2 diabetes-associated proteinuria[J]. Biological Trace Element Research, 2015, 168(2): 321-329.
[7] MOORADIAN A D, MORLEY J E. Micronutrient status in diabetes mellitus[J]. The American Journal of Clinical Nutrition, 1987, 45(5): 877-895.
[9] FORTE G, BOCCA B, PERUZZU A, et al. Blood metals concentration in Type 1 and Type 2 diabetics[J]. Biological Trace Element Research, 2013, 156(1/2/3): 79-90.
[10]NICOLOFF G, MUTAFTCHIE V K, STR-ASHIMIROV D, et al. Serum manganese in children with diabetes mellitus Type 1[J]. Diabetol Croat, 2004, 33(2): 47-51.
[11]WARD M I, PIM B. Trace element concentrations in blood plasma from diabetic patients and normal individuals[J]. Biological Trace Element Research, 1984, 6(6): 469-487.
[12]KAZI T G, AFRIDI H I, KAZI N, et al. Copper, chromium, manganese, iron, nickel, and zinc levels in biological samples of diabetes mellitus patients[J]. Biological Trace Element Research, 2008, 122(1): 1-18.
[13]WALTER R M, URIU-HARE J Y, OLIN K L, et al. Copper, zinc, manganese, and magnesium status and complications of diabetes mellitus[J]. Diabetes Care, 1991, 14(11): 1 050-1 056.
[14]SERDAR M, BAKIR F, HASIMI A, et al. Trace and toxic element patterns in nonsmoker patients with noninsulin-dependent diabetes mellitus, impaired glucose tolerance, and fasting glucose[J]. International Journal of Diabetes in Developing Countries, 2009, 29(1): 35-40.
[15]MOON S S. Association of lead, mercury and cadmium with diabetes in the Korean population: the Korea National Health and Nutrition Examination Survey (KNHANES) 2009-2010[J]. Diabetic Medicine, 2013, 30(4): e143-e148.
[16]AFRIDI H I, KAZI T G, KAZI N, et al. Evaluation of status of toxic metals in biological samples of diabetes mellitus patients[J]. Diabetes Research and Clinical Practice, 2008, 80(2): 280-288.
[17]CHEN H, TAN C. Prediction of type 2 diabetes based on several element levels in blood and chemometrics[J]. Biological Trace Element Research, 2012, 147(1/2/3): 67-74.
[18]CAM M C, BROWNSEY R W, MCNEILL J H. Mechanisms of vanadium action: insulin-mimetic or insulin-enhancing agent?[J]. Canadian Journal of Physiology and Pharmacology, 2000, 78(10): 829-847.
[19]EKIN S, MERT N, GUNDUZ H, et al. Serum sialic acid levels and selected mineral status in patients with Type 2 diabetes mellitus[J]. Biological Trace Element Research, 2003, 94(3): 193-201.
[21]KUO C C, HOWARD B V, UMANS J G, et al. Arsenic exposure, arsenic metabolism, and incident diabetes in the strong heart study[J]. Diabetes Care, 2015, 38(4): 620-627.
[22]ZIMA T, MESTEK O, TESAR V, et al. Chromium levels in patients with internal diseases[J]. IUBMB Life, 1998, 46(2): 365-374.
[23]MERTZ W. Chromium in human nutrition: a review[J]. J Nutr, 1993, 123(4): 626-633.
[24]TIKARE S N, DAS GUPTA A, DHUNDASI S A, et al. Effect of antioxidants I-ascorbic acid and alpha-tocopherol supplementation in nickel-exposed hyperglycemic rats[J]. Journal of Basic and Clinical Physiology and Pharmacology, 2008, 19(2): 89-102.
[25]KUO C C, MOON K, THAYER K A, et al. Environmental chemicals and Type 2 diabetes: an updated systematic review of the epidemiologic evidence[J]. Current Diabetes Reports, 2013, 13(6): 831-849.
[26]EDWARDS J R, PROZIALECK W C. Cadmium, diabetes and chronic kidney disease[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 289-293.
[27]FLORES C R, PUGA M P, WROBEL K, et al. Trace elements status in diabetes mellitus Type 2: possible role of the interaction between molybdenum and copper in the progress of typical complications[J]. Diabetes Research and Clinical Practice, 2011, 91(3): 333-341.
[28]CHEN Y W, YANG C Y, HUANG C F, et al. Heavy metals, islet function and diabetes development[J]. Islets, 2009, 1(3): 169-176.
Concentrations of 19 Trace Elements in Type Ⅱ Diabetes Compared with Healthy Male Controls
XIONG Chan1,2, JIANG Xue-hui1, TIAN Ya-ping3, MA Qing-wei4, GUO Guang-hong3
(1.DepartmentofPrecisionInstrumentandOpto-ElectronicsEngineering,TianjinUniversity,Tianjin300072,China;2.InstitutionofChemistry,Karl-FranzensUniversityGraz,GrazA-8010,Austria;3.DepartmentofClinicalBiochemistry,ChinesePLAGeneralHospital,Beijing100853,China;4.BioyongTechnologyInc,Beijing102206,China)
There are increasing evidences showing that the metabolism of trace elements in diabetic patients has being varied. These elements might play some specific roles in the pathogenesis of diabetes and its development. The differences of human serum trace element concentration between age range of 50-60 years old male with type 2 diabetes (95 cases) and healthy control group (91 cases) were studied. Concentrations of 19 trace elements in the serum samples were determined with acid assist microwave digestion by inductively coupled plasma mass spectrometry (ICP-MS) platform with a dilution factor of 25. The detection limit, precision and reproducibility were proved sufficient to serum trace element measurement. Compared with the control group, the patients of diabetes have higher concentration of elements Mn, Co, Cu, Ba, Pb and have lower concentration of elements V, Zn, As, Sb, W, there is no significant statistical differences between the diabetic patients and the healthy control group of elements Cr, Fe, Ni, Se, Mo, Cd, Sn, Hg, Tl. The results show that there are 10 trace elements which closely related to the diabetes mellitus have significant statistical concentration differences between the diabetic patients and the healthy control group with the age range of 50-60 years old male. This conclusion is helpful to study further on the pathogenesis of diabetes-related diseases which related on excess or deficiency of trace elements in the human serum, and also offer data support to further elaborate mechanisms and the development of diabetes which related with trace elements in the human serum.
trace elements; diabetes; serum; inductively coupled plasma mass spectrometry (ICP-MS)
2016-04-20;
2016-06-18
国家863计划(2014AA022305,2014AA020901)资助
熊 婵(1986—),女(汉族),湖北宜昌人,博士后,分析化学专业。E-mail: chinaxc@tju.edu.cn
郭广宏(1974—),男(汉族),河北大城人,从事临床检测研究。E-mail: 1974ggh@sina.com
时间:2016-12-28;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20161228.0934.016.html
O657.63
A
1004-2997(2017)02-0195-08
10.7538/zpxb.youxian.2016.0060
