大气压化学电离质谱分析苯二苯硫醚异构体
2017-03-28王陈璐莫雅雯曹小吉莫卫民
王陈璐,莫雅雯,曹小吉,莫卫民,
(1.浙江工业大学化学工程学院,浙江 杭州 310014;2.浙江工业大学分析测试中心,浙江 杭州 310014)
大气压化学电离质谱分析苯二苯硫醚异构体
王陈璐1,莫雅雯1,曹小吉2,莫卫民1,2
(1.浙江工业大学化学工程学院,浙江 杭州 310014;2.浙江工业大学分析测试中心,浙江 杭州 310014)
芳香性苯基硫醚是用于合成具有生物活性的含硫杂环物质的重要前体化合物。本工作采用大气压化学电离(APCI)/离子阱二级质谱技术结合量子化学密度泛函理论计算,对邻、间、对苯二苯硫醚三类位置异构体的质谱裂解反应机理进行研究。苯二苯硫醚三类位置异构体经过碰撞诱导解离(CID),发生HS自由基和苯硫自由基的中性丢失;并且仅在邻苯二苯硫醚类化合物中可观察到连续中性丢失2个HS自由基产生的碎片离子,而在间、对苯二苯硫醚类化合物中则观察到S2的特征丢失;取代苯硫酚的中性丢失只能在邻、间苯二苯硫醚类化合物中检测到,此外,间苯二苯硫醚类化合物还有取代苯的特征性丢失。综上,三类苯二苯硫醚位置异构体在APCI-MS/MS条件下的质谱裂解行为有显著差异,根据HS自由基、S2、取代苯硫酚和取代苯的特征丢失,可实现这些异构体的区分鉴定。
大气压化学电离质谱(APCI-MS);苯二苯硫醚;碰撞诱导解离(CID);裂解机理;位置异构体;理论计算
近年来,随着生命科学研究的不断深入,具有生物活性的物质受到学者们越来越多的关注。含硫化合物具有高生物活性,以其为对象的研究工作无论是在生命科学领域,还是在药学、生物学和化学领域都变得愈加活跃[1-2]。
质谱在含硫物质的裂解反应机理研究领域扮演着重要的角色。Hu等[3]在电喷雾离子源下,对砜类物质通过环化加成丢失SO2的反应进行了讨论。此外,研究发现含硫杂环和硫醚类化合物在质谱裂解反应中经过环化重排介导,能够发生HS自由基、单质S以及SO2等小分子的中性碎片丢失[4-11]。但关于苯二苯硫醚类化合物质谱裂解反应机理的研究未见报道。
本工作拟采用大气压化学电离源-二级质谱(APCI-MS/MS)技术,结合密度泛函理论计算,研究苯二苯硫醚三类位置异构体及其衍生物的质谱裂解反应机理,并根据特征性碎片离子,建立区分3种位置异构体的质谱分析方法。
1 实验部分
1.1 主要仪器
LCQ Deca XP MAX 离子阱质谱仪:美国Thermo Fisher 公司产品,配有大气压化学电离源(APCI)及Xcalibur 2.2 数据处理系统;GCT Premier 飞行时间质谱仪:美国Waters公司产品,配有电子轰击(EI)离子源。
1.2 主要样品与试剂
5个邻位,5个间位和4个对位的苯二苯硫醚类化合物:由江西师范大学万结平老师提供;甲醇:色谱纯,德国Merck公司产品。
1.3 实验条件
1.3.1 样品制备 取适量样品溶于甲醇,过0.45 μm滤膜,用注射泵输送至质谱仪进行分析, 流速20 μL/min。
1.3.2 LCQ Deca XP MAX离子阱质谱条件
大气压化学电离正离子扫描模式(APCI+),质量扫描范围m/z100~800;毛细管温度150 ℃;毛细管电压23 V;鞘气流速18 L/min;溶剂蒸发器温度450 ℃;电晕放电针电流5 μA;碰撞气为氦气,碰撞能量37%。
1.3.3 GCT Premier飞行时间质谱条件 电子轰击(EI)电离源,电子能量70 eV,离子源温度230 ℃,质量扫描范围m/z50~600,采用全氟三丁胺对质量轴进行校正。
1.3.4 计算条件 采用Gaussian 03软件,密度泛函理论(density functional theory, DFT),在B3LYP/6-31+G(d, p) 水平上对分子结构进行模拟和优化。对所有优化的结构进行振动频率分析,其中过渡态有且仅有一个虚频,计算所得的能量为电子能和热能之和。
2 结果与讨论
2.1 APCI-MS/MS分析
邻、间、对苯二苯硫醚及其衍生物的化学结构等信息列于表1,在APCI下,这些化合物均产生分子离子峰[M]+·。14种化合物二级质谱裂解所产生的主要碎片离子及其相对丰度列于表2。可知,邻苯二苯硫醚类化合物经碰撞诱导解离(CID)后,中性丢失取代苯硫自由基、取代苯硫酚、HS自由基以及2个HS自由基,分别产生碎片离子a、b、c、d。在间苯二苯硫醚类化合物中,并没有观察到2个HS自由基的中性丢失,而出现了中性丢失S2和取代苯产生的碎片离子e和 f。至于对苯二苯硫醚类化合物,则只观察到取代苯硫自由基、HS自由基及S2中性丢失。下面以未取代的邻、间、对苯二苯硫醚,即化合物2、7、12为例,讨论中性丢失HS自由基和苯硫酚的质谱裂解反应机理,以及3种位置异构体的质谱区分。

表1 邻、间、对苯二苯硫醚类化合物的化学结构Table 1 Chemical structures of the o, m, p-bis (phenylthio) benzenes
2.2 环化介导的HS自由基和苯硫酚丢失,以及3种异构体的质谱区分
化合物2、7、12的二级质谱图示于图1,其相关理论计算数据列于表3。
化合物2经电荷诱导C—S键异裂,中性丢失苯硫自由基后产生碎片离子a(m/z185)。碎片离子b(m/z184.034 8,理论m/z184.034 1,误差3.8×10-6)、碎片离子c(m/z261.073 3,理论m/z261.073 2,误差0.4×10-6)和碎片离子d(m/z228.092 0,理论m/z228.093 4,误差-6.1×10-6)分别为丢失苯硫酚、HS自由基和2个HS自由基所致,其可能的裂解途径示于图2。化合物2的分子离子Mo0中的S原子上的自由基离域,通过五元杂环进行自由基加成,得到中间体Mo1;之后发生1,2-H自由基迁移,同时C1—S均裂开环,形成中间体Mo2;接着,苯环m上的硫酮互变为硫酚形式,得到含苯硫酚结构的中间体Mo3;随后,苯硫酚结构上的自由基再次离域,发生二次环加成,得到中间体Mo4;1,2-H质子迁移开环,形成含苯硫酮结构的中间体Mo5;苯硫酮-苯硫酚互变,得到中间体Mo6;Mo6丢失一个HS自由基后,得到含七元环结构的产物离子c(m/z261.1),再连续丢失HS自由基,得到产物离子d(m/z228.3)。根据文献[12],发现含硫杂环物质在裂解过程中存在中性丢失HS自由基的现象,此过程与邻苯二苯硫醚丢失HS自由基非常相似。另一方面,当C1—S键发生异裂,苯环n上的C3原子直接亲核进攻C1原子,形成离子中性复合物INCo1;随后,二苯并噻吩离子中C3原子上的H自由基转移至苯硫醚自由基的S原子上,得到离子中性复合物INCo2;INCo2直接分离,中性丢失苯硫酚产生碎片离子b(m/z184.2)。由理论计算可得化合物2丢失HS自由基和苯硫酚的反应势能曲线,示于图3。可见,丢失苯硫酚裂解路径的最高过渡态(TSo3, 171.9 kJ/mol)和产物离子能量(Mo9, -33.5 kJ/mol)比丢失HS自由基的能量(TSo1, 234.1 kJ/mol; Mo7, 67.4 kJ/mol; Mo8, 142.7 kJ/mol)低,结合质谱图中碎片离子b较高的相对离子丰度,可知邻苯二苯硫醚丢失苯硫酚的裂解反应在动力学和热力学上都具有优势。另外,无论对位取代基是推电子基团还是吸电子基团,在动力学和热力学上都倾向于中性丢失苯硫酚,但是随着取代基电负性的增强,两种碎片离子的丰度差异逐渐减小。

表2 邻、间、对苯二苯硫醚类化合物碰撞诱导解离产生的主要碎片离子Table 2 CID mass spectra data for o, m, p-bis (phenylthio) benzenes

图1 化合物2(a)、化合物7(b)和化合物12(c)的APCI-MS/MS图(m/z 294.1)Fig.1 APCI-MS/MS spectra of compound 2 (a), compound 7 (b) and compound 12 (c) (m/z 294.1)
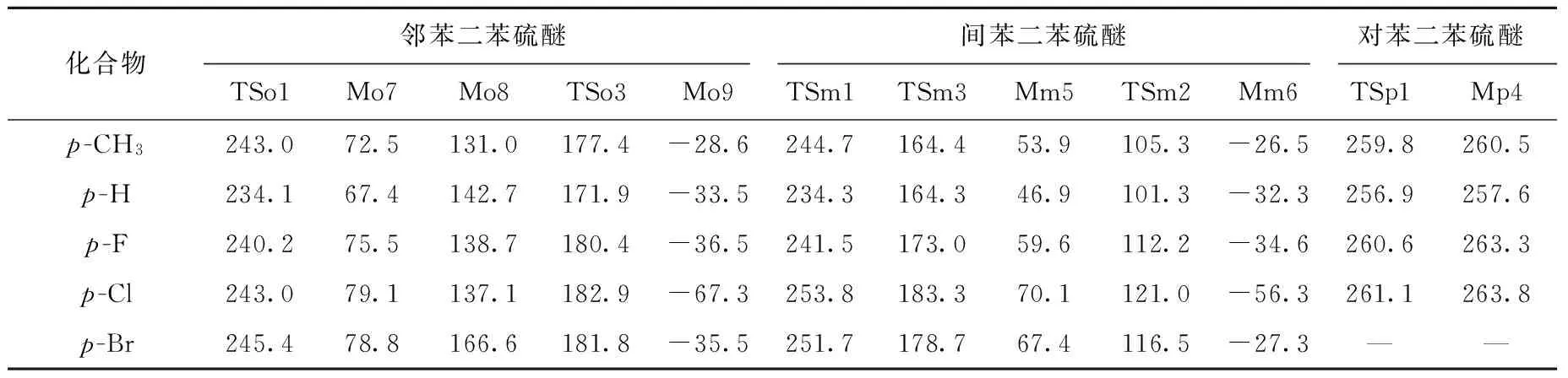
表3 苯二苯硫醚类化合物相关理论计算数据(kJ/mol)Table 3 Relevant energy data of bis (phenylthio) benzenes (kJ/mol)
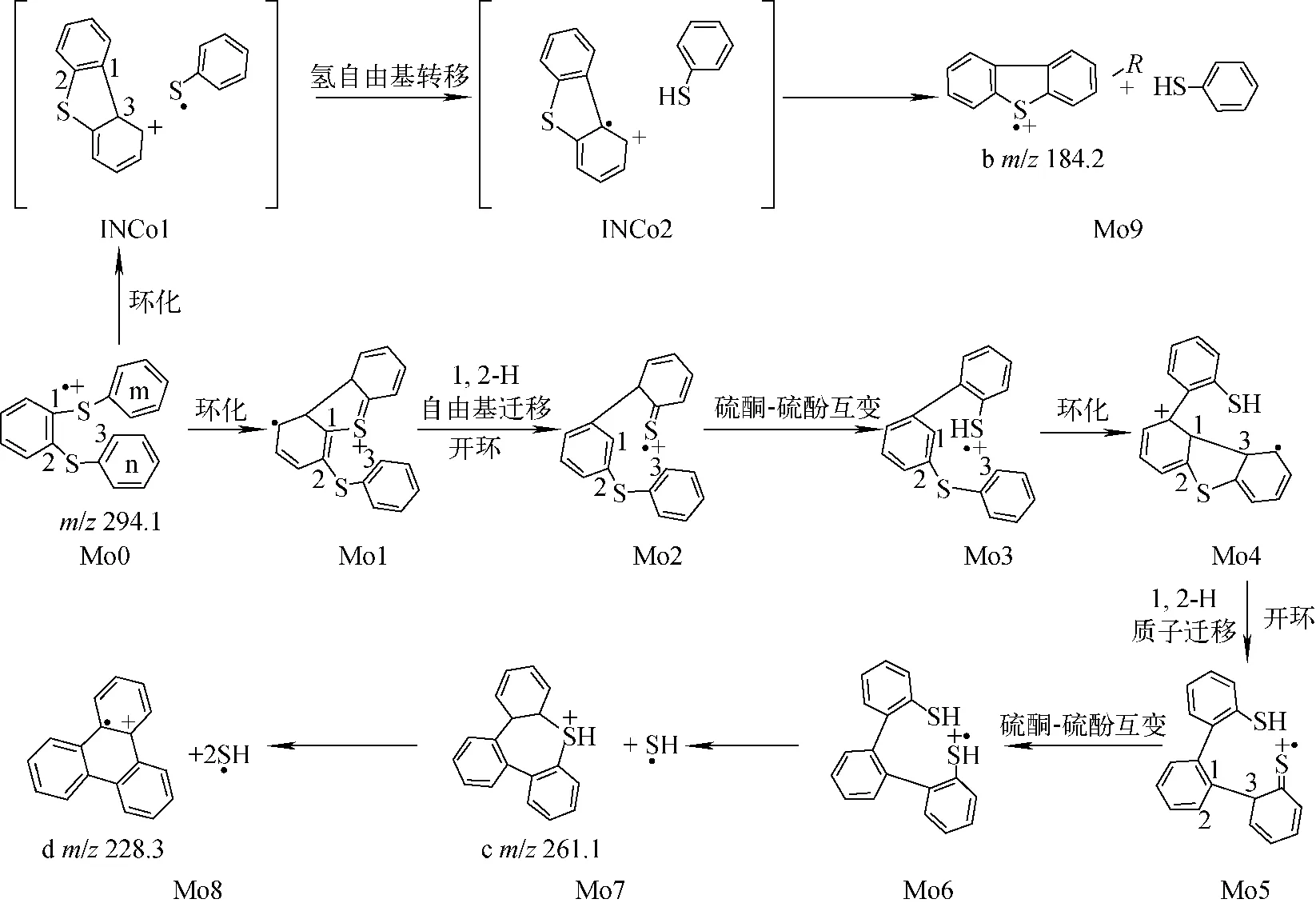
图2 化合物2丢失HS自由基和苯硫酚的裂解途径Fig.2 Proposed fragmentation mechanism for neutral loss of HS radical and benzenethiol from compound 2
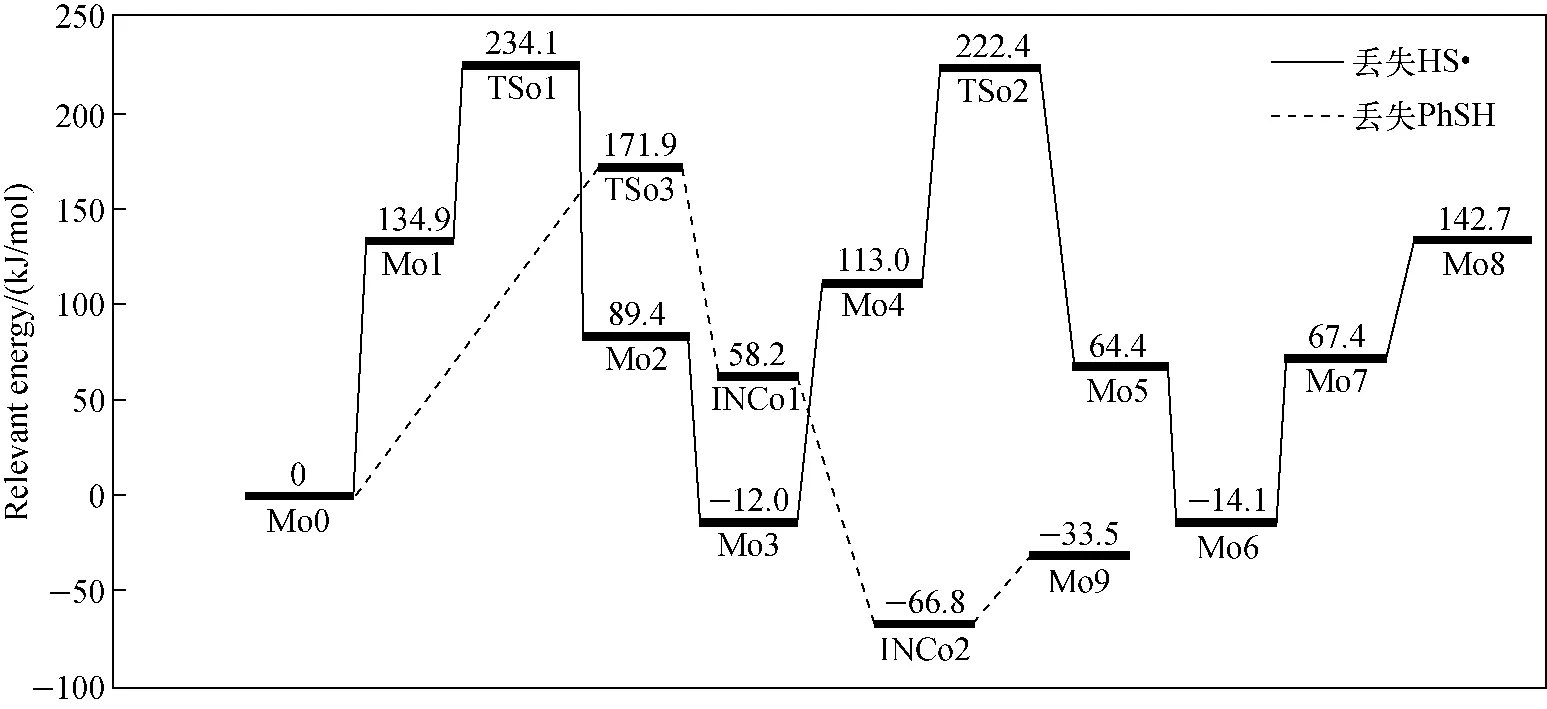
图3 化合物2丢失HS自由基和苯硫酚的反应势能曲线图Fig.3 Potential energy diagram for neutral loss of HS radical and benzenethiol from compound 2
间苯二苯硫醚(化合物7)的二级质谱图示于图1b,对比图1a可知,图1b中并没有观察到丢失2个HS自由基产生碎片离子d的信号,反而出现碎片离子e(m/z230.108 6,理论m/z230.109 0,误差-1.7×10-6)和丢失苯产生的碎片离子f(m/z216.005 5,理论m/z216.006 2,误差-3.2×10-6)。其中,碎片离子e是由2个取代苯环迁移后,C—S键直接断裂丢失S2所致[13-15]。碎片离子b(m/z184.3)和c(m/z261.2)经高分辨质谱验证,与化合物2一样都是由丢失苯硫酚和HS自由基产生的,其可能的裂解途径示于图4。当Mm0的自由基离域至Cc原子后,发生自由基环加成,得到含有五元杂环的中间体Mm1;随后发生1,2-H自由基迁移,Cb—Sf均裂开环,形成中间体Mm2;紧接着,Mm2中的苯硫酮互变为苯硫酚结构,Ca—Sf键异裂,丢失HS自由基,Ca—Sg成键,得到含五元硫杂环的产物离子c(m/z261.2)。另一方面,Mm2中Cc原子上的H也可以发生1,4-H质子迁移至Sg原子上,同时Ce—Sg键异裂,Sf原子亲核进攻Ce,得到产物离子b(m/z184.3)。产生这两种碎片离子的势能曲线示于图5。可见,间苯二苯硫醚丢失苯硫酚和HS自由基的裂解路径的最高过渡态能量是一致的(TSm1, 234.3 kJ/mol),但是从产物稳定性看,丢失苯硫酚的产物稳定性更好(Mm6, -32.6 kJ/mol; Mm5, 46.9 kJ/mol)。如表2所示,当对位取代基为吸电子基团时,倾向于丢失取代苯硫酚;当取代基为供电子基团时,则有利于丢失HS自由基。理论计算数据表明,中性丢失取代苯硫酚和HS自由基的最高过渡态能量是一致的,但前者的产物稳定性始终好于后者。由此可知,热力学并不是控制两个竞争反应的主要因素。
化合物12(对苯二苯硫醚)的二级质谱图示于图1c,图中并未出现丢失苯硫酚的碎片离子b(m/z184),只存在中性丢失苯硫自由基、HS自由基和S2产生的碎片离子a(m/z185.1)、c(m/z261.2)和e(m/z230.3)。丢失HS自由基的裂解途径示于图6。分子离子Mp0经自由基离域,发生环加成,得到中间体Mp1;然后越过256.9 kJ/mol能垒,发生1,2-H自由基迁移,形成中间体Mp2;接着,苯硫酮和苯硫酚互变,产生含苯硫酚结构的中间体Mp3;随后,苯硫酚结构中C—S键发生异裂并环化,最终得到含四元环结构的碎片离子c(Mp4,257.6 kJ/mol)。
以上结果表明,三类苯二苯硫醚位置异构体的分子离子经碰撞诱导解离,皆产生取代苯硫自由基和HS自由基的中性丢失。其中,邻苯二苯硫醚类化合物在裂解过程中,通过环化重排,减小了2个苯硫醚基团间的空间位阻,发生了连续2个HS自由基的特征丢失;而特征中性丢失S2只能在间、对苯二苯硫醚类化合物中观察到,此外,间苯二苯硫醚类化合物还会产生取代苯的特征中性丢失;对苯二苯硫醚类化合物直线形的分子构型导致了该类化合物不易产生苯硫酚的中性丢失。综上可知,连续HS自由基和S2中性丢失的信号可以区分邻苯二苯硫醚类化合物和其他两种位置异构体,取代苯硫酚和取代苯中性丢失则可区分间苯二苯硫醚和对苯二苯硫醚类化合物。
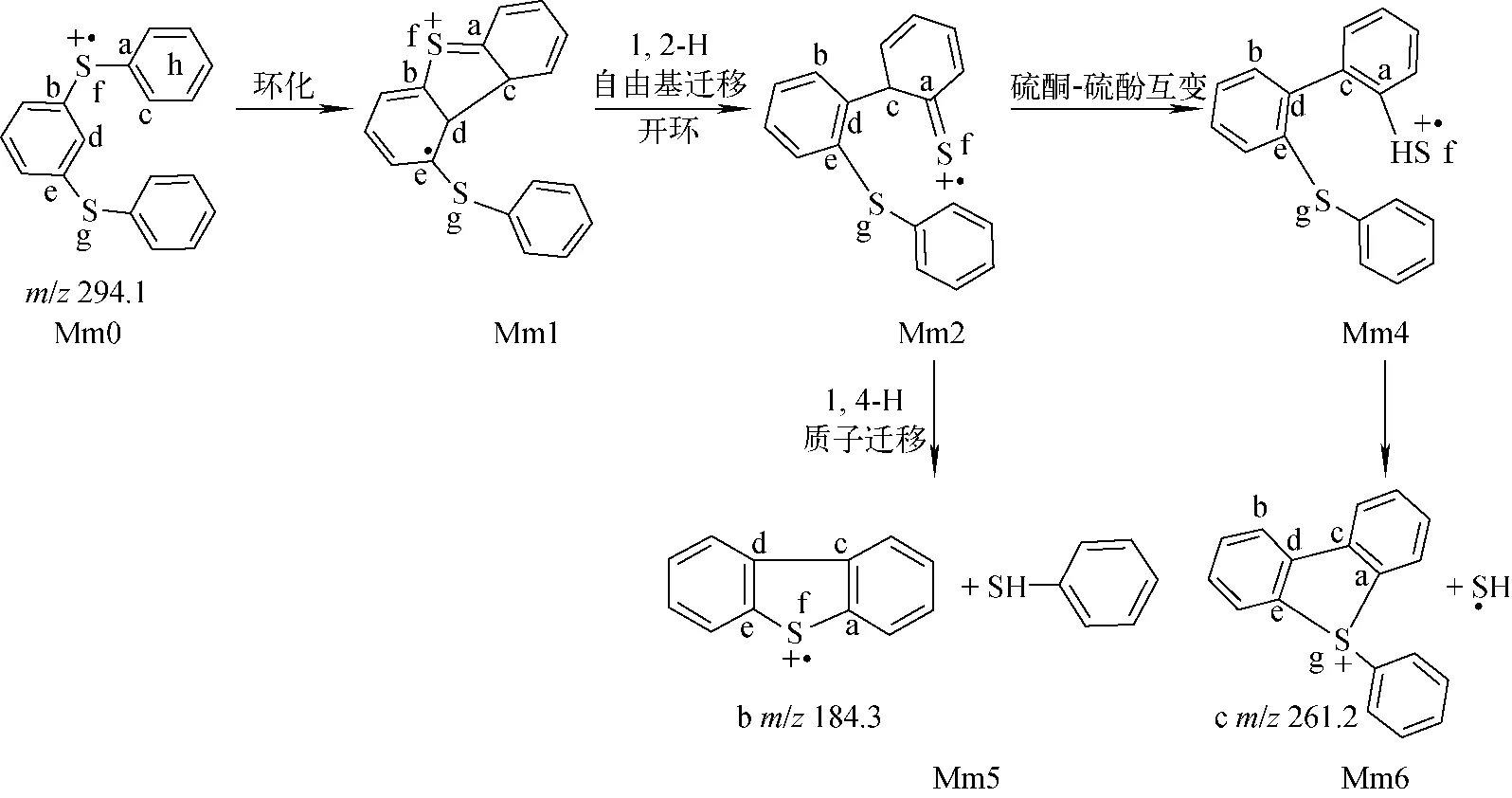
图4 化合物7丢失HS自由基和苯硫酚的裂解途径Fig.4 Proposed fragmentation mechanism for neutral loss of HS radical and benzenethiol from compound 7
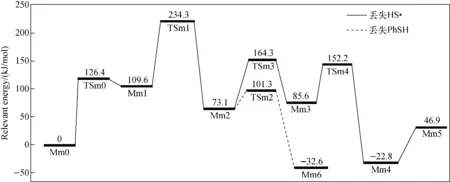
图5 化合物7丢失HS自由基和苯硫酚的反应势能曲线图Fig.5 Potential energy diagram for neutral loss of HS radical and benzenethiol from compound 7
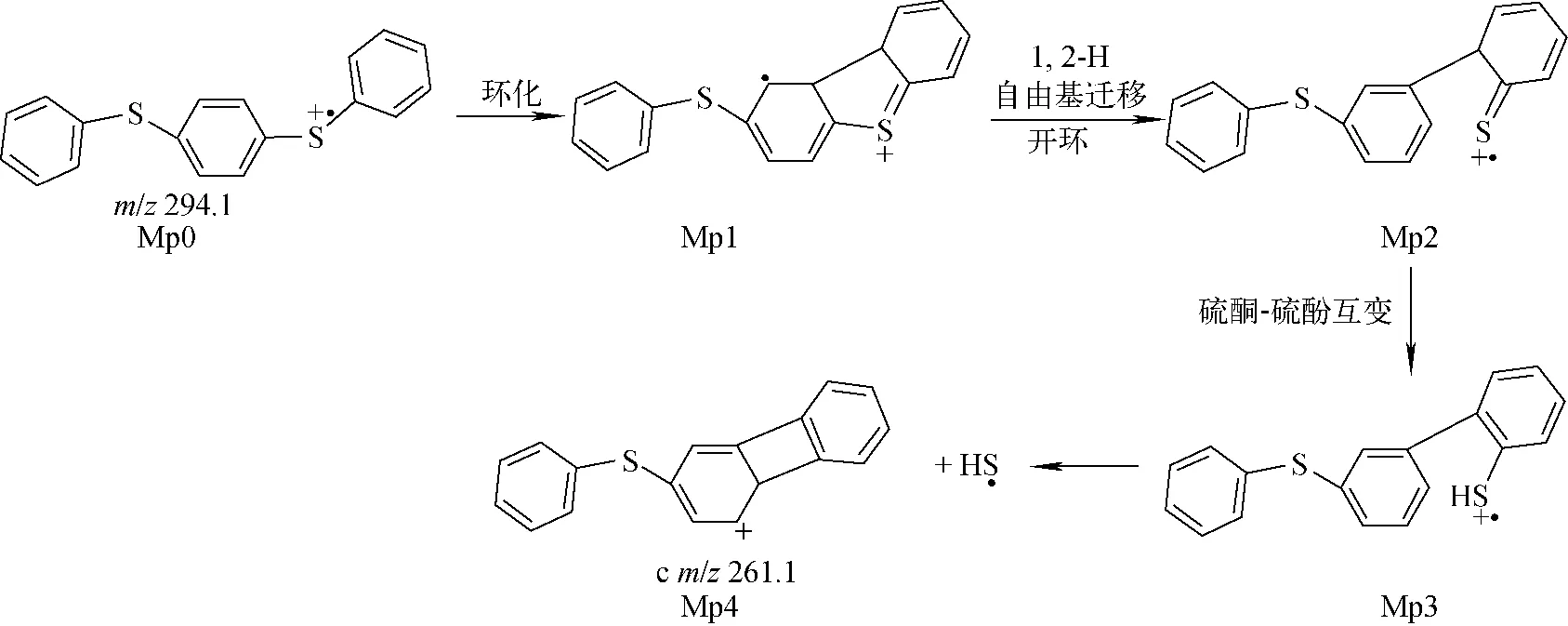
图6 化合物12丢失HS自由基的裂解途径Fig.6 Proposed fragmentation mechanism for neutral loss of HS radical from compound 12
3 结论
本工作采用APCI-MS/MS技术,结合量子化学密度泛函理论,对苯二苯硫醚三类位置异构体进行质谱裂解反应机理研究。结果表明,三类异构体经碰撞诱导解离,电荷诱导C—S键异裂,皆产生苯硫自由基中性丢失。而在自由基离域诱导环加成,硫酮-硫酚互变后,还能够产生中性HS自由基丢失。邻、间苯二苯硫醚类化合物都会产生取代苯硫酚中性丢失,其裂解途径也是由成环所介导。此外,苯二苯硫醚三类位置异构有明显的特征碎片丢失:邻苯二苯硫醚类化合物有连续丢失2个HS自由基的特征碎片离子;特征中性丢失S2只存在于间、对苯二苯硫醚类物质中,此外,间苯二苯硫醚类化合物还有取代苯的中性丢失;对苯二苯硫醚类化合物很明显少了丢失取代苯硫酚产生的碎片离子信号。综上可知,连续HS自由基和S2中性丢失的信号可以将邻苯二苯硫醚类化合物和其他两种位置异构体进行区分,而取代苯硫酚和取代苯则可以将间、对苯二苯硫醚这两种位置异构体区分开。三类苯二苯硫醚位置异构体裂解反应机理的探究,可为硫醚类化合物的相关性质研究提供理论基础;同时,邻、间、对苯二苯硫醚三类位置异构体特征中性丢失的讨论,也可为实现该类物质的区分鉴定提供依据。
[1] FRANK M. QSAR study of the biologically active organosulfurs in natural products[J]. E-Journal of Chemistry, 2010, 7(Suppl 1): S335-S343.
[2] MUSAH R A, HE Q, KUBEC R. Discovery and characterization of a novel lachrymatory factor synthase in Petiveria alliancea and its influence on alliianse-mediated formation of biologically active organosulfur compounds[J]. Plant Physiology, 2009, 151(3): 1 294-1 303.
[3] HU N, LIU P Y, JIANG K Z, et al. Mechanism study of SO2elimination from sulfonamides by negative electrospray ionization mass spectrometry[J]. Rapid Communication in Mass Spectrometry, 2008, 22(17): 2 715-2 722.
[4] CAO X J, ZHANG F F, ZHU K D, et al. Identifying the proton transfer reaction mechanism via a proton-bound dimeric intermediate for esomeprazoles by a kinetic method combined with density functional theory calculations[J]. Rapid Communication in Mass Spectrometry, 2014, 28(9): 1 045-1 050.
[5] HERRERA L C, RAMALEY L, GROSSERT J S. Fragmentation pathways of some benzothiophene radical cations formed by atmospheric pressure chemical ionization[J]. Rapid Communication in Mass Spectrometry, 2009, 23(5): 571-579.
[6] SHERADSKY T, ITZHAK N. Cycloaddition of nitroso dipolarophiles to thiazoliium-4-olates. Part 1. Nitrosobenzene and 1-chloro-1-nitrosocyclohexane[J]. Journal of the Chemical Society, 1992, 24(18): 2 389-2 393.
[7] PEPE C, SAYER H, LEDOUX S, et al. Study of the fragmentation pathways of dimethyl disulfide derivative of 2-methyl-1,4-pentadiene by GC/MS to locate the double bonds in substituted unsaturated compounds[J]. Analusis, 1999, 27(3): 255-258.
[8] BROER W J, WERINGA W D, NIEUWPOORT W C. Rearrangements and fragmentations of [C2H5S]+ions[J]. Organic Mass Spectrometry, 1979, 14(10): 543-549.
[9] FOX M A, TRIEBEL C A. A new pathway for cleavage of some phenacyl and styryl thioethers[J]. Journal of Organic Chemical, 1983, 48(6): 835-840.
[10]SCHUHFRIED E, PROBST M, LIMTRAKUL J, et al. Sulfides:Chemical ionization induced fragmentation studied with proton transfer reaction-mass spectrometry and density functional calculations[J]. Journal of Mass Spectrometry, 2013, 48(3): 367-378.
[11]DIJKSTRA P J, WERINGA W D. Rearrangements and fragmentations of phenyl styryl sulfides. 1. Metastable-ion spectra[J]. Organic Mass Spectrometry, 1982, 17(9): 424-429.
[12]HUNT D F, SHABANOWLTZ J. Determination of organosulfur compounds in hydrocarbon matrices by collision activated dissociation mass Spectrometry[J]. Analytical Chemistry, 1982, 54(3): 574-578.
[13]KEATS N G, SUMMERS L A. Mass spectral fragmentation pattern of 2, 2′-bipyridyls. Part VII 2,2′-dithiodipyridine[J]. Journal of Heterocyclic Chemistry, 1977, 14(2): 231-233.
[14]BORTOLINI O, FOGAGNOLO M. Mass spectrometry of sulfur containing compounds in organic and bioorganic fields[J]. Mass Spectrometry Reviews, 1995, 14(2): 117-162.
[15]GIES A P, ELLISON S T, GEIBEL J F, et al. MALDI-TOF/TOF CID study of Poly(phenylsulfidesulfone) fragmentation reactions[J]. Macromolecules, 2011, 44(13): 5 093-5 104.
Analysis and Differentiation ofbis(phenylthio) Benzene Isomers by Atmospheric Pressure Chemical Ionization-Mass Spectrometry
WANG Chen-lu1, MO Ya-wen1, CAO Xiao-ji2, MO Wei-min1,2
(1.CollegeofChemicalEngineering,ZhejiangUniversityofTechnology,Zhejiang310014,China;2.ResearchCenterofAnalysisandMeasurement,ZhejiangUniversityofTechnology,Zhejiang310014,China)
Compounds contain sulfur and their relevant derivatives are applied universally in the fields of chemistry, biochemistry, life science and so on. Among them, aryl thioethers are potential useful precursors for constructing various biological active of sulfur-containing heterocycles. Thus, researches for phenyl sulfides have received more and more concern. In this work, gas phase fragmentation reaction mechanism of three kinds ofbis(phenylthio) benzene isomers was studied by atmospheric pressure chemical ionization in positive ion mode combined with ion trap mass spectrometer. Meanwhile, theoretical calculations were performed by the density functional theory (DFT) method at the B3LYP level with 6-31+G (d, p) basis set in the Gaussian 03 package to verify cleavage pathways. Under the positive ion mode, all compounds generated molecular ions firstly, and after collision-induced dissociation (CID), some interesting fragmentation behaviors were observed. Benzensulfur radical loss resulted from direct heterolytic cleavage of C—S bond and neutral elimination of HS radical were obtained among all compounds. Foro-bis(phenylthio) benzenes, loss of HS radical was induced by radical delocalization, followed by cycloaddition and a serious of rearrangements. Moreover, continuous loss of HS radical appeared via similar fragmentation pathway with that of single HS radical loss. In addition, elimination of substituted benzenethiol was also detected, which was triggered by nucleophilic substitution, with H radical shift in the formed ion-neutral complex intermediate going after. Form-bis(phenylthio) benzenes, similar dissociation pattern leading to neutral elimination of HS radical was proposed, among which 1, 4-H proton transfer instead of thioketone-thiophenol interconversion resulted in substituted benzenethiol loss. In the case of neutral HS radical loss existed inp-bis(phenylthio) benzenes, reaction mechanism mediated by cycloaddition was illustrated as well. However, because of the linear chain structure, substituted benzenethiol could not be generated fromp-bis(phenylthio) benzenes. Furthermore, distinctive elimination of S2triggered by phenyl transfer existed only inmandp-bis(phenylthio) benzenes due to smaller steric hindrance. There was also characteristic neutral loss of substituted benzene ring inm-bis(phenylthio) benzenes. As a result,o-bis(phenylthio) benzenes and the other two isomers could be differentiated according to the continuous HS radical and S2losses. Whilemandp-bis(phenylthio) benzenes could be differentiated based on the eliminations of substituted benzenethiol and substituted benzene. This work investigated reaction mechanism about main neutral loss of HS radical and substituted benzenethiol for three kinds ofbis(phenylthio) benzene isomers in gas phase, using tandem mass spectrometry combined with theory calculation, which would provide support for further researches about sulfur-containing compounds. At the same time, discussion for the different fragmentation behaviors and characteristic neutral eliminations helps to realize differentiation and identification forbis(phenylthio) benzene isomers.
atmospheric pressure chemical ionization-mass spectrometry (APCI-MS);bis(phenylthio) benzenes; collision-induced dissociation (CID); fragmentation mechanism; positional isomers; theoretical calculation
2016-02-02;
2016-04-08
浙江省公益性技术应用研究计划项目(2010C33074)资助
王陈璐(1990—),女(汉族),浙江宁波人,硕士研究生,分析化学专业。E-mail: 471494135@qq.com
莫卫民(1957—),男(汉族),浙江温岭人,教授,从事分析化学、有机化学研究。E-mail: mowm@zjut.edu.cn
O657.63
A
1004-2997(2017)02-0169-08
10.7538/zpxb.2016.0015
