高电压LiNiPO4正极材料合成改性及研究进展①
2017-03-27魏广科陈桂敏盛锁江
魏广科, 陈桂敏, 盛锁江
(1.江苏氢电新能源有限公司,江苏 苏州 215300;2.苏州大学物理与光电·能源学部,江苏 苏州 215006; 3.轻工业化学电源研究所,江苏 苏州 215006)
1 前言
近年来,随着微电子技术和移动电子设备的发展,可充电锂离子电池作为动力要求能量高,体积小,重量轻且安全可靠,因此高电压锂离子电池是目前电池行业重要的发展趋势[1]。橄榄石结构的磷酸盐系列化合物LiMPO4(M=Fe、Mn、Co、Ni)已成为新能源材料领域研究的热点[2]。其中,LiFePO4,由于成本低,环境友好,过充条件下稳定性及放电过程中热稳定性好且高容量 (170mAh/g)等优点吸引众多研究这的眼光,目前已经商业化。但该材料能量密度偏低,这是因为其相对于锂的电极电势较低,仅为3.4V。而同系列材料LiMnPO4的电压平台在4.1V,但Mn3+的姜一泰勒效应其容量衰减严重。LiCoPO4和LiNiPO4正极材料均具有较高的充放电平台,相比之下,LiNiPO4材料具有最高的氧化还原电位,因此其能量密度也最高。理论计算结果表明应该在5V以上,研究者们试图通过实验来验证这一理论,但由于在如此高电压下无匹配的电解液以及该材料导电性很差,因此都失败了。该材料还存在很多缺陷:首先,LiNiPO4材料活性很低,离子导电性和电子导电性非常差,导致材料倍率性能很差[3-4],室温下,LiNiPO4材料导电性特别差,表现为绝缘性,随温度的升高,导电性逐渐变好,100℃下为10S·cm-1~14S·cm-1,200℃为10S·cm-1~12S·cm-1,300℃下为10S·cm-1~11S·cm-1,400℃下为 10S·cm-1~8 S·cm-1[5]。M.Prabu等人[6]及Jun Sugiyama等人[7]都对LiNiPO4材料的锂离子扩散性能进行了研究,其Li+扩散系数为2.7(4)×10-10cm2/s。其次,LiNiPO4材料可逆性很差,其中一个可能的原因是晶格塌陷。
2 LiNiPO4的结构特点及脱嵌机理
LiNiPO4为橄榄石型结构,六方密堆积结构,属于Pmna空间群,其中氧原子分别与Li+和Ni2+结合,占据了1/2的八面体位,而P5+则占据了1/8的四面体位置。LiNiPO4结构在c轴平行方向上是链式的,1个NiO6八面体与2个LiO6八面体和1个PO4四面体共边,而1个PO4四面体则与1个NiO6八面体和2个LiO6八面体共边,由此形成三维空间网状结构。八面体之间的PO4四面体限制了晶格体积的变化,使得 Li+的嵌脱受到影响。在这种含磷的橄榄石结构中,所有的氧离子与 P5+以很强的共价键形式结合成聚阴离子PO43-( 四面体),使整个空间结构变得稳固[8, 9]。除橄榄石型结构外,还可通过改变外界环境压力,在20Gpa可合成尖晶石结构的LiNiPO4材料,在4Gpa~20Gpa之间的压力中,还可生成一种新的结构,即亚稳态Na2CrO4型LiNiPO4材料,但该种结构的LiNiPO4正极材料与橄榄石结构的LiNiPO4材料结构不同,其Li+独立占据四面体位,阻碍Li+的扩散,使得其电化学活性更低[10]。
近年来,人们对磷酸盐系列化合物LiMPO4(M=Fe、Mn、Co、Ni)中LiFePO4和LiCoPO4材料的锂离子脱嵌机理的研究十分广泛,许多研究者认为Li+嵌脱过程是一个两相反应,即MPO4相和LiMPO4相,两相共存,Li+扩散经过两相界面,且Li+的扩散能力与LiMPO4粒径有关。Lucangelo Dimesso等人[11]用Pechini辅助溶胶凝胶法合成了石墨碳泡沫/LiNiPO4复合材料,他认为LiNiPO4正极材料在脱锂过程中存在两相,即LiNiPO4和NiPO4,或者为两相的结合。Manickam Minakshi等人[12]认为在锂离子的脱嵌过程中有不定型的NiPO4生成。目前针对LiNiPO4正极材料的锂离子脱嵌机理的研究不是很多,因为纯相的LiNiPO4材料导电性很低,很难进行充放电测试,因此,至今无法真正了解其锂离子脱嵌机理。
3 LiNiPO4正极材料和成及改性研究
LiNiPO4正极材料的电子导电性和锂离子扩散系数都很低,且合成条件要求十分严格,不同方法或者不同条件下合成的LiNiPO4正极材料的导电性也会有很大差异,因此在很大程度上限制了该材料的应用,许多研究人员对LiNiPO4正极材料的合成方法做了大量的探索,目前报道中用到的合成方法有固相法,Pechini法,溶胶凝胶法,溶液燃烧法及多元醇法等。
C.M.Julien等人[13]采用固相法,分别用Li2CO3,(NH4)2HPO4,NiO和NiO,LiH2PO4为原料合成了A-LiNiPO4和B- LiNiPO4材料。实验结果表明,A-LiNiPO4材料结晶良好,且无杂质峰,B-LiNiPO4中含有NiO杂质,结晶性较差。LiNiPO4材料的纯度对合成条件非常的敏感,当合成参数不是最优条件时,很容易出现NiO等杂质。另外,P.J.Baker等人[14]和A.Gofii等人[15]也采用固相法合成了LiNiPO4正极材料。Feng Yu等人[16]曾采用微波辅助固相法合成了LiMPO4材料。
S.Karthickprabhu等人[17]采用多元醇法,以CH3COOLi·2H2O,Ni(O(C=O)CH3)2·4H2O和H3PO4为原料,分别以1,2-丙二醇和乙二醇为介质,合成了LiNiPO4正极材料。XRD表明,以1,2-丙二醇为介质较乙二醇为介质制备的材料在低温度下具有更好的结晶度。SEM表明,该法合成的LiNiPO4材料为球形粒子,导电率随烧结温度的增加而增加,且在最优条件下的导电性高于之前文献中用同种方法和成的LiNiPO4材料。
但纯相的LiNiPO4正极材料很差的电子导电性和很低的锂离子扩散速率,几乎无活性。因此,我们需要寻找方法对LiNiPO4正极材料进行改性,总得来说有以下几种方法:1、合成纳米级材料。2、包覆导电性物质。 3、掺杂。
3.1 合成纳米级材料
较小的粒径可减少锂离子和电子扩散路径,从而提高其电化学性能,纳米级粒子能提高其倍率性能,同时减小结构分解塌陷和在循环中的张力,且纳米级粒子具有较大的比表面积,加大了材料与电解液的接触面积,增大了反应动力学。
M.Prabu[6]等人通过Pechini-type 可聚合前驱体法,将化学计量比的原料LiNO3,Ni(NO3)2·6H2O和NH4H2PO4溶于适量蒸馏水中,并以柠檬酸和聚乙二醇为螯合剂,350℃下热处理2h,得到均匀的黑色粉末,经研磨后800℃烧结8h得到的XRD测试表明,材料具有正交体系橄榄石型单晶结构,属Pnma空间群,晶胞参数为:a=10.07Å,b=5.860Å,c=4.620Å, V=272.62Å。SEM表明,材料为纳米级,如图1所示。BET测试的表面积为0.25(±0.2)m2·g-1,拉曼测试表明在945cm-1有一个强吸收峰,这是四面体(PO4)3-正常的对称震动,在更高频率(1010cm-1,1070cm-1和1083cm-1)是(PO4)3-的不对称伸缩震动,在200cm-1和300cm-1之间的吸收峰是Li-O键的不对称伸缩震动。在低频区,LiNiPO4材料介电常数是温度的函数。

图1 可聚合前驱体法合成的LiNiPO4样品SEM图Figure 1. SEM photograph of LiNiPO4
Gangulibabu等人[18]采用柠檬酸辅助改性溶胶凝胶法,将原料(CH3COO)2Co·4H2O,LiOOCCH3·2H2O,(CH3COO)2Ni·4H2O 和 NH4H2PO4先溶于适量热水中,形成均匀溶胶,然后加入柠檬酸和丙烯酰胺和N,N-亚甲基-二丙烯酰胺,加热并搅拌,得到凝胶,继续搅拌并110℃下热处理12h,研磨,在马弗炉中300℃烧结6h,研磨后在800℃下烧结5h得到LiNiPO4材料。XRD表明,材料无杂质峰,为纯相的LiNiPO4,且结晶性良好,为正交体系,且得到的材料的粒径小于50nm,说明该方法可有效降低LiNiPO4材料粒子尺寸,合成纳米级晶体材料。CV循环测试表明,用该方法合成的LiNiPO4材料氧化还原电位较低,分别在3.8V和3.5V。
3.2 包覆导电性物质
包覆导电媒介,如碳,有机聚合物或者镍化磷也很普遍,其目的是通过增加活性物质粒子之间和活性物质和导电剂之间的电接点来提高材料的电子导电率。
Lucangelo Dimesso等人[11,19]采用Pechini辅助溶胶凝胶法,以Li(CH3COO)·2H2O, Ni(CH3COO)2·7H2O为原料溶于蒸馏水中,以柠檬酸为螯合剂,加入化学计量比的磷酸和多孔的泡沫石墨碳,然后首先在285℃空气中加热12h,然后氮气氛围中785℃烧结2h。石墨碳泡沫/LiNiyPO4(y=0.8~1.0)复合材料,且 LiNiPO4∶石墨碳泡沫=10∶90。XRD测试表明,y=1.0时,直接在空气中800℃处理5h得到的样品含有LiPO3和NiO杂质,首先在空气中285℃处理12h,然后氮气中785℃烧结2h得到的样品中含有Li4P2O7和Ni3P杂质。HREM测试表明,y=1.0时,在LiNiPO4均匀分布在石墨碳泡沫的表面。当y<1.0时,在石墨碳泡沫表面的层状物质并不均匀,且存在一些孔洞和裂缝,y=0.8时最严重,这可能与Li2Ni3(P2O7)2杂质的生成有关。CV曲线表明,如图2所示,当y=1.0时,氧化峰在4.88V,y=0.9或0.8时,氧化峰为5.17V。充放电测试表明,0.1C下y=1.0,0.9和0.8时的放电容量分别为86mAh/g,76mAh/g和122mAh/g,但y=1.0时的容量保持率最好,10圈后,容量损失10%,但y=0.8时却损失86%。这是因为y=0.8时,材料中存在Li2Ni3(P2O7)2杂质和不稳定脱锂相减弱了电化学性能。循环测试前进行阻抗测试表明当y=1.0到0.9时其阻抗由172Ω减少到77Ω,而当y=0.8时,阻抗明显增加至223Ω。
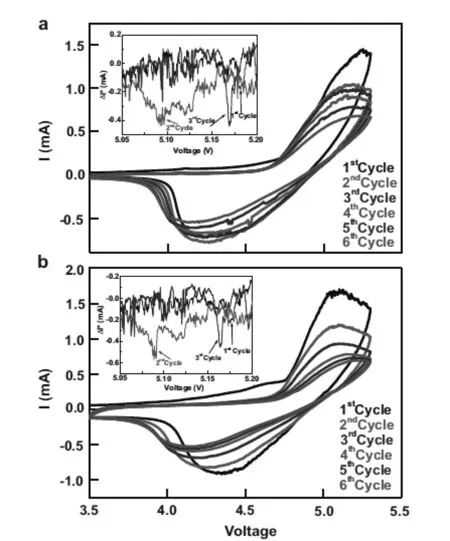
图2 Pechini辅助溶胶凝胶法合成的LiNiyPO4 a)y=0.9 and b)y=0.8样品在3.5V~5.3V电压 范围内的循环伏安曲线(扫描速度0.2mV·s-1)Figure 2. Cyclic voltammograms recorded for the graphic carbon foam-LiNiyPO4 composites for a)y=0.9 and b)y=0.8 respectively (scan rate 0.2mV·s-1, in the potential range 3.5V~5.3V vs Li+/Li-.)
3.3 掺杂金属离子
掺杂的目的是可能形成晶格间缺陷或者晶格膨胀,掺杂可提高LiNiPO4材料的导电性,有些可增加Li+的扩散率,少部分可增加材料的电化学活性。其取代离子可以为过渡金属(Fe,Mn,Co),也可为无电化学活性的金属(Mg,Ca,Al,Zn),掺杂后容量没有增加,但可改变其结构性能和电荷密度,提高其电化学性能。
Lakshmi Vijayan等人[20]采用溶液燃烧技术,以LiNO3,Ni(NO3)2·6H2O,NH4H2PO4和柠檬酸为原料,800℃~850℃下烧结得到LiNiPO4、LiNi1-xMgxPO4(x=0.1,0.2,0.3,0.4和0.5)和LiNi1-xCuxPO4(x=0.1,0.2,0.3,0.4和0.5)材料。材料为橄榄石结构,属Pmnb空间群。 XRD表明,当Mg含量较低时,合成的材料为单相的对称斜方晶系。Cu取代得到的材料具有杂质峰,Cu2+半径较大,很可能没有占据Ni2+位。合成材料为纳米级晶体,当取代量较少时,材料的导电性随Mg,Cu含量的增加而增大,当取代量过大时,由于反位空缺的缘故其导电性并没有明显增大。
M.PRABU等人[21]以LiNO3,Ni(NO3)2·6H2O,Eu(NO3)3·6H2O,NH4H2PO4,为原料,柠檬酸和乙二醇为螯合剂,采用Pechini法,350℃热解2h,得到均一的黑色粉末前驱体,研磨,800℃下烧结8h得到纯的LiNiPO4和铕掺杂的LiNiPO4正极材料。XRD表明,其均为 LiNiPO4型的橄榄石正交晶系,属Pmna空间群,且铕掺杂后衍射峰强度增强,说明材料结晶性良好。LiNiPO4室温下导电系数为9.34×10-9S/cm,铕掺杂后,导电性增加至7.02×10-8S/cm。
G.Butt等人[22]采用标准的固相法,以Li3PO4,Fe2O3, TiO2,NiO和NH4H2PO4为原料合成了LiNi1-xTixPO4(x=0~0.2)正极材料。所得样品为正交晶系,橄榄石结构,属Pnma空间群。拉曼测试表明,LiNiPO4中含有杂质相,如钛磷酸盐等,且随着Ti含量的增加至0.2,杂质相的含量也在不断增加,784cm-1处的特征峰很强。
Woochul Kim等人[23]以Li2CO3,NH4H2PO4,NiO和57Fe为原料,先研磨,然后5000N/cm2下压成圆形,然后封闭在疏散石英管内,之后高温煅烧,先在400℃下烧结然后升至700℃,保持一天。XRD测试表明,LiNi0.9957Fe0.01PO4材料为正交晶系,属Pnma空间群。磁化测试表明,其为不规律的反磁铁性。
M.Prabu等人[24]采用Pechini-型可聚合前驱体法,以LiNO3,Ni(NO3)2·6H2O, Y(NO3)3·6H2O和NH4H2PO4为原料,以柠檬酸和聚乙烯醇为螯合剂,两段温度处理(350℃下热处理2h,800℃下烧结8h)后得到纯的LiNiPO4和钇掺杂的Li0.99Y0.01NiPO4正极材料。XRD表明,产品为纯相LiNiPO4和钇掺杂的Li0.99Y0.01NiPO4正交晶系,且结晶性良好。XRD和IR测试表明,掺杂的Y取代Li+进入到LiNiPO4的晶格中,且掺杂后的LiNiPO4材料晶格体积增加,为Li+脱嵌提供了更大的空间,钇的嵌入可减少粒子尺寸,导致形成空位,因此可增加其导电性,通过钇掺杂后其导电性增加了两个数量级。介电损耗光谱表明,随频率增加,介电常数增加。
除了单纯的导电碳包覆和金属离子掺杂,Lucangelo Dimesso等人[25]还采用两种方法的结合,合成了Mg取代石墨碳泡沫/LiNi1-yMgyPO4复合材料。其结构和外貌以及电化学性能与Mg含量有关。y=0时,有杂质相Li4P2O7和Ni3P,当y=0.1时和当y=0.2时,在785℃氮气中退火处理得到的样品在泡沫碳相中观察到了LiNiPO4相,而当y=0.3时,出现了杂质相LiMgPO4。循环伏安曲线表明,如图3所示,当y=0.2时,氧化还原电位最高,分别在5.2V~5.3V和5.1V。Mg取代Ni后(y=0.2),0.1C下首次放电容量增加,大约126mAh/g,y=0.86mAh/g,y=0.1为123mAh/g。Mg离子可增加橄榄石结构的热力学稳定性,这可能是由于电化学惰性膜(SEI)的形成,抑制了锂离子的扩散。阻抗测试与电化学性能测试表明,当y=0.1时,电荷转移电阻降低,可能是由于Mg2+和Ni2+的互溶性,这也与其热稳定增加一致。Mg含量的增加,电荷转移电阻可能与异价取代有关(Mg2+取代Li+)。Mg/Ni等价取代可能已经影响到了其Li+扩散机理。
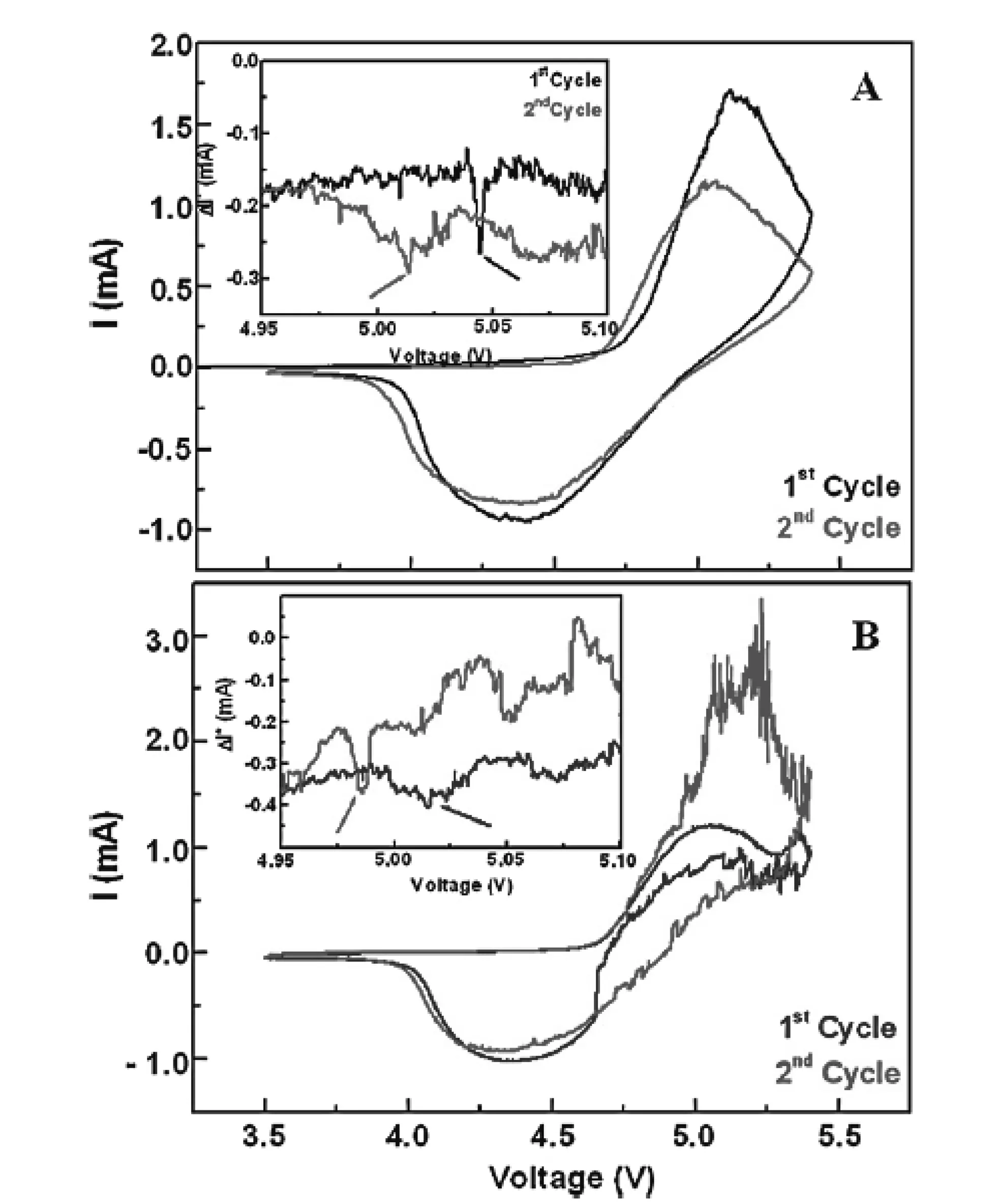
图3 Mg取代石墨碳泡沫/LiNi1-yMgyPO4 A)y=0.1和 B)y=0.2在3.5V~5.4V电压下的的循环伏安曲线 (扫速为0.2mV·s-1)Figure 3. Cyclic voltammograms recorded for the graphic carbon foam-LiNi1-yPO4 composites for (A)y=0.1 and (B)y=0.2 respectively (scan rate 0.2mV·s-1, in the potential range 3.5V~5.4V vs Li+/Li-.)
4 高电压电解液的研究
近几年,高电压正极材料的不断开发和研究,如LiCoPO4,Li3V2(PO4)3,Li2CoPO4F,LiNiPO4和富锂层状氧化物等氧化还原电位都在4.8V以上,而普通电解液只能承受4.5V的电压,当正极材料电压超过电解液所能承受的电压范围时,电解液会发生分解,使电池容量迅速衰减,因此锂离子电池性能除了与正极材料本身电化学性能有关,电解液是锂离子电池的重要组成部分,电池的电化学性能直接受到电解液和电极的界面反应和Li+的扩散性能的影响,因此,找到匹配的高电压电解液也十分重要。有人[3]曾采用1M:LiPF6环丁砜作为电解液,环丁砜作为电解液具有较高的氧化电位,约5.8V。Meng Hu等人[26]认为,目前,高电压溶剂的研究主要集中在新型稳定溶剂和功能溶剂。与有机碳酸酯溶剂相比,室温下的离子液体具有较高的热稳定性,不易燃,低挥发性和较宽的电压窗口,较高的电化学稳定性使离子液体成为当今高电压的备选电解液,但离子液体的高粘度和低的离子导电性使电池的循环稳定性和倍率性能较差,与电极的兼容性由于低湿润性也不是很好,较高的熔点使低温性能不俗很好,最好的方法就是加入一定量的传统的碳酸酯溶剂或其他混合溶剂,对离子液体的阳离子稳定性有好的影响。另外,砜类化合物也可作为电解液溶剂,其氧化电位在5.5V。实验结果表明0.5%四甲基砜(TMS){溶剂}+氟代碳酸乙烯酯(FEC)/碳酸二甲酯(DMC)[1∶4]{电解质}作为高电压电解液性能最好。
5 结语
目前,如何最大程度的提高锂离子电池的比容量是锂离子电池的重要发展方向,因此,正极材料较好嵌脱锂性质、更好的循环特性和高倍率特性成为主要研究内容之一。LiNiPO4具有的高电压、高能量密度等优点,使其成为新一代的高电压正极材料。虽然LiNiPO4正极材料在电压和能量密度方面较其他正极材料有很大优势,但正极材料LiNiPO4电化学性能受制于:材料的电子导电率很低;较高的充放电平台,目前没有匹配的电解液。另外,LiNiPO4材料可逆性和倍率性能很差,且LiNiPO4材料对合成条件非常敏感,需要严格控制合成条件。目前,在普通电解液中,很难得到LiNiPO4材料的充放电曲线[27],其锂离子脱嵌机理还不是很清楚,需要进一步的探索和研究。
[1] Wang H P, Maljukb A, Christian G F, Blum et al, Growth, characterization, and magnetic properties of a Li(Mn,Ni)PO4single crystal[J]. Journal of Crystal Growth, 2014, 386, 16-21.
[2] Toft-Petersen R, Jensen J, Jensen T B S, et al, High-field magnetic phase transitions and spin excitations in magnetoelectric LiNiPO4[J]. American Physical Society, 2011, 054408, 1-10.
[3] Wolfenstine J, Allen J, Ni3+/Ni2+redox potential in LiNiPO4[J]. Journal of Power Sources, 2005, 142, 389-390.
[4] Sung-Woo Cho, Kwang-Sun Ryu, Sulfur anion doping and surface modification with LiNiPO4of a LiNi0.5Mn0.3Co0.2O2cathode[J]. Materials Chemistry and Physics, 2012, 135, 533-540.
[5] Stefan M. Rommel, Norbert Schall, Christian Bru¨nig, Richard Weihrich, Challenges in the synthesis of high voltage electrode materials for lithium-ion batteries: a review on LiNiPO4[J]. Monatsh Chem, 2014, 145, 385-404.
[6] Prabu M, Selvasekarapandian S, Dielectric and modulus studies of LiNiPO4, Materials[J]. Chemistry and Physics, 2012, 134, 366-370.
[7] Sugiyama J, Nozaki H, Harada M et al, Diffusive behavior in LiMPO4with M = Fe, Co, Ni probed by muon-spin relaxation[J]. American Physical Society, 2012, 85, 283-288.
[8] 胡国荣, 童汇, 肖政伟, 石迪辉, 胡国华, 锂离子电池正极材料LiMPO4的研究进展[J]. 电池, 2006. 12, 36(6), 478-480.
[9] Zhou F, Cococcioni M, Kang K, Ceder G, The Li intercalation potential of LiMPO4and LiMSiO4olivines with M= Fe, Mn, Co, Ni, Electrochemistry Communications[J].2004, 6, 1144-1148.
[10] Koleva V, Stoyanova R, Zhecheva E, Formation of Metastable Na2CrO4-Type LiNiPO4from a Phosphate-Formate Precursor[J]. Eur. J. Inorg. Chem, 2010, 127-131.
[11] Dimesso L, Becker D, Spanheimer C, Jaegermann W, Investigation of graphitic carbon foams/LiNiPO4composites[J]. J Solid State Electrochem, 2012, 16, 3791-3798.
[12] Minakshi M, Singh P, Appadoo D, Danielle E. Martin, Synthesis and characterization of olivine LiNiPO4for aqueous rechargeable battery[J]. Electrochimica Acta, 2011, 56, 4356-4360.
[13] Julien C M, Mauger A, Zaghib K, Veillette R, Groult H, Structural and electronic properties of the LiNiPO4orthophosphate[J]. Ionics, 2012, 18, 625-633.
[14] Baker P J, Franke I, Pratt F L, Lancaster T, Prabhakaran D, Hayes W, Blundell S J, Probing magnetic order in LiMPO4(M = Ni, Co, Fe) and lithium diffusion in LixFePO4[J]. American Physical Society, 2011, 174403, 1-8.
[15] Gofii A, Lezam L, Barberis G E, Pizarro J L, Arriortua M I, Rojo T, Magnetic properties of the LiMPO4, (M = Co, Ni) compounds[J]. Journal of Magnetism and Magnetic Materials, 1996, 164, 35l-255.
[16] Yu F,Zhang L L,Zhu M Y,An Y X, Xia L L, Wang X G, Dai B, Overwhelming microwave irradiationassisted synthesis of olivine-structured LiMPO4(M=Fe,Mn,Co and Ni) for Li-ion batteries[J]. Nano Energy, 2014, 3, 64-79.
[17] Karthickprabhu S,Hirankumar G,Maheswaran A, Sanjeeviraja C, Daries Bella R S, Structural and conductivity studies on LiNiPO4synthesized by the polyol method[J]. Journal of Alloys and Compounds, 2013, 548, 65-69.
[18] Gangulibabu,Bhuvaneswari D,Kalaiselvi N,Jayaprakash N,Periasamy P,CAM sol-gel synthesized LiMPO4(M=Co, Ni) cathodes for rechargeable lithium batteries[J]. J Sol-Gel Sci Technol, 2009,49, 137-144.
[19] Dimesso L,Spanheimer C,Jaegermann W,Investigation on graphitic carbon foams-LiNiyPO4(y=0.8-1.0) composites[J]. Solid State Sciences, 2012,14 ,1372-1377.
[20] Vijayan L, Cheruku R, Govindaraj G, Electrical, optical and magnetic investigations on LiNiPO4based olivines synthesized by solution combustion technique, Materials Research Bulletin[J]. 2014, 50, 341-347.
[21] Prabulk M,Selxasakarapandlan S,Kulkarni A R,Kar-thikeyan S,Sanjeeviraja C,Influence of europium doping on conductivity of LiNiPO4, Nonferrous Met[J]. Soc. China, 2012, 22, 342-347.
[22] Butt G, Sammes N,Tompsett G,Smirnova A,Yam-amoto O,Raman spectroscopy of superionic Ti-doped Li3Fe2(PO4)3and LiNiPO4structures[J]. Journal of Power Sources, 2004, 134, 72-79.
[23] Kim W, Rhee C H, Kim H J, Moon S J,Kim C S, Strong crystalline field at the Fe site and spin rotation in olivine LiNi0.9957Fe0.01PO4material by Mössbauer spectroscopy[J]. American Institute of Physics, 2010, 96, 242505, 1-2.
[24] Prabu M,Selvasekarapandian S,Kulkarni A R,Kar-thikeyan S, Hirankumar G, Sanjeeviraja C, Structural, dielectric, and conductivity studies of yttrium-doped LiNiPO4cathode materials[J]. Ionics, 2011, 17, 201-207.
[25] Dimesso L, Spanheimer C, Jaegermann W, Effect of the Mg-substitution on the graphitic carbon foams-LiNi1-yMgyPO4composites as possible cathodes materials for 5 V applications[J]. Materials Research Bulletin, 2013, 48, 559-565.
[26] Hu M, Pang X L, Zhou Z, Recent progress in high-voltage lithium ion batteries[J]. Journal of Power Sources, 2013, 237, 229-242.
[27] 刘竞雅, 5V高电压锂离子电池阴极材料研究进展[J]. 电源世界, 2011.1, 53-57.
