番茄PIN基因家族的生物信息学分析及其表达模式
2017-03-27赵瑞瑞生吉萍
赵瑞瑞,申 琳,生吉萍
(1.清华大学生命科学学院,北京 100084;2.中国农业大学食品科学与营养工程学院,北京 100083;3.中国人民大学农业与农村发展学院,北京 100872)
番茄PIN基因家族的生物信息学分析及其表达模式
赵瑞瑞1,2,申 琳2,生吉萍3,*
(1.清华大学生命科学学院,北京 100084;2.中国农业大学食品科学与营养工程学院,北京 100083;3.中国人民大学农业与农村发展学院,北京 100872)
PIN蛋白是生长素输出蛋白,具有多个跨膜结构域,能够介导生长素在整个植物体内的流动。番茄作为一种具有重要经济价值的果蔬,对其生长发育调控的研究具有重要的意义。研究表明,PIN蛋白对植物果实的生长发育起着重要的调控作用。本研究通过生物信息学的方法对番茄PIN基因组中10 个SlPINs的核酸和氨基酸序列进行分析,构建番茄SlPINs的进化树,并分析番茄SlPINs在不同组织和果实生长发育过程中的表达量变化,为进一步研究SlPINs的生物学功能提供理论依据。
番茄果实;PIN基因;生物信息学分析;表达模式
生长素协调细胞的分裂和增殖分化,进而影响植物的生长发育。因此,生长素的时空分布调控对器官形成、胚胎形成、根的分生区生长及茎的生长具有重要的意义[1]。生长素控制果实发育的多个过程,包括果实形成、生长、成熟和脱落[2]。子房中生长素含量的异常增加或者破坏生长素的运输会影响受精作用,导致出现单性结实的果实[3-4]。通过下调生长素反应调节因子如Aux/IAAs或者生长素反应因子ARFs也会产生单性结实[5-7]。生长素的极性运输是调节生长素分布的重要机制,主要由控制生长素输出和输入的PIN蛋白和AUX/LAX蛋白介导[1]。PIN蛋白和AUX/LAX蛋白在细胞和组织间的非对称分布产生了生长素梯度和生长素的定性流动[8-10]。
PIN蛋白存在于所有陆生植物中,甚至在藓类中也存在PIN蛋白,目前已经从克伦藻属和双星藻中鉴定到PIN基因[11]。拟南芥中生长素的运输和PIN蛋白的功能已得到充分的研究报道[12]。拟南芥PIN蛋白为跨膜蛋白,具有两个疏水区和一个中央亲水环,可直接参与生长素梯度的形成[10]。拟南芥PIN蛋白对细胞内和细胞间生长素的定向运输起重要的作用[12-17],参与根系发育过程中生长素、乙烯、细胞分裂素和独角金内酯之间的相互作用[18],并在胚胎发育、器官发生、组织分化和定性反应中存在功能冗余[11]。
Mounet等[19]研究发现,番茄SlPIN4基因沉默会产生果实单性结实现象,SlPIN4基因沉默影响生长素调控的果实生长发育相关基因的表达,使影响花蕾发育早期的生长素内稳态和ARF、Aux/IAA基因表达量发生变化,最终导致授精之前果实过早发育成熟,出现单性结实现象。Pattison等[20]对番茄10 个PIN基因在不同组织和生长阶段的表达有较为详细的报道,同时发现SlPIN4基因沉默的植株会出现叶片弯曲的现象。
本研究利用数据库中番茄SlPINs的序列信息,通过生物信息学的方法系统研究番茄SlPINs家族的序列信息,包括SlPINs所编码氨基酸的特性、SlPINs的系统进化树以及SlPINs在不同组织和果实生长发育过程中的表达模式等,目的在于为进一步研究SlPINs的生物学功能奠定基础。
1 材料与方法
1.1 植物中PIN家族基因序列的获得
番茄、紫花苜蓿、拟南芥、水稻和玉米5 种植物共53 个PIN家族成员的CDs序列、基因组序列和氨基酸序列信息来自NCBI(http://www.ncbi.nlm.nih.gov/)数据库。
1.2 方法
1.2.1 番茄SlPINs的基本特征分析
利用ExPASy(http://www.expasy.org/tools)中的ProtParam(http://web.expasy.org/protparam/)分析SlPINs的分子质量、理论等电点、不稳定系数、亲水性指数和脂溶指数,利用PSORT(http://www.psort.org/)分析亚细胞定位,利用TMHMM(http://www.cbs.dtu.dk/services/ TMHMM-2.0/)分析跨膜结构域,利用SOPMA(http:// npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma. html)进行蛋白质二级结构预测。
1.2.2 番茄SlPINs的进化树分析
利用Clustal X软件对5 种植物53 个PIN氨基酸序列进行多重比对,使用MEGA 4.0软件分析比对结果,并用邻接法(neighbor-joining,NJ)构建系统进化树,用重复1 000 次的bootstrap进行检验。
1.2.3 番茄SlPINs的表达量分析
番茄SlPINs在不同组织和果实生长发育不同时期的表达量数据来自番茄转录组数据库(http://bar.utoronto.ca),并作图。
2 结果与分析
2.1 番茄PIN基因的基本特征分析
在NCBI数据库中共检索到10 条番茄PIN基因序列(表1),分布在9 条染色体上,其中10号染色体上有SlPIN7和SlPIN9两个PIN基因。番茄PIN基因编码氨基酸长度在358~653 个氨基酸之间,其中编码氨基酸长度在300~400 个氨基酸的有3 个;氨基酸长度在500~600 个氨基酸之间的有3 个;氨基酸长度在600~700 个氨基酸之间的有4 个。编码氨基酸最长的是SlPIN4,其分子质量为71.2 kD,编码氨基酸最短的是SlPIN10,其分子质量为38.41 kD。10 个PIN蛋白的理论等电点在6.98~9.19之间,只有SlPIN4和SlPIN10的理论等电点分别为6.98和6.99,其他PIN蛋白均为碱性氨基酸。根据PIN的不稳定系数发现,大部分PIN蛋白为稳定蛋白(不稳定系数小于40),只有SlPIN2和SlPIN4所编码的蛋白为不稳定蛋白(不稳定系数大于40)。亲水性指数表明,SlPIN5、SlPIN8和SlPIN10编码的蛋白是疏水性蛋白,其脂溶指数也都大于100,其余亲水性指数介于-0.5~+0.5之间为两性蛋白。拟南芥PIN蛋白主要分布在细胞质膜和内质网膜,而番茄SlPIN5和SlPIN6编码的蛋白质定位于细胞质膜和内质网膜上,其余均定位于细胞质膜上。

表1 番茄PIN 基因家族成员信息Table1 Information about members of the PIN gene family in Solanum lycopersicum
2.2 番茄PIN的基因结构和蛋白结构分析
根据NCBI数据库中基因组信息,分析了番茄SlPINs家族成员的基因结构,如图1所示,番茄SlPINs的进化树分为2 个分支,SlPIN5和SlPIN10处于一个分支,其余SlPINs基因处于一个分支。SlPIN5和SlPIN10具有5 个外显子和4 个内含子,在SlPIN1所在的分支中SlPIN6和SlPIN8具有7 个外显子和6 个内含子,其余SlPINs基因都具有6 个外显子和5 个内含子,SlPIN1、SlPIN9和SlPIN7进化关系最近,SlPIN3和SlPIN4进化关系最近。
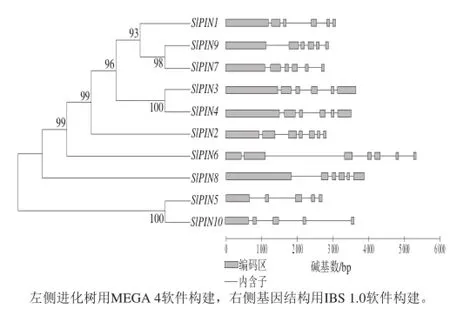
图1 番茄SlPINs 的进化树和基因组结构图Fig.1 Phylogenetic relationships and gene structures of SlPINs
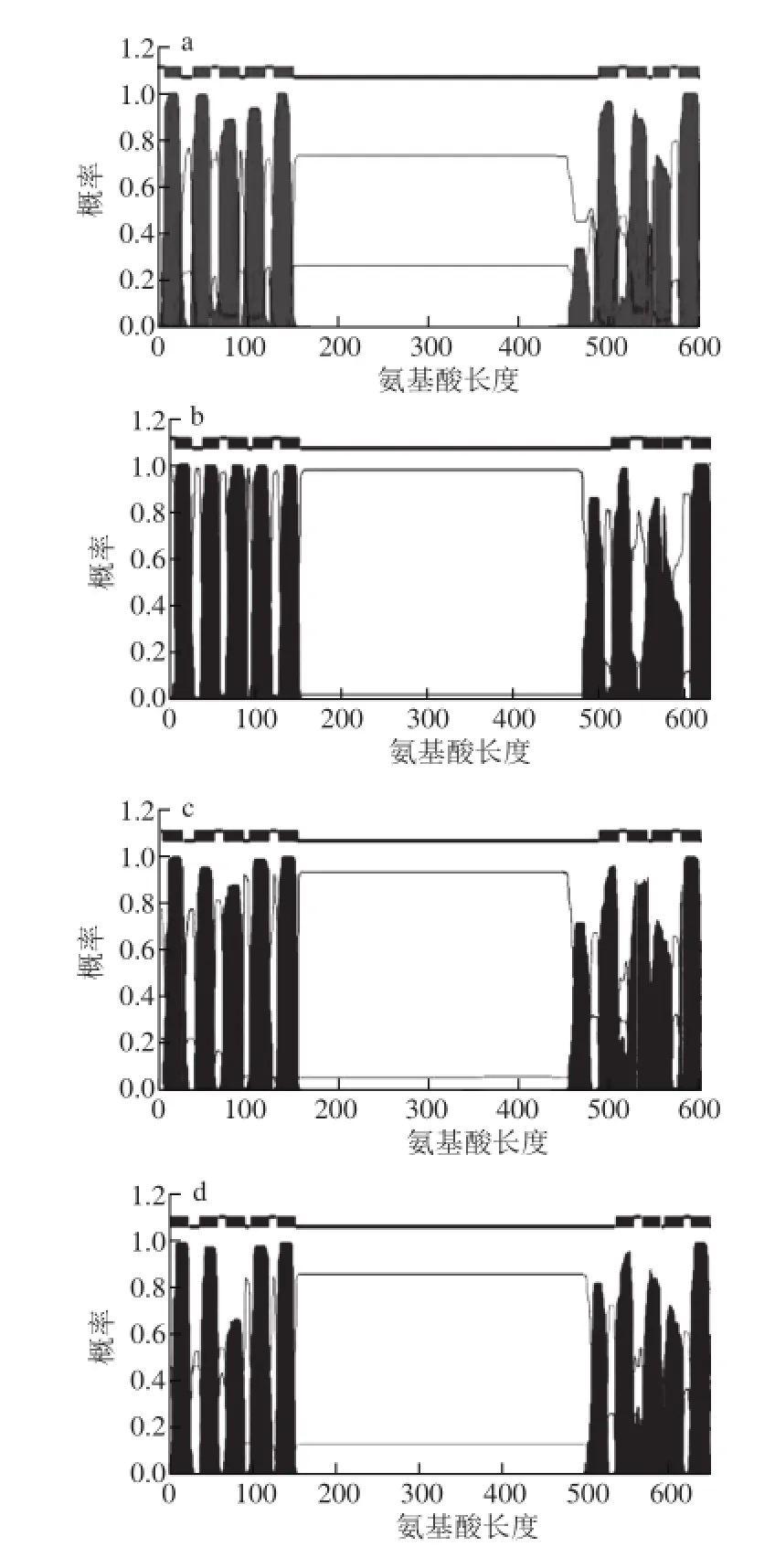
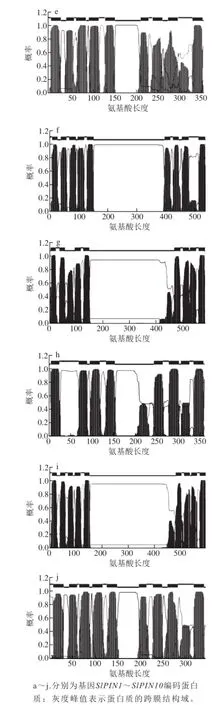
图2 番茄SlPINs 编码蛋白质的跨膜结构特征预测图Fig.2 Predicted protein prof i les of SlPINs gene family member transporters from tomato
PIN家族蛋白结构的特点是含有两端两个疏水区和一个中间亲水区,每个疏水区由5 个跨膜折叠组成。番茄SlPINs所编码的蛋白具有典型的N端跨膜结构域-中间胞质区-C端跨膜区结构域特征(图2),中间胞质区的长度区别很大,其中SlPIN5、SlPIN8和SlPIN10编码蛋白的胞质区长度大约为50 个氨基酸,而其余SlPINs编码的蛋白胞质区长度大都在250~350 个氨基酸之间。

表2 番茄PIN蛋白家族成员的二级结构分析Table2 Secondary structures of members of the PIN protein family in Solanum lycopersicum
如表2所示,番茄SlPINs编码的蛋白质由α-螺旋、延伸链、无规卷曲和β-转角组成,其中α-螺旋和无规卷曲占比较高,除了SlPIN5、SlPIN8和SlPIN10编码蛋白质的无规卷曲比α-螺旋的占比低外,其他SlPINs编码蛋白质的无规卷曲占比均大于α-螺旋。
2.3 番茄PIN家族的进化分析

图3 番茄SlPINs蛋白的系统进化树Fig.3 Phylogenetic relationships of the tomato PIN auxin transporters
利用MEGA 4的邻接法构建了番茄、紫花苜蓿、拟南芥、水稻和玉米5 种植物共53 个PIN蛋白的进化树(图3),番茄SlPINs蛋白与拟南芥AtPINs、紫花苜蓿MtPINs进化关系最为接近,而玉米ZmPINs和水稻OsPINs的进化关系最接近。番茄SlPIN1、2、3、4、6、8分别与拟南芥AtPINs对应。由于拟南芥和紫花苜蓿没有PIN10、SlPIN5和SlPIN10处于同一个染色体上,并且基因组结构相似,所以SlPIN10可能是通过基因组复制产生的。
2.4 番茄PIN基因的表达量变化
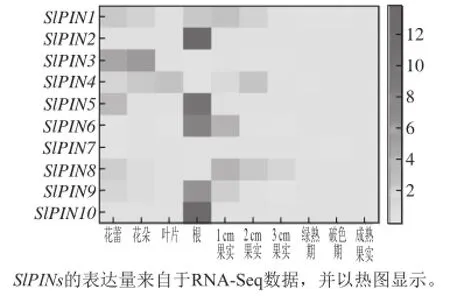
图4 番茄不同组织中SlPINs基因的表达量变化Fig.4 Tissue-specific expression profiles of SlPINs genes
如图4所示,根据番茄基因表达数据库分析番茄SlPINs在不同组织和发育阶段的表达发现,SlPIN1在花、叶、根和果实中都表达,在1 cm果实中表达量最高,AtPIN1也在各个组织中表达[21];SlPIN2在根中有特异的表达,与AtPIN2特异性的在根中表达相同[22];SlPIN3的表达主要集中在花器官中,在叶、根和果实中也有一定水平的表达,而AtPIN3主要在根分生组织和幼芽中表达[23];SlPIN4在花、叶、根和果实中都有较高水平的表达,而拟南芥AtPIN4主要在根中表达,并在胚胎的极性建成时大量表达[24];SlPIN5在花蕾和根中特异地表达,在根中表达量最高,研究表明,过表达AtPIN5的转基因植株植株矮小、分枝较多,出现根和下胚轴生长缺陷及叶片细长皱缩[15];SlPIN6主要在1 cm和2 cm果实中表达;SlPIN7、SlPIN8在各组织中表达量较低,但SlPIN8在1 cm果实中表达量最高,而AtPIN8在花药中特异表达,调控花粉的发育[14];SlPIN9在花、根和未成熟果实中表达量高,在根中表达量最高;SlPIN10特异性的在根中表达。本研究预测的SlPINs表达情况与Pattison等[20]的实验结果非常类似,这为研究SlPINs对生长发育的调控机制增加了新的依据。
分析SlPINs在果实中的表达情况,随着果实的不断生长,SlPIN1、SlPIN4、SlPIN6、SlPIN8的表达量不断降低,到果实完全成熟时SlPINs的表达量降至极低的水平,推测PIN蛋白调控的生长素在果实生长过程中起着非常重要的作用,当果实生长到一定大小时,PIN基因的表达量降低,因而生长素的作用减弱,推测生长素与乙烯之间可能存在相互抑制的关系。
3 结 论
PIN蛋白作为一种生长素输出载体在植物尤其是在果实的生长发育过程中起着重要的作用。番茄的基因组中共有10 个PIN基因,对其基因表达模式的分析发现SlPINs主要分布在根和花器官中。SlPIN4在果实生长的初期(2 cm)有较高水平的表达,Mounet等[19]的研究也证明番茄SlPIN4基因沉默会导致果实的单性结实,进一步说明番茄SlPINs在果实生长发育中起着重要的作用。SlPIN1、SlPIN6、SlPIN8随着果实的的不断长大其表达量下降,推测SlPIN1、SlPIN6、SlPIN8也对果实的生长发育起重要作用,但目前对SlPIN1、SlPIN6、SlPIN8在果实中的功能还缺少实验证据。因而关于番茄SlPINs在果实生长发育中的作用机制还有待进一步深入,SlPINs在果实生长发育中作用机制的研究将成为重要的研究内容。
[1] VANNESTE S, FRIML J. Auxin: a trigger for change in plant development[J]. Cell, 2009, 136(6): 1005-1016. DOI:10.1016/ j.cell.2009.03.001.
[2] SRIVASTAVA A, HANDA A K. Hormonal regulation of tomato fruit development: a molecular perspective[J]. Journal of Plant Growth Regulation, 2005, 24(2): 67-82. DOI:10.1007/s00344-005-0015-0.
[3] DORCEY E, URBEZ C, BLÁZQUEZ M A, et al. Fertilizationdependent auxin response in ovules triggers fruit development through the modulation of gibberellin metabolism in Arabidopsis[J]. Plant Journal, 2009, 58(2): 318-332. DOI:10.1111/j.1365-313X.2008.03781.x.
[4] SERRANI J C, CARRERA E, RUIZ-RIVERO O, et al. Inhibition of auxin transport from the ovary or from the apical shoot induces parthenocarpic fruit-set in tomato mediated by gibberellins[J]. Plant Physiology, 2010, 153(2): 851-862. DOI:10.1104/pp.110.155424.
[5] WANG H, JONES B, LI Z G, et al. The tomato Aux/IAA transcription factor IAA9is involved in fruit development and leaf morphogenesis[J]. Plant Cell, 2005, 17(10): 2676-2692. DOI:10.1105/ tpc.105.033415.
[6] GOETZ M, HOOPER L C, JOHNSON S D, et al. Expression of aberrant forms of AUXIN RESPONSE FACTOR8 stimulates parthenocarpy in Arabidopsis and tomato[J]. Plant Physiology, 2007, 145(2): 351-366. DOI:10.1104/pp.107.104174.
[7] de JONG M, MARIANI C, VRIEZEN W H. The role of auxin and gibberellin in tomato fruit set[J]. Journal of Experimental Botany, 2009, 60(5): 1523-1532. DOI:10.1093/jxb/erp094.
[8] WIŚNIEWSKA J, XU J, SEIFERTOVÁ D, et al. Polar PIN localization directs auxin fl ow in plants[J]. Science, 2006, 312: 883. DOI:10.1105/tpc.109.072678.
[9] SWARUP K, BENKOVÁ E, SWARUP R, et al. The auxin influx carrier LAX3 promotes lateral root emergence[J]. Nature Cell Biology, 2008, 10(8): 946-954. DOI:10.1038/ncb1754.
[10] PETRÁSEK J, FRIML J. Auxin transport routes in plant development[J]. Development, 2009, 136(16): 2675-2688. DOI:10.1242/dev.030353.
[11] BENNETT T. PIN proteins and the evolution of plant development[J]. Trends in Plant Science, 2015, 20(8): 498-507. DOI:10.1016/ j.tplants.2015.05.005.
[12] ADAMOWSKI M, FRIML J. PIN-dependent auxin transport: action, regulation, and evolution[J]. Plant Cell, 2015, 27(1): 20-32. DOI:10.1105/tpc.114.134874.
[13] dal BOSCO C, DOVZHENKO A, LIU X, et al. The endoplasmic reticulum localized PIN8 is a pollen-specific auxin carrier involved in intracellular auxin homeostasis[J]. Plant Journal, 2012, 71(5): 860-870. DOI:10.1111/j.1365-313X.2012.05037.x.
[14] DING Z J, WANG B J, MORENO I, et al. ER-localized auxin transporter PIN8 regulates auxin homeostasis and male gametophyte development in Arabidopsis[J]. Nature Communications, 2012, 3: 941. DOI:10.1038/ncomms1941.
[15] MRAVEC J, SKŮPA P, BAILLY A, et al. Subcellular homeostasis of phytohormone auxin is mediated by the ER-localized PIN5 transporter[J]. Nature, 2009, 459: 1136-1140. DOI:10.1038/ nature08066.
[16] CAZZONELLI C I, VANSTRAELEN M, SIMON S, et al. Role of the Arabidopsis PIN6 auxin transporter in auxin homeostasis and auxin-mediated development[J]. PLoS ONE, 2013, 8(7): e70069. DOI:10.1371/journal.pone.0070069.
[17] BARBEZ E, KUBEŠ M, ROLČÍK J, et al. A novel putative auxin carrier family regulates intracellular auxin homeostasis in plants[J]. Nature, 2012, 485: 119-122. DOI:10.1038/nature11001.
[18] KOLTAI H. Receptors, repressors, PINs: a playground for strigolactone signaling[J]. Trends in Plant Science, 2014, 19(11): 727-733. DOI:10.1016/j.tplants.2014.06.008.
[19] MOUNET F, MOING A, KOWALCZYK M, et al. Down-regulation of a single auxin eff l ux transport protein in tomato induces precocious fruit development[J]. Journal of Experimental Botany, 2012, 63(13): 4901-4917. DOI:10.1093/jxb/ers167.Epub2012Jul27.
[20] PATTISON R J, CATALÁ C. Evaluating auxin distribution in tomato (Solanum lycopersicum) through an analysis of the PIN and AUX/LAX gene families[J]. Plant Journal, 2012, 70(4): 585-598. DOI:10.1111/ j.1365-313X.2011.04895.x.
[21] RAST M I, SIMON R. Arabidopsis JAGGED LATERAL ORGANS acts with ASYMMETRIC LEAVES2 to coordinate KNOX and PIN expression in shoot and root meristems[J]. Plant Cell, 2012, 24(7): 2917-2933. DOI:10.1105/tpc.112.099978.
[22] KUMAR M, PANDYA-KUMAR N, DAM A, et al. Arabidopsis response to low-phosphate conditions includes active changes in actin filaments and PIN2 polarization and is dependent on strigolactone signalling[J]. Journal of Experimental Botany, 2015, 66(5): 1499-1510. DOI:10.1093/jxb/eru513.
[23] ZHANG K X, XU H H, YUAN T T, et al. Blue-light-induced PIN3 polarization for root negative phototropic response in Arabidopsis[J]. Plant Journal, 2013, 76(2): 308-321. DOI:10.1111/tpj.12298.
[24] FRIML J, BENKOVÁ E, BLILOU I, et al. AtPIN4 mediates sinkdriven auxin gradients and root patterning in Arabidopsis[J]. Cell, 2002, 108(5): 661-673. DOI:10.1016/S0092-8674(02)00656-6.
Bioinformatic Analysis of the PIN Gene Family in Tomato and Its Expression Pattern
ZHAO Ruirui1,2, SHEN Lin2, SHENG Jiping3,*
(1. School of Life Sciences, Tsinghua University, Beijing 100084, China; 2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 3. School of Agricultural Economics and Rural Development, Renmin University of China, Beijing 100872, China)
PIN-FORMED (PIN) proteins work as auxin eff l ux proteins with multiple transmembrane domains and mediate auxin fl ow throughout the plant. As tomato is an important cash crop, studies aimed to regulate its growth and development are of great significance. Studies have shown that PIN proteins play an important role in regulating the growth and development of fruits. In this study, we predicted the characteristics of ten tomato PIN members by using on-line software, constructed a phylogenetic tree for SlPINs, and analyzed expression changes of SlPINs in different tissues and during fruit growth and development. This study will provide a basis for future study on the biological functions of SlPINs.
tomato fruit; PIN gene; bioinformatic analysis; expression pattern
10.7506/spkx1002-6630-201704001
TS255.3
A
1002-6630(2017)04-0001-05
赵瑞瑞, 申琳, 生吉萍. 番茄PIN基因家族的生物信息学分析及其表达模式[J]. 食品科学, 2017, 38(4): 1-5. DOI:10.7506/ spkx1002-6630-201704001. http://www.spkx.net.cn
ZHAO Ruirui, SHEN Lin, SHENG Jiping. Bioinformatic analysis of the PIN gene family in tomato and its expression pattern[J]. Food Science, 2017, 38(4): 1-5. (in Chinese with English abstract)
10.7506/spkx1002-6630-201704001. http://www.spkx.net.cn
2016-04-17
国家自然科学基金面上项目(31371847;31272215);国家重点基础研究发展计划(973计划)项目(2013CB127106)
赵瑞瑞(1984—),女,博士,研究方向为植物生理与分子生物学。E-mail:zhaorui1012@gmail.com
*通信作者:生吉萍(1967—),女,教授,博士,研究方向为食品科学与食品安全管理。E-mail:shengjiping@126.com
