四妙勇安汤调控滋养血管网重建稳定ApoE-/-小鼠动脉粥样硬化易损斑块的实验研究*
2017-03-27张军平漆仲文
李 萌,张军平**,朱 科,漆仲文,邹 升
(1.天津中医药大学第一附属医院 天津 300193;2.天津中医药大学研究生院 天津300193)
近年来对于动脉粥样硬化(Atherosclerosis,AS)的研究已由聚焦于血管内膜的“由内向外”炎症反应机制逐步转变为“由外向内”,血管外膜在AS发病过程中的作用越来越受到重视。血管外膜是集成血管壁功能的主要监管机构,可视为“中央处理器”,大中动脉管壁外膜及中膜外1/3存在丰富的VV网,为宿主血管壁输送氧气和营养物质并排出代谢废物,维持宿主血管的物质代谢及能量平衡,保持宿主血管结构与功能的完整性[1]。有研究对高脂血症猪模型的冠状动脉进行观察,发现在AS早期血管外膜VV出现异常增生,VV密度增加,且VV密度与AS病变程度呈正相关[2,3]。AS斑块内的新生VV 96.5%起源于血管外膜,病理性新生VV具有结构缺陷,其脆性大、渗漏性高,容易破裂出血,造成巨噬细胞浸润、脂质/坏死核心扩大,导致斑块不稳定,同时也为血细胞及血液可溶性成分(如脂质、细胞因子、生长因子等)进入斑块提供通道[4]。AS病变的主要临床危险性在于斑块的不稳定性、易损性,斑块内VV新生是促进稳定斑块发展为易损斑块的重要病理机制,其与斑块内出血、斑块破裂及临床心脑血管事件的发生密切相关[5]。四妙勇安汤载于清·鲍相敖《验方新编》中,由金银花、玄参、当归和甘草组成,具有清热解毒活血之功效,为治疗热毒型脱疽的经典良方。近年来该方广泛应用于AS性疾病的治疗,例如冠心病、下肢动脉硬化闭塞症、脑梗死等。本研究以VV新生为切入点,探讨四妙勇安汤干预AS易损斑块的效应机制。
1 材料与方法
1.1 实验动物
8周龄雄性ApoE-/-小鼠,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004,SPF级,体重20-25 g。8周龄雄性C57BL/6小鼠,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001,SPF 级,体重20-25 g。室温保持22-24℃,相对湿度50%,12 h交替照明,饮水不限,自由摄食。
1.2 实验药品、试剂及仪器
四妙勇安汤饮片(金银花90 g,玄参90 g,当归60 g和甘草30 g)购自天津中医药大学第一附属医院;辛伐他汀(舒降之,杭州默沙东制药有限公司,规格20 mg/片);L-蛋氨酸(M5308,美国sigma公司);LDLC、HDL-C、TG、TC 测定试剂盒(A113-2、A112-2、A110-2、A111-2,南京建成生物工程研究所有限公司);饱和油红O染色剂(G1260,北京索莱宝科技有限公司);苏木素-伊红染色试剂盒(C0490,天津百浩生物科技有限公司);CD34兔单克隆抗体(ab81289,英国Abcam公司);MOMA-2大鼠单克隆抗体(ab33451,英国Abcam公司);HIF-1 Alpha兔多克隆抗体(bs-0737R,北京博奥森生物技术有限公司);Apelin-13兔多克隆抗体(bs-2425R,北京博奥森生物技术有限公司);Apelin Receptor兔多克隆抗体(bs-2430R,北京博奥森生物技术有限公司);Phospho-p44/42 MAPK(Erk1/2)(Thr202/Tyr204)兔单克隆抗体(4370,Cell Signaling Technology公司);GAPDH小鼠单克隆抗体(ab9484,英国Abcam公司);CM1900石蜡切片机(Leica);光学显微镜(DM3000,Leica);JA1003型电子分析天平(上海精科公司);ELX800型光吸收酶标仪(美国BIO-TEK公司);Roche Modular P800型全自动生化测定仪(瑞士罗氏公司);电泳仪(北京六一仪器厂)。
1.3 四妙勇安汤冻干粉的制备与质控标准
按照四妙勇安汤原方配比称取金银花90 g、玄参90 g、当归60 g、甘草30 g,混合均匀,加入8倍量(2 160 ml)55%的乙醇,浸泡20 min,回流提取2 h,过滤,收集滤液。再重复提取1次,合并滤液,得到55%乙醇提取液和药渣。将药渣再用纯水回流提取2 h,过滤,得到的滤液与前次滤液合并。将所得提取液浓缩后置于冷冻干燥机内,制备四妙勇安汤冻干粉。质控标准:金银花中绿原酸含量不得少于1.5%;玄参中哈巴苷和哈巴俄苷的总量不得少于0.45%;当归中阿魏酸含量不得少于0.05%;甘草中甘草苷含量不得少于0.50%,甘草酸不得少于2.0%[6]。
1.4 方法
1.4.1 动物分组及模型建立
将雄性8周龄ApoE-/-小鼠随机分为3组,模型组、辛伐他汀组、四妙勇安汤组,每组15只,共45只,并以C57BL/6小鼠作为正常对照组。采用添加1.1%L-蛋氨酸的高脂饲料(维持饲料基础上添加1.1%L-蛋氨酸、21%脂肪、0.15%胆固醇)喂养ApoE-/-小鼠8周,自由摄食和饮水。8周后,辛伐他汀以2.6 mg·kg-1剂量灌胃给药,四妙勇安汤以11.7 mg·kg-1剂量灌胃给药,给药剂量参考《药理实验方法学》[7],正常对照组与模型组给予相同体积的蒸馏水灌胃,连续给药8周。
1.4.2 标本采集
于16周后取材,取材前禁食水12 h,采用乙醚吸入麻醉,摘眼球取血。迅速打开胸腹腔,暴露心脏,由心尖部灌注PBS缓冲液,取主动脉根部连带部分心肌组织置于4%中性甲醛固定液中固定,用于苏木素-伊红染色(HE染色)、免疫组化染色,剩余部分于-80℃冰箱冻存以备Western blot检测。
1.4.3 血脂检测
采用全自动生化分析仪检测血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)水平,严格按照试剂盒操作方法进行检测。
1.4.4 病理形态学观察
HE染色观察主动脉根部斑块的病理形态变化,将已固定标本脱水、石蜡包埋切片(厚度约5 μm),HE染色,在100倍光镜下观察并采集图像,应用Image-Pro plus Version 6.0专业图像分析软件进行分析,测量斑块面积(PA)、血管管腔面积(LA)、最小纤维帽厚度及中膜面积,并计算PA/LA之比。
表1 各组小鼠血清TC、TG、LDL-C、HDL-C含量的变化(mmol/L)

表1 各组小鼠血清TC、TG、LDL-C、HDL-C含量的变化(mmol/L)
注:与正常对照组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与辛伐他汀组比较,dP<0.01,eP<0.05。
1.4.5 免疫组化染色
检测小鼠主动脉根部斑块内与主动脉外膜CD34标记的VV密度以及主动脉根部斑块内MOMA-2阳性表达。石蜡切片脱蜡至水,PBS清洗10 min×3次,3%过氧化氢孵育10 min,PBS清洗5 min×3次,EDTA抗原修复液,高压热修复10min,PBS清洗5 min×3次,滴加5%BSA封闭20 min,滴加一抗工作液,4℃孵育过夜(湿盒保湿),PBS清洗10 min×3次,滴加二抗工作液,37℃孵育30 min,PBS清洗10 min×3次,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。采用微血管密度计数方法(MVD)[8],在400倍光镜下观察,随机计数5个高倍视野斑块区或血管外膜区域的微血管数量,计算微血管密度值(n·mm-2),取其平均值。在400倍光镜下观察,随机选取5个高倍视野斑块区,采用Image-Pro plus Version 6.0专业图像分析软件进行分析,计算MOMA-2阳性表达面积与斑块面积的百分比,取其平均值。
1.4.6 Western blot检测
检测HIF-1α-Apelin/APJ信号通路的关键节点蛋白。提取组织的总蛋白,BCA法测定蛋白浓度。进行SDS-PAGE电泳,并转移至PVDF膜上,置于封闭液中室温封闭1 h,将封闭后的PVDF膜置入一抗工作液中,4℃孵育过夜,室温洗膜后,置于二抗工作液中室温孵育1 h,抗体结合区带用化学发光法检测。以GAPDH作为内参,以目的蛋白吸光度值/GAPDH吸光度值的比值表示所检测标本目的蛋白的相对含量,进行数据统计分析。
1.4.7 统计学方法
2 结果
2.1 四妙勇安汤对小鼠血脂水平的影响
与正常对照组比较,模型组小鼠血清TC水平显著升高(P<0.01);与模型组比较,辛伐他汀组血清TC水平显著降低(P<0.01);四妙勇安汤组血清TC水平降低,差异有统计学意义(P<0.05)。与正常对照组比较,模型组小鼠血清TG水平显著升高(P<0.01);与模型组比较,辛伐他汀组血清TG水平显著降低(P<0.01);四妙勇安汤组血清TG水平降低,差异有统计学意义(P<0.05)。与正常对照组比较,模型组小鼠血清LDL-C水平显著升高(P<0.01);与模型组比较,两给药组血清LDL-C水平均显著降低(P<0.01)。与正常对照组比较,模型组小鼠血清HDL-C水平显著降低(P<0.01);与模型组比较,辛伐他汀组血清HDL-C水平显著升高(P<0.01),但四妙勇安汤组血清HDL-C水平无明显的变化,差异无统计学意义(P>0.05),见表1。
2.2 四妙勇安汤对小鼠AS斑块病理形态的影响
HE染色显示:与正常对照组比较,模型组小鼠主动脉根部斑块面积显著增大(P<0.01);主动脉管腔面积无明显变化,差异无统计学意义(P>0.05);斑块与管腔面积比显著升高(P<0.01);斑块具有薄纤维帽、大脂质核心的特点,斑块内可见大量泡沫细胞和胆固醇结晶沉积,甚至出现斑块破裂出血,斑块处于不稳定状态;主动脉内膜明显增厚,中膜平滑肌排列紊乱且萎缩变薄,中膜面积显著降低(P<0.01)。与模型组比较,两给药组小鼠主动脉根部斑块面积均显著减小(P<0.01),主动脉管腔面积无明显变化,差异无统计学意义(P>0.05),斑块与管腔面积比显著降低(P<0.01),最小纤维帽厚度显著增加(P<0.01),且未出现断裂,斑块未见明显破裂与出血,但中膜面积无明显改善,差异无统计学意义(P>0.05)。与辛伐他汀组比较,四妙勇安汤组最小纤维帽厚度增加更为显著,差异有统计学意义(P<0.05),见图1,表2。
2.3 四妙勇安汤对小鼠主动脉斑块内及主动脉外膜滋养血管的影响
免疫组化半定量分析显示:与正常对照组比较,模型组小鼠主动脉根部斑块内CD34阳性染色的新生滋养血管密度显著增高(P<0.01)。与模型组比较,辛伐他汀组与四妙勇安汤组斑块内新生滋养血管密度显著降低(P<0.01),见图2,表3。

图1 四妙勇安汤对小鼠主动脉根部斑块HE染色的影响(×100)
表2 各组小鼠主动脉根部斑块形态比较(±s)

表2 各组小鼠主动脉根部斑块形态比较(±s)
注:与正常对照组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与辛伐他汀组比较,dP<0.05。

图2 四妙勇安汤对小鼠主动脉根部斑块内新生滋养血管的影响(×400)
表3 各组小鼠主动脉根部斑块内新生滋养血管密度(n/mm2,±s)
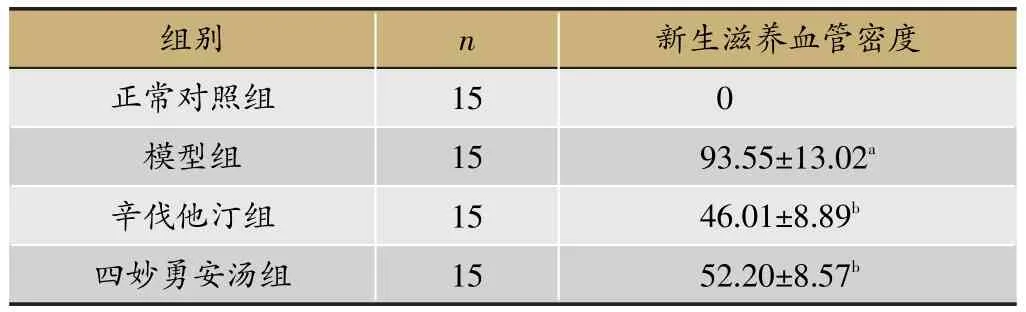
表3 各组小鼠主动脉根部斑块内新生滋养血管密度(n/mm2,±s)
注:与正常对照组比较,aP<0.01;与模型组比较,bP<0.01。
免疫组化半定量分析显示:与正常对照组比较,模型组小鼠主动脉外膜CD34阳性染色的滋养血管密度显著增高(P<0.01)。与模型组比较,辛伐他汀组与四妙勇安汤组主动脉外膜滋养血管密度显著降低(P<0.01),见图3,表4。
2.4 四妙勇安汤对小鼠主动脉斑块内巨噬细胞含量的影响
免疫组化半定量分析显示:与正常对照组比较,模型组小鼠主动脉根部斑块内巨噬细胞MOMA-2阳性面积百分比显著增高(P<0.01)。与模型组比较,辛伐他汀组斑块内巨噬细胞MOMA-2阳性面积百分比显著降低(P<0.01);四妙勇安汤组斑块内巨噬细胞MOMA-2阳性面积百分比降低,差异有统计学意义(P<0.05)
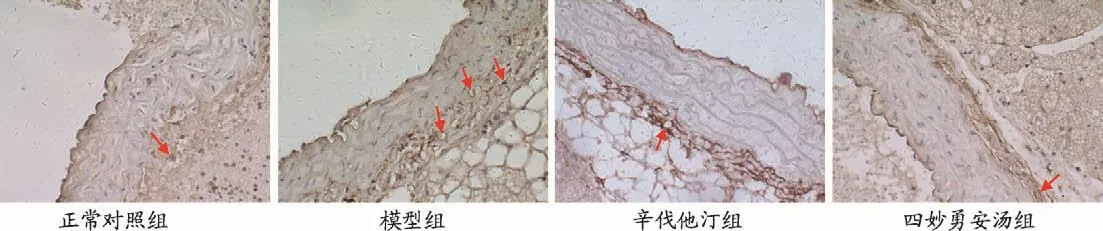
图3 四妙勇安汤对小鼠主动脉外膜滋养血管的影响(×400)
表4 各组小鼠主动脉外膜滋养血管密度(n/mm2,±s)

表4 各组小鼠主动脉外膜滋养血管密度(n/mm2,±s)
注:与正常对照组比较,aP<0.01;与模型组比较,bP<0.01。
表5 各组小鼠主动脉根部斑块内巨噬细胞含量(%,±s)

表5 各组小鼠主动脉根部斑块内巨噬细胞含量(%,±s)
注:与正常对照组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05。

图4 四妙勇安汤对小鼠主动脉根部斑块内巨噬细胞含量的影响(×400)
2.4 四妙勇安汤对小鼠主动脉HIF-1α-Apelin/APJ信号通路的影响
与正常对照组比较,模型组小鼠主动脉HIF-1α蛋白表达水平显著升高(P<0.01)。与模型组比较,两给药组HIF-1α蛋白表达水平均显著降低(P<0.01)。与辛伐他汀组比较,四妙勇安汤组降低HIF-1α蛋白表达水平的作用更加显著,差异有统计学意义(P<0.05)。
与正常对照组比较,模型组小鼠主动脉Apelin蛋白表达水平显著升高(P<0.01)。与模型组比较,两给药组Apelin蛋白表达水平均显著降低(P<0.05)。
与正常对照组比较,模型组小鼠主动脉APJ蛋白表达水平显著升高(P<0.01)。与模型组比较,两给药组APJ蛋白表达水平均降低,差异有统计学意义(P<0.05)。
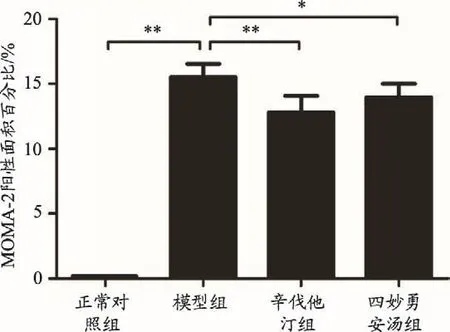
图5 各组小鼠主动脉根部斑块内巨噬细胞MOMA-2蛋白的表达
与正常对照组比较,模型组小鼠主动脉Phospho-MEK1/2(Ser217/221)蛋白表达水平显著升高(P<0.01)。与模型组比较,两给药组Phospho-MEK1/2(Ser217/221)蛋白表达水平均显著降低(P<0.01)。
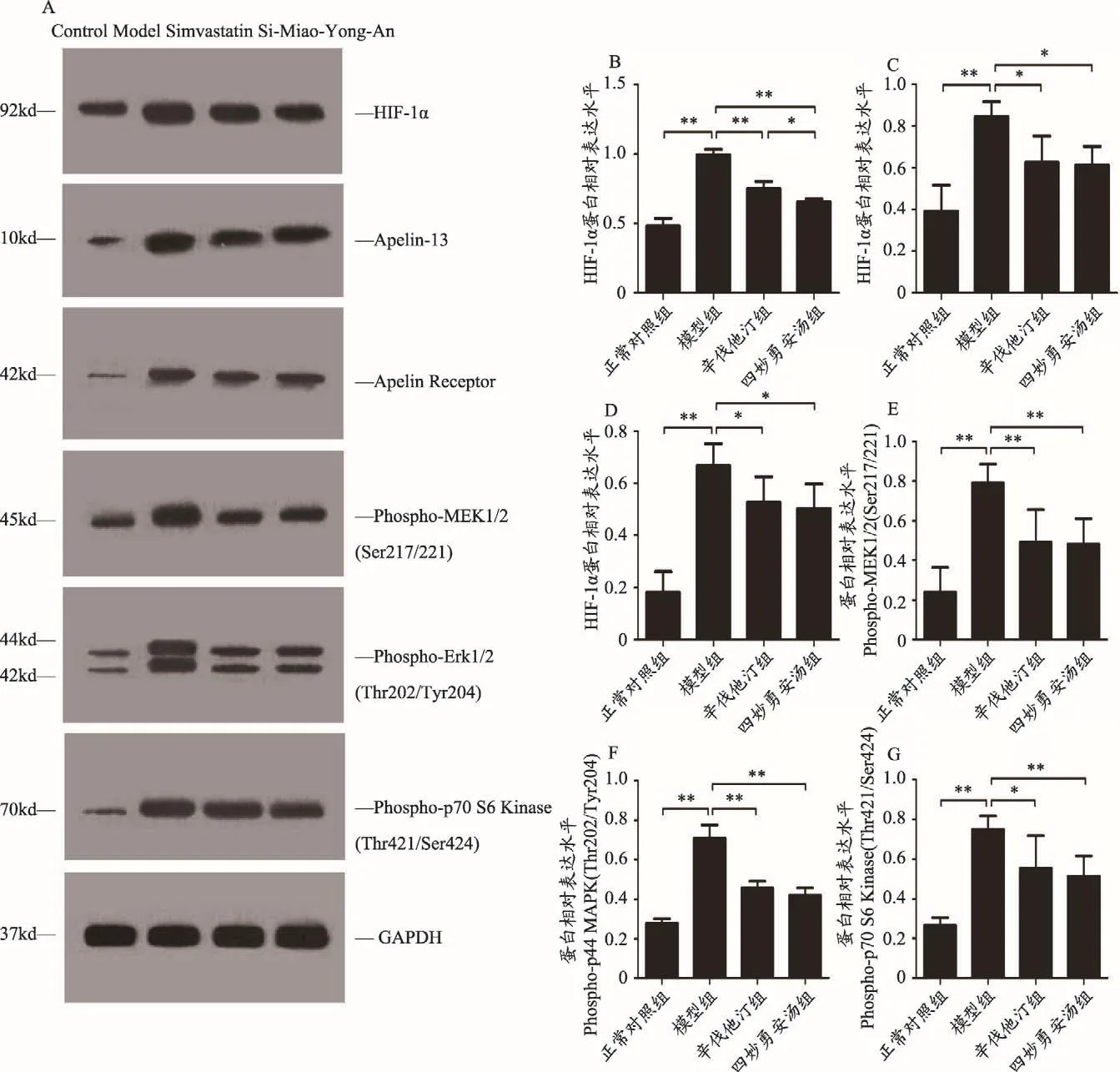
图6 四妙勇安汤对ApoE-/-小鼠主动脉HIF-1α-Apelin/APJ信号通路的影响
与正常对照组比较,模型组小鼠主动脉Phosphop44/42 MAPK(Erk1/2)(Thr202/Tyr204)蛋白表达水平显著升高(P<0.01)。与模型组比较,两给药组Phosphop44/42 MAPK(Erk1/2)(Thr202/Tyr204)蛋白表达水平均显著降低(P<0.01)。
与正常对照组比较,模型组小鼠主动脉Phosphop70 S6 Kinase(Thr421/Ser424)蛋白表达水平显著升高(P<0.01)。与模型组比较,辛伐他汀组Phosphop70 S6 Kinase(Thr421/Ser424)蛋白表达水平降低,差异有统计学意义(P<0.05);四妙勇安汤组Phosphop70 S6 Kinase(Thr421/Ser424)蛋白表达水平显著降低(P<0.01),见图6。
3 讨论
AS病变的主要临床危险性在于斑块的易损性,斑块内VV新生是促进稳定斑块发展为易损斑块的重要病理机制,其与斑块破裂、出血以及临床心脑血管事件的发生密切相关。因此,深入研究VV的结构与功能及关键信号途径在AS中的作用,有望从根本上阻止稳定斑块发展为易损斑块,延缓AS进展,对于AS性疾病的治疗具有重要意义。
VV为宿主血管壁输送氧气和营养物质并排出代谢废物,维持宿主血管的物质代谢及能量平衡,保持宿主血管结构与功能的完整性。AS发生早期,活性氧、趋化因子、炎症介质等多种活性因子在血管外膜聚集,并随微循环进入VV,黏附于滋养血管网,破坏滋养血管运输功能;血管腔内弥散的氧和营养物质对管壁的供应不足,内膜代偿性增厚导致的动脉氧供不足会缩短氧与营养物质在内膜深层与管腔表面的扩散距离,造成局部缺氧、动脉内壁缺血损伤,从而诱导HIF-1α表达[9,10]。HIF-1α被称为“缺氧基因表达的总开关”,是一种与特定核辅因子联系紧密的DNA结合转录因子[11]。缺氧条件下,HIF-1α通过激活一系列转录基因从而启动各种适应性反应来应对氧分压降低[12-14]。
Apelin是HIF-1α的靶基因,HIF-1α与Apelin的第一内含子结合,触发Apelin4持续释放,其与内源性受体APJ结合,促进ECs活化与增殖,并且Apelin和一些传统的血管源性分子存在交互作用,如VEGF、成纤维细胞生长因子等,共同调节血管新生[15]。APJ是1993年发现的新型G蛋白偶联受体,其内源性配体Apelin于1998年由Tatemoto等利用反向药理学方法在牛胃分泌物中分离纯化而成。Apelin是一种强效的血管生成因子和细胞分裂素,包括Apelin-12、Apelin-13、Apelin-17和Apelin-36,其中Apelin-13活性最高,其通过激活APJ受体促进血管新生与重构。Apelin-APJ系统在胚胎血管发育及成年后的血管新生中起重要作用[16,17]。Apelin-APJ结合后,通过作用于MEK/ERK信号通路,激活p70 S6 kinase,从而促进ECs活化与增殖,促进VV新生[18]。由此可见,HIF-1α-Apelin/APJ信号通路在VV新生中起着关键作用,研究通路中关键节点蛋白的表达,对探索VV新生的发生机制及AS易损斑块的有效治疗均有重要意义。
四妙勇安汤最早见于华佗《神医秘传》,清末鲍相敖将其收载于《验方新编·卷二》中,本方重用金银花、玄参为君药,金银花清热解毒,玄参清热凉血,泻火解毒,且有养阴散结之功效,两药合用,既清气分邪热,又解血分热毒,臣以当归之温润,养血活血、化瘀散结,甘草为使调和诸药,全方仅四味药,量大力专,用之巧妙,具有清养结合,毒瘀并祛之功效,为治疗热毒型脱疽的经典良方。
本研究对四妙勇安汤稳定AS斑块的效应进行观察,结果显示四妙勇安汤能够显著改善小鼠主动脉斑块病理形态,减小斑块面积及斑块与管腔面积比,增加最小纤维帽厚度以稳定斑块,且四妙勇安汤对纤维帽厚度的改善明显优于辛伐他汀;可有效抑制斑块内及血管外膜VV新生,降低斑块内巨噬细胞含量,从而发挥稳定斑块的作用。四妙勇安汤可有效降低小鼠血清TC、TG、LDL-C水平,从而调节血脂水平,但对血清HDL-C水平无明显的改善作用。
以VV新生为切入点,探讨四妙勇安汤稳定易损斑块的机制,结果显示四妙勇安汤能够有效改善主动脉血管壁缺血缺氧的状态,从而降低HIF-1α蛋白表达水平,且其作用优于辛伐他汀;下调主动脉Apelin蛋白、APJ蛋白表达水平,抑制Apelin蛋白的持续释放,减少Apelin蛋白与其受体APJ结合;显著降低Phospho-MEK1/2(Ser217/221)蛋白表达,抑制MEK1/2蛋白的激活;显著降低Phospho-p44/42 MAPK(Erk1/2)(Thr202/Tyr204)蛋白表达,抑制p44/42 MAPK(Erk1/2)蛋白的激活;显著降低Phospho-p70 S6 Kinase(Thr421/Ser424)蛋白表达,抑制p70 S6 Kinase蛋白的激活,从而抑制ECs活化、增殖,抑制VV新生。综上,四妙勇安汤稳定ApoE-/-小鼠动脉粥样硬化易损斑块的机制可能与抑制小鼠主动脉HIF-1α-Apelin/APJ信号通路,从而抑制VV新生有关。
此外,将抑制VV新生与促进新生VV成熟化结合起来综合干预,可能为临床上防治AS带来新理念、新变革。四妙勇安汤对新生VV成熟化的影响有待进一步研究。
1 Williams J K,Heistad D D.Structure and function of vasa vasorum.Trends Cardiovasc Med,1996,6(2):53-57.
2 Schinkel A F,Krueger C G,Tellez A,et al.Contrast-enhanced ultrasound for imaging vasa vasorum: comparison with histopathology in a swine model of atherosclerosis. EurJ Echocardiogr,2010,11(8):659-64.
3 Kwon H M,Sangiorgi G,Ritman E L,et al.Enhanced coronary vasa vasorum neovascularization in experimental hypercholesterolemia.J Clin Invest,1998,101(8):1551.
4 Mulligan-Kehoe M J,Simons M.Vasa vasorum in normal and diseased arteries.Circulation,2014,129(24):2557-66.
5 Kwon T G,Lerman L O,Lerman A.The Vasa Vasorum in Atheroscl-erosis:The Vessel Within the Vascular Wall.J Am Coll Cardiol,2015,65(23):2478-80.
7 徐叔云.药理实验方法学.北京市:人民卫生出版社,2002:200-223.
8 Tonar Z,KuralT J,Kochová P,et al.Vasa vasorum quantification in human varicose great and small saphenous veins.Ann Anat.2012,94(5):473-481.
9 Björnheden T,Levin M,Evaldsson M,et al.Evidence of hypoxic areas within the arterial wall in vivo.Arterioscler Thromb Vasc Biol,1999,19(4):870-876.
10 Nakashima Y,Chen Y X,Kinukawa N,et al.Distributions of diffuse intimal thickening in human arteries: preferential expression in atheros-clerosis-prone arteries from an early age.Virchows Arch,2002,441(3):279-288.
11 Lim C S,Kiriakidis S,Sandison A,et al.Hypoxia-inducible factor pathway and diseases of the vascular wall.J Vasc Surg,2013,58(1):219-230.
12 Zimna A, Kurpisz M. Hypoxia-Inducible Factor-1 in Physiological and Pathophysiological Angiogenesis: Applications and Therapies.Biomed Res Int,2015,2015:549412.
13 He L,Xu J,Chen L,et al.Apelin/APJ signaling in hypoxiarelated diseases.Clin Chim Acta,2015,451(Pt B):191-8.
14 Koivunen P,Serpi R,Dimova E Y.Hypoxia-inducible factor prolyl 4-hydroxylase inhibition in cardiometabolic diseases.Pharmacol Res,2016,114:265-273.
15 Yu X H,Tang Z B,Liu L J,et al.Apelin and its receptor APJ in cardiovascular diseases.Clin Chim Acta,2014,428:1-8.
16 Wu L,Chen L,Li L.Apelin/APJ system:A novel promising therapy target for pathological angiogenesis.Clin Chim Acta,2016,466:78-84.
17 Folino A,Montarolo P G,Samaja M,et al.Effects of apelin on the cardiovascular system.Heart Fail Rev,2015,20(4):505-18.
18 Masri B,van den Berghe L,Sorli C,et al.Apelin signalisation and vascular physiopathology.J Soc Biol,2009,203(2):171-9.
