杜仲雄花主要活性成分含量的多样性*
2017-03-27杜庆鑫魏艳秀刘攀峰杜红岩
杜庆鑫 魏艳秀 刘攀峰 杜红岩
(中国林业科学研究院经济林研究开发中心 国家林业局杜仲工程技术研究中心 郑州 450003)
杜仲雄花主要活性成分含量的多样性*
杜庆鑫 魏艳秀 刘攀峰 杜红岩
(中国林业科学研究院经济林研究开发中心 国家林业局杜仲工程技术研究中心 郑州 450003)
【目的】 研究不同种质杜仲雄花主要活性成分含量的遗传变异规律,比较并评价杜仲雄花主要活性成分含量的多样性,为雄花用杜仲优良资源选育和开发利用提供科学依据和材料。【方法】 以193份不同种质杜仲雄花为材料,采用AlCl3比色法测定杜仲雄花中总黄酮含量,全自动氨基酸分析仪测定氨基酸含量,HPLC法测定桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、异槲皮苷、紫云英苷6种活性成分含量,并对8种活性成分含量进行变异分析、相关性分析、主成分分析和聚类分析。【结果】 不同种质杜仲雄花8种活性成分含量和多样性指数均以氨基酸最高,分别为206.23 mg·g-1和2.05; 变异系数以京尼平苷最高,达112.00%,氨基酸最低,仅为12.52%。相关性分析结果显示:桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷及异槲皮苷5种活性成分间均呈极显著正相关,氨基酸除与总黄酮呈极显著正相关外,与其他活性成分相关性不显著。通过主成分分析,前4个主成分的累计贡献率达87.040%,可以用于杜仲雄花资源前期的评价选择。基于8种活性成分,将193份杜仲种质划分为5个类群,各类群8种活性成分含量之间均存在显著性差异。第Ⅰ类群种质8种活性成分含量均较低; 第Ⅱ类群种质氨基酸含量最高; 第Ⅲ类群种质黄酮类化合物及其组分含量最高; 第Ⅳ类群种质环烯醚萜类化合物组分含量最高; 第Ⅴ类群种质绿原酸和京尼平苷酸含量最高。初步明确杜仲种质雄花的不同类型。【结论】 杜仲种质雄花8种活性成分含量较高,开发利用价值大,而且表现出丰富的多样性和变异,很有选择潜力和改良潜力。
杜仲; 雄花; 种质; 活性成分; 多样性
杜仲(Eucommiaulmoides),杜仲科杜仲属,为第四纪冰川侵袭后仅留存于我国的孑遗树种,是我国特有的珍稀濒危二级保护植物和天然药食两用植物,具有很高的经济、药用、营养和生态价值,在军工、航空航天、橡胶工业、医疗保健、健康食品等领域有着广泛的应用(杜红岩等, 2006; 杜红岩, 2014; 赫锦锦, 2010)。杜仲雌雄异株,雄花簇生于当年生枝条基部,产量高,易于采集(白喜婷等, 2008)。我国传统以杜仲干皮入药,具有补肝肾、强筋骨的功效(Dongetal., 2011a; 杜红岩等, 2011)。以往对杜仲的研究多集中在皮、叶上,现代研究表明,杜仲雄花富含与皮、叶中类似的桃叶珊瑚苷、京尼平苷酸、京尼平苷等环烯醚萜类化合物组分,异槲皮苷、紫云英苷等黄酮类化合物组分,以及绿原酸和氨基酸等活性成分(吴敏等, 2014; 叶东旭等, 2012)。环烯醚萜类化合物具有抗炎、抗肿瘤、利胆、保肝、通便及治疗风湿等功能活性,绿原酸具有抗菌、抑制突变、保护心血管等作用,黄酮类化合物具有降脂减肥、抗自由基、抗菌、抗病毒等生物活性,氨基酸具有很高的营养价值。其中,总黄酮和氨基酸在杜仲雄花中的含量远高于皮和叶,其他活性成分含量也较高(张欣等, 2012; Takamuraetal., 2007; 刘严, 2012; 杜红岩等, 2013)。杜仲雄花已被列为新食品原料,以杜仲雄花为原料开发出的杜仲雄花茶、杜仲雄花酒、杜仲雄花功能饮料等产品具有良好的医疗保健功能(Dongetal., 2011b),备受市场青睐。
目前对杜仲雄花中活性成分含量的研究还不够系统和深入,仅涉及少数活性成分或少数材料,尤其是多样性的研究还没有开展。从杜仲育种、遗传改良及种质资源的利用来看,系统研究不同种质杜仲雄花主要活性成分含量多样性具有重要意义。本研究对193份杜仲种质雄花中桃叶珊瑚苷、京尼平苷酸、京尼平苷、绿原酸、异槲皮苷、紫云英苷、总黄酮和氨基酸8种主要活性成分含量进行测定,并进行变异分析、相关性分析、主成分分析和聚类分析,旨在揭示杜仲种质雄花主要活性成分含量的遗传变异规律,比较并评价杜仲雄花8种活性成分含量的多样性,以期为雄花用杜仲优良资源选育提供重要依据和材料,并为进一步开发利用我国丰富的杜仲雄花资源提供参考。
1 材料与方法
1.1 试验材料
供试材料193份,均采自中国林业科学研究院经济林研究开发中心原阳试验基地(113°36′ E,34°55′ N)杜仲基因库。基因库采用6株小区,定植行间距为3 m×3 m。每份试验材料选取6株树,每株树均于盛花期分别在树冠中部的东、西、南、北4个方向采摘雄花各约10簇,低温冷藏带回实验室,保存备用。
1.2 仪器与试剂
仪器: A300型自动氨基酸分析仪,德国曼默博尔公司; AG135型十万分之一电子天平,METILER TOLEDO; ND200-1氮吹仪,杭州瑞诚仪器有限公司; DHG-91013SA 型电热恒温鼓风干燥箱,上海三发科学仪器有限公司; Cary 300紫外-可见分光光度计,美国安捷伦; HT-300BQ 型数控超声波清洗器,济宁恒通超声电子设备有限公司; HH-8数显恒温水浴锅,郑州元强仪器设备有限公司; Shimadzu LC-20A型高效液相色谱仪,日本岛津; SPD-20A紫外检测器,日本岛津。
试剂: 芦丁、桃叶珊瑚苷、京尼平苷酸、京尼平苷、绿原酸、异槲皮苷、紫云英苷对照品购自上海源叶生物科技有限公司; 17种氨基酸标准品购自美国Sigma公司; 甲醇为色谱纯,其他试剂均为国产分析纯。
1.3 试验方法
1.3.1 总黄酮和氨基酸含量的测定 将采集的杜仲雄花样品在105 ℃下杀青3 min,然后60 ℃烘干,粉碎过60目筛。总黄酮含量测定参照AlCl3显色法(范杰平, 2006),以芦丁为标准品。氨基酸含量测定参照GB/T5009.124—2003《食品中氨基酸的测定》方法,并略有改动。称取0.100 g杜仲雄花样品,置于10 mL安瓿瓶中,精密加入6 mol·L-1盐酸溶液10 mL,抽真空后封口,于110 ℃烘箱内水解24 h,取出冷却后过滤,定容至50 mL,从中取0.5 mL滤液脱酸,加入2 mL样品稀释液,过0.45 μm微孔滤膜,用A300型氨基酸自动分析仪分析,进样量为20 μL。总黄酮和氨基酸含量的测定结果均为3次重复的平均值。
1.3.2 桃叶珊瑚苷、京尼平苷酸等6种活性成分含量的测定 采用HPLC法(郭洋静等, 2014),并进行改进。将采集的杜仲雄花样品在105 ℃下杀青3 min,然后60 ℃烘干,粉碎过60目筛。称取杜雄花粉末0.100 g,加入50%的甲醇溶液2.5 mL,称定质量,超声40 min,放至室温,称定质量,用50%的甲醇补足质量损失后摇匀,过0.22 μm微孔滤膜,即得供试品溶液。精密称取对照品桃叶珊瑚苷2.80 mg、京尼平苷酸1.40 mg、绿原酸2.80 mg、京尼平苷1.60 mg、异槲皮苷0.60 mg和紫云英苷0.60 mg,置同一5 mL的容量瓶中,甲醇定容至刻度,摇匀,即得混合对照品溶液。6种活性成分含量的测定结果均为3次重复的平均值。
色谱条件: Thermo hypersil gold色谱柱(250 mm × 4.6 mm, 5 μm),以甲醇(B)-0.5%磷酸水溶液(C)为流动相, 梯度洗脱(0~30 min,5%~15%B; 30~70 min,15%~30%B; 70~100 min,30%~54%B); 检测波长: 206 nm(0~15 min),236 nm(15~55 min),255 nm(55~100 min); 流速: 1.0 mL·min-1; 进样量: 8 μL; 柱温30 ℃。
分别精密吸取混合对照品溶液1.0,2.0,4.0,6.0,8.0,10.0 μL 进样,测定其峰面积。以进样量为横坐标,色谱峰面积为纵坐标,分别得到以下回归方程。桃叶珊瑚苷:Y=6.0×105X+11 980(R2=0.999 9),京尼平苷酸:Y=3.8×105X+11 553(R2=0.999 9),绿原酸:Y=1.0×106X+39 526(R2=0.999 9),京尼平苷:Y=5.3×105X+21 454(R2=0.999 9),异槲皮苷:Y=2.8×105X+10 358(R2=0.999 9),紫云英苷:Y=2.4×105X+8 860.3 (R2=0.999 9)。
1.4 数据统计与分析
利用Excel软件计算各活性成分含量的均值、标准差、变异系数和遗传多样性指数。遗传多样性指数用Shannon-wiener指数表示,即H′=-∑PilnPi(Shannonetal., 1949; 胡建斌等, 2013)。利用SPSS 20.0软件进行相关性分析、主成分分析和聚类分析。各成分含量间的相关性用Pearson相关系数表示,主成分分析采用方差最大化正交旋转方法,以累计贡献率大于85%为提取主成分标准,同时采用欧式平方距离,Ward法进行系统聚类(刁松锋等, 2014; 王飞权等, 2015)。
2 结果与分析
2.1 杜仲雄花主要活性成分含量变异及分布特征
193份杜仲种质雄花主要活性成分含量基本统计参数见表1。氨基酸含量最高,平均为206.23 mg·g-1,其次是总黄酮(21.99 mg·g-1),紫云英苷(0.23 mg·g-1)最低。8种活性成分遗传多样性指数(H′)均较大,由大到小依次为氨基酸(2.05)、异槲皮苷(2.04)、桃叶珊瑚苷(2.02)、总黄酮(2.00)、绿原酸(1.97)、京尼平苷酸(1.94)、紫云英苷(1.74)、京尼平苷(1.73)。
杜仲雄花主要活性成分含量在不同材料间变异程度不同,京尼平苷变异系数(112.00%)最大,其次是紫云英苷(89.56%),其他活性成分变异系数由大到小依次为京尼平苷酸(88.60%)、异槲皮苷(55.65%)、绿原酸(52.11%)、桃叶珊瑚苷(44.72%)、总黄酮(24.97%)、氨基酸(12.52%)。可见,杜仲雄花京尼平苷含量在不同材料间变异程度最大;氨基酸不但含量高,而且变化相对稳定。
进一步分析杜仲雄花主要活性成分含量在不同取值区域的分布情况, 结果见图1。桃叶珊瑚苷含量主要分布在2.00~17.00 mg·g-1,在5.00~14.00 mg·g-1尤为集中; 京尼平苷酸含量主要分布在9.00 mg·g-1以内,且呈左偏移增加趋势; 绿原酸含量主要分布在1.00~12.00 mg·g-1; 京尼平苷含量主要分布在3.00 mg·g-1以内,也呈现左偏移增加趋势; 异槲皮苷含量主要分布在0.05~2.05 mg·g-1; 紫云英苷含量几乎全部集中在0.75 mg·g-1以内; 大部分杜仲种质雄花总黄酮含量分布在12.50~30.00 mg·g-1;氨基酸含量基本分布在160.00~255.00 mg·g-1。
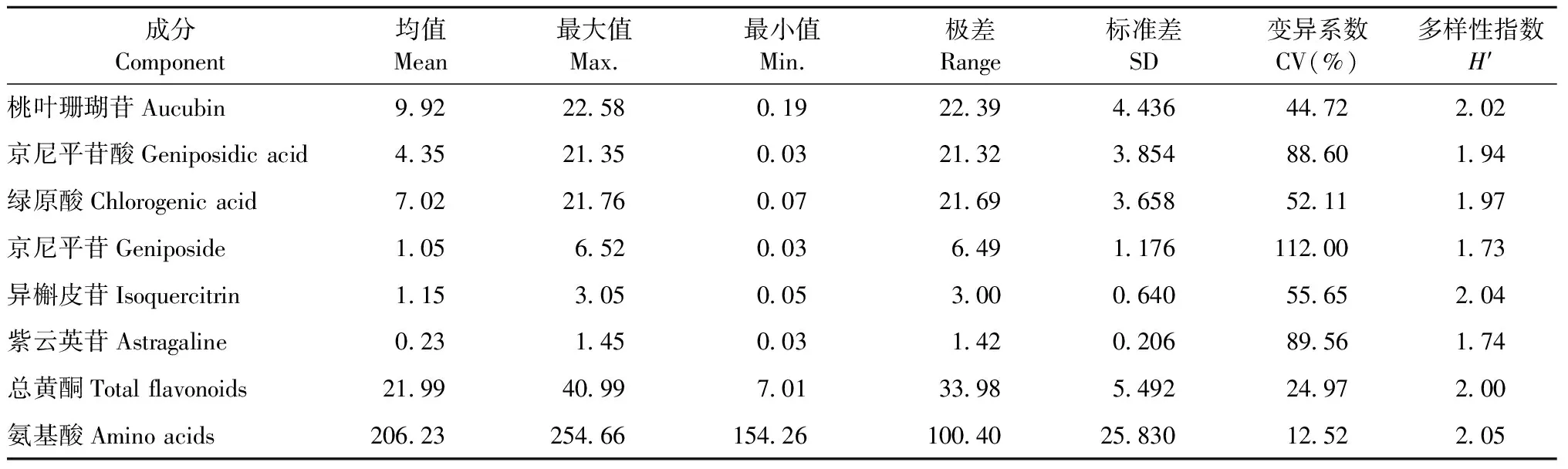
表1 杜仲雄花主要活性成分含量基本统计参数Tab.1 Basic statistic parameters of main active components content in E. ulmoides male flowers mg·g-1
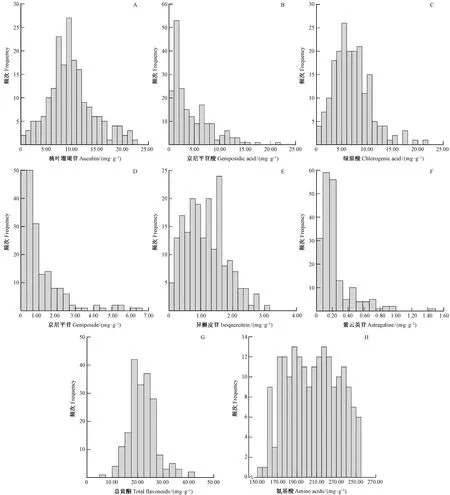
图1 杜仲雄花主要活性成分含量分布Fig.1 Distribution of main active components content in E. ulmoides male flowers
2.2 杜仲雄花主要活性成分含量的相关性分析
杜仲雄花主要活性成分含量相关性分析结果见表2。8种活性成分含量之间存在不同程度的相关性。其中,桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷及异槲皮苷5种活性成分间均呈极显著正相关。紫云英苷与京尼平苷间呈显著正相关,与异槲皮苷间呈极显著正相关。总黄酮与异槲皮苷、氨基酸间呈极显著正相关,相关系数分别为0.292和0.192,而与其他活性成分相关不显著,说明异槲皮苷对总黄酮的影响大于氨基酸。氨基酸除与总黄酮呈极显著正相关外,与其他活性成分相关性不显著。
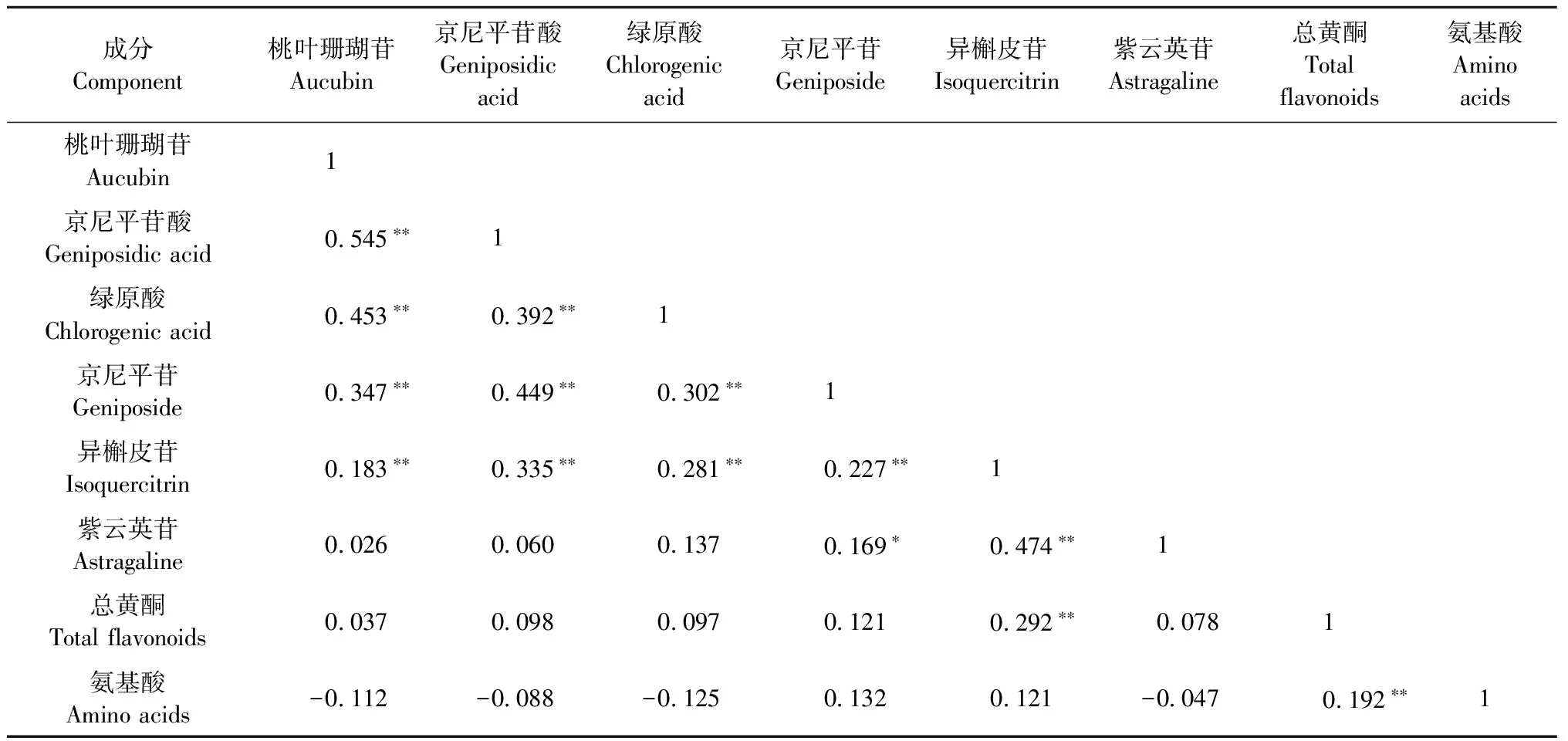
表2 杜仲雄花主要活性成分含量间相关性①Tab. 2 Correlation between main active components content in E. ulmoides male flowers
①** 和 *分别表示活性成分之间在0.01和0.05水平上相关。** and * mean correlation at 0.01 and 0.05 level between 8 active components.
2.3 杜仲雄花主要活性成分含量的主成分分析
对杜仲雄花8种主要活性成分含量进行主成分分析(表3),前4个主成分的累计贡献率达87.040%,基本包含所有性状的大部分信息。 第1主成分贡献率达到43.386%,桃叶珊瑚苷、京尼平苷酸、绿原酸和京尼平苷贡献较大,主要表征的是环烯醚萜类化合物组分和绿原酸的信息。第2主成分贡献率为19.005%,紫云英苷和异槲皮苷贡献较大,主要表征的是黄酮类化合物组分的信息。第3主成分贡献率为14.188%,氨基酸贡献最大,主要表征的是氨基酸的信息。第4主成分贡献率为10.461%,总黄酮贡献最大,主要表征的是总黄酮的信息。
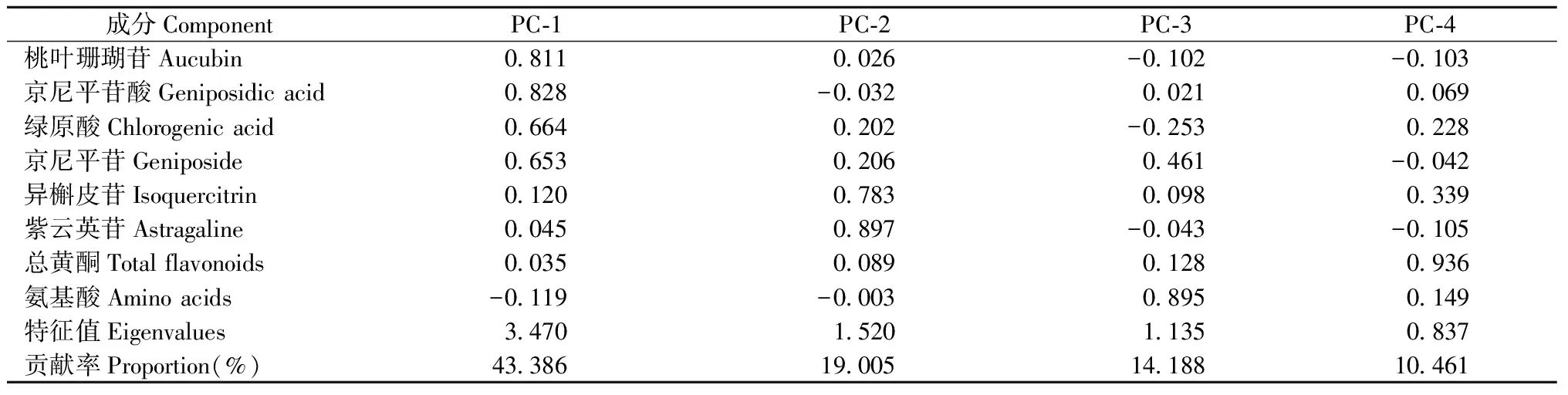
表3 杜仲雄花主要活性成分含量的主成分分析Tab. 3 Principal components analysis of main active components content in E. ulmoides male flowers
2.4 杜仲雄花主要活性成分含量的聚类分析
根据杜仲雄花8种主要活性成分含量,对193份杜仲种质进行聚类,在欧氏距离7.0处划分为5个类群(图2),各类群的主要活性成分含量见表4。5个类群8种活性成分含量均存在显著差异。其中,第Ⅰ类群包括60份材料,该类群种质桃叶珊瑚苷和氨基酸含量在5个类群中仅处于第4位,其他6种活性成分含量均为5个类群中最低。第Ⅱ类群包括57份材料,该类群种质氨基酸含量最高,平均达221.53 mg·g-1,显著高于第Ⅰ,Ⅲ,Ⅴ类群种质,总黄酮含量也较高,平均为24.01 mg·g-1,在5个类群中位居第2位。综合来看,该类群种质属于氨基酸和总黄酮含量都很高的种质。第Ⅲ类群包括18份材料,该类群种质总黄酮含量在5个类群中最高,平均为26.82 mg·g-1,显著高于其他4个类群种质,黄酮类化合物组分异槲皮苷含量(1.87 mg·g-1)和紫云英苷含量(0.69 mg·g-1)也显著高于其他4个类群种质。综合来看,该类群种质属于黄酮类化合物及其组分含量很高的种质。第Ⅳ类群包括19份材料,该类群种质环烯醚萜类化合物组分含量很高,桃叶珊瑚苷含量(16.18 mg·g-1)和京尼平苷含量(3.46 mg·g-1)显著高于其他4 个类群种质,京尼平苷酸含量也达到8.32 mg·g-1,在5个类群中位居第2位。绿原酸和氨基酸含量分别为9.06 mg·g-1和220.61 mg·g-1,均处于第2位。综合来看,该类群种质属于氨基酸和环烯醚萜类化合物组分都很高的种质。第Ⅴ类群包括39份材料,该类群种质绿原酸含量(9.22 mg·g-1)和京尼平苷酸含量(8.91 mg·g-1)最高。综合来看,该类群种质属于绿原酸和京尼平苷酸含量很高的种质。
3 讨论
本研究对193份不同种质杜仲雄花8种主要活性成分含量进行测定,发现杜仲雄花桃叶珊瑚苷、京尼平苷酸、绿原酸和京尼平苷平均含量均比郭洋静等(2014)测定结果要高,这可能与材料的数量及来源不同有关。此外,杜仲雄花中异槲皮苷含量与中药材罗布麻(Apocynumvenetum)叶的含量接近(相淞华等, 2010),总黄酮含量明显高于银杏(Ginkgobiloba)叶总黄酮含量(郁万文等, 2014)。氨基酸含量是油松(Pinustabulaeformis)、白皮松(Pinusbungeana)、黑松(Pinnsthunbergii)花粉氨基酸含量的2倍左右(支崇远等, 2004)。

图2 杜仲雄花主要活性成分聚类分析Fig.2 Cluster analysis of main active components in E. ulmoides male flowers
通过系统比较与评价,发现不同种质间杜仲雄花8种活性成分含量存在明显差异。由于试验材料全部来自同一地点,其栽培立地条件和管理条件基本一致,因此说明不同种质间杜仲雄花8种活性成分存在遗传变异。8种活性种成分含量的变异系数介于12.52%~112.00%; 除京尼平苷和紫云英苷外,其他活性成分含量的遗传多样性指数均大于1.90,表现出丰富的多样性。
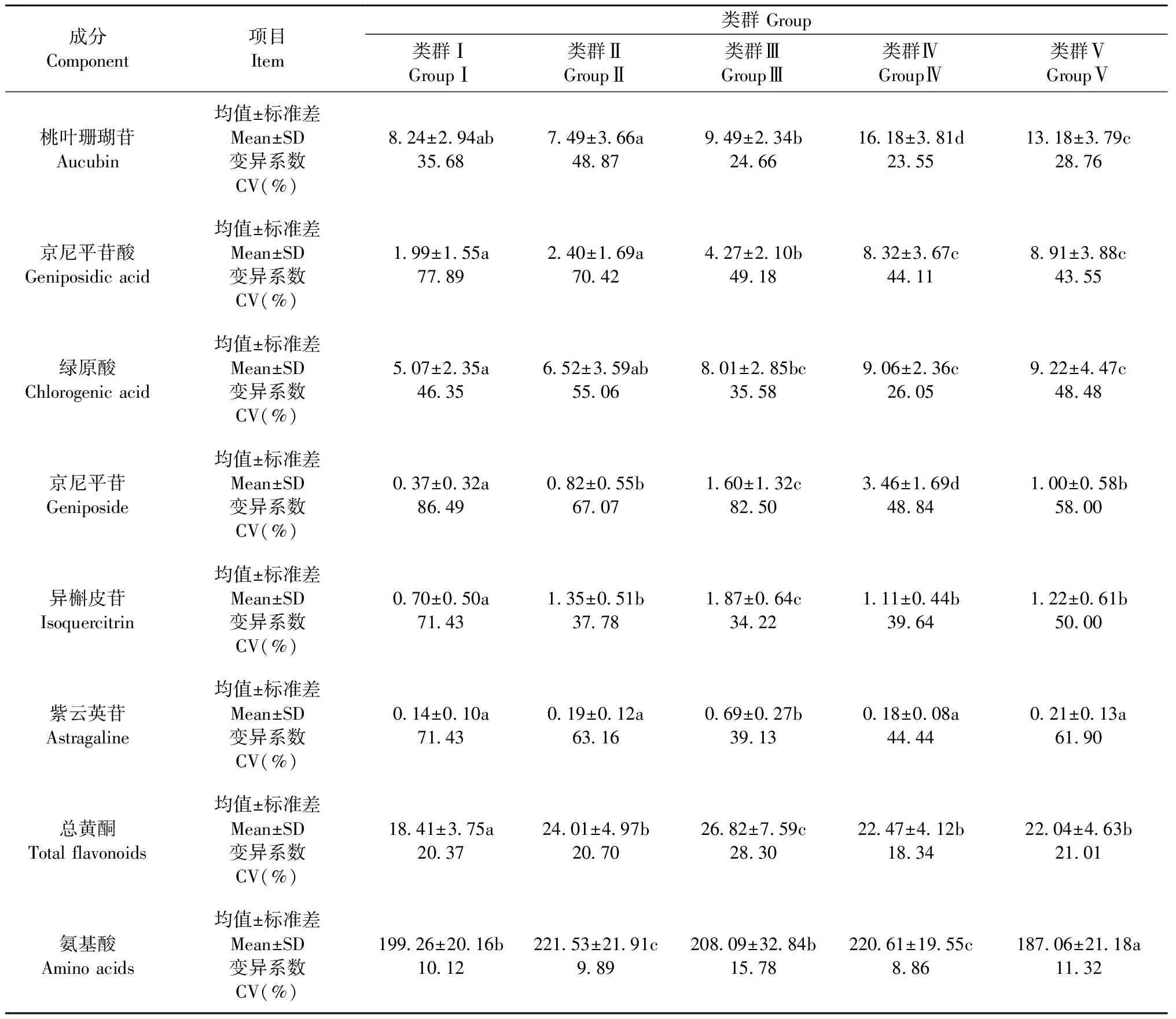
表4 不同类群主要活性成分含量比较①Tab.4 Comparison of main active components among five groups mg·g-1
① 同行不同字母表示该成分在0.05水平上差异显著(类群间比较)。The different letters in the same row mean sinificant difference at 0.05 level(comparison among groups).
杜仲雄花中8种活性成分含量之间存在不同程度的相关关系,其中,桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷及异槲皮苷5种活性成分间均呈极显著正相关,总黄酮与异槲皮苷、氨基酸间呈极显著正相关。根据性状间的相关关系,可以在选择某一性状时预测其对其他性状可能产生的影响,因此,在相关性极强的性状间进行选择时,一个性状得到改良,其他性状也会得到改良(康永祥等, 2011; 田治国等, 2012)。根据表2,桃叶珊瑚苷含量提高会促进京尼平苷酸、绿原酸、京尼平苷和异槲皮苷等活性成分含量提高。
根据8种活性成分含量的测定结果,对193份杜仲种质进行主成分分析,前4个主成分反映了杜仲雄花主要活性成分的大部分信息,累计贡献率达到87.040%,可以对杜仲雄花资源进行早期间接评价选择,为杜仲育种及雄花资源开发利用提供便利。聚类分析可以将性状相似的聚为一类,以便系统地分析各种质特点,对植物育种和资源利用也有较好的指导作用。本试验对杜仲雄花8种主要活性成分含量进行聚类,在欧氏距离7.0处将193份杜仲材料聚为5类。5个类群杜仲种质雄花8种活性成分含量均存在显著差异,这些差异是良种选育的基础。
4 结论
杜仲种质资源雄花8种主要活性成分含量较高,有很大的开发利用价值,且表现出丰富的变异和多样性,有较大的选择潜力和改良潜力。杜仲雄花8种活性成分含量之间存在不同程度的相关性。通过聚类,初步明确杜仲种质雄花的不同类型。根据不同的开发利用目标选择优良资源,可在较大程度上提高雄花用杜仲良种选育效率,对于雄花用杜仲资源开发利用也有很大的实际应用价值。
白喜婷,朱文学,罗 磊,等.2008.杜仲雄花及花茶中总黄酮含量的测定.食品科技, (4): 186-188.
(Bai X T, Zhu W X, Luo L,etal. 2008. Determination of total flavone contents in male flowers and flower tea ofEucommiaulmoidesOliver. Food Science & Technology, (4): 186-188.[in Chinese])
刁松锋,邵文豪,姜景民,等.2014.基于种实性状的无患子天然群体表型多样性研究.生态学报,34(6): 1451-1460.
(Diao S F, Shao W H, Jiang J M,etal. 2014. Phenotypic diversity in natural populations ofSapindusmukorossibased on fruit and seed triats. Acta Ecologica Sinica, 34(6): 1451-1460.[in Chinese])
杜红岩,李芳东,杜兰英,等.2006.不同产地杜仲果实形态特征及含胶量的差异性研究.林业科学,42(3): 35-39.
(Du H Y, Li F D, Du L Y,etal. 2006. Difference of samara’s form characters and gutta-percha content from different producing areas associated withEucommiaulmoides. Scientia Silvae Sinicae, 42(3): 35-39.[in Chinese])
杜红岩. 2014.中国杜仲图志.北京: 中国林业出版社, 76-79.
(Du H Y. 2014. ChinaEucommiapictorial. Beijing: China Forestry Publishing House,76-79.[in Chinese])
杜红岩,李 钦,赫锦锦,等.2011.不同变异类型杜仲皮中几种主要活性成分含量的比较.林业科学研究, 24(2): 230-233.
(Du H Y, Li Q, He J J,etal. 2011. Comparison of the main active components contents in barks of different variance-types ofEucommiaulmoides. Forest Research, 24(2): 230-233.[in Chinese])
杜红岩,胡文臻,俞 锐,等.2013.杜仲产业绿皮书.北京: 社会科学文献出版社,188-195.
(Du H Y, Hu W Z, Yu R,etal. 2013. Green book ofEucommiaindustry. Beijing: Social Sciences Academic Press, 188-195.[in Chinese])
范杰平.2006.柿叶中有效成分的提取与分离研究.杭州: 浙江大学博士学位论文.
(Fan J P. 2006. Study on the extraction and separation of the active components in the leaves ofDiospyroskaki. Hangzhou: PhD thesis of Zhejiang University.[in Chinese])
郭洋静,丁艳霞,许兰波,等.2014.HPLC法同时测定杜仲雄花中5种活性成分.中成药, 36(10): 2131-2134.
(Guo Y J, Ding Y X, Xu L B,etal. 2014. Simultaneous determination of five compounds in male flowers ofEucommiaululmoidesOliv by Hplc. Chinese Traditional Patent Medicine, 36(10): 2131-2134.[in Chinese])
赫锦锦.2010.杜仲皮及雄花中次生代谢产物的变化规律研究.开封: 河南大学硕士学位论文.
(He J J. 2010. Studies on variation of secondary metabolites inEucommiabark andEucommiamale flower. Kaifeng: MS thesis of Henan University.[in Chinese])
胡建斌,马双武,李建吾,等.2013.国外甜瓜种质资源形态性状遗传多样性分析.植物学报,48(1): 42-51.
(Hu J B, Ma S W, Li J W,etal. 2013. Genetic diversity of foreign melon (Cucumismelo)germplasm resources by morphological characters. Chinese Bulletin of Botany, 48(1): 42-51.[in Chinese])
康永祥,赵宝鑫,贠玉洁,等.2011.毛梾天然群体种实表型多样性研究.西北农林科技大学学学报: 自然科学版, 39(3): 107-117.
(Kang Y X, Zhao B X, Yun Y J,etal. 2011. Study on phenotypic diversity of seeds and fruits’ characteristics inCornuswalteri. Journal of Northwest A & F University: Nat Sci Ed, 39(3): 107-117.[in Chinese])
刘 严.2012.杜仲雄花功能成分的提取、分离及活性研究.洛阳: 河南科技大学硕士学位论文.
(Liu Y. 2012. Study on extraction, separation and activity of functional compounds fromEucommiaulmoidesmale flowers. Luoyang: MS thesis of Henan University of Science and Technology.[in Chinese])
田治国,王 飞,王 朴,等.2012.新疆树上干杏形态学形状的多样性研究.西北农林科技大学学报: 自然科学版, 40(3): 147-153.
(Tian Z G, Wang F, Wang P,etal. 2012. Morphological diversity of ‘shushanggan’ apricot in Xinjiang. Journal of Northwest A & F University: Nat Sci Ed, 40(3): 147-153.[in Chinese])
王飞权,冯 花,王 芳,等.2015.42份武夷名丛茶树资源生化成分多样性分析.植物遗传资源学报,16(3): 670-676.
(Wang F Q, Feng H, Wang F,etal. 2015. Diversity analysis of biochemical components of 42 Wuyi Mingcong tea germplasms. Journal of Plant Genetic Resources, 16(3): 670-676. [in Chinese])
相淞华,宋建平,刘训红,等.2010.罗布麻叶黄酮类成分分析及其动态研究.中华中医药学刊,28(10): 2115-2117.
(Xiang S H, Song J P, Liu X H,etal. 2010. Study on the dynamic change of flavonoids content in foliumApocyniveneti. Chinese Archives of Traditional Chinese Medicine, 28(10): 2115-2117. [in Chinese])
吴 敏,赵 阳,马志刚,等.2014.果园化栽培模式杜仲雄花、果实和叶片产量的调查分析.林业科学研究, 27(2): 270-276.
(Wu M, Zhao Y, Ma Z G,etal. 2014. Investigation of male flower, fruit and leaf yield from anEucommiaulmoidesorchard system. Forest Research, 27(2): 270-276.[in Chinese])
叶东旭,杜红岩,李 钦,等.2012.杜仲雄花HPLC指纹图谱及成分积累规律的研究.中成药, 34(4): 706-709.
(Ye D X, Du H Y, Li Q,etal. 2012. HPLC fingerprint and accumulation rule of principal component inEucommiaulmoidesmale flower. Chinese Traditional Patent Medicine, 34(4): 706-709.[in Chinese])
郁万文,刘新亮,曹福亮,等.2014.不同银杏叶药用成分差异及聚类分析.植物学报,49(30): 292-305.
(Yu W W, Liu X L, Cao F L,etal. 2014. Cluster analysis on the main medicinal components in different leaves of Ginkgo clones. Chinese Bulletin of Botany, 49(30): 292-305.[in Chinese])
张 欣,张春风,祁东利,等.2012.HPLC同时测定杜仲叶中7种成分的含量.中国药科大学学报,43(5): 435-437.
(Zhang X, Zhang C F, Qi D L,etal. 2012. Simultaneous determination of seven compounds inEucommiafolium by HPLC. Journal of China Pharmaceutical University, 43(5): 435-437.[in Chinese])
支崇远,王开发.2004.四种松花粉营养成分比较研究.中国自然医学杂志,6(2): 81-85.
(Zhi C Y, Wang K F. 2004. Study on the nutrient components of four kinds of pollen in China. China J Nat Med, 6(2): 81-85.[in Chinese])
Dong J E, Ma X H, Qin W,etal. 2011a. Effects of growing location on the contents of secondary metabolites in the leaves of four selected superior clones ofEucommiaulmoides. Industrial Crops and Products, 34(3): 1607-1614.
Dong J E, Ma X H, Fu Z R,etal. 2011b. Effects of microwave drying on the contents of functional constituents ofEucommiaulmoidesflower tea. Industrial Crops and Products, 34(1): 1102-1110.
Shannon C E, Weaver W. 1949. The mathematical theory of communication. Urbana: University of Illinois Press, 3-14.
Takamura C, Hirata T, Yamaguchi Y,etal. 2007. Studies on the chemical constituents of green leave ofEucommiaulmoidesOliv. Journal of Natural Medicines, 61(2): 220-222.
(责任编辑 王艳娜 郭广荣)
Diversity of the Content of Main Active Components inEucommiaulmoidesMale Flowers
Du Qingxin Wei Yanxiu Liu Panfeng Du Hongyan
(Non-TimberForestResearchandDevelopmentCenterofChineseAcademyofForestryTheEucommiaEngineeringResearchCenterofStateForestryAdministrationZhengzhou450003)
【Objective】 This study aimed to disclose the genetic variation, compare and evaluate the diversity in contents of 8 main active components inEucommiaulmoidesmale flowers, to provide a scientific basis and materials for resources selection and utilization of the male flower. 【Method】 A total of 193E.ulmoidesgermplasms were selected as samples, the content of total flavonoids and amino acids were determined by the AlCl3colorimetric method and an automatic amino acids analyzer, respectively. Aucubin, geniposidic acid, chlorogenic acid, geniposide, isoquercitrin and astragaline were determined by HPLC method. Furthermore, variation analysis, multiple comparison, correlation analysis, principal component analysis and cluster analysis were carried out based on 8 active components contents. 【Result】 In differentE.ulmoidesgermplasms, the content and diversity index of amino acids were highest among the 8 components, with an average of 206.23 mg·g-1and 2.05, respectively. The variation coefficient of geniposide content was highest (112.00%) and of amino acids content was lowest (12.52%). Correlation analysis showed that aucubin, geniposidic acid, chlorogenic acid, geniposide and isoquercitrin were extremely significantly and positively correlated with each other. The correlation between amino acids and total flavonoids was extremely significant and positive, while amino acids were not significantly correlated with the other 6 components. Principal component analysis revealed that the first four principal components represented 87.040% of 8 active components, and they were suitable for assessing theE.ulmoidesmale flower resources. Based on data of 8 active components, 193E.ulmoidesgermplasms were clustered into 5 groups and the contents of 8 active components were significantly different among the 5 groups. The contents of 8 active components were comparatively lower in the first group, the amino acids content in the second group was higher than the other 4 groups, the content of total flavonoids and flavonoids components were highest in the third group, the content of iridoid components were highest in the fourth group, and chlorogenic acid and geniposidic acid content in the fifth group were higher than the other 4 groups. Different types ofE.ulmoidesmale flowers were preliminarily defined. 【Conclusion】 The contents of 8 main active components inE.ulmoidesmale flowers were high with great value of utilization, and high diversity and variation were found in different germplasms, which showed great potential for selection and imporvement. Thus, it could provide basal materials for the male flower breeding and the resources development and utilization.
Eucommiaulmoides; male flowers; germplasms; active components; diversity
10.11707/j.1001-7488.20170205
2016-01-05;
2016-02-29。
国家“十二五”农村领域科技计划课题研究任务合约(2012BAD21B0502)。
S789
A
1001-7488(2017)02-0035-09
*杜红岩为通讯作者。
