杨树不同种质花粉萌发和致敏蛋白的差异*
2017-03-27章小铃王留强吴立栓卢孟柱胡建军
章小铃 王留强 孙 佩 吴立栓 樊 玮 张 进 卢孟柱 胡建军
(1. 林木遗传育种国家重点实验室 国家林业局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091; 2. 中国科学院植物研究所光生物学重点实验室 北京 100093)
杨树不同种质花粉萌发和致敏蛋白的差异*
章小铃1王留强1孙 佩1吴立栓2樊 玮1张 进1卢孟柱1胡建军1
(1. 林木遗传育种国家重点实验室 国家林业局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091; 2. 中国科学院植物研究所光生物学重点实验室 北京 100093)
【目的】 研究6份杨树种质(36号杨、南杨、110杨、森海2号杨、小叶杨和钻天杨)成熟花粉的萌发特性以及致敏蛋白差异,为低致敏杨树品种选育及植物过敏性疾病控制等研究提供理论依据。【方法】 2015 年3月,在北京、河北和河南采集6份不同杨树种质的花枝,经水培后收集花粉,采用液体培养法进行杨树花粉萌发试验,并通过双向电泳、实时荧光定量PCR等研究不同杨树种质的花粉致敏蛋白差异。【结果】 1) 在6份杨树种质花粉中,36号杨、南杨和钻天杨花粉活力较高,其次为110杨和小叶杨,森海2号杨活力最差; 24 h时花粉萌发率最大的种质是36号杨,高达74.42%(±2.36%),而三倍体森海2号杨花粉萌发率为0; 钻天杨花粉管平均长度为456.00 μm(±2.05 μm),小叶杨花粉管最短,为276.44 μm(±11.08 μm),且不同种质的花粉萌发率和花粉管萌发长度差异极显著(P<0.01),表明不同种质的花粉活力存在很大差异。2) 利用Imagemaster 2D platinum 6.0软件分析南杨、110杨、森海2号杨、小叶杨和钻天杨的2-DE图谱,共发现有408个蛋白点相匹配,以36号杨鉴定的28个潜在致敏蛋白为参照,在5份种质花粉中有6个致敏蛋白均缺失表达,南杨和森海2号杨花粉有21个致敏蛋白,110杨次之,有19个,而小叶杨和钻天杨的致敏蛋白数量最少,为18个。对其余22个致敏蛋白进行差异表达量分析发现,其中有12个致敏蛋白在5份杨树种质中均低于36号杨,其相对表达量范围为-3.99~-0.02,尤其是森海2号杨和小叶杨分别有10个和8个致敏蛋白表达量显著(P<0.05)或极显著(P<0.01)低于36号杨; 南杨和钻天杨降低趋势最小。有3个致敏蛋白在5份种质中表达均高于36号杨,其中南杨最高,达到极显著水平(P<0.01),其次为钻天杨、森海2号杨和110杨、小叶杨。组间差异方差分析发现南杨和钻天杨的17个致敏蛋白表达量显著或极显著大于小叶杨和森海2号杨。3) qRT-PCR分析结果表明,9个致敏蛋白编码基因中有5个在南杨和钻天杨中表达量都较高,包括spots 12、51、200、216和161,其次是小叶杨,而森海2号杨和110杨均只有2个致敏基因表达高。【结论】 杨树不同种质间花粉活力、致敏蛋白数量以及表达量存在明显差异,可为今后杨树低致敏新品种选育提供重要的参考,但是成熟花粉致敏蛋白表达量的高低与其致敏性强弱的相关性还有待进一步深入研究。
杨树; 成熟花粉; 致敏蛋白; 双向电泳; 实时荧光定量PCR
近年来,过敏性疾病已经成为许多国家和地区季节性的流行病(吕相征等, 2005),受到社会各界的广泛关注,被世界卫生组织列为21世纪重点防治的三大疾病之一。在众多的过敏原之中,花粉是自然界中最常见的吸入型过敏原,容易造成过敏患者出现支气管哮喘、季节性鼻炎、枯草热及皮炎等症状(陈绍宁等, 2008)。新的统计结果表明,几乎所有工业化国家的花粉过敏病人口都在剧增,例如美国、日本、意大利、西班牙、奥地利等国家花粉过敏症的人数占总人口的15%左右,而挪威、瑞典、比利时、英国和法国花粉过敏患者高达30%左右。在我国,花粉过敏的发病率为0.5%~1%,高发病区达5%,虽然没有上述一些国家那么严重,但近年来发病率也呈现逐年增高趋势(杨琼梁等, 2015)。
木本植物花粉过敏现象在许多国家都有报道,花粉飘散具有明显的季节性和地域性,不同国家和地区在不同季节有不同的致敏花粉。Lin等(2002)调查了引起花粉过敏症主要的过敏原,结果发现引起过敏(患病率)的花粉树种主要是美国白栎(Quercusalba)(34.3%)、垂枝桦(Betulapendula)(32.9%)和梣叶槭(Acernegundo)(32.9%),其次为山毛榉(Fagusgrandifolia)(29.6%)、美国白梣(Fraxinusamericana)(26.0%)、美国榆(Ulmusamericana)(24.6%)和美洲黑杨(Populusdeltoides)(20.6%)。根据土耳其锡夫里希萨尔气传致敏花粉浓度的调查结果显示,松科(Pinaceae)、柏科(Cupressaceae)、白蜡树属(Fraxinus)、杨属(Populus)是主要的气传致敏花粉(Erkara, 2008)。Mardones 等(2013)研究了塔卡尔2007年5月—2008年4月期间大气花粉粒数,发现空气中花粉数量最多的树种是二球悬铃木(Platanusacerifolia),其花粉浓度达到每周平均每日高达203粒·m-3; 其次是埃及榕(Acerpseudoplatanus)(116粒·m-3),杨属(103粒·m-3)和木犀榄(Oleaeuropaea)(19粒·m-3)相对较少。在我国,由于南北地理、海拔、气温等差异大,花粉致敏种类不尽相同。我国南方花粉致敏树种主要有悬铃木属(Platanus)、松属(Pinus)、构属(Broussonetia)等,而北方主要以悬铃木属、杨属、柳属(Salix)、桦木属(Betula)为代表(辛嘉楠等, 2007; 杨琼梁等, 2015)。花粉能引起人过敏是因为花粉中含有能剌激机体发生过敏反应的物质,其主要成分是蛋白质。迄今为止,关于木本植物花粉过敏原的研究报道主要有悬铃木属(Pla a 1和Pla a 2)(Asturiasetal., 2002; Ibarrolaetal., 2004)、桦木属(Bet v 1,Bet v 2和Bet v 4等)(Ebneretal., 1995; Twardoszetal., 1997)、榆属(Ulmus)(Car b 1)(Hiraharaetal., 2001)、日本柳杉(Cryptomeriajaponica)(Cry j 1,Cry j 2和Jun a 1)(Larsenetal., 1992; Midoroetal., 1999)等。
我国是世界上杨树人工林面积最大的国家,面积已超666.7万hm2(贾黎明等, 2013)。杨树不仅是速生丰产林、防护林的主要造林树种,也是我国城市绿化常用的树种,杨树的花期3—4月,雄株产生大量的花粉,具有过敏的潜能。为了解杨树花粉致敏原,本实验室建立了杨树花粉蛋白提取和分离技术体系,并对美洲黑杨36号杨(P.deltoides‘2KEN8’)花粉进行了蛋白分离和致敏蛋白预测(Zhangetal., 2015),为研究其他杨树种质花粉致敏性奠定了基础。杨树种类繁多,不同种质间的花粉致敏性可能存在差异。为了探索不同杨树种质间花粉致敏蛋白的表达特性差异,本文选用目前生产上常见的6份杨树种质为研究材料,开展了杨树不同种质花粉萌发率、花粉管长度等基本特性研究; 并利用差异蛋白质组技术,以36号杨成熟花粉预测的28个致敏蛋白为基础,对其他5份杨树种质间花粉致敏蛋白的表达水平进行了比较,为探索杨树不同种质的花粉致敏性差异、选育低致敏杨树品种以及控制植物过敏性疾病等研究提供理论依据。
1 材料与方法
1.1 花粉收集与保存
6份杨树种质[36号杨(Populusdeltoides‘2KEN8’)、南杨(P.deltoides‘Nanyang’)、110杨(P.deltoides×P.maximowiczii‘Eridano’)、森海2号杨(P.deltoides×P.cathayana‘Senhai 2’)、小叶杨(P.simonii)和钻天杨(P.nigravar.italica)]花枝于2015年3月采自北京、河北和河南(表1)。将花枝适当修剪,在室内进行隔离水培,室温(20±2) ℃。待雄花成熟散粉时,用培养皿收集花粉,室温晾干后,装于50 mL离心管中,在-20 ℃冰箱中保存。
1.2 花粉离体培养
采用液体培养法进行杨树花粉萌发试验(胡超, 2011),稍有改动。将花粉从-20 ℃冰箱中取出,每份杨树种质称取0.01 mg花粉,在4 ℃条件下充分吸水4 h。将花粉均匀撒入液体培养基(15%蔗糖 + 100 mg·L-1硼酸 + 300 mg·L-1CaCl2+ 200 mg·L-1MgSO4+ 100 mg·L-1KNO3,pH6.0)上,21 ℃暗培养2,4,8,12,24 h后,在光学显微镜下观察花粉萌发情况,统计花粉萌发数并测量花粉管长度。每个处理随机观察5个视野,每个视野花粉粒不少于30个,以花粉管长度大于花粉粒直径视为萌发。萌发率=已萌发花粉数/花粉总数 × 100%。每个样品在不同培养时间随机选取50个已萌发的花粉,采用显微测微尺测量花粉管长度。每份种质设置3次生物学重复。
1.3 成熟花粉可溶性总蛋白的提取
采用三氯乙酸丙酮(TCA-丙酮)沉淀法提取5份杨树种质成熟花粉可溶性总蛋白质(Zhangetal., 2015)。具体操作: 将花粉从-20 ℃冰箱中取出,称取1 mg花粉,置于4 ℃条件下充分吸水4 h。加液氮充分研磨至粉末,置于100 mL预冷的TCA-丙酮溶液(10%TCA,0.07%β-巯基乙醇)中,震荡混匀后在-20 ℃条件下静置过夜,再14 000 r·min-1离心30 min,弃上清; 用冷丙酮(含0.07%β-巯基乙醇)冲洗沉淀1 h后,14 000 r·min-1离心30 min,重复上述步骤3~4次,直至沉淀物为白色; 真空冻干成干粉,-80 ℃保存备用。
1.4 成熟花粉可溶性总蛋白的双向电泳
按照1 mg·mL-1的比例用蛋白质裂解缓冲液[7 mol·L-1尿素,65 mmol·L-1DTT,4%(W/V)CHAPS,0.01%PMSF,0.2%载体两性电解质]溶解冻存的蛋白样品,并用Bradford法测定蛋白浓度。取600 μg样品与水化液(7 mol·L-1尿素,2 mol·L-1硫脲,4%CHAPS,65 mmol·L-1DTT,0.002 kg·L-1Bio-Lyte)充分混合后作为上样样品,总体积为350 μL。首先,使用非线性IPG固相胶条进行第1向等电聚胶电泳。电泳结束后,立即将IPG胶条依次于10 mL平衡液Ⅰ[6 mol·L-1尿素,0.02 kg·L-1SDS,0.375 mol·L-1Tris-HCl(pH8.8),30%甘油,0.02 kg·L-1DTT]和平衡液Ⅱ[6 mol·L-1尿素,0.021 kg·L-1SDS,0.375 mol·L-1Tris-HCl(pH8.8), 20%甘油,0.04 kg·L-1碘乙酰胺]中各平衡15 min。然后进行第2向电泳,待溴酚蓝线至凝胶底部边缘时停止电泳,将SDS-PAGE胶在固定液中(10%乙酸,40%甲醇,50%ddH2O)震荡过夜,再转移至考马斯亮蓝G-250染色液(0.1%G-250,25%异丙醇,10%冰醋酸)中震荡染色13 h。 最后用ddH2O脱色至背景近无色。每个品种的双向电泳试验平行重复3次,以确保试验结果的可靠性。

表1 试验材料基本情况Tab. 1 The background of experimental materials
1.5 实时荧光定量PCR(qRT-PCR)
杨树花粉总RNA提取方法参照植物总RNA提取试剂盒(RNeasy Plant Kit)使用说明书,将提取的RNA纯化后进行反转录成cDNA(TaKaRa,China),以cDNA为模板进行qRT-PCR。利用在线设计软件Primer3 Input 0.4.0设计实时定量PCR引物,其引物序列见表2。参照SYBR® Premix Ex TaqTMKit(TaKaRa,China)配制PCR 反应体系,反应在Roche480(Roche,USA)上进行,程序为: 95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 30 s,40个循环; 60 ℃ 1 min; 50 ℃ 30 s。以PtActin作为内参对照,以36号杨的致敏相关基因作为对照组,qRT-PCR数据分析参照采用2-ΔΔCt方法(Pfaffl, 2001)。为了确保试验结果的真实性和可靠性,每个试验均设3次生物学重复和4次技术重复。

表2 用于qRT-PCR分析致敏蛋白基因的引物Tab. 2 Primers used in RT-PCR analysis of the allergenic proteins
1.6 分析方法
试验数据采用SPSS 13.0和Originlab 9.0软件进行方差分析、显著性分析和图表分析等。
2 结果与分析
2.1 花粉萌发率及花粉管长度差异分析
通过光学显微镜分别观察6份杨树种质成熟花粉在暗培养2,4,8,12和24 h后的萌发动态,统计萌发花粉的数量,并测量花粉管长度。当培养到2 h时,花粉粒已经吸水膨大,部分花粉粒的花粉管已经伸出,随着培养时间的延长,花粉萌发率和花粉管长度逐渐提高(图1A)。萌发试验结果显示,除森海2号杨花粉一直没有萌发外,其他5份杨树种质的花粉萌发率均随着培养时间的延长逐渐提高。36号杨和南杨花粉萌发较快,在培养2 h时,萌发率分别为29.12%(±0.16%)和21.44%(±0.25%); 在培养4 h时,钻天杨花粉萌发率迅速增加,达到36.67%(±0.02%); 在培养8 h时,110杨花粉仍未萌发; 在培养12 h时,小叶杨和110杨花粉萌发率迅速增加到41.74%(±1.51%)和38.83%(±0.16%); 在培养24 h时,36号杨花粉萌发率最大,高达74.42%(±2.36%),其他依次是南杨67.23%(±2.10%)、钻天杨62.54%(±0.01%)、小叶杨56%(±0.04%)和110杨42.23%(±1.95%)。差异分析结果显示,不同杨树种质的花粉萌发率差异达到了极显著水平(P<0.01)(图1B)。由图1C可看出,杨树花粉管平均长度随着培养时间的延长呈现逐渐增加趋势。培养24 h时,钻天杨花粉管平均长度为456.00 μm(±2.05 μm),其他依次为南杨410.10 μm(±11.31 μm),110杨390.06 μm(±12.59 μm),36号杨310.16 μm(±11.13 μm)和小叶杨276.44 μm(±11.08 μm),而且不同杨树种质的花粉管萌发长度差异也达到了极显著水平(P<0.01)。以上结果表明,36号杨、南杨和钻天杨花粉活力较高,其次为110杨和小叶杨,森海2号杨活力最差,且不同杨树种质的成熟花粉活力存在明显差异。
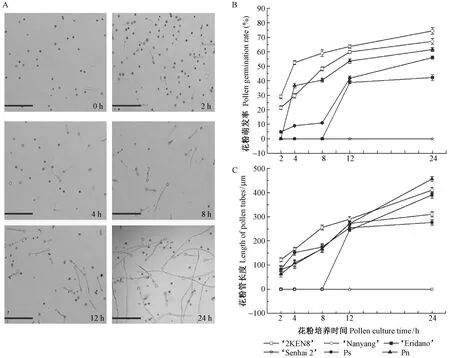
图1 不同培养时间下6份杨树种质花粉萌发动态、萌发率和花粉管长度比较(标尺:200 μm)Fig.1 Change of the pollen germination, tube length with time for culturing in six poplar germplasms(Bar:200 μm)A. 花粉萌发0,2,4,8,12,24 h的萌发状态; B. 6份杨树种质的花粉萌发率; C. 6份杨树种质的花粉管长度随培养时间的变化。A. Pollen germinating state at 0, 2, 4, 8, 12 and 24 h respectively; B. Pollen germination rate of six poplar germplasms; C. Change of pollen tube length with culturing time of poplar germplasms.
2.2 杨树成熟花粉蛋白的双向电泳图谱分析
南杨、110杨、森海2号杨、小叶杨和钻天杨成熟花粉蛋白的2-DE电泳图谱(图2)十分相似,表明该5份杨树种质之间可以进行差异蛋白表达量的分析。利用Imagemaster 2D Platinum 6.0软件对5份杨树种质花粉的2-DE图谱进行比较分析,在南杨、110杨、森海2号杨、小叶杨和钻天杨的2-DE图谱上分别检测到449,442,428,419和422个蛋白质点,5份杨树种质间共有408个蛋白点相匹配,这些蛋白质的分子质量范围为5~63 kDa,等电点为4~7。但是,5份杨树种质成熟花粉却未发现特异蛋白。

图2 5份杨树种质成熟花粉2-DE图谱Fig.2 2-DE profile of mature pollen of five poplar germplasms
2.3 致敏蛋白在不同杨树种质的表达差异分析
以36号杨已鉴定的28个潜在致敏蛋白(Zhangetal., 2015)为参照,对其他5份杨树种质成熟花粉的致敏蛋白相对表达量进行分析。从表3中可看出,南杨有22个致敏蛋白,森海2号杨有21个致敏蛋白,110杨有20个致敏蛋白,小叶杨有19个致敏蛋白,钻天杨的致敏蛋白数量最少,为18个。与36号杨中的28个潜在致敏蛋白相比,有6个致敏蛋白点(spot 22,66,84,142,144,184)在该5份种质成熟花粉中均不存在,其他22个致敏蛋白点在电泳图谱中的放大图如图3所示。随后,对该22个致敏蛋白进行差异表达量分析,其中有12个致敏蛋白(spot 3,5,78,95,117,135,156,164,181, 197, 200, 203)在5份杨树种质中表达量较低,其相对表达量范围为-3.99~-0.02,其中森海2号杨和小叶杨表达量最低,其平均相对表达量分别为-1.83和-1.98。差异分析显示,森海2号杨和小叶杨分别有10个和8个致敏蛋白显著(P<0.05)或极显著(P<0.01)低于36号杨。南杨和钻天杨表达量稍低,分别为-0.83和-0.54。有3个致敏蛋白(spot 133, 208,216)在5份种质间表达量均较高。其中南杨最高,其平均相对表达量为2.88,均极显著大于36号杨(P<0.01); 其次为钻天杨(2.60)、森海2号杨(1.19)、110杨(0.83)和小叶杨(0.81)。组间差异方差分析发现,南杨和钻天杨的17个致敏蛋白表达量均显著(P<0.05)或极显著(P<0.01)高于小叶杨和森海2号杨,例如肌球蛋白抑制蛋白4(spot 216)在南杨的表达量高达小叶杨的8倍之多。
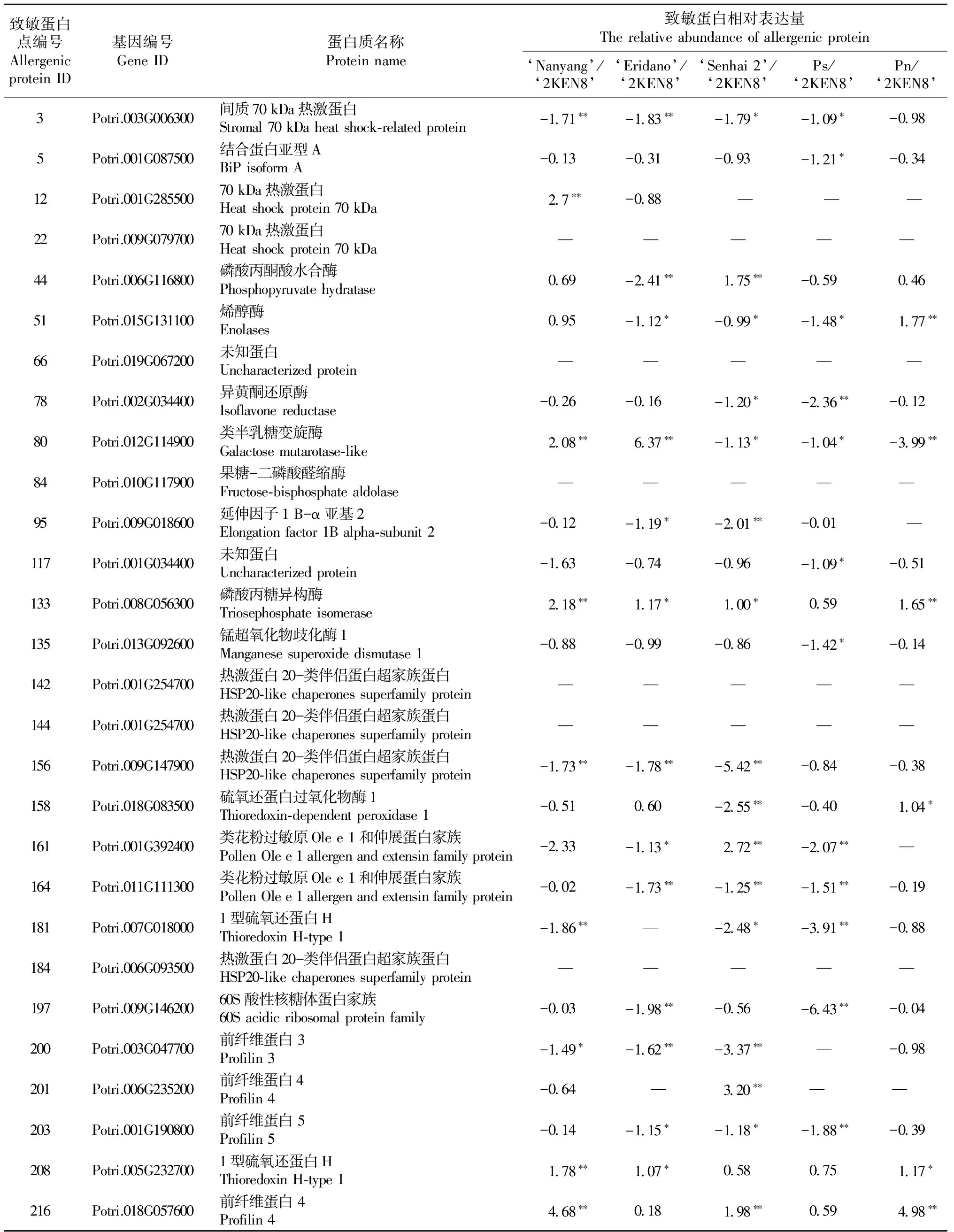
表3 致敏蛋白在不同杨树种质间的表达量差异分析①Tab. 3 The different expression of allergic protein among different poplar germplasms
① “—”代表该种质花粉没有这个致敏蛋白点; “*”,“**”分别代表对照组与试验组之间差异显著(P<0.05)和极显著(P<0.01)。“—”represents the germplasm without this allergenic protein; “*”, “**” represent significant (P<0.05) and highly significant (P<0.01)difference between control and treatment, respectively.

图3 5份杨树种质的致敏蛋白点的放大Fig.2 Enlargement view of allergenic proteins in five poplar germplasms
2.4 致敏蛋白编码基因在杨树花粉中的转录水平
为进一步了解致敏蛋白编码基因在6份杨树种质间的转录水平,随机选取9个致敏蛋白基因,通过qRT-PCR对这9个基因的转录水平进行分析(图4)。结果显示,spot 12,51, 200和216蛋白编码基因在南杨和钻天杨中的表达量显著(P<0.05)或极显著高于其他种质; spot 44和spot 197蛋白编码基因在森海2号杨、小叶杨和钻天杨中的表达量极显著高于其他种质; spot 161蛋白编码基因在南杨、森海2号杨、小叶杨和钻天杨花粉中的表达量均是对照组36号杨的4 700倍以上,在钻天杨花粉中的表达量竟高达8 453.06(±267.47)倍; spot 5蛋白编码基因仅在小叶杨中表达相对较高,达到显著水平; spot 80蛋白编码基因在5份种质花粉中的表达差异不显著。综合以上分析表明,9个致敏蛋白编码基因中,大多在南杨和钻天杨中表达量较高,而在森海2号杨和小叶杨中表达量较低,这与前面致敏蛋白在5份种质间的表达模式相一致。因此,差异定量结果分析也进一步验证了差异蛋白质组分析结果。

图4 qRT-PCR分析致敏相关基因在杨树成熟花粉中的表达情况Fig.4 Expression of related allergenic genes in poplar mature pollen by qRT-PCR “*”和“**”分别代表对照组与试验组之间差异显著(P<0.05)和极显著(P<0.01)。 “*” and “**” represent significant (P<0.05) and highly significant (P<0.01) difference between control and treatment, respectively.
3 讨论
过敏原作为花粉的激发物质,分析其在不同杨树种质的差异对于低致敏品种选育具有重要意义。从本研究中的6份杨树种质成熟花粉致敏蛋白数量、表达量及致敏蛋白编码基因表达量来看,南杨和钻天杨的致敏蛋白表达量显著或极显著大于其他杨树种质。其致敏蛋白主要涉及蛋白质的合成与加工(spot 3,5,95,156, 197)、信号转导(spot 200, 201和203)、糖酵解(spot 44,51和133)以及防御或胁迫反应(spot 78,135和208),这些蛋白为植物花粉的发育提供物质基础和能量保障,促进花粉的萌发,与花粉萌发试验结果相符。Ole e 1是木犀榄花粉主要过敏原,90%木犀榄花粉过敏患者的过敏原都是Ole e 1(Quiralteetal., 2002),其同源成员被鉴定为许多植物花粉的过敏原,如木樨科(Oleaceae)[如欧梣(Fraxinusexcelsior)、紫丁香(Syringaoblata)和欧洲女贞(Ligustrumvulgare)等]、平车前(Plantagodepressa)、藜(Chenopodiumalbum)等,但Ole e 1家族蛋白具体的功能和作用机制目前尚不清楚(Lombarderoetal., 2002)。在本研究中,Ole e 1家族蛋白(spot 161)在南杨、森海2号杨、小叶杨和钻天杨花粉中的表达量均是对照组36号杨的4 700倍以上,特别是在钻天杨花粉的表达量竟高达8 453.06(±267.47)倍,故推测Ole e 1可能是杨树花粉的主要过敏原。此外,有6个致敏蛋白在5份种质花粉中均没有检测到表达情况,这可能是由于其表达量相对较低,双向电泳技术很难检测出来。
三倍体植物具有产量高和抗性强的双重优势,但是其花粉育性低(杨诗勤, 2014)。森海2号杨是通过人工杂交选育出的抗性强的优良三倍体新品种(贾会霞等, 2015)。在本研究中,森海2号杨的花粉没有萌发,可能由于多倍体小孢子母细胞发育异常造成花粉活力差和育性低(曹媛等, 2012),而且其致敏蛋白表达水平也显著低于其他种质。Kondo等(1997)发现三倍体日本柳杉(Cryptomeriajaponica)花粉过敏原Cry j 1和Cry j 2含量低于二倍体,认为三倍体植物可能具有低致敏性,可以考虑作为低致敏杨树品种选育的一个方面。目前,对于三倍体花粉的低育性、低致敏性的机制还不清楚,有待于进一步深入研究。而且,本研究只是比较了杨树不同种质的成熟花粉致敏蛋白差异,未对花粉萌发的不同阶段进行差异蛋白质组分析。相关研究表明,花粉萌发伴随着表达基因数量的降低及特异性转录本的增加,同时也会导致蛋白质组的变化(赵丽娟, 2011)。因此,花粉萌发可能会丢失或产生过敏蛋白,值得进一步研究。
本研究表明,不同杨树种质间致敏蛋白表达量和致敏性存在差异,但问题是,致敏蛋白表达量的高低和致敏蛋白基因的表达量的多少与致敏性强弱有直接关联吗?Son等(1999)认为苹果(Malus×domestica)不同品种间的致敏性差异主要与过敏原的表达量差异有关。Bolhaar等(2005)通过酶联免疫测定金冠苹果的Mald 1(苹果主要过敏原)含量远低于‘Jonathan’品种,但前者的Mald 1同患者血清中的抗体(sIgE)结合能力要强于后者。Zuidmeer等(2006)通过体外免疫测定方法,进一步研究了造成这种结果冲突的原因,认为可能是过敏原结构的不稳定,难以控制。本研究初步探索了5份杨树种质成熟花粉致敏蛋白的表达特性,在今后的研究中,可以结合 IgE 检测、组胺释放试验(HAT)、酶联免疫吸附试验(ELISA)等技术测定过敏原对患者血清中抗体结合能力的强弱来验证致敏蛋白的表达量与致敏性的相关性以及确定低致敏性杨树种质(Sichereretal., 2010)。同时,还可以借助现代分子生物技术如RNA干扰进行基因沉默,以达到消除致敏蛋白的目的(Galloetal., 2009)。
4 结论
本研究通过杨树成熟花粉萌发试验、差异蛋白质组、qRT-PCR技术对不同杨树种质花粉中致敏蛋白表达量的差异进行了分析,结果表明杨树不同种质的花粉活力、致敏蛋白表达水平存在显著差异。其中36号杨、南杨和钻天杨花粉活力较高; 南杨和森海2号杨的致敏蛋白数量最多,小叶杨和钻天杨的致敏蛋白数量最少,且22个致敏蛋白在6份杨树种质的表达存在很大差异,南杨和钻天杨致敏蛋白表达量极显著高于其他种质。该结果对今后筛选低致敏杨树品种及控制植物过敏性疾病等研究具有重要参考价值。
曹 媛,康向阳,张志毅,等. 2012. 毛白杨花粉败育过程中Ca2+-ATPase 的异常变化. 北京林业大学学报,34 (4): 10-17.
(Cao Y,Kang X Y,Zhang Z Y,etal. 2012. Anomalous changes in Ca2+-ATPase distribution during the process of pollen abortion inPopulustomentosaCarr. Journal of Beijing Forestry University,34(4): 10-17. [in Chinese])
陈绍宁,王 伟,叶永忠. 2008. I型花粉致敏原的分子特性及其生物学功能. 植物生理学通讯,44 (2): 341-344.
(Chen S N,Wang W,Ye Y Z. 2008. Molecular characteristics and biological function of group-1 pollen allergens. Plant Physiology Communications,44(2): 341-344. [in Chinese])
胡 超. 2011. 欧美黑杨与小叶杨杂交后代性状分析及胚培养研究.武汉: 华中农业大学硕士学位论文.
(Hu C. 2011. Researches on offspring’s characters and embryo culture of hybrids betweenPopuluseuramericanaandPopulussimonii. Wuhan: MS thesis of Huazhong Agricultural University. [in Chinese])
贾会霞,姬慧娟,胡建军,等. 2015. 杨树新品种的SSR指纹图谱构建和倍性检测. 林业科学,51 (2): 70-79.
(Jia H X,Ji H J,Hu J J,etal. 2015. Fingerprints of SSR markers and ploidy detection for newPopulusvarieties. Scientia Silvae Sinicae,51(2): 70-79. [in Chinese])
贾黎明,刘诗琦,祝令辉,等. 2013. 我国杨树林的碳储量和碳密度. 南京林业大学学报:自然科学版,37 (2): 1-7.
(Jia L M,Liu S Q,Zhu L H,etal. 2013. Carbon storage and density of poplars in China. Journal of Nanjing Forestry University: Natural Sciences,37(2): 1-7. [in Chinese])
吕相征,刘秀梅,杨晓光. 2005. 健康人群食物过敏状况的初步调查. 中国食品卫生杂志,17 (2): 119-121.
(Lü X Z,Liu X M,Yang X G. 2005. Preliminary survey on status of food allergy in young Chinese students. Chinese Journal of Food Hygiene,17(2): 119-121. [in Chinese])
辛嘉楠,欧阳志云,郑 华,等. 2007. 城市中的花粉致敏植物及其影响因素. 生态学报,27 (9): 3820-3826.
(Xin J N,Ouyang Z Y,Zheng H,etal. 2007. Allergenic pollen plants and their influencing factors in urban area. Acta Ecologica Sinica,27(9): 3820-3826. [in Chinese])
杨琼梁,欧阳婷,颜 红,等. 2015. 花粉过敏的研究进展. 中国农学通报,31 (24): 163-164.
(Yang Q L, Ouyang T, Yan H,etal. 2015. Research progress of pollen allergy. Chinese Agricultural Science Bulletin,31(2): 163-164. [in Chinese])
杨诗勤. 2014. 水稻减数分裂相关基因OsPHS1的转化与鉴定. 武汉: 湖北大学硕士学位论文.
(Yang S Q. 2014. Transformation and identification ofOsPHS1 gene related to rice meiosis. Wuhan: MS thesis of Hubei University. [in Chinese])
赵丽娟. 2011. 小黑杨(Populussimonii×P.nigra)花粉功能基因组和蛋白质组研究. 哈尔滨: 东北林业大学博士学位论文.
(Zhao L J. 2011. Functional genomics and proteomics ofPopulussimonii×P.nigrapollen. Harbin: PhD thesis of Northeast Forestry University. [in Chinese])
Asturias J,Ibarrola I,Bartolome B,etal. 2002. Purification and characterization of Pla a 1, a major allergen fromPlatanusacerifoliapollen. Allergy,57(3): 221-227.
Bolhaar S T H P,van de Weg W E,van Ree R,etal. 2005. In vivo assessment with prick-to-prick testing and double-blind, placebo-controlled food challenge of allergenicity of apple cultivars. Journal of Allergy and Clinical Immunology, 116 (5): 1080-1086.
Ebner C,Hirschwehr R,Bauer L,etal. 1995. Identification of allergens in fruits and vegetables: IgE cross-reactivities with the important birch pollen allergens Bet v 1 and Bet v 2 (birch profilin). Journal of Allergy and Clinical Immunology,95(5): 962-969.
Erkara I P. 2008. Concentrations of airborne pollen grains in Sivrihisar (Eskisehir), Turkey. Environmental Monitoring and Assessment,138 (1-3): 81-91.
Gallo M,Richard S. 2009. Removing allergens and reducing toxins from food crops. Current Opinion in Biotechnology, 20 (2): 191-196.
Hirahara K,Tatsuta T,Takatori T,etal. 2001. Preclinical evaluation of an immunotherapeutic peptide comprising 7 T-cell determinants of Cry j 1 and Cry j 2, the major Japanese cedar pollen allergens. Journal of Allergy and Clinical Immunology,108(1): 94-100.
Ibarrola I,Arilla M,Martínez A,etal. 2004. Identification of a polygalacturonase as a major allergen (Pla a 2) fromPlatanusacerifoliapollen. Journal of Allergy and Clinical Immunology,113 (6): 1185-1191.
Kondo Y,Ipsen H,Løwenstein H,etal. 1997. Comparison of concentrations of Cry j 1 and Cry j 2 in diploid and triploid Japanese cedar (Cryptomeriajaponica) pollen extracts. Allergy,52(4): 455-459.
Larsen J N,Strøman P,Ipsen H. 1992. PCR based cloning and sequencing of isogenes encoding the tree pollen major allergen Car b I fromCarpinusbetulus, hornbeam. Molecular Immunology,29(6): 703-711.
Lin R Y,Clauss A E,Bennett E S. 2002. Hypersensitivity to common tree pollens in New York City patients. Allergy and Asthma Proceedings,23 (4): 253-258.
Lombardero M,Obispo T,Calabozo B,etal. 2002. Cross-reactivity between olive and other species. Role of Ole e 1-related proteins. Allergy,57(s71): 29-34.
Mardones P,Grau M,Araya J,etal. 2013. First annual register of allergenic pollen in Talca, Chile. Allergologia Et Immunopathologia,41 (4): 233-238.
Midoro H T,Goldblum R M,Kurosky A,etal. 1999. Isolation and characterization of the mountain cedarJuniperusasheipollen major allergen, Jun a 1. Journal of Allergy and Clinical Immunology,104 (3): 608-612.
Pfaffl M W. 2001. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research,29(9): 45.
Quiralte J,Florido F,Arias J,etal. 2002. Olive allergen-specific IgE responses in patients withOleaeuropaeapollinosis. Allergy,57(s71): 47-52.
Sicherer S H,Sampson H A. 2010. Food allergy. Journal of Allergy and Clinical Immunology,125 (2): 116-125.
Son D Y,Scheurer S,Hoffmann A,etal. 1999. Pollen-related food allergy: cloning and immunological analysis of isoforms and mutants of Mal d 1, the major apple allergen, and Bet v 1, the major birch pollen allergen. European Journal of Nutrition,38 (4): 201-215.
Twardosz A,Hayek B,Seiberler S,etal. 1997. Molecular characterization, expression inEscherichiacoli, and epitope analysis of a two EF-hand calcium-binding birch pollen allergen, Bet v 4. Biochemical and Biophysical Research Communications,239(1): 197-204.
Zhang J,Wu L S,Fan W,etal. 2015. Proteomic analysis and candidate allergenic proteins inPopulusdeltoidescl. “2KEN8” mature pollen. Frontiers in Plant Science,6: 1-22.
Zuidmeer L,van Leeuwen W A,Kleine B I,etal. 2006. Allergenicity assessment of apple cultivars: hurdles in quantifying labile fruit allergens. International Archives of Allergy and Immunology,41 (3): 230-240.
(责任编辑 徐 红)
Differences in Pollen Germination and Allergenic Proteins among DifferentPopulusGermplasms
Zhang Xiaoling1Wang Liuqiang1Sun Pei1Wu Lishuan2Fan Wei1Zhang Jin1Lu Mengzhu1Hu Jianjun1
(1.StateKeyLaboratoryofTreeGeneticsandBreedingKeyLaboratoryofTreeBreedingandCultivationoftheStateForestryAdministrationResearchInstituteofForestry,CAFBeijing100091; 2.KeyLaboratoryofPhotobiology,InstituteofBotany,ChineseAcademyofSciencesBeijing100093)
【Objective】 The characteristics of pollen germination and the differences of allergenic proteins among six poplar germplasms (Populusdeltoides‘2KEN8’,P.deltoides‘Nanyang’,P.deltoides×P.maximowiczii‘Eridano’,P.deltoides×P.cathayana‘Senhai 2’,P.simoniiandP.nigravar.italica) were studied to provide a theoretical basis and scientific evidence for breeding hypoallergenic poplar varieties and for the control of plant allergy. 【Method】 Pollen was collected from flower branches of six poplar germplasms collected from Beijing, Hebei and Henan in March 2015 for a period of hydroponic culture, pollen germination was studied by liquid culture method, and pollen allergenic proteins of different poplar germplasms was used by two-dimensional electrophoresis and real-time quantitative PCR. 【Result】 1) The pollen viability ofP.deltoides‘2KEN8’,P.deltoides‘Nanyang’ andP.nigravar.italicawas higher, followed byP.simoniiandP.deltoides×P.maximowiczii‘Eridano’, however, the viability ofP.deltoides×P.cathayana‘Senhai 2’ was the worst; the largest pollen germination rate was inP.deltoides‘2KEN8’, up to 74.42% (±2.36%), while the pollen germination of triploidP.deltoides×P.cathayana‘Senhai 2’ was 0; the average length of pollen tube ofP.nigravar.italicawas 456 μm (±2.05 μm), the shortest was inP.simonii, 276.44 μm (±11.08 μm), and the difference of pollen germination rate and pollen tube length among different entities were highly significant (P<0.01), suggesting that the pollen viability was significantly different among different germplasms. 2) The 2-DE maps ofP.deltoides‘Nanyang’,P.deltoides×P.maximowiczii‘Eridano’,P.deltoides×P.cathayana‘Senhai 2’,P.simoniiandP.nigravar.italicamature pollen were analyzed by Imagemaster 2D platinum 6.0, a total of 408 protein spots were matched. Based on the 28 potentially allergenic proteins ofP.deltoides‘2KEN8’ identified in our previous study, 6 allergenic proteins were missing expression in the other five entities; bothP.nigravar.italicaandP.deltoides‘Nanyang’ had 21 allergenic proteins,P.deltoides×P.maximowiczii‘Eridano’ had 19; whileP.deltoides×P.cathayana‘Senhai 2’ andP.deltoides‘2KEN8’ had the least number of allergenic proteins, only 18. Morover, the analysis of difference expression indicated that 12 of the 22 remaining allergenic proteins were less expressed in the five entities than inP.deltoides‘2KEN8’, the range of relative expression level was -3.99--0.02. The expression level ofP.deltoides×P.cathayana‘Senhai 2’ andP.simoniiwas the least, especially they had 10 and 8 allergenic proteins which were significantly or highly significant lower than that ofP.deltoides‘2KEN8’, respectively. The expression of 3 allergenic proteins in the 5 entities was higher than inP.deltoides‘2KEN8’. The strongest expression was inP.deltoides‘Nanyang’, significantly greater than inP.deltoides‘2KEN8’, followed byP.nigravar.italica,P.deltoides×P.cathayana‘Senhai 2’,P.deltoides×P.maximowiczii‘Eridano’ andP.simonii. Variance analysis among groups suggested that the expression of 17 allergenic proteins ofP.nigravar.italicaandP.deltoides‘Nanyang’ were significantly (P<0.05) or highly significantly (P<0.01) greater than that ofP.deltoides×P.cathayana‘Senhai 2’ andP.simonii. 3) qRT-PCR results showed that there were 5 of 9 allergenic proteins encoding genes highly expressed inP.nigravar.italicaandP.deltoides‘Nanyang’, including spot 12, 51, 200, 216 and 161, followed byP.simonii, while both ofP.deltoides×P.maximowiczii‘Eridano’ andP.deltoides×P.cathayana‘Senhai 2’ had only 2 highly expressed allergenic protein coding genes.【Conclusion】 The pollen viability, the number and expression levels of allergenic proteins were significantly different among the 6 germplasm entities, providing an important basis for future breeding of new poplar hypoallergenic varieties. However, further study is needed to understand the correlation between expression levels and allergenicity of the allergenic proteins of mature pollen.
Populus; mature pollen; allergenic protein; two-dimensional electrophoresis; real-time quantitative PCR
10.11707/j.1001-7488.20170207
2016-04-06;
2016-04-19。
“十二五”林业行业公益类重大专项(201304103)。
S718.43
A
1001-7488(2017)02-0054-11
*胡建军为通讯作者。
