胶质瘤对MPPa-PDT敏感性研究中ABCG2的作用
2017-03-27林海丹李开庭白定群孔渝菡欧云生虞乐华
潘 黎,田 思,张 利,林海丹,苟 慧,陈 青,李开庭,白定群,孔渝菡,欧云生,虞乐华
1.重庆医科大学附属第一医院康复医学科,重庆 400016;2.重庆医科大学附属第二医院康复医学科,重庆 400010;3.重庆医科大学附属第一医院骨科,重庆 400016
胶质瘤对MPPa-PDT敏感性研究中ABCG2的作用
潘 黎1,田 思1,张 利1,林海丹1,苟 慧2,陈 青1,李开庭1,白定群1,孔渝菡1,欧云生3,虞乐华2
1.重庆医科大学附属第一医院康复医学科,重庆 400016;2.重庆医科大学附属第二医院康复医学科,重庆 400010;3.重庆医科大学附属第一医院骨科,重庆 400016
背景与目的:三磷酸腺苷结合转运蛋白G超家族成员2(adenosine triphosphate-binding cassette superfamily G member 2,ABCG2)在多种肿瘤细胞中表达,能通过外排抗癌药物参与肿瘤耐药。本研究的目的旨在探讨人胶质瘤细胞对焦脱镁叶绿酸甲酯(pyropheophorbide-a methyl ester,MPPa)介导的光动力疗法(photodynamic therapy,PDT)杀伤效应的敏感性及其与ABCG2的关系。方法:选取处于对数生长期的胶质瘤细胞株U87、A172,分别经MPPa-PDT或MPPa-PDT+烟曲霉毒素C(fumitremorgin C,FTC)处理后,采用CCK-8法检测细胞活性;采用蛋白[质]印迹法(Western blot)检测细胞内ABCG2的表达;流式细胞技术法检测未光照前各组细胞内MPPa的含量;Annexin Ⅴ-FITC/PI双染流式细胞术检测细胞凋亡率;DCFH-DA染色观察细胞内活性氧(reactive oxygen species,ROS)的产生。结果:MPPa-PDT能抑制A172、U87细胞的活性,且呈一定的光能量依赖性,A172达到半数致死量所需光能量密度为U87的8倍;A172较U87细胞对MPPa-PDT不敏感;A172细胞内高表达的ABCG2影响MPPa在细胞内的聚集;抑制ABCG2后,不仅可以增强MPPa-PDT对A172细胞的杀伤作用,同时可增加MPPa-PDT触发产生的ROS的量及细胞对MPPa的摄取。结论:人胶质瘤细胞株A172对MPPa-PDT相对不敏感,并且产生这种现象的机制可能是ABCG2外排MPPa,减少MPPa的细胞内聚集,进而减弱光敏剂活化后对肿瘤细胞的杀伤作用。
三磷酸腺苷结合转运蛋白G超家族成员2;焦脱镁叶绿酸甲酯;光动力疗法;敏感性;胶质瘤
神经胶质母细胞瘤(glioblastoma multiforme,GBM)是最常见且侵袭性最强的原发性脑肿瘤,导致GBM患者的中位生存期只有15个月[1],仅有3%~5%的患者能存活超过5年[2]。常规治疗对大脑的损伤及药物难以通过血脑屏障,导致胶质母细胞瘤的根治非常困难[3]。光动力疗法(photodynamic therapy,PDT)作为一种新型的肿瘤靶向治疗方式,因其特异性强、敏感度高,被用于多种肿瘤的治疗[4]。光敏剂可作为荧光染料对手术切除胶质瘤进行引导,也可利用光敏剂在肿瘤组织的高聚集特点,在手术中通过PDT直接对肿瘤细胞进行靶向查杀以期达到“完全切除”[5]。研究表明细胞的异质性及耐药性使用于GBM治疗的药物不能完全渗透进入细胞,从而影响药物作用,也降低肿瘤细胞对PDT治疗的敏感性,导致许多GBM复发[3]。ABCG2作为ABC转运蛋白家族的成员,参与多种肿瘤的耐药过程[6]。近期有研究报道抑制人基底细胞癌BCC-1/KMC细胞内高表达的ABCG2后,可增强PDT对该肿瘤的治疗效果。由此,笔者推测ABCG2在GBM对PDT不敏感中可能起到了关键性作用。本研究选择同一恶性程度来源的两株GBM细胞株A172、U87,观察PDT对其作用效果,利用ABCG2特异性抑制剂烟曲霉毒素C(fumitremorgin C,FTC)探讨人胶质瘤细胞对PDT杀伤效应不敏感的可能机制,为PDT更好地用于GBM的临床治疗提供实验依据。
1 材料和方法
1.1 材料
光敏剂焦脱镁叶绿酸甲酯(pyropheophorbide -a methyl ester,MPPa)购自美国Sigma-Aldrich公司,用二甲基亚砜溶解后过滤除菌,配制成终浓度为10 mmol/L储存液避光储存于-20 ℃的冰箱中;LED多波长光源由本课题组自行研制(本实验选择波长630 nm、连续输出方式、光功率密度30 mW/cm2);DMEM高糖培养基、胰蛋白酶购自上海碧云天生物技术有限公司;胎牛血清购自德国PAN公司;CCK-8购自日本同仁化学研究所;Anne Ⅴ-PI双染检测试剂盒购自南京凯基生物技术有限公司;DCFH-DA购自美国Sigma公司;ABCG2抗体购自美国Abcam公司;β-actin抗体购自美国Proteintech公司;二抗购自北京中杉金桥生物技术有限公司。GBM细胞株U87、A172均由上海复旦大学生物医学研究院培养。
1.2 细胞培养
GBM细胞株U87、A172在37 ℃、CO2体积分数为5%及饱和湿度的条件下于DMEM高糖培养液(含1%青链双抗和10%胎牛血清)中进行传代培养。
1.3 实验分组及处理
MPPa-PDT处理:处于对数生长期的U87、A172细胞,与2 μmol/L的光敏剂MPPa共同温育24 h后,按LED光能量密度:0、0.9、1.8、3.6、7.2和10.8 J/cm2进行随机分组及光照;MPPa-PDT+FTC处理:将处于对数生长期的A172细胞随机分为4组,其中A组为空白对照组,B组为FTC组,C组为MPPa-PDT组,D组为MPPa-PDT+FTC组。B、D组按参考文献要求选择5 μmol/L FTC,A、C组加入含等浓度的二甲基亚砜的培养基于37 ℃、CO2体积分数为5%的条件下温育24 h后,更换培养基,按以上分组加入MPPa浓度2 μmol/L继续避光温育24 h。以上均使用波长630 nm、连续输出方式、光功率密度为30 mW/cm2的集成LED特种光源照射。A、B、C和D组细胞接受240 s的光照(光照能量=功率×光照时间)。
1.4 检测指标
1.4.1 CCK-8法检测细胞活性
经上述分组处理后的细胞继续避光培养24 h后加入CCK-8试剂10 μL,于37 ℃、CO2体积分数为5%的条件下温育30 min,用全波长酶标仪于450 nm波长下测定各孔吸光度(D)值,取平均值,并按公式计算细胞存活率:存活率=(D实验组平均值-D阴性对照组值)∕(D空白对照组平均值-D阴性对照组值)×100%。
1.4.2 流式细胞技术检测细胞内MPPa的含量
处于对数生长期的细胞用胰酶消化,以1×105个/孔接种于6孔板中。待细胞贴壁后,每孔加入2 μmol/L的MPPa温育24 h,PBS洗涤细胞3次,收集细胞,采用流式细胞技术检测细胞内MPPa含量。
1.4.3 蛋白[质]印迹法(Western blot)检测ABCG2蛋白的表达
提取处于对数生长期的GBM细胞A172、U87全蛋白,采用BCA法测各细胞蛋白浓度并配平。取等质量上述蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法将蛋白质转移至0.45 μm的PVDF膜上,室温下摇床上封闭2 h、温育ABCG2一抗(1∶1 000)、二抗(1∶5 000)后采用ECL化学发光法显色,观察两细胞内相应蛋白的表达情况。以β-actin为内参,采用Image J软件进行条带的量化。
1.4.4 膜联蛋白Annexin V-PI双染,流式细胞仪检测A172细胞的凋亡率
取处于对数生长期的A172胶质瘤细胞,以1×105个/孔的密度接种于6孔板培养。待其贴壁后按以上分组进行光动力处理。24 h后离心消化收集所有悬浮及贴壁细胞,AnnexinV-FITC/PI双染,流式细胞仪检测细胞凋亡率。
1.4.5 DCFH-DA染色检测A172细胞内活性氧(reactive oxygen species,ROS)水平
不带荧光的DCFH-DA可被细胞内的ROS氧化为带绿色荧光的DCF,通过检测DCF的量可以反应细胞内ROS的水平。将处于对数生长期的A172细胞均匀接种于48孔板中,待其贴壁后按以上分组进行光动力处理,倒掉原培养基,用PBS轻轻洗涤细胞3次,加入含25 μmol/L的DCFH-DA无血清培养基,用置于37 ℃、CO2体积分数为5%的条件下温育30 min,弃掉培养基后PBS洗涤细胞3次,荧光显微镜下观察并拍照。细胞接种于6孔板中,用PDT处理后,按上述方法进行DCFH-DA染色后用全波长酶标仪对ROS水平进行定量检测(激发波长为488 nm;发射波长525 nm)。
1.5 统计学处理
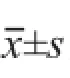
2 结 果
2.1 CCK-8法检测A172、U87两细胞对Mppa-PDT杀伤效应的敏感性
CCK-8法结果显示,同一MPPa浓度温育后,MPPa-PDT对两细胞的杀伤效应存在光能量依赖性,光能量密度越大,细胞活性越低(图1A);A172半数致死量所需光能量密度值为7.2 J/cm2,U87则为0.9 J/cm2(图1B);采用7.2 J/c m2的光能量密度照射后,A 1 7 2细胞活性为0.5 5 3±0.0 3 7,而U 8 7仅为0.017±0.002(P<0.05,图1C);提示与U87细胞相比,A172对MPPa-PDT的杀伤效应相对不敏感。故选择最终能量密度7.2 J/cm2用于A172细胞株后续的相关实验。

图1 不同光能量密度照射对两细胞活性的影响Fig. 1 The ef f ect of dif f erent light energy on the two kinds of cells viability
2.2 两细胞株中ABCG2蛋白表达的鉴定及MPPa含量的比较
Western blot检测结果显示,A172细胞内ABCG2的表达明显高于U87(t=4.021,P<0.05,图2A);流式定量检测显示,A172细胞内MPPa的含量明显低于U87,约为U87的1/4(t=24.61,P<0.05,图2B)。
2.3 抑制ABCG2后,A172细胞对MPPa-PDT杀伤效应敏感性的变化
CCK-8细胞活性检测发现,各组间细胞活性比较差异有统计学意义(F=27.803,P<0.001),但A组与B组间差异无统计学意义(P>0.05),加入ABCG2特异性抑制剂FTC的D组细胞活性较C组明显降低,且差异有统计学意义(P<0.001);采用流式细胞术对细胞凋亡进行测定发现,D组细胞凋亡率也明显高于C组,且差异有统计学意义(χ2=3 873.629,P<0.001,图3)。
2.4 抑制ABCG2后,对A172细胞内MPPa的含量及PDT后ROS水平的影响
通过流式细胞术对各组细胞内MPPa红色荧光强度及含量的检测均发现,D组细胞内MPPa含量明显高于C组,差异有统计学意义(F=527.8,P<0.001,图4);对ROS进行DCFHDA染色发现,D组荧光强度最高,提示D组产生ROS的量最多(图4);采用流式细胞术对ROS进行定量检测其结果也显示,4组中D组产生的ROS的量明显高于其他各组(F=312.427,P<0.001,图4)。

图2 两细胞株中ABCG2蛋白表达的鉴定及MPPa含量的比较Fig. 2 Identif i cation of the expression of ABCG2 protein and comparison the content of intracellular in the two cell lines
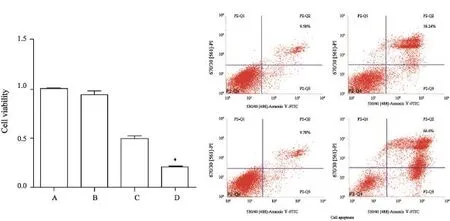
图3 各组细胞活性和细胞凋亡率比较Fig. 3 The comparison of cell viability and cell apoptosis rate in each group
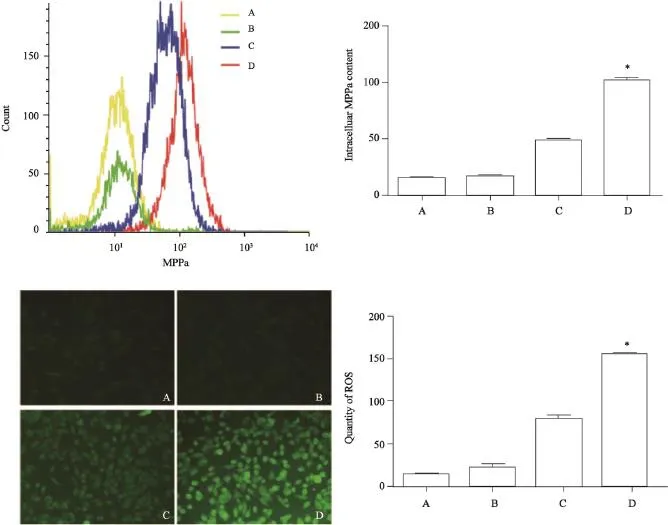
图4 流式定量检测各组细胞内MPPa含量并比较各组细胞内ROS水平Fig. 4 The intracellular contents of MPPa in each group without illumination were tested by fl ow cytometry and comparison the level of intracellular ROS in each group
3 讨 论
ABC转运蛋白利用ATP的绑定和(或)水解的能量驱动跨膜结构域的构象变化来转运分子[7]。不同转运蛋白转运底物不同[8],如ABC转运蛋白家族成员ABCG2,又称乳腺癌耐药蛋白,可以通过外排光敏剂,从而降低细胞内光敏剂的积聚[9-11]。MPPa为叶绿素a的衍生物,是第二代新型光敏剂,因具有明确的化学结构、较长的吸收波长及较强的组织渗透性等优点,使其在临床上有广泛的应用前景[12-14]。有研究发现,MPPa是ABCG2转运蛋白的特异性底物,在高表达ABCG2的人结肠癌细胞株、乳腺癌细胞株[15]、人类基底癌细胞株[16]及骨髓瘤细胞[11]中均发现细胞内MPPa外排现象。本实验中A172细胞内MPPa明显低于U87细胞,而两者ABCG2蛋白含量差异则为U87明显低于A172,提示A172细胞内MPPa含量较低可能与其高表达的ABCG2外排MPPa有关。已知PDT杀伤肿瘤的主要原理为光敏剂在一定波长的光照激发下发生复杂的光化学反应,通过产生ROS导致肿瘤组织不可逆的损伤[17]。提示PDT杀伤肿瘤细胞的关键是肿瘤细胞内光敏剂活化产生的ROS。所以,细胞内光敏剂含量的减少将直接导致PDT对肿瘤细胞的杀伤效应的减弱。在对早期肺癌患者进行PDT治疗中发现,肺癌细胞中ABCG2对光敏剂的外排作用直接影响PDT的疗效[18]。本研究也发现,A172与U87两细胞株在相同光能量密度处理下,A172细胞活性均高于U87;同时,两细胞株达到半数致死量所需的光能量密度也存在差异,A172所需光能量密度为7.2 J/cm2,高于U87的0.9 J/cm2。提示A172对MPPa-PDT的敏感性较U87差。结合此前两细胞株中胞内MPPa浓度及ABCG2含量的差异,我们推测A172对MPPa-PDT敏感性差可能与ABCG2外排MPPa后引起MPPa-PDT所致的ROS减少有关。
FTC是一种从烟曲霉中分离得到的霉菌毒素,通过增加耐药细胞内的药物积聚、改变拓扑异构酶的活性等方式逆转由ABCG2介导的多药耐药[19-20]。在表达功能性的ABCG2人胃癌细胞S-120中加入ABCG2抑制剂FTC后,可逆转S-120的耐药特性,增加抗肿瘤药物SN-38对S-120细胞的毒性作用[21]。本实验也证实,加入FTC抑制A172细胞高表达的ABCG2后,细胞活性下降,而凋亡率显著升高,这说明A172细胞中ABCG2被FTC特异性抑制后,MPPa-PDT对A172细胞的杀伤效应增强。在PDT中,ROS的产生源于MPPa的激活,细胞内MPPa的含量将直接影响其被光照激活后ROS的产量,进一步影响PDT对细胞的杀伤效果。本实验发现抑制ABCG2蛋白的功能,细胞内MPPa的含量明显增多,并伴随着ROS的产量的增加。这种现象在人结肠癌HCT116和人肾癌A498两细胞系中也得到证实,两细胞系中ABCG2表达的减弱,可使PDT诱导的ROS的产生增多,增强PDT对这两细胞系的杀伤效应[22]。另外Choi等[22]的研究发现,ABCG2蛋白的表达受核因子E2相关转录因子2(the transcription factor NF-E2-related factor 2,NRF2)的调控。采用小干扰RNA技术敲除人乳腺癌MDA-MB-231细胞内NRF2基因后,细胞对光敏剂的摄取明显多于未敲除组,且细胞内ABCG2蛋白表达量降低;而未敲除组经ABCG2抑制剂处理后,与敲除NRF2基因的细胞相比,两者在细胞内光敏剂浓度及产生的ROS水平间比较,则差异无统计学意义[22]。Hajri等[23]在结肠癌HT293细胞中也进一步证实NRF2-ABCG2通路参与HT293对MPPa介导的PDT的不敏感。在相关实验中也证明NRF2还可通过下游分子血红素氧合酶1、NADP(H)醌氧化还原酶等的表达发挥强大的抗氧化及细胞保护作用,从而对PDT产生耐受[24-27]。
综上所述,本实验证明,GBM细胞株A172对MPPa-PDT相对不敏感,并且产生这种现象的机制可能是ABCG2外排MPPa,减少MPPa的细胞内聚集,进而减弱光敏剂活化后对肿瘤细胞的杀伤作用。为临床提高PDT治疗GBM的治疗效果提供一定的实验依据。
[1] BLEEKER F E, MOLENAAR R J, LEENSTRA S. Recent advances in the molecular understanding of glioblastoma[J]. J Neurooncol, 2012, 108(1): 11-27.
[2] GALLEGO O. Nonsurgical treatment of recurrent glioblastoma[J]. Curr Oncol, 2015, 22(4): e273-e281.
[3] LAWSON H C, SAMPATH P, BOHAN E, et al. Interstitial chemotherapy for malignant gliomas: the Johns Hopkins experience[J]. J Neurooncol, 2007, 83(1): 61-70.
[4] HUANG H C, MALLIDI S, LIU J, et al. Photodynamic therapy synergizes with irinotecan to overcome compensatory mechanisms and improve treatment outcomes in pancreatic cancer[J]. Cancer Res, 2016, 76(5): 1066-1077.
[5] STUMMER W, PICHLMEIER U, MEINEL T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase Ⅲ trial[J]. Lancet Oncol, 2006, 7(5):392-401.
[6] CHUNA C, ZAIDEN N, CHONG K H, et al. Characterization of a side population of astrocytoma cells in response to temozolomide[J]. J Neurosurg, 2008, 109(5): 856-866.
[7] HOLLENSTEIN K, DAWSON R J, LOCHER K P. Structure and mechanism of ABC transporter proteins[J]. Curr Opin Struct Biol, 2007, 17(4): 412-418.
[8] POHL A, DEVAUX P F, HERRMANN A. Function of prokaryotic and eukaryotic ABC proteins in lipid transport[J]. Biochim Biophys Acta, 2005, 1733(1): 29-52.
[9] MERLIN J L, GAUTIER H, BARBERI-HEYOB M, et al. The multidrug resistance modulator SDZ-PSC 833 potentiates the photodynamic activity of chlorin e6 independently of P-glycoprotein in multidrug resistant human breast adenocarcinoma cells[J]. Int J Oncol, 2003, 22(4): 733-739.
[10] TSAI T, HONG R L, TSAI J C, et al. Effect of 5-aminolevulinicacid-mediated photodynamic therapy on MCF-7 and MCF-7/ ADR cells[J]. Lasers Surg Med, 2004, 34(1): 62-72.
[11] ROBEY R W, STEADMAN K, POLGAR O, et al. ABCG2-mediated transport of photosensitizers: potential impact on photodynamic therapy[J]. Cancer Biol Ther, 2005, 4(2):187-194.
[12] LUO T, WILSON B C, LU Q B. Evaluation of oneand two-photon activated photodynamic therapy with pyropheophorbide-a methyl ester in human cervical, lung and ovarian cancer cells[J]. J Photochem Photobiol B, 2014, 132: 102-110.
[13] GUELLUY P H, FONTAIN-AUPART M P, GRAMMENOS A, et al. Optimizing photodynamic therapy by liposomal formulation of the photosensitizer pyropheophorbide-a methyl ester: in vitro and ex vivo comparative biophysical investigations in a colon carcinoma cell line[J]. Photochem Photobiol Sci, 2010, 9(9): 1252-1260.
[14] XU J, XIA X, LEUNG A W, et al. Sonodynamic action of pyropheophorbide-a methyl ester induces mitochondrial damage in liver cancer cells[J]. Ultrasonics, 2011, 51(4): 480-484.
[15] HAZLEHURST L A, FOLEY N E, GLEASON-GUZMAN M C, et al. Multiple mechanisms confer drug resistance to mitoxantrone in the human 8 226 myeloma cell line[J]. Cancer Res, 1999, 59(5): 1021-1028.
[16] SUN W, KAJIMOTO Y, INOUE H, et al. Gefitinib enhances the efficacy of photodynamic therapy using 5-aminolevulinic acid in malignant brain tumor cells[J]. Photodiagnosis Photodyn Ther, 2013, 10(1): 42-50.
[17] RKEIN A M, OZOG D M. Photodynamic therapy[J]. Dermatol Clin, 2014, 32(3): 415-425.
[18] USUDA J, TSUNODA Y, ICHINOSE S, et al. Breast cancer resistant protein (BCRP) is a molecular determinant of the outcome of photodynamic therapy (PDT) for centrally located early lung cancer[J]. Lung Cancer, 2010, 67(2): 198-204.
[19] ROSS D D, YANG W, ABRUZZO L V, et al. Atypical multidrug resistance: breast cancer resistance protein messenger RNA expression in mitoxantrone-selected cell lines[J]. J Natl Cancer Inst, 1999, 91(5): 429-433.
[20] RABINDRAN S K, HE H, SINGH M, et al. Reversal of a novel multidrug resistance mechanism in human colon carcinoma cells by fumitremorgin C[J]. Cancer Res, 1998, 58(24):5850-5858.
[21] CHANG C H, WANG Y, ZALATH M, et al. Combining ABCG2 inhibitors with IMMU-132, an anti-Trop-2 antibody conjugate of SN-38, overcomes resistance to SN-38 in breast and gastric cancers[J]. Mol Cancer Ther, 2016, 15(8):1910-1919.
[22] CHOI B H, RYOO I G, KANG H C, et al. The sensitivity of cancer cells to pheophorbide a-based photodynamic therapy is enhanced by Nrf2 silencing[J]. PloS one, 2014, 9(9):e107158.
[23] HAJRI A, WACK S, MEYERR C, et al. In vitro and in vivo efficacy of photofrin and pheophorbide a, a bacteriochlorin, in photodynamic therapy of colonic cancer cells[J]. Photochem Photobiol, 2002, 75(2): 140-148.
[24] ADACHI T, NAKAGAWA H, CHUNG I, et al. Nrf2-dependent and -independent induction of ABC transporters ABCC1, ABCC2, and ABCG2 in HepG2 cells under oxidative stress[J]. J Exp Ther Oncol, 2007, 6(4): 335-348.
[25] CHEN Q, LI W, WAN Y, et al. Amplified in breast cancer 1 enhances human cholangiocarcinoma growth and chemoresistance by simultaneous activation of Akt and Nrf2 pathways[J]. Hepatology, 2012, 55(6): 1820-1829.
[26] JIA Y, CHEN J, ZHU H, et al. Aberrantly elevated redox sensing factor Nrf2 promotes cancer stem cell survival via enhanced transcriptional regulation of ABCG2 and Bcl-2/ Bmi-1 genes[J]. Oncol Rep, 2015, 34(5): 2296-2304.
[27] MASUDE Y, VAZIRI N D, LI S, et al. The effect of Nrf2 pathway activation on human pancreatic islet cells[J]. PloS one, 2015, 10(6): e0131012.
The role of ABCG2 in the sensitivity of glioma to pyropheophorbide-amethyl ester-mediated photodynamic therapy
PAN Li1, TIAN Si1, ZHANG Li1, LIN Haidan1, GOU Hui2, CHEN Qing1, LI
Kaiting1, BAI Dingqun1, KONG Yuhan1, OU Yunsheng3, YU Lehua2(1. Department of Rehabilitation Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China; 2. Department of Rehabilitation Medicine, the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China; 3. Department of Rehabilitation Medicine Orthopaedics, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China)
Background and purpose: Adenosine triphosphate-binding cassette superfamily G member 2 (ABCG2), which has been found over-expressed in a variety of cancer cells, takes part in the drug resistance of cancer through efflux of anticancer drugs. The purpose of this study was to investigate the mechanisms of human glioblastoma cells sensitivity to pyropheophorbide-a methyl ester (MPPa)-mediated photodynamic therapy (PDT) eradicating tumour cells and its relationship to ABCG2. Methods: U87 and A172 glioma cell lines in the logarithmic growth phase wereselected and exposed to the treatment of MPPa-PDT and MPPa-PDT+fumitremorgin C (FTC) respectively. The cell viability was measured with the use of CCK-8 assay. The expression of ABCG2 was detected by Western blot. The intracellular contents of MPPa in each group without illumination were tested by fl ow cytometry. Flow cytometry with Annexin Ⅴ-FITC/PI double staining was used to detect the cell apoptotic rate. DCFH-DA staining was used to assess the generation of intracellular reactive oxygen species (ROS). Results: The MPPa-mediated PDT could eradicate A172 and U87 cancer cells in an energy-dependent manner. The light energy density in A172 was 8 times of that in U87 when the cell viability reached median lethal dose after MPPa-mediated PDT. The high expression of ABCG2 in A172 cells af f ected the accumulation of intracellular MPPa. Inhibition of ABCG2, not only could enhance the eradicating ef f ect of MPPa-PDT on A172 cells, but also could increase the yield of ROS triggered by MPPa-PDT and the accumulation of intracellular MPPa. Conclusion: The human glioblastoma cell line A172 is insensitive to MPPa-mediated PDT. The mechanism may relate to ABCG2, which decreases the MPPa content in cancer cells through efflux of MPPa, resulting in decline of cytotoxicity.
Adenosine triphosphate-binding cassette superfamily G member 2; Pyropheophorbide-a methyl ester; Photodynamic therapy; Sensitivity; Glioma
KONG Yuhan E-mail: Kong-yuhan@foxmail.com
10.19401/j.cnki.1007-3639.2017.02.001
R739.41
A
1007-3639(2017)02-0081-08
2016-08-30
2016-11-29)
国家自然科学基金资助项目(81401865,81572634)。
孔渝菡 E-mail:Kong_yuhan@foxmail.com
