莫氏马尾藻多糖的分离及理化性质评价
2017-03-26侯宁宁张全斌
侯宁宁, 王 晶, 张全斌
莫氏马尾藻多糖的分离及理化性质评价
侯宁宁1, 2, 王 晶1, 张全斌1
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049)
以莫氏马尾藻()为原料, 分别采用热水和稀酸两种提取方式提取莫氏马尾藻多糖, 通过DEAE-Sepharose FF柱层析进行分级纯化, 利用化学分析方法并结合高效液相色谱法(HPLC)、红外谱图、核磁共振谱图对分离到的莫氏马尾藻多糖及其分级组分的理化性质及基本结构进行分析, 并对其主要组分的抗氧化与抗凝血活性进行研究。研究结果表明: 莫氏马尾藻多糖是以岩藻糖为主, 且含有少量硫酸根和糖醛酸的酸性多糖; 莫氏马尾藻多糖清除自由基能力较强, 具有良好的抗氧化活性; 同时, 该多糖可以通过抑制内源性凝血途径起到抗凝血作用, 具有一定的开发前景。
莫氏马尾藻多糖; 岩藻糖; 抗氧化; 抗凝血
莫氏马尾藻(), 隶属于褐藻门、圆子纲、墨角藻目、马尾藻科、马尾藻属。藻体高达1.5 m, 黄褐色。莫氏马尾藻主要分布于香港、广东、海南和广西沿海等海域, 生长于低潮带或潮下带岩石上[1]。莫氏马尾藻具有生长快和生物量大的特点, 是在海洋环境生态修复上具有显著优势的一种大型海藻。截止目前, 国内外对莫氏马尾藻的研究还仅限于对其繁殖生物学及其多酚成分的抗氧化和抗肿瘤细胞增殖作用等方面[2-3]。对于莫氏马尾藻中多糖等其他活性成分的分离、理化性质及活性评价尚未见报道。
研究表明, 马尾藻属藻类含有丰富的膳食纤维、褐藻淀粉、矿物质和维生素以及优质的高度不饱和脂肪酸和合理的必需氨基酸组成, 脂肪含量较低, 可作为保健食品和药物的优质原料[4]。
马尾藻属藻类含以岩藻糖为主要组成单糖的硫酸化多糖, 但是不同藻类中多糖的理化特性和生物活性有很大差别。目前已有南海亨氏马尾藻()、半叶马尾藻()等多糖抗肿瘤活性的研究, 表明亨氏马尾藻多糖对小鼠艾氏腹水瘤和腹水型肉瘤180有较明显的抑制作用[5]。
本文以莫氏马尾藻为研究材料, 对其多糖的分离、理化性质和抗氧化、抗凝血活性进行评价, 以期为莫氏马尾藻多糖的研究和应用提供一定依据。
1 材料与方法
1.1 材料
莫氏马尾藻(Setch)采集自中国广东硇洲岛, 由广东海洋大学谢恩义教授鉴定并提供。原料经自来水洗涤, 除去泥沙, 干燥, 然后粉碎成藻粉保存备用。
单糖标准品: D-甘露糖(Man), L-鼠李糖(Rha), D-葡萄糖醛酸(GlcA), D-葡萄糖(Glc), D-半乳糖(Gal), D-木糖(Xyl), L-岩藻糖(Fuc), 2-脱氧核糖均购自Sigma公司。Folin 酚试剂购自北京鼎国昌盛生物技术有限公司。不同分子量右旋糖酐(dextran)购自中国药品生物制品检定所。活化部分凝血活酶时间(APTT)测定试剂盒, 凝血酶原时间(PT)测定试剂盒, 凝血酶时间(TT)测定试剂盒均购自南京建成有限公司。其余试剂均为国产分析纯。
BXM-30R立式压力蒸汽灭菌器(上海东亚压力容器制造有限公司); L2S可见分光光度计(上海仪电分析仪器有限公司); 高效液相色谱仪(日本岛津LC-20AT); 恒温水浴锅(天津泰斯特仪器有限公司); 旋转蒸发仪(无锡市星海王生化设备有限公司); SHZ-D(Ⅲ)循环水多用真空泵(郑州英峪领科仪器设备有限公司); 电热恒温鼓风干燥箱(上海精宏实验设备有限公司); BSA124S电子分析天平(北京赛多利斯科学仪器有限公司); L-550台式低速离心机(长沙湘仪离心机仪器有限公司)。
1.2 方法
1.2.1 莫氏马尾藻多糖的提取
莫氏马尾藻采用乙醇加热回流方法脱脂, 去除色素和小分子脂溶性物质, 固形物干燥后分别采用热水提取和稀酸提取两种方式提取莫氏马尾藻多糖。
(1) 热水提取: 料液比1︰30, 加压提取, 温度120℃, 提取时间4 h, 提取液进行硅藻土过滤、浓缩, 浓缩液中加入CaCl2溶液至浓度为0.2 mol/L, 离心去除褐藻胶沉淀, 上清液透析, 醇沉, 得到粗多糖SMP。
(2) 稀酸提取: 采用0.1 mol/L的稀盐酸进行搅拌提取, 料液比1︰15, 提取时间2 h, 提取液用氢氧化钠中和至pH5~7, 后续处理过程同热水提取, 得到酸提粗多糖SMP-A。
1.2.2 多糖分级纯化
粗多糖SMP和SMP-A分别通过DEAE-Sepharose Fast Flow阴离子交换柱层析进行分级纯化, 采用0~ 2 mol/L NaCl溶液梯度洗脱方式对获取的粗多糖进行分级纯化, 苯酚-硫酸法检测多糖浓度, 绘制浓度曲线, 收集分级组分, 减压浓缩后透析, 冷冻干燥, 得到纯化多糖组分。
1.2.3 低分子质量多糖样品制备及分级纯化
将粗多糖样品SMP采取自由基方式降解, 采用过氧化氢与抗坏血酸降解, 并对获取的降解组分采用DEAE-Sepharose Fast Flow弱阴离子柱层析进行分级。
1.2.4 理化性质分析
可溶性总糖: 苯酚-硫酸法[6]; 岩藻糖含量: 半胱氨酸盐酸盐法[7]; 硫酸根含量: 明胶-氯化钡法[8]; 糖醛酸含量: 咔唑比色法[9]; 多酚含量: 没食子酸-福林酚法[10]; 单糖组成分析: 1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生高效液相色谱法[11]; 分子质量分布分析: 高效凝胶色谱法, 色谱条件: 流动相为0.1 mol/L的Na2SO4溶液, 色谱柱为TSK Gel G3000 PWxl 柱, RI检测器。红外光谱测定: 采用溴化钾压片法, 在Nicolet iS10傅立叶变换红外光谱仪上进行测定。核磁分析: 将多糖(50 mg)与氘代水混合, 冷冻, 重复上述步骤两次, 再以氘代水溶解样品, 进行核磁共振波谱分析。
1.2.5 抗氧化活性研究
1.2.5.1 超氧阴离子自由基(O2.)清除能力采用邻苯三酚比色法[12]
于10 mL比色管中依次加入4.5 mL 0.1 mol/L Tris-HCl缓冲液(pH=8.2), 不同浓度的待测多糖溶液1 mL, 蒸馏水 2.4 mL, 混匀, 25℃下保温10 min后加入 0. 1 mL 6 mmol/L邻苯三酚, 计时, 摇匀, 准确反应3 min后, 加入10 mol/L HCl溶液0.1 mL, 终止反应, 以双蒸水为对照, 在325 nm下测定吸光值。
清除率计算公式为
清除率(%)=[1–(i–j)/0]×100
其中,0为用水代替多糖时测得的吸光值:i为不同多糖浓度下测得的吸光值;j为用水代替邻苯三酚时不同多糖浓度下测得的本底吸光值。
1.2.5.2 羟基自由基清除能力(.OH)采用硫酸亚铁-水杨酸法[12]
在10 mL的试管中依次加入6 mmol/L的FeSO4溶液1 mL、不同浓度的多糖溶液1 mL和6 mmol/L的H2O2溶液1 mL, 摇匀, 静置10 min, 再加入6 mmol/L的水杨酸溶液1 mL, 摇匀, 静置30 min后, 以双蒸水为对照, 于510 nm处测其吸光值。清除率计算公式为
清除率(%)=[1–(i–j)/0]×100
其中,0为用水代替多糖时测得的吸光值;i为不同多糖浓度下测得的吸光值;j为用水代替水杨酸时不同多糖浓度下测得的本底吸光值。
1.2.5.3 DPPH采用DPPH标准品-乙醇法测定
1 mL 0.1 mmol/L的DPPH乙醇溶液加入到不同浓度的样品溶液中(3 mL, 样品用50%乙醇溶解), 剧烈摇动, 室温放置20 min, 最后在517 nm测定。对照组, 采用50%乙醇替代样品液。
清除率(%)=(1–样/对照)×100
1.2.5.4 还原力的测定采用铁氰化钾-三氯化铁法
1.25 mL 铁氰化钾(1%)加入到不同浓度的样品溶液中(1 mL), 然后50℃水浴20 min, 加入三氯乙酸(2.5 mL)停止反应, 最后加入三氯化铁(1.5 mL), 振匀, 于700 nm测定吸光度。
1.2.6 抗凝血能力测定
活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)的测定严格按照试剂盒的说明书进行。
2 结果与讨论
2.1 理化性质分析
2.1.1 莫氏马尾藻粗多糖
通过热水提取及稀酸提取, 分别获取粗多糖SMP与SMP-A。水提及酸提粗多糖的差别主要在岩藻糖及硫酸根的含量上, 酸提多糖岩藻糖和硫酸根含量明显高于水提多糖, 从单糖组成分析, 二者单糖种类一样, 但是各单糖的含量则有所差异。水提多糖和酸提多糖的多酚含量均低于1%(分别为0.93%和0.66%), 见表1。
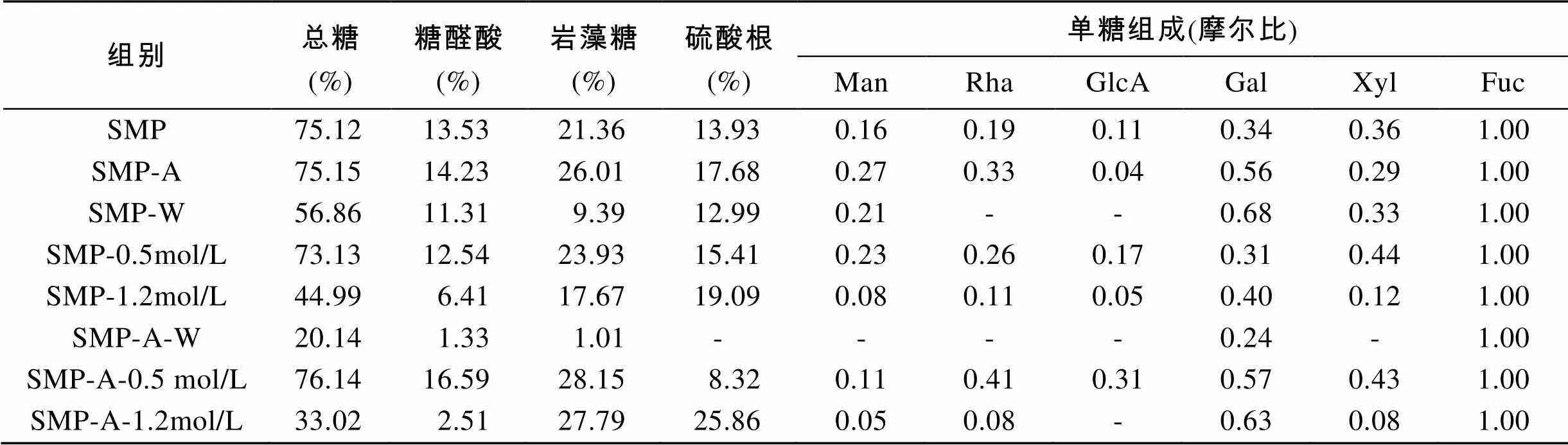
表1 莫氏马尾藻粗多糖及分级组分的化学组分分析
注: -表示未检出
2.1.2 粗多糖的分级纯化
通过DEAE-Sepharose Fast Flow阴离子交换柱, 采用0~2 mol/L NaCl溶液梯度洗脱方式对获取的粗多糖进行分级纯化, 水洗后的洗脱曲线图1所示。除上样后的水洗部分分别得到水洗组分(分别为SMP-W、SMP-A-W)外, 从图中可以看出, 二者的洗脱曲线类似, 均呈现一个主要的洗脱峰, 对应洗脱浓度为0.5 mol/L (分别为SMP-0.5 mol/L、SMP-A-0.5 mol/L),对主洗脱峰后的洗脱液收集后得到1.2 mol/L洗脱组分(分别为SMP-1.2 mol/L、SMP-A-1.2 mol/L), 对每一组分进行透析除盐、冷冻干燥, 最后样品分级的总回收率在70%左右; 其中0.5 mol/L洗脱组分含量最多, 为主要组分, 也是后期活性测定的主要组分。并对各分级组分进行相应的组成成分分析, 结果见表1。

图1 SMP与SMP-A洗脱曲线
根据所得数据分析可知, 0.5 mol/L洗脱组分是以岩藻糖为主, 单糖组成较复杂的硫酸化杂多糖, 含有少量的硫酸根。其中, SMP-A-0.5 mol/L的岩藻糖含量及半乳糖含量要高于SMP-0.5 mol/L, 这与其粗多糖的分析结果一致。SMP-A-W硫酸根和糖醛酸含量都很低, 基本为有岩藻糖和半乳糖组成的中性多糖, 而水提多糖SMP的水洗组分SMP-W组成更为复杂。1.2 mol/L洗脱组分均具有更高的硫酸根含量, 这也符合阴离子交换洗脱的规律。
2.1.3 水提粗多糖的降解
由于SMP分子质量超过800 kD, 为了评价分子质量大小对多糖SMP抗凝血活性的影响, 本研究采用自由基降解方法对SMP进行降解, 制备了重均分子质量为10 kD的水提多糖降解产物SMP-D, 并采用同样的阴离子交换方式进行分级处理, 获取其主要的分级组分SMP-D-0.5 mol/L, 二者的化学组分分析结果如表2所示。降解后多糖的分子质量明显降低, 其他单糖组成等指标没有明显变化。

表2 SMP降解产物及其分级组分理化性质分析
2.2 红外和核磁共振波谱分析
对获取的莫氏马尾藻多糖及其主要分级组分(0.5 mol/L洗脱组分)以及低分子量莫氏马尾藻多糖进行FT-IR分析, 红外谱图如图2所示。由红外谱图可知, 莫氏马尾藻粗多糖及其0.5 mol/L分级组分具有相似的官能团吸收峰; 其中SMP-0.5 mol/L与SMP-D-0.5 mol/L的IR谱图基本一致, 表明氧化降解没有破坏多糖的结构骨架。对谱峰分析结果为: 821 cm–1为C-2位硫酸根取代峰; 1 200 cm–1左右处为O=S=O; 1 417和1 602 cm–1为糖醛酸中C=O伸缩振动; 3 352 cm–1为糖残基中O-H的伸缩振动; 1 027 cm–1是糖苷键的C-O-C伸缩振动。表明其为典型的硫酸化多糖。

图2 莫氏马尾藻多糖的红外谱图
由于粗多糖结构复杂, 其核磁共振谱图难以辨析, 因此需要对多糖进行一定处理方可进行相关谱图分析。作为莫氏马尾藻多糖的主要分级组分, 多糖SMP-D-0.5 mol/L分子质量相对较低、且多糖理化指标具有一定的代表性, 因此以组分SMP-D-0.5 mol/L为基础, 对多糖的结构进行初步研究。图3所示为SMP-D-0.5 mol/L的13C-NMR谱图。由于SMP-D- 0.5 mol/L为多种单糖组成的杂多糖, 无论是90×10–6~105×10–6的异头碳区域, 还是60×10–6~90×10–6的C2- C5信号区域, 都非常复杂, 单凭一维碳谱难以辨识每个信号归属。176×10-6区域的信号说明该多糖含有一定的糖醛酸, 而15×10–6~17×10–6的岩藻糖C-6甲基信号非常明显。结合红外谱图及核磁共振谱图, 并参考相应的理化数据可知, 莫氏马尾藻多糖是以岩藻糖为主, 硫酸根主要在C2的含有少量糖醛酸的结构复杂的多糖。
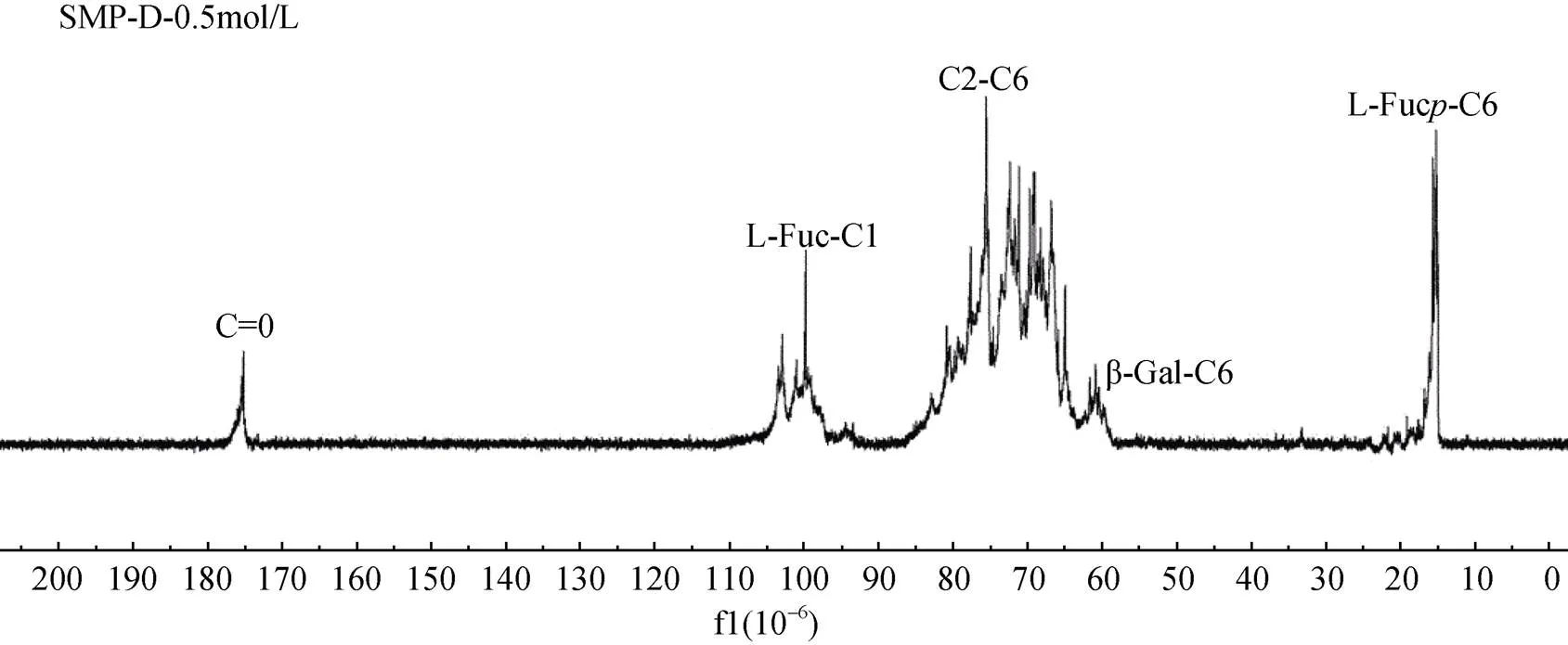
图3 SMP-D-0.5 mol/L碳核磁共振谱图
2.3 活性测定
通过理化性质分析, 粗多糖SMP、SMP-A及其0.5 mol/L分级组分(即SMP-0.5 mol/L、SMP-A-0.5 mol/L)的总糖含量较高, 而两种粗多糖对应的水洗组分及1.2 mol/L组分总糖含量较低, 且回收得率较高, 因此在活性测定方面选取总糖含量及得率相对较高粗多糖SMP、SMP-A及其0.5 mol/L分级组分(SMP-0.5 mol/L、SMP-A-0.5 mol/L)进行相关活性测定。
2.3.1 抗氧化活性
以抗坏血酸Vc作为阳性对照, 分别测定样品SMP、SMP-A、SMP-0.5 mol/L及SMP-A-0.5 mol/L的抗氧化能力。莫氏马尾藻多糖清除超氧阴离子自由基的结果见图4, 可以看出, 莫氏马尾藻多糖清除超氧阴离子自由基的能力较Vc弱, 但是随着浓度增加, 其清除能力逐渐增强, 在浓度达到0.4 g/L时趋于稳定, 且清除率均达到50%以上; 且在相同浓度下, 其清除能力大小为Vc>SMP-A-0.5 mol/L>SMP- 0.5 mol/L>SMP>SMP-A。
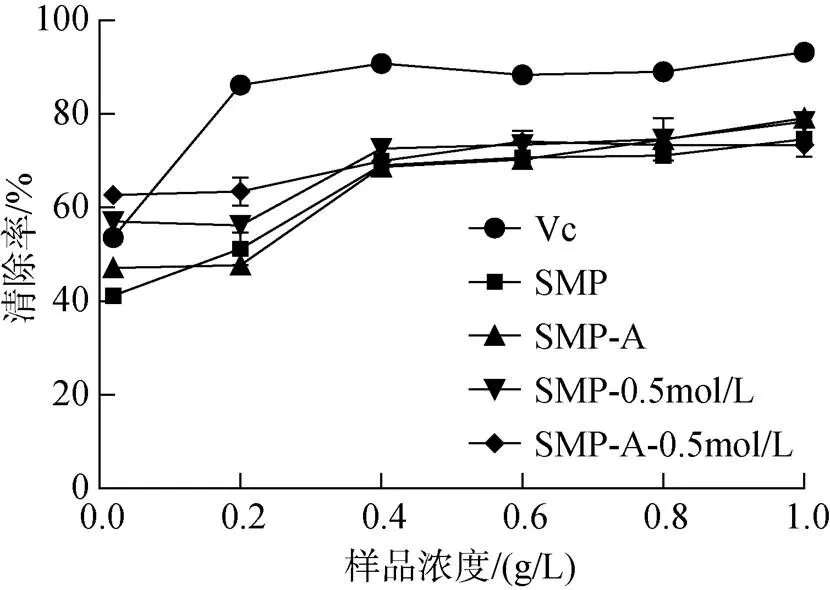
图4 莫氏马尾藻多糖对超氧阴离子自由基的清除作用
莫氏马尾藻多糖对羟自由基的清除作用见图5。由图5可知, 水提粗多糖SMP及其分级组分SMP- 0.5 mol/L对羟基自由基的清除能力较Vc强, 而酸提粗多糖SMP-A及其分级组分SMP-A-0.5 mol/L的清除能力则较Vc要弱; 但是都具有浓度依赖性。且在一浓度下, 其清除能力大小为SMP>SMP-0.5 mol/L> Vc>SMP-A>SMP-A-0.5 mol/L。
莫氏马尾藻多糖组分对DPPH的清除作用见图6(数据SD值小于0.01, 无法在图中显示)。四种多糖对DPPH自由基的清除能力均弱于Vc, 且在浓度达到5 g/L时, 四种多糖的清除能力仍小于50%。但是, 对于DPPH自由基的清除能力均有浓度依赖性。且在相同浓度下, 其清除能力大小为Vc>SMP>SMP- 0.5 mol/L>SMP-A>SMP-A-0.5 mol/L。

图5 莫氏马尾藻多糖对羟基自由基的清除作用
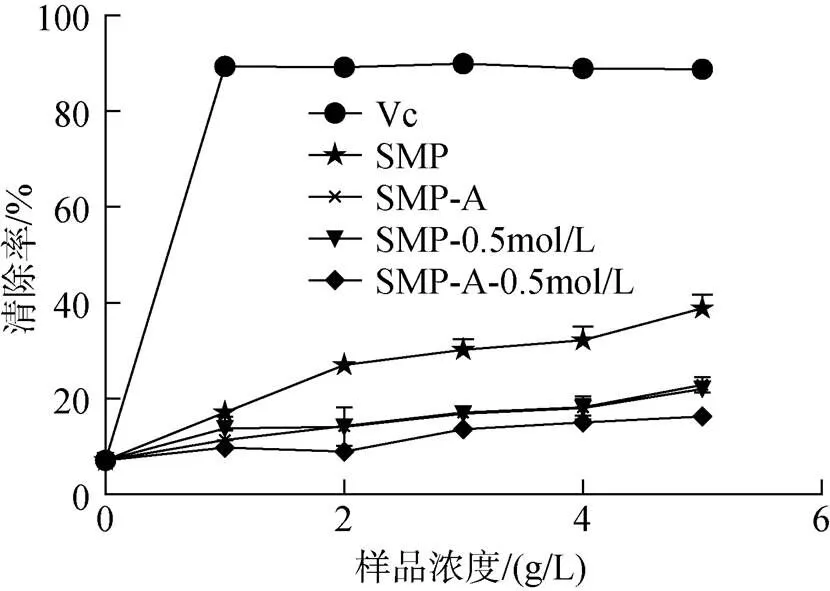
图6 莫氏马尾藻多糖的对DPPH自由基的清除作用
还原能力实验主要用于测定样品对三价铁和铁氰化物的还原能力, 作为抗氧化能力的一个重要指标; 且在700 nm的吸光度越大, 代表还原能力越强。由图7可知, 四种多糖的还原能力均随着浓度增大而逐渐增强, 但是却弱于维生素C(在该浓度范围下, Vc的吸光度已超出范围; 且数据SD值小于0.01, 无法在图中显示)。在相同浓度下, 其清除能力大小为SMP>SMP-0.5 mol/L>SMP-A>SMP-A-0.5 mol/L。
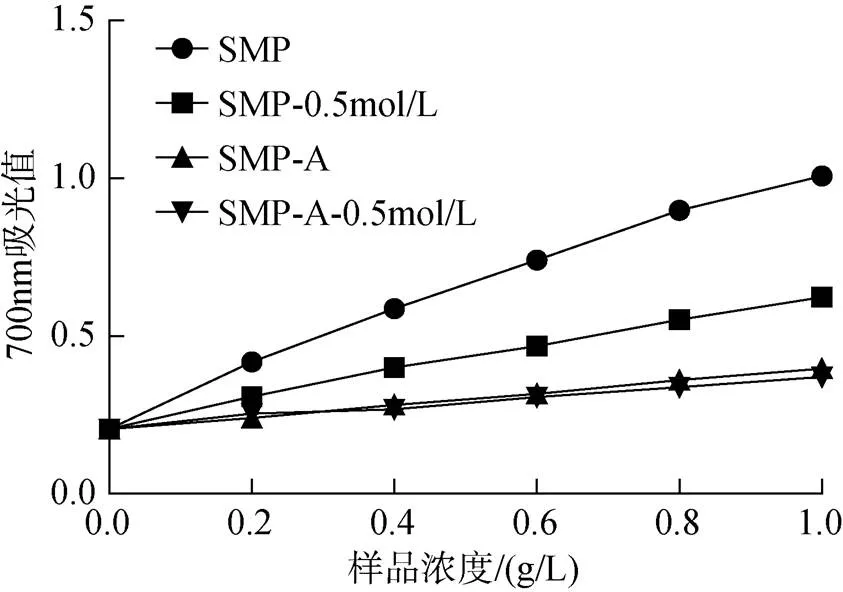
图7 莫氏马尾藻多糖的还原能力
通过对四种多糖在清除自由基能力方面的测定发现, 四种多糖均具有一定的抗氧化能力, 且随着浓度增加逐渐增强, 这与王晶、金维华等[13-15]对于海藻多糖抗氧化能力的研究结果一致。从结果中可以发现, 水提莫氏马尾藻多糖及其分级组分的清除自由基及还原能力较酸提多糖及其分级组分要强。
2.3.2 抗凝血活性
以生理盐水为阴性对照, 肝素钠(HP)为阳性对照, 测定了几种多糖及降解后的低分子量多糖的抗凝血活性。同时, 对其他褐藻多糖的研究表明分子质量对多糖抗凝血活性有一定影响, 因此为评价分子质量大小对多糖SMP抗凝血活性的影响, 利用氧化降解方法制备粗多糖SMP的降解物SMP-D, 并对其抗凝血活性进行测定。
通过实验发现, 各种多糖的APTT及TT测试中与浓度呈现一定的正相关(谱图较多, 未放入), 但是PT实验中凝血时间长短与浓度则没有相关性。故对每一种多糖选取了0.5 g/L的浓度进行比较其抗凝血能力强弱。结果如图8-10所示。
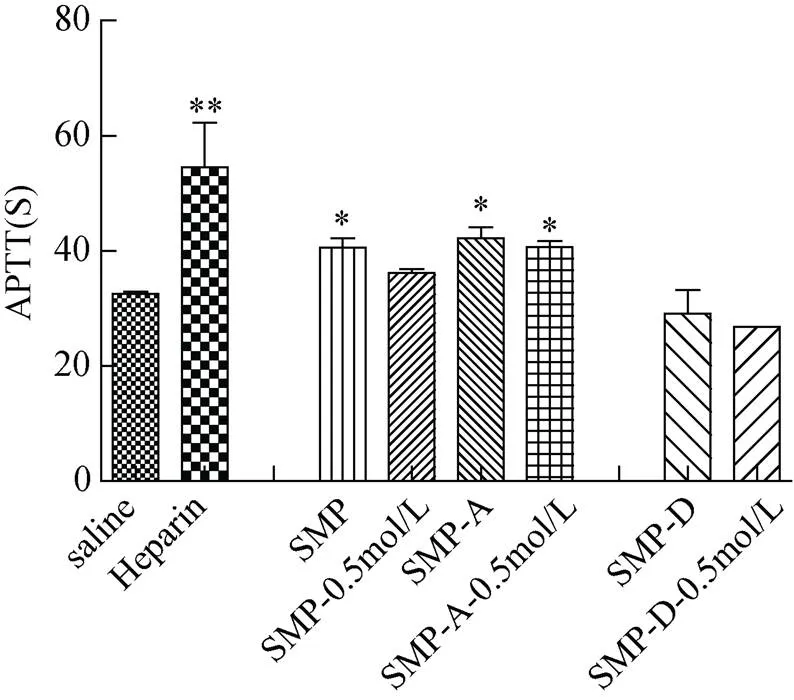
图8 不同莫氏马尾藻多糖的活化部分凝血酶时间(**. P< 0.01, *. P<0.05)
由图8可知, 在样品浓度为0.15g/L时, 样品的凝血时间均短于肝素钠, 即抗凝效果要弱于肝素钠。但是与生理盐水组相比较, 除了低分子量多糖及其分级组分外, 其余四种多糖的凝血时间均大于生理盐水组, 其中SMP、SMP-A及SMP-A-0.5 mol/L与生理盐水对照组相比差异性显著, 说明未降解的四种多糖组分具有一定的延长活化部分凝血酶时间的作用。由图9 可知, 与生理盐水相比, 六种多糖组分在凝血酶时间的测定时, 未显现出明显差别, 只有细微的区别。由图10 可知, 六种多糖组分在凝血酶原时间的测定时, 与生理盐水组相比, 没有较明显差别, 即对于延长凝血酶原时间无效。

图9 不同莫氏马尾藻多糖的凝血酶时间(**. P<0.01, *. P<0.05)
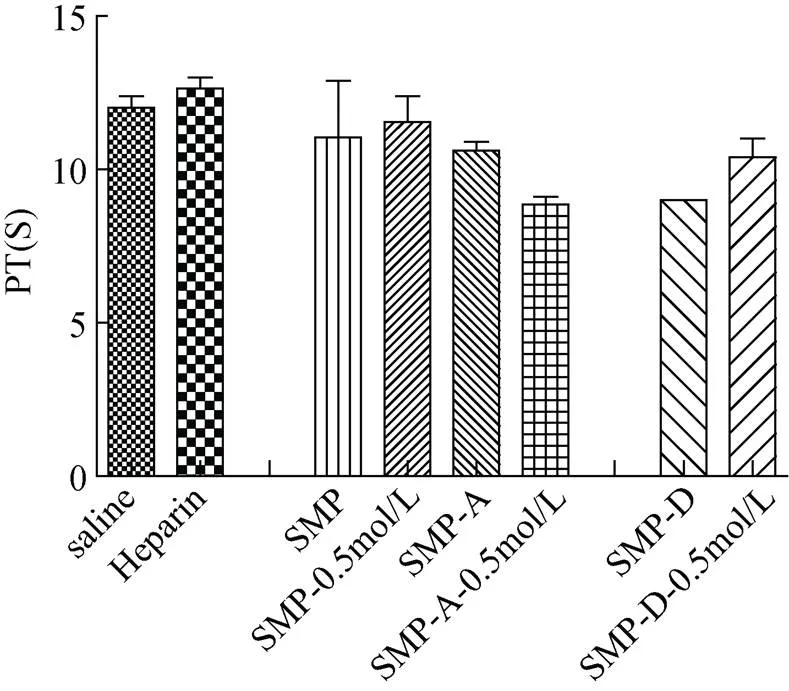
图10 不同莫氏马尾藻多糖的凝血酶原时间(**. P<0.01, *. P<0.05)
通过上述实验数据分析可知, 大分子质量的莫氏马尾藻多糖对于延长活化部分凝血酶时间(APTT)具有良好的作用, 但是对于凝血酶原时间(PT)则无效。而低分子质量的多糖及其分级组分在三种实验中均没有表现出效果, 说明抗凝血作用与分子质量大小相关, 分子质量太小, 影响抗凝血活性, 这与于广利等的研究结果一致[16-18]。
APTT时间的延长说明样品抑制了内源性凝血系统, TT时间的延长说明样品抑制了凝血酶活性或纤维蛋白的聚合作用, 而PT时间延长则说明样品抑制外源性凝血系统。在本实验中, 样品可显著延长APTT, 但是对于PT则没有效果, 说明莫氏马尾藻多糖的抗凝血作用主要是通过抑制内源性凝血系统起作用的, 这与刘雪莲等对于海藻多糖的抗凝血活性研究结果一致[19-21]。
3 结论
通过热水提取和稀酸提取获得的莫氏马尾藻粗多糖, 并对其进行分级纯化。结果表明, 莫氏马尾藻多糖是以岩藻糖为主, 含有糖醛酸及多种单糖的结构较复杂的硫酸化多糖。
莫氏马尾藻多糖具有良好的抗氧化和抗凝血活性。其抗氧化能力与浓度呈现正相关, 且水提多糖的抗氧化能力要强于酸提多糖。抗凝血主要是通过抑制内源性凝血途径起抗凝血作用的, 并且与分子量呈正相关。本文研究结果表明莫氏马尾藻多糖可以作为良好的抗氧化和抗凝血剂, 具有较好的药用开发前景。
[1] 曾呈奎, 陆保仁. 中国海藻志: 第三卷, 第二册-褐藻门, 墨角藻目[M]. 北京: 科学出版社, 2000: 75-77. Zeng Chengkui, Lu Baoren. Chinese seaweed: the third volume, the second volume-brown algae, Mexican algae order[M]. Beijing: Science Press, 2000: 75-77.
[2] 贾柽, 杨彬, 谢恩义. 莫氏马尾藻繁殖生物学初步研究[J]. 水产科学, 2012, 31(10): 616-619. Jia Cheng, Yang Bin, Xie Yien. Reproductive Biology of Seaweed Sargassum moclurei[J]. Fisheries Science, 2012, 31(10): 616-619.
[3] 卢虹玉, 刘义, 邵海艳, 等. 莫氏马尾藻() 褐藻多酚的抗氧化和抗肿瘤细胞增殖作用[J]. 食品科学, 2012, 33(23): 104-105.Lu Hongyu, Liu Yi, Shao Haiyan, et al. Antioxidant and antiproliferative effects of phlorotannins from[J]. Food Science, 2012, 33(23): 104-105.
[4] 李来好, 杨贤庆, 吴燕燕, 等. 马尾藻的营养成分分析和营养学评价[J]. 青岛海洋大学学报: 自然科学版, 1997, 27(3): 319-325. Li Laihao, Yang Xianqing, Wu Yanyan, et al. Analysis of nutritive composition inand its evaluation in nutriology[J]. Journal of Ocean University of Qingdao, 1997, 27(3): 319-325.
[5] 傅明辉, 佘纲哲. 亨氏马尾藻多糖的分离、纯化和鉴定[J]. 中国生化药物杂志, 2000, 21(2): 66-68. Fu Minghui, She Gangzhe. Isolation, purification and identification of polysaccharides from[J]. Chinese Journal of Biochemical and Pharmaceuticals, 2000, 21(2): 66-68.
[6] Smith F, Gilles M A, Hamilton J K, et al. Colorimetric method for determination of sugar related substances[J]. Anal Chem, 1956, 28(3): 350-356.
[7] Gibbons M N. The determination of methylpentoses[J]. Analyst, 1955, 80(949): 268-276.
[8] Kawai Y, Seno N, Anno K. A modified method for chondrosulfatase assay[J]. Analytical Biochemistry, 1969, 32(2): 314-321.
[9] Bitter T, Muir H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330- 334.
[10] Li X, Lin J, Gao Y, et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal, 2012, 6(1): 140-141.
[11] Zhang J, Zhang Q, Wang J, et al. Analysis of the monosaccharide composition of fucoidan by precolumn derivation HPLC[J]. Chinese Journal of Oceanology and Limnology, 2009, 27: 578-582.
[12] 王雪艳, 陈发河, 吴光斌, 等. 龙眼多糖清除自由基活性的研究[J]. 集美大学学报 (自然科学版), 2010, 15(2): 109-114. Wang Xueyan, Chen Fahe, Wu Guangbin, et al. Study on free-radical scavenging activities of polysaccharide extracts from Longan[J].Journal of Jimei University (Natural Science), 2010, 15(2): 109-114.
[13] 张胜帮, 麻卫锋, 于萍. 羊栖菜多糖提取分离及其清除自由基的活性研究[J]. 食品科学, 2009, 30(18): 192-195. Zhang Shengbang, Ma Weifeng, Yu Ping. Extraction, purification and hydroxyl radical scavenging activity of polysaccharides from[J]. Food Science, 2009, 30(18): 192-195.
[14] Wang J, Zhang Q, Zhang Z, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132.
[15] Jin W, Zhang W, Wang J, et al. The neuroprotective activities and antioxidant activities of the polysaccharides from[J]. International Journal of Biological Macromolecules, 2013, 58: 240-244.
[16] Wu J, Zhang M, Zhang Y, et al. Anticoagulant and FGF/FGFR signal activating activities of the heparinoid propylene glycol alginate sodium sulfate and its oligosaccharides[J]. Carbohydrate Polymers, 2016, 136: 641-648.
[17] 张喆迩, 刘雪莲, 杨靖亚, 等. 羊栖菜硫酸多糖的抗凝血活性研究[J]. 安徽农业科学, 2008, 36(18): 7505- 7508. Zhang Zheer, Liu Xuelian, Yang Jingya, et al. Study on anticoagulant activity of sulfated Polysaccharides from[J]. Journal of Anhui Agricultural Sciences, 2008, 36(18): 7505-7508.
[18] Ustyuzhanina N E, Bilan M I, Gerbst A G, et al. Anticoagulant and antithrombotic activities of modified xylofucan sulfate from the brown alga[J]. Carbohydrate Polymers, 2016, 136: 826-833.
[19] Jin W, Zhang Q, Wang J, et al. A comparative study of the anticoagulant activities of eleven fucoidans[J]. Carbohydrate Polymers, 2013, 91(1): 1-6.
[20] 王静凤, 张学成, 姜国良, 等. 枝管藻多糖的提取及其抗凝血活性的初步研究[J]. 青岛海洋大学学报: 自然科学版, 2003, 33(1): 75-79. Wang Jingfeng, Zhang Xuecheng, Jiang Guoliang, et al. Preliminary studies on the extraction of polysaccharide fromand its anti-coagulation activity[J]. Journal of Ocean University of Qingdao, 2003, 33(1): 75-79.
[21] Li Q, Zeng Y, Wang L, et al. The heparin-like activities of negatively charged derivatives of low-molecular- weight polymannuronate and polyguluronate[J]. Carbohydrate Polymers, 2017, 155: 313-320.
(本文编辑: 康亦兼)
Isolation and Characterization of polysaccharides from
HOU Ning-ning1, 2, WANG Jing1, ZHANG Quan-bin1
(1. Key Laboratory of Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Polysaccharides were extracted fromby hot water and diluted acid. Subsequently, they were fractionated by an anion exchange column chromatography. The physicochemical properties and structural features of the polysaccharides were elucidated based on HPLC, FT-IR, NMR, and other chemical analyses. Moreover, the antioxidant and anticoagulation activities were examined in vitro. The results showed that the polysaccharides fromwere a type of sulfated polysaccharides, composed mainly of fucose, with some uronic acid. The in vitro antioxidation experiment indicated that thepolysaccharides had good antioxidant activity and a strong ability to scavenge free radicals. Additionally, the anticoagulant assay indicated that the polysaccharides could inhibit the intrinsic pathways.The results that are presented in this study demonstrate the potential use of polysaccharides as antioxidants and anticoagulants.
; polysaccharides; fucose; antioxidant activity; anticoagulant activity
Feb. 18, 2017
侯宁宁(1991-), 女, 山东寿光人, 研究方向: 海藻化学及海洋药物, 电话: 0532-82898708, Email: houningning14@mails.ucas.ac.cn; 张全斌,
, 博士生导师, 研究员, 研究方向: 海藻化学与海洋药物, 电话: 0532-82898708, Email: qbzhang@qdio.ac.cn
A
1000-3096(2017)09-0102-08
10.11759/hykx20170218001
2017-02-18;
2017-04-25
山东省重点研发计划(海洋医用食品)(2016YYSP002); 国家海洋公益性行业科研专项(201405040)
[The Key Research and Development Project of Shandong province, No.2016YYSP002; Marine Scientific Research in the Public Interest, No.201405040]
