三角褐指藻紫外线诱变及高产EPA藻株选育
2017-03-26刘红全潘艺华林小园李洁琼卢恩秋
刘红全, 潘艺华, 林小园, 李洁琼, 袁 莎, 卢恩秋
三角褐指藻紫外线诱变及高产EPA藻株选育
刘红全, 潘艺华, 林小园, 李洁琼, 袁 莎, 卢恩秋
(广西民族大学 海洋与生物技术学院, 化学与生物转化过程新技术广西高校重点实验室, 广西 南宁 530006)
利用紫外诱变法对三角褐指藻()进行诱变育种。实验得到三角褐指藻的最佳紫外辐射剂量为18 W的紫外灯距离藻液35 cm照射15 min。通过单细胞分离技术获得1株突变株UP1, 与出发藻株相比, 突变株UP1的EPA产量提高10.2%。研究了诱变株的最适生长及产EPA的条件, 结果表明UP1在NaNO375 mg/L, pH 7.5, 昼夜温度17~15℃, 接种量为10%时培养7天, 具有最大的生长速率和EPA产量。探讨了诱变株的遗传稳定性, 结果表明诱变株可稳定遗传。
三角褐指藻(); 紫外诱变; EPA; 培养条件; 遗传稳定性
三角褐指藻()是一种真核海洋单细胞硅藻, 光合作用极强, 是重要的光能转换器, 在海洋生态系统中处于重要的营养级别[1]。由于海洋微藻富含各种营养物质及代谢产物被作为潜在的巨大资源, 应用于工业各个领域。三角褐指藻能够大量合成并积累PUFAs, 特别是EPA, 有望作为工业化生产EPA的来源[2]。微藻PUFAs的积累量不仅与培养条件有关, 还受藻种自身遗传决定。目前对三角褐指藻产脂肪酸培养条件的研究见诸多报道[3-4],但在藻种的诱变改良方面的研究相对较少[5]。目前, 生产采用的藻种多直接从自然界分离获得, 性状单一, 藻种易退化, 微藻的产量及生物活性物质无法满足人们日益增长的需求[6]。因此利用海洋微藻的育种技术, 改良微藻品质, 培养出生长快速, EPA产量高的新品种迫在眉睫。
紫外辐射是一种最常用有效的物理诱变方法, 其诱变效应是引起物种的DNA结构改变而形成突变型[7]。研究表明中波长的紫外辐射对微藻的光合作用、细胞分裂及不饱和脂肪酸的产量具有促进作用[8]。Liang等[5]研究结果表明, 三角褐指藻通过紫外辐射能显著提高不饱和脂肪酸的含量, 尤其是EPA的含量。本实验用紫外线照射对三角褐指藻进行诱变, 以期筛选出生长速度快, EPA含量高的株系。
1 材料与方法
1.1 藻种
试验所用的三角褐指藻购买于武汉中国科学院水生生物研究所。
1.2 培养条件
250 mL的三角瓶内装100 mL的培养液, 于121 ℃高压灭菌20 min。培养温度(24±1)℃, 光照强度(4×40 W日光灯照射), 光暗周期为12 h/12 h。培养液采用F/2配方配制, 人工海水的配方参考陈百灵[9]的稍作改进。每天振摇2~3次, 藻悬液长到指数生长后期时, 用于试验。
0.5 mg/mL尼罗红溶液配置[10]: 称取0.01 g尼罗红粉末溶于20 mL丙酮, 配置得到0.5mg/mL的尼罗红溶液, 在1mL的藻液中(细胞密度为106个/mL)加入染色液20 μL。
1.3 紫外线的诱导突变
1.3.1 紫外线诱变预实验
取对数生长期的藻液6 mL置于 9 cm 培养皿底部铺一薄层, 距离18 W 的紫外灯35 cm进行不同时间的照射, 时间梯度为 : 0、5、10、15、20和30 min, 设置 3 个平行样。诱变后, 置于暗环境中培养12 h, (避免光修复), 再转至光照环境中培养。第3天待藻细胞死亡率稳定后, 统计其死亡率。将恢复生长后的藻液进行扩大培养, 测定比生长速率, 及粗脂肪含量, 确定合适的诱变剂量。
1.3.2 紫外线诱变及突变株的筛选
以预试验中确定的诱变剂量对出发株诱变。诱变后将全部藻液转移到50 mL三角瓶中, 遮光12 h, 3 d后将藻液涂布在固体培养基上, 12 d后挑取体积较大、颜色较纯的藻落200株于50 mL的培养液中。比较藻液颜色、是否贴壁筛选30株, 接种到150 mL培养液中培养, 2个平行样。以未经诱变的藻液为对照, 每隔一天计算细胞密度, 10 d后离心, 干燥, 测定脂肪酸。以C0为对照组, 根据终细胞密度及脂肪酸含量选育一株优良藻株, 进行后续工作。
1.4 致死率的计算
待藻液死亡细胞稳定后用血球计数板记录各组存活细胞数量, 按下面公式进行计算:
致死率(%)=(1–处理组存活细胞数/对照组细胞数)×100
1.5 脂肪酸含量的初步测定——尼罗红染色法
尼罗红是一种脂溶性荧光染色剂, 通过染色选择合适的而激发波长和自发波长可测定细胞内的油脂含量, 细胞经染色后的荧光强度与细胞内油脂含量显著相关[11]。取1mL细胞密度为106个/mL的藻液, 加入尼罗红染料(0.5 mg/mL)20 μL于40℃孵育10 min, 将染好颜色的藻细胞滴入载玻片中, 于荧光显微镜下进行观察细胞中脂滴的大小和数量[12]。
1.6 培养条件的优化
1.6.1 NaNO3对诱变株生长及产EPA的影响
NaNO3设置6个梯度: 0、37.5、75、102.5和150 mg/L, 其余培养条件不变。每个梯度设置3个平行样, 隔天测细胞密度, 求平均值, 实验重复2次。
1.6.2 pH对诱变藻株生长及产EPA的影响
pH设置5个梯度: 6.5、7.0、7.5、8.0、8.5, 其余培养条件不变。每个梯度设置3个平行样 , 隔天测细胞密度, 求平均值, 实验重复2次。
1.6.3 温度对诱变藻株生长及产EPA的影响
温度设置5个梯度: 17、20、23、25、27和30℃, pH为7.5, 其余培养条件不变。每个梯度设置3个平行样, 隔天测细胞密度, 求平均值, 实验重复2次。
1.6.4 环境条件的正交试验对诱变藻株生长及产EPA的影响
根据微藻生长及产EPA的条件差异, 选择合适的培养条件, 通过正交试验筛选出培养条件的优化组合, 正交试验表如下。
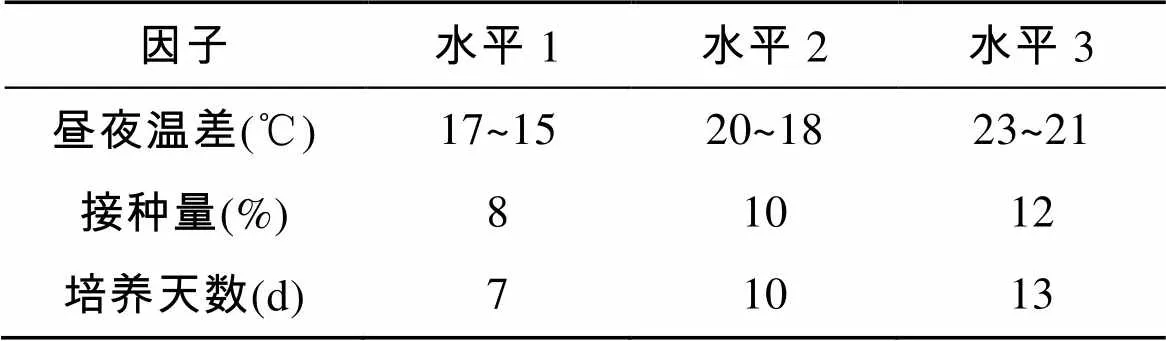
表1 试验因子及其水平
pH为7.5, 其余培养条件不变。每个试验重复3次, 隔天测细胞密度, 求平均值。
1.7 遗传稳定性分析
将筛选得到的诱变株连续转接6代, 测定第一代和第六代的EPA含量, 看是否能稳定遗传。
1.8 不饱和脂肪酸的提取及气相谱测定
1.8.1 采用甲醇—氯仿提取法
参考姚领等[13]采用氯仿–甲醇混溶液(2︰1,/)超声提取粗脂肪酸, 将粗提液加入3 mL1 mol/L的KOH–CH3OH混溶液于75℃水浴中皂化, 最后用正己烷萃取上机气相色谱测定。
1.8.2 脂肪酸的色谱测定法
采用日本岛津的气相色谱仪, 60 m×0.32 mm× 0.25 μm石英毛细管柱, 汽化室和检, 测器的温度均为250℃, 色谱柱的升温程序: 初始70℃, 以30 ℃/min的速率升温至150℃, 然后以5 ℃/min升温到250℃, 保持到所测样品的峰值都出现。载气为高纯N2, 流速30 mL/min, H2流速为40 mL/min, 空气流速为450 mL/min, 分流比为l︰60, 进样量1μL。通过与标准脂肪酸保留时间的对比鉴别各脂肪酸组分, 面积归一化法计算出各脂肪酸的相对含量。
2 实验结果与分析
2.1 紫外线对三角褐指藻诱变的实验结果
在紫外线的照射下, 随照射时间的延长藻液颜色逐渐变浅, 活细胞数也随照射时间的延长而降低。当照射15~20 min时藻液变为浅色且有混浊白色, 而照射30 min后的藻液出现白色糁状固体。待藻细胞死亡率稳定下来, 统计其死亡率(图1)。
由图1可看出, 辐射时间从15 min增至20 min时, 藻细胞死亡率倍增, 说明此时的辐射量是处于多数细胞的敏感区域与耐受极限。经紫外诱变处理后的三角褐指藻生长受到抑制, 恢复生长的速度缓慢, 当照射30 min后几乎不生长。为了获得较多的突变型, 又不因辐射剂量过大造成大部分细胞死亡而残留一些不活跃的细胞, 同时根据恢复生长后测得的比生长速率及EPA含量, 本实验认为三角褐指藻的最佳辐射条件为在18 W紫外灯的照射下, 距离 35 cm照射15 min。

图1 紫外照射下三角褐指藻的致死率
2.2 诱变后优良藻株的选育
2.2.1 尼罗红染色进行初筛
尼罗红是一种亲脂性的恶嗪类荧光染料, 能与脂类物质结合, 在一定的激发波长下能发射脂特异性荧光, 通过检测脂荧光强度可以对细胞中的油脂进行定量分析。利用荧光显微镜观察比较细胞内油珠的大小、数量, 荧光强度可以判断微藻油脂含量高低。尼罗红染色法可以作为富油微藻初筛的指标, 简便快速。对分离得到的微藻进行尼罗红染色, 观察荧光强度。
由图2可看出筛选得到的诱变藻株细胞和脂肪粒都比出发藻株大, 尤其细胞内脂肪粒明显增多, 根据激发出的荧光强度可以初步判定诱变株的总脂肪酸含量要高于对照组。这与气象色谱测定的脂肪酸含量提高相一致。

图2 诱变藻株油脂的荧光定性分析(10×20倍)
2.2.2 通过比生长速率及EPA含量进行筛选
经过预实验的最佳诱变剂量诱变后, 利用单细胞分离技术筛选得到1株生长较快, 脂肪酸含量较高的藻株, 以诱变剂名称及微藻名称的首字母命名为UP1。其EPA质量比及比生长速率分别见图3和图4。

图3 诱变后选育藻株的EPA质量比
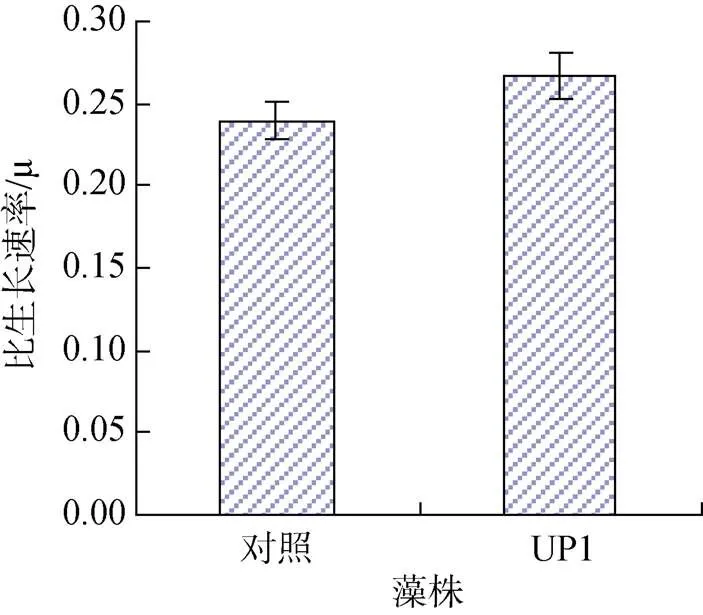
图4 诱变后选育藻株的比生长速率
由图3中可看出选育出的藻株EPA质量比明显高于对照组, 为23.53 mg/g, 比对照组提高了10.2%。由图4可看出EMS诱变后的微藻生长受到轻微抑制, 比生长速率略低于对照组。
2.3 对选育出的藻株进行培养条件的优化
2.3.1 氮源对诱变藻株产EPA的影响
氮源是海洋微藻生存的必需营养盐, 不仅影响细胞的生长速度, 而且严重影响细胞内活性物质的合成积累。本实验考察了氮源浓度对诱变藻株产EPA的影响, 结果见图5。
由图5可知在一定质量浓度范围内随氮源含量的增加脂肪酸积累量增大, 在NaNO3质量浓度为75 mg/L时, EPA的积累量达到最大, 此后随NaNO3质量浓度增加, EPA含量降低。这与Mujtaab[14]研究的相一致较低的氮源浓度有利于脂肪酸的积累。通过方差分析(=0.096)发现氮源对UP1产EPA的影响不是很显著。

图5 NaNO3对三角褐指藻诱变株产EPA的影响
2.3.2 pH对诱变藻株产EPA的影响
pH对海洋微藻的生长及生化组分的有着重要的影响作用。有些研究者认为pH 会影响藻细胞在光合作用中对CO2及有机碳源的利用效率, 并在培养基中影响微藻细胞对离子的吸收和利用[15]。本实验的pH值试验结果见图6。
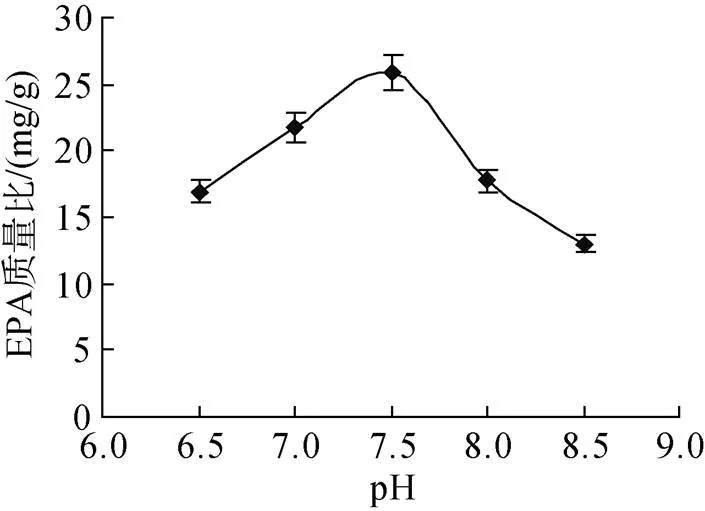
图6 pH对UP1产EPA的影响
由图6可看出诱变株产EPA的最适pH值为7.5。在此pH条件下UP1 EPA产量为25.87 mg/g, 通过方差分析得到值小于0.05, 说明pH对微藻EPA的产量影响呈显著性差异。
2.3.3 温度对诱变藻株产EPA的影响
海洋微藻的较适生长温度一般在20~30℃, 但低温有利于提高不饱和脂肪酸含量, 以增加膜的流动性[16]。结果见图7。
由图7可看出低温更有利于三角褐指藻EPA的积累, 在30℃条件下三角褐指藻几乎不生长, EPA产量低。筛选获得的诱变藻在20℃条件下EPA质量比最高, 为 22.59 mg/g。通过方差分析发现温度对EPA的产量影响差异性不显著(= 0.89)。

图7 温度对UP1产EPA的影响
2.3.4 环境条件的正交组合对诱变藻株产EPA的影响
不同的培养条件对微藻中EPA含量的影响见直观分析表2。根据表2中R值得到, 影响UP1产EPA的因素主次顺序: 接种量>培养天数>昼夜温度, 其最优化组合为: 17~15 ℃、接种量10%、培养7 d。由此可看出较低温及短时间培养更有利于三角褐指藻积累EPA。
2.4 遗传稳定性分析
鉴于诱变藻株的性状常常不稳定, 尤其是在连续继代培养时, 为了检测所得藻株的性状是否稳定, 在同样的培养条件下连续转接6代, 测定第一代和第六代的EPA含量, 结果见图8。
由图8可看出诱变株第一代和第6代的EPA产量变化不显著(=0.16), 说明选育的变异藻种具有良好的遗传稳定性。
3 讨论
近年来随着生物技术的发展, 微藻的商业化开发不再局限于只作为海产养殖的食物饵料, 还广泛应用于食品, 医药保健, 化妆品等领域。但微藻的应用价值需依赖于藻种的生理遗传稳定性及生产活性物质的高效性。目前已从自然界中分离得到几种较好的生产藻种[17-18], 但在长期培养下, 易退化, 活性物质的产量降低。因此需做大量工作, 在现有的藻种资源中选育出更多的优良藻种。紫外线辐照作为最常用, 成本最低的遗传育种方法, 已广泛应用微藻的诱变育种中。周玉娇等[19]采用紫外线对小球藻 Y019 进行诱变, 筛选获得M37 和 M67 两个高含油量株系, 油脂含量分别提高了24.58%、17.88%。张学成等[20]采用紫外线诱变小球藻, 筛选得到突变株M51、M59、M73, 其生长速率比出发藻株分别提高了6.23%、3.8%、5.92%, 蛋白含量提高约2.5%。本文采用18 w的紫外辐射对三角褐指藻进行诱变, 筛选得到1株油脂产量较高的藻株命名为UP1, 其EPA产量为23.53 mg/g, 比对照组提高了10.2%。

表2 培养条件对UP1产EPA的影响正交试验结果及直观分析

图8 诱变藻株第1代与第6代的EPA含量比较
海洋微藻的脂肪酸组分及产量不仅与藻种自身有关, 还受生长的环境条件影响, 如培养基组分, CO2的通气量, 光照辐射量及温度等密切相关, 其中氮源及磷酸盐作为基础元素, 对微藻的生长及脂肪酸的积累有直接的影响。大量研究表明, 氮源缺乏会减少微藻细胞的蛋白质含量, 而增加脂肪酸和碳水化合物的含量 [21-22]。因为在氮源不足时, 细胞的蛋白合成和增殖分裂活动均受到抑制, 而不断吸收的多余碳源就转化为脂肪酸贮存在细胞中。Piorreck等[23]报道三角褐指藻和杜氏藻在缺氮的情况下, 有利于脂肪酸的积累。在本试验中诱变株UP1在不同氮浓度的培养基中, 随着氮浓度的升高, 油脂积累量逐渐下降, 在NaNO3为75 mg/L时EPA产量最大, 与前人的实验结果基本一致[24]。微藻的生长及油脂积累也随pH不同呈现差异。pH通过影响细胞内代谢酶活性和对离子的吸收作用从而影响微藻的生长代谢。本实验得到三角褐指藻的产EPA的较适pH 为7.5, 这与Pahl等的研究一致, 硅藻的最适生长 pH 为7.2~8.1[25]。在实验中发现三角褐指藻生长和产EPA的温度比小球藻的要低, 在高于27℃以上, 三角褐指藻几乎不生长。这可能与藻种有关, 三角褐褐藻属于底栖硅藻, 在较低温, 低光密度下也能自养生长[26]。钱振明等[27]考察了温度对8种底栖硅藻生长及其理化成分的影响.结果表明: 在15.~25℃时细胞的比生长速率及主要理化成分(蛋白、多糖、脂肪酸)含量均可达到最大, 而低于15℃或高于30℃均不利于细胞生长及理化成分的积累。在实际实验中发现三角褐指藻的较适生长温度要比产脂肪酸的温度稍高, 因此本实验采用昼夜温差的培养方式。
在单因素实验的基础上, 对筛选得到的诱变藻株UP1进行培养条件优化, 得到较适培养条件为: NaNO375 mg/L, pH 7.5, 昼夜温度17~15℃、接种量10%、培养7 d, 在此条件下培养, 藻株的EPA产量为26.38 mg/g。通过遗传稳定性试验分析可知UP1的第一代和第6代EPA产量变化不显著(=0.16), 说明选育的变异藻种具有良好的遗传稳定性。
[1] Thelen J J, Ohlrogge J B. Metabolic engineering of fatty Acid biosynthesis in Plants[J]. Metabolic Engineering, 2002, 4(1): 12-21.
[2] Domergue F, Abbadi A, Ott C, et al. Acyl carriers used as substrates by the desaturases and elongases involved in very long-chain polyunsaturated fatty acids biosynthesis reconstituted in yeast[J]. Journal of Biological Chemistry, 2003, 278(37): 35115-35126.
[3] Kadar E, Rooks P, Lakey C, et al. The effect of engineered iron nanoparticles on growth and metabolic status of marine microalgae cultures[J]. Science of the Total Environment, 2012, 439C(22): 8-17.
[4] Huerlimann R, Nys R D, Heimann K. Growth, lipid content, productivity, and fatty acid composition of tropical microalgae for scale-up production[J]. Biotechnology & Bioengineering, 2010, 107(2): 245-257.
[5] Liang Y, Beardall J, Heraud P. Effects of nitrogen source and UV radiation on the growth, chlorophyll fluorescence and fatty acid composition ofand(Bacillariophyceae)[J]. Journal of Photochemistry and Photobiology B: Biology, 2006, 82(3): 161-172.
[6] 杨世杰, 王希善, 李继芬, 等. 螺旋藻培养初探[J]. 中国农业大学学报, 1988, 7(1): 71-76. Yang Shijie, Wang Xishan, Li Jifen, et al. Preliminary study on spirulina culture[J]. Journal of China Agricultural University, 1988, 7(1): 71-76.
[7] Beardall J, Raven J A. The potential effects of global climate change on microalgal photosynthesis, growth and ecology[J]. Phycologia, 2004, 43(1): 26-40.
[8] Odmark S, Wulff A, Wängberg S Å, et al. Effects of UVB radiation in a microbenthic community, of a marine shallow-water sandy sediment[J]. Marine Biology, 1998, 132(2): 335-345.
[9] 陈百灵. 磷硅对三角褐指藻生长和脂肪酸组成的影响[D]. 青岛: 中国海洋大学, 2011. Chen B. Effect of Phosphorus and silicon on the growth and fatty acid composition of[D]. Qingdao: Ocean University of China, 2011.
[10] Moazami N, Ranjbar R, Ashori A, et al. Biomass and lipid productivities of marine microalgae isolated from the Persian Gulf and the Qeshm Island[J]. Biomass & Bioenergy, 2011, 35(5): 1935-1939.
[11] Elsey D, Jameson D, Raleigh B, et al. Fluorescent measurement of microalgal neutral lipids[J]. Journal of Microbiological Methods, 2007, 68(3): 639-642.
[12] Chen W, Zhang C, Song L, et al. A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J]. Journal of Microbiological Methods, 2009, 77(1): 41-47.
[13] 姚领, 胡萍, 胡蓓娟, 等. 两种溶剂提取法提取三角褐指藻中不饱和脂肪酸的比较[J]. 食品工业科技, 2006(12): 114-116. Yao Ling, Hu Ping, Hu Beijuan, et al.The differences in unsaturated fatty acids extracted by different two solvent systems from[J].The Food Industry Science and Technology, 2006(12): 114-116.
[14] Mujtaba G, Choi W, Lee C G, et al. Lipid production by Chlorella vulgaris, after a shift from nutrient-rich to nitrogen starvation conditions[J]. Bioresource Technology, 2012, 123(4): 279-283.
[15] Borowitzka M A, Borowitzka L J. Micro-algal Biotechnology[M]. Cambridge: Cambridge University Press, 1988.
[16] Pahl S L, Lewis D M, Chen F, et al. Heterotrophic growth and nutritional aspects of the diatom(Bacillariophyceae): Effect of some environmental factors(microbial physiology and biotechnology)[J]. Journal of Bioscience & Bioengineering, 2010, 109: 235-239.
[17] Mutanda T, Ramesh D, Karthikeyan S, et al. Bioprospecting for hyper-lipid producing microalgal strains for sustainable biofuel production.[J]. Bioresource Technology, 2011, 102(1): 57-70.
[18] Chan Y, Jun S Y, Lee J Y, et al. Selection of microalgae for lipid production under high levels carbon dioxide[J]. Bioresource Technology, 2010, 101 Suppl 1(1): S71- S74.
[19] 周玉娇, 李亚军, 费小雯, 等. 小球藻紫外线诱变及高含油藻株筛选[J]. 热带作物学报, 2010, 31(12): 2124-2129. Zhou Yujiao, Li Yajun, Fei Xiaowen, et al. UV-Irradiation ofvulgaris and screening of petroliferous strains[J]. Chinese Journal of Tropical Crops, 2010, 31(12): 2124-2129.
[20] 张学成, 时艳侠, 孟振. 小球藻紫外线诱变及高产藻株筛选[J]. 中国海洋大学学报(自然科学版), 2007, 37(5): 749-753. Zhang Xuecheng, Shi Yanxia, Meng Zhen. The UV-Irradiation ofvulgaris beijerinck and screening of productive strain[J]. Periodical of Ocean University of China, 2007, 37(5): 749-753.
[21] Widjaja A, Chien C C, Ju Y H. Study of increasing lipid production from fresh water microalgae[J]. Journal of the Taiwan Institute of Chemical Engineers, 2009, 40(1): 13-20.
[22] Courchesne N M D, Parisien A, Wang B, et al. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches[J]. Journal of Biotechnology, 2009, 141(1): 31-41.
[23] Piorreck M, Baasch K H, Pohl P. Biomass production, total protein, chlorophylls, lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes[J]. Phytochemistry, 1984, 23(2): 207- 216.
[24] Yeesang C, Cheirsilp B. Effect of nitrogen, salt, and iron content in the growth medium and light intensity on lipid production by microalgae isolated from freshwater sources in Thailand[J]. Bioresource Technology, 2011, 102(3): 3034-3040.
[25] 杨官品, 张继民. 温度逆境处理提高拟微球藻()EPA含量的研究[J]. 海洋学报, 2002, 24(4): 132-135. Yang Guanpin, Zhang Jimin, et al. Obvious increase of EPA content ofachieved in temperature stresses[J]. Acta Oceanologica Sinica, 2002, 24(4): 132-135.
[26] Yamamoto T, Jin O S, Goto I. Effects of temperature, salinity and irradiance on the growth of microphytobenthossp.[J]. Japanese Journal of Phycology, 2004, 52: 5-11.
[27] 钱振明, 邢荣莲, 吴春雪, 等. 温度对8种底栖硅藻生长及其理化成分的影响[J]. 烟台大学学报: 自然科学与工程版, 2009, 22(1): 30-34. Qian Zhenming, Xing Ronglian, Wu Chunxue, et al. Effects of temperature on growth and physiological biochemical compositions of eight benthic diatoms[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2009, 22(1): 30-34.
(本文编辑: 梁德海)
UV irradiation toand screening of EPA strains
LIU Hong-quan, PAN Yi-hua, LIN Xiao-yuan, LI Jie-qiong, YUAN Sha, LU En-qiu
(College of Marine Science and Biotechnology, Guangxi University for Nationlities , Guangxi Key Laboratory Cultivation Base for Polysaccharide Materials and their Modification, Key Laboratory of Utilization of Microbial and Botanical Resources, Nanning 530006, China)
This study investigated the mutagenesis ofinduced by UV irradiation and its capacity of EPA accumulation influenced by various cultivation factors. The appropriate ultraviolet irradiation dose that can be applied towas found to be below 35 cm for 15 min. A special clone UP1 was isolated from more than 200 mutant clones. Compared with the wild species, the EPA content of mutant UP1 was increased by about 10.2%. The effects of NaNO3concentration, pH of the medium, and temperature on EPA production were investigated, which showed that the optimal cultivation conditions were NaNO375 mg/L, pH 7.5, natural day/night temperature about 17–15℃, and 10% of inoculation density for 7 days of cultivation. The mutant species demonstrated inherited stable.
; UV mutagenesis; EPA; culture condition; genetic stability
Nov. 29, 2016
刘红全(1975-), 男, 黑龙江肇东人, 副教授, 博士, 主要从事生物技术研究, 电话: 13977113695, E-mail: lhongquan@163.com
A
1000-3096(2017)09-0087-07
10.11759/hykx20140423005
2016-11-29;
2017-03-20
国家自然科学基金项目(30960215); 广西自然科学基金项目(桂科青0728019)
[National Natural Science Foundation of China, No. 30960215; Guangxi Natural Science Foundation Program, No. 0728019]
