石岛湾四种常见鱼类的热耐受性比较
2017-03-26窦硕增宋骏杰田洪林刘永叶
窦硕增, 南 鸥, 曹 亮, 宋骏杰, 田洪林, 刘永叶
石岛湾四种常见鱼类的热耐受性比较
窦硕增1, 2, 3, 南 鸥1, 3, 曹 亮1, 2, 宋骏杰1, 3, 田洪林1, 3, 刘永叶4
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 海洋国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266071; 3. 中国科学院大学 北京 100049; 4. 环境保护部核与辐射安全中心, 北京 100082)

热耐受性; 温升速率; 驯化温度; 最大临界温度; 24 h高起始致死温度; 鱼类
全球变暖导致了全球海洋表层水温呈升高的趋势。美国国家海洋和大气管理局(NOAA)的研究表明, 1901—2015年, 全球海洋的海表温度每10年平均上升了0.13℃。预计在下个百年全球平均气温将增加1~7℃[1], 这将进一步影响海洋水温的变化, 并对水生生物和生态环境产生重大潜在影响。中国沿海地区分布了许多大型火电厂和核电厂, 普遍采用直流冷却的方式, 以冷却水为载体将大量的废热排放到海洋中[2]。这些温排水可使受纳水域的水温升高, 而排水口的水温可升高8~12℃[3]。大量的温排水在近岸局部海域形成高温区, 不仅改变了受纳水体的理化性质, 而且影响了各类海洋生物的繁殖、发育和生长, 对海洋生态环境造成严重影响[4]。全球气候变暖和大型电厂的温排水带来的热污染已经成为中国近海一个日益严重的重大环境问题。
温度可显著影响鱼类的生化、生理和生活史过程。鱼类属于变温动物, 自身缺乏体温调节能力, 其体温随着环境温度变化而变化, 对水温的反应敏感和迅速, 易受环境温度影响[5]。温度能够直接影响近海生态系统中鱼类种类组成和数量变动, 而鱼类对温度的适应能力也决定了其时空分布。例如, 随着水温的升高, 耐温性或喜温性鱼类在群落中所占的比例有增加的趋势; 而一些喜低温的种类则可能向高纬度或外海迁移。另一方面, 鱼类会主动选择适宜的温度环境。因此, 在适温范围内, 适度温升能提高海洋鱼类的摄食能力, 促进其性成熟, 加速生长。当鱼类无法逃离不利水温环境时, 机体可能会自主进行一系列内生理调整以适应新的环境, 以维持内环境稳态, 即所称的热忍受或热耐受[6]。


1 材料与方法
1.1 实验材料
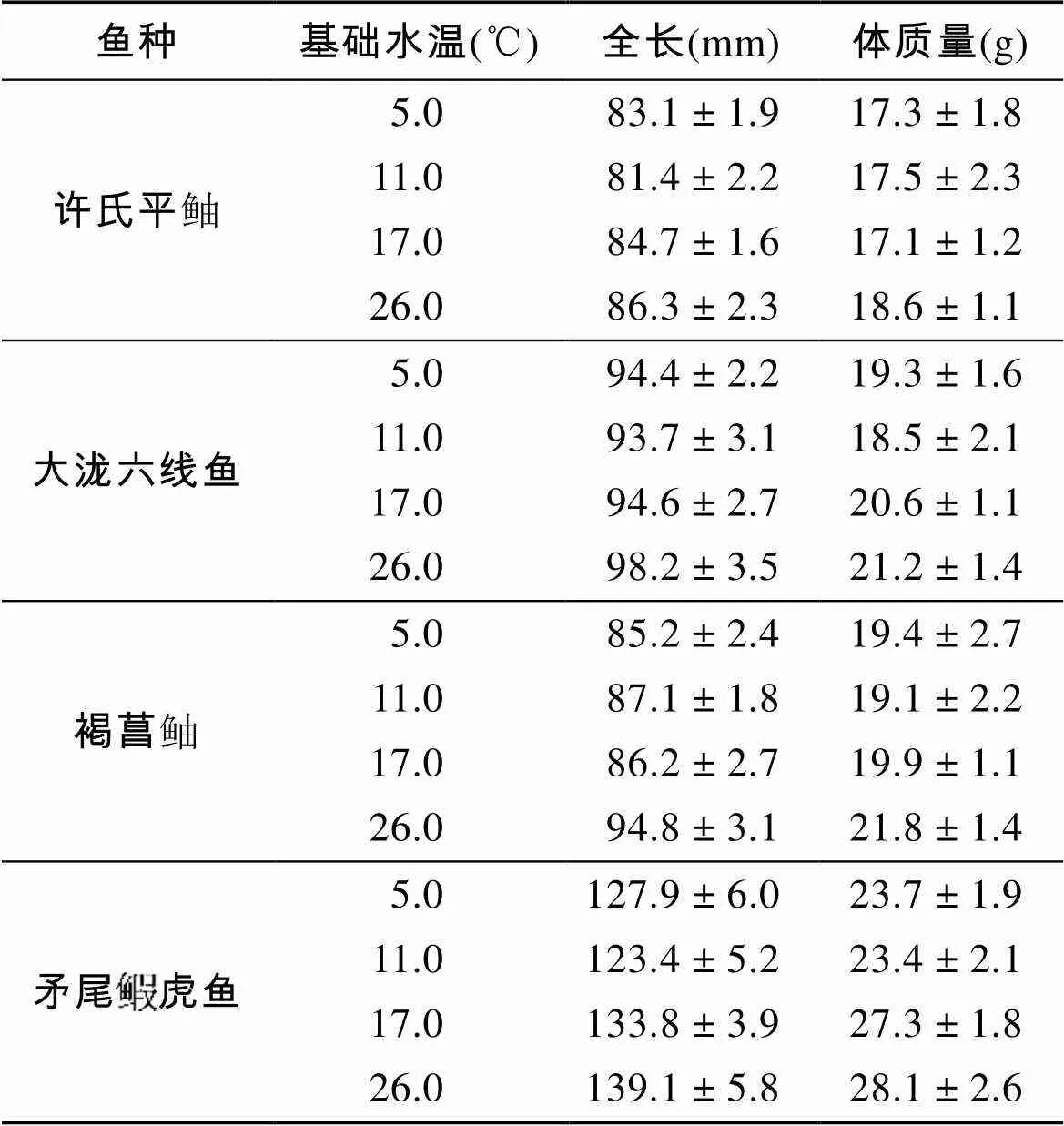
表1 各实验中4种鱼类的全长和体质量
1.2 实验方法
1.2.1 实验条件
实验分季节进行。实验水槽为150 L水体, 实验用水为砂滤后的石岛湾自然海水, 盐度为28.8~31.8, pH为8.0~8.2。实验过程中充气, 自然光照条件。水槽水温由精密控温仪(温控范围0~90℃, 感温灵敏度0.1℃, 韩国A-MI 211H)和钛加热棒(100~2 000 W, 德国Armaturenbau)控制。实验期间定时用精密水银温度计测定核对水槽内水温, 并对温度控制器加以校正。
1.2.2 动态实验
实验在持续升温条件下进行, 主要测定实验鱼类的CTM。根据各季节自然海水的平均水温状况, 将实验的基础水温设置为5.0℃(冬季)、11.0℃(春季)、17.0℃(秋季)和 26.0℃(夏季)。考虑到核电厂温排水可能造成的局部温升情况, 每个基础温度下均设置9个温升速率梯度: 0.5、1.0、2.0、3.0、4.0、6.0、9.0、12.0和15.0℃/h。每个温升处理设3个平行组, 采用多物种同时混养实验方式。以驯化水温为实验起始温度, 按照设定的温升速率对水体进行持续加热, 观察记录实验鱼类的死亡情况, 分析其CTM值。实验过程中以鱼类出现运动紊乱、失去平衡或身体翻转等作为CTM的临界点, 将临界点的水温定义为CTM。
1.2.3 静态实验
本实验将鱼类从驯化水温直接暴露于一系列较高水温, 观察一定时间内实验鱼类的存活情况, 以获取各种实验鱼类的24 h高起始致死温度。分别在5.0℃(冬季)、11.0℃(春季)、17.0℃(秋季)和 26.0℃(夏季)4个基础水温下, 按照1~2℃温差设置温度梯度, 每个温度组设3个平行组。实验过程中每个处理中的水温保持恒定, 从驯化水槽每种选取6~10尾大小相近、活动力强的个体, 直接移入不同实验温度的水槽中, 观察实验生物的行为反应。实验过程中及时观察和取出死亡个体并做记录。实验结束后统计每个温度组中各生物的死亡率, 利用Probit回归分析求得24 h UILT50。
1.3 数据分析
数据统计结果表示为平均值±标准偏差(mean± S.D.), 对数据进行正态分布检验和方差齐性检验。在满足正态分布和方差齐性条件下进行方差分析(ANOVA)和多重比较(Duncan test)。
对动态实验中各物种的CTM数据进行双因素方差分析(two-way ANOVA), 检验温升速率和基础水温对各种鱼类CTM影响的差异显著性。动态实验中同一物种在不同温升速率下的CTM 的差异以及静态实验中各物种在不同基础水温下的24 h UILT50的差异均采用one-way ANOVA检验显著性。统计分析均在IBM SPSS Statistics 20.0上进行, 显著性水平设为<0.05。
2 结果
2.1 动态实验: 各季节基础水温下不同温升速率对实验鱼类CTM的影响

温升速率对各实验鱼类CTM的影响因基础水温和鱼种不同而异。

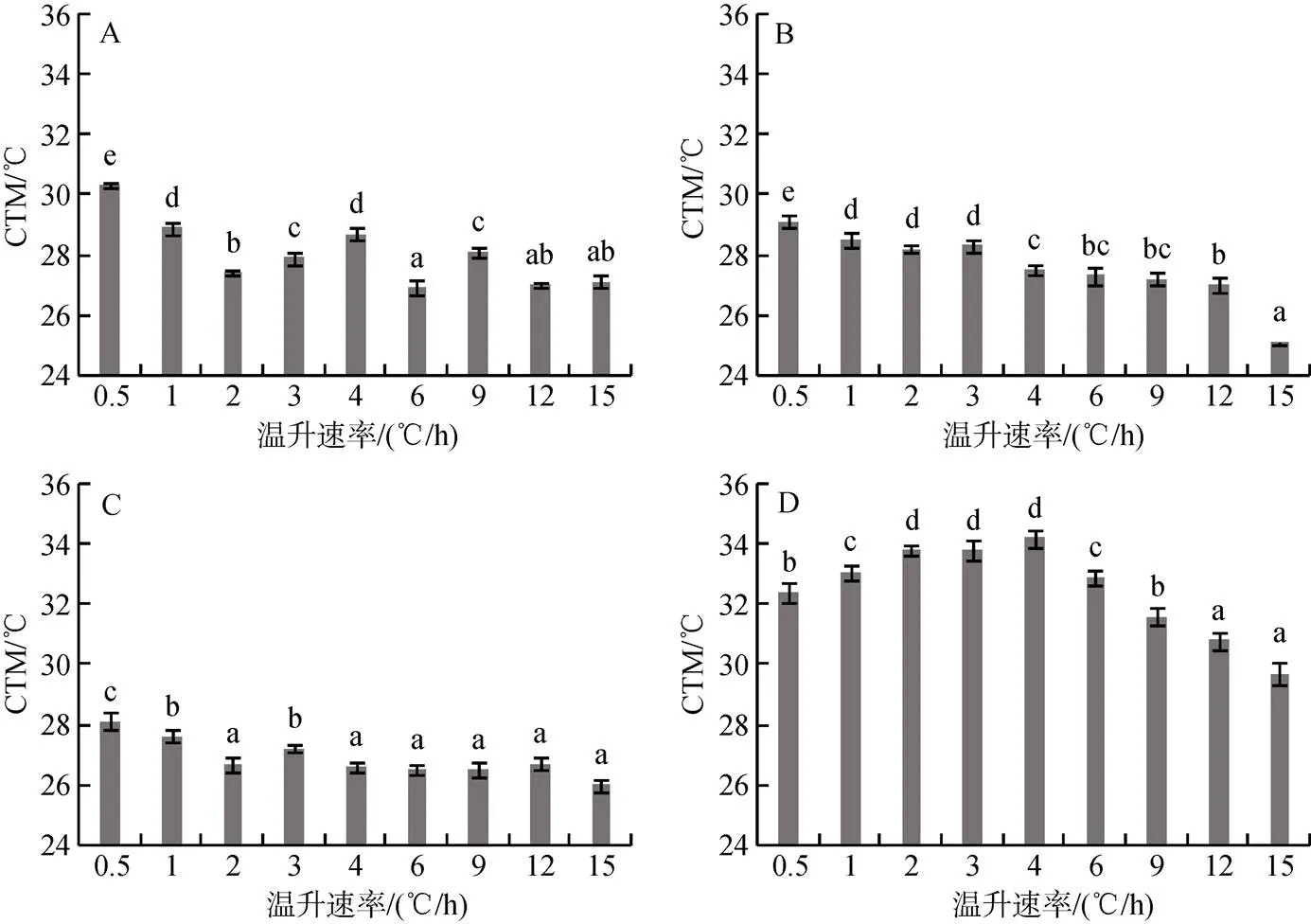
图1 冬季水温5.0℃时许氏平鲉(A)、大泷六线鱼(B)、褐菖鲉(C)、矛尾虎鱼(D)在不同温升速率下的最大临界温度(℃)
平均值±标准偏差; Duncan多重比较, 同一鱼种柱状图上不同字母表示各温升速率处理组之间的差异显著,<0.05, 图2~图4同
mean ± S.D., ANOVA. Values with different letters are significantly different between heating rate groups of the same species,< 0.05, Duncan test, the same as Fig. 2–Fig. 4

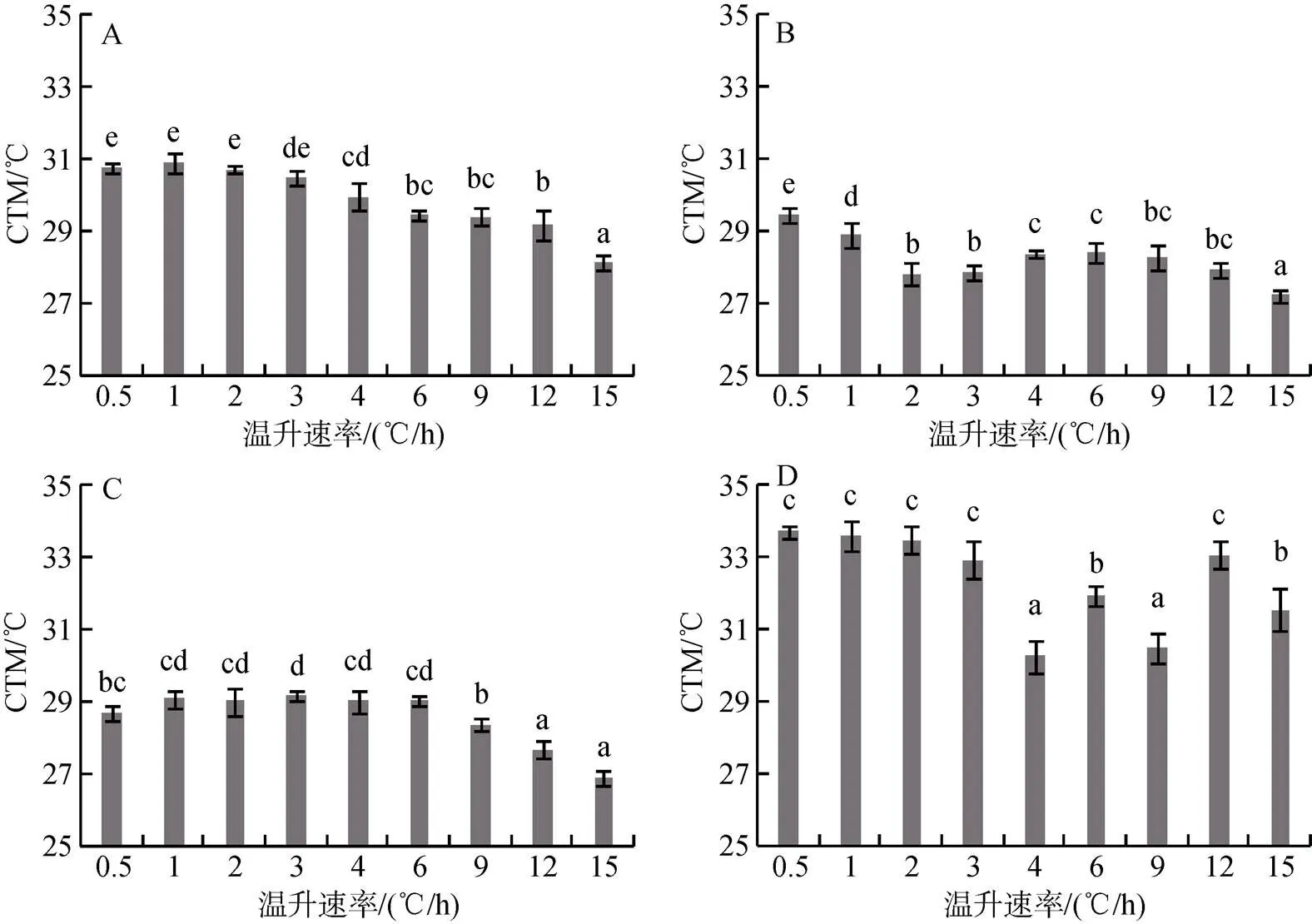
图2 春季水温11.0℃时许氏平鲉(A)、大泷六线鱼(B)、褐菖鲉(C)、矛尾虎鱼(D)在不同温升速率下的最大临界温度(℃)


图3 秋季水温17.0℃时许氏平鲉(A)、大泷六线鱼(B)、褐菖鲉(C)、矛尾虎鱼(D)在不同温升速率下的最大临界温度(℃)


图4 夏季水温26.0℃时许氏平鲉(A)、大泷六线鱼(B)、褐菖鲉(C)、矛尾虎鱼(D)在不同温升速率下的最大临界温度(℃)
2.2 静态实验: 各季节基础水温下实验鱼类的24 h高起始致死温度

3 讨论
3.1 鱼类热耐受性的研究方法及CTM与24 h UILT50比较
鱼类的热耐受性通常是通过动态或静态的实验方法来量化研究的[8-9]。动态法用来估算实验鱼类的最大临界温度[9], 实验过程中以某种特定的温升速率(如1℃/h)持续升温, 直至鱼体达到一个临界点如失去平衡和身体翻转等, 以鱼类开始到达临界点时的温度作为最大临界温度[10-11]。静态法用来估算实验鱼类的高起始致死温度[12], 生物体从适应的温度突然被暴露于实验温度, 统计某一特定时间内(24 h)实验鱼类的死亡情况。静态法能较直观地反映实验鱼类的死亡率与温度之间的关系, 不足之处是需要较多的实验鱼个体, 而且由于以鱼类的死亡率作为端点, 所需实验时间也较长[12]。动态法更容易模拟自然水温条件开展实验, 所需的实验鱼类数量较少, 且能够较快地获取数据, 无需致死鱼类, 尤其适用于对濒危物种的耐热性研究。因此, 动态法被广泛应用于比较研究种间或种内热耐受性的差异, 其缺点是实验结果受温升速率的影响, 过慢或过快的升温均可能对实验鱼类的耐热性评估产生一定的影响[9, 13]。这两种方法通常被同时应用在生物的热耐受研究中, 以相互补充。

图5 4种鱼类在不同基础水温下的24 h高起始致死温度
s平均值±标准偏差, Duncan test; 同一鱼种折线上不同字母表示各基础水温之间的差异显著,<0.05
mean ± S.D.; ANOVA, Duncan test; Values with different letters on the same polygonal lines are significantly different between acclimation temperatures ,< 0.05

3.2 基础温度对鱼类热耐受性的影响
鱼类的热耐受性受生物因素(实验物种的种间差异、遗传特性、个体大小、年龄、性别、生活史阶段和营养状况等)和非生物因素(驯化温度、驯化时间、栖息地环境和水质等)影响。在这些因素中, 驯化温度通常被认为是最重要的影响因素之一[8, 16]。

3.3 温升速率对CTM的影响
在采用动态法测定鱼类的热耐受性时, 除了驯化温度, 温升速率是影响实验结果的另一关键因素。温升速率过快可能导致实验鱼类的实际感受温度或体温在某种程度上滞后于实验水温, 从而过高地估计了其热耐受温度[9]。相反, 较缓慢的温升会导致实验鱼类逐渐适应新的温度, 可能会提升其热耐受性。但是, 如果温升速率太缓慢, 实验鱼类则在致命水温下暴露更长的时间, 测得实验生物的热耐受温度就偏低[27]。因此, 有学者认为有必要制定标准化的温升速率, 以比较鱼类种间或种内的热耐受性差异。但目前对温升速率标准化问题存在争议, 有学者认为足够快的温升速率可以避免由于实验生物被驯化而影响实验结果, 建议统一采用较快的温升速率如0.3℃/min[34]和1℃/min[9]; 也有人认为缓慢升温可使实验生物有充足时间对改变的环境温度进行调节适应, 能更客观地反映出实验生物本身的热忍耐力, 建议采用1℃/d的温升速率[5]。


在水温较低的冬季和春季, 较缓慢的温升对鱼类的生命过程是有利的, 鱼类有充足的时间通过机体自身的代谢去适应温度的变化, 其发育生长一般会得以促进发展。但是, 过快的温升可能使水环境温度迅速超出了鱼类的适宜生存温度, 其生理机能发生剧烈的变化, 在较短时间即出现临界反应。这可能是冬季和春季大部分实验鱼类的CTM均随温升速率的升高而降低的一个重要的原因。而在基础水温较高的夏季, 所有实验鱼类的CTM则随温升速率的增大而显著升高。较缓慢的温升意味着实验鱼类在致命水温下暴露的时间更长, 而长时间的高温暴露需要鱼类的脑、心、肝等重要组织器官的活性增强, 各种酶活性提高以抵御热冲击的胁迫而维持生命, 因此, 实验鱼类可能在相对较低的温度下就到达临界温度。
目前关于鱼类热耐受性的研究大多集中在高温的影响方面, 而对低温影响方面的关注却比较少。然而, 自然界中由于低温造成鱼类的死亡也很为普遍。此外, 温排水受纳水域的温度高于其他区域, 生活在温暖的水域可能会为某些水生物种增加生长和生存提供更好的环境条件。在自然水温较低的冬季, 许多生物表现出对热的喜好, 聚集在温排水区。当水生生物适应这种较高的水温后, 若突然停止温水排放, 增温区的水生生物将承受温度骤降的危害。鱼类长期暴露于低温下会减慢其新陈代谢过程, 导致鱼类行为迟钝和游速减缓, 不利于其逃离低温区[6], 并最终导致鱼类死亡。因此, 在今后相关研究中, 应加强对鱼类的低温胁迫和暴露时间对生物的热耐受性的影响等问题研究。
[1] Ficke A D, Myrick C A, Hansen L J. Potential impacts of global climate change on freshwater fisheries[J]. Reviews in Fish Biology and Fisheries, 2007, 17: 581- 613.
[2] 刘永叶, 陈鲁, 乔亚华, 等. 北方典型滨海核电厂温排水最高排放温度限值研究[J]. 海洋环境科学, 2016, 35(6): 827-830. Liu Yongye, Chen Lu, Qiao Yahua, et al. The maximum temperature limit of thermal discharge from typical northern coastal npp[J]. Marine Environmental Science, 2016, 35(6): 827-830.
[3] Bamber R N. The influence of rising background temperature on the effects of marine thermal effluents[J]. Journal of Thermal Biology, 1995, 20(l-2): 105-110.
[4] Gooseff M N, Strzepek K, Chapra S C. Modeling the potential effects of climate change on water temperature downstream of a shallow reservoir, Lower Madison river, MT[J]. Climatic Change, 2005, 68(3): 331-353.
[5] 陈全震, 曾江宁, 高爱根, 等. 鱼类热忍耐温度研究进展[J]. 水产学报, 2004, 28(5): 562-567. Chen Quanzhen, Zeng Jiangning, Gao Aigen, et al. Advances in study of temperature of thermal tolerance of fishes[J]. Journal of Fisheries of China, 2004, 28(5): 562-567.
[6] Kir M, Sunar M C, Altındağ B C. Thermal tolerance and preferred temperature range of juvenile meagre acclimated to four temperatures[J]. Journal of Thermal Biology, 2017, 65: 125-129.
[7] 刘永叶, 刘森林, 陈晓秋. 核电站温排水的热污染控制对策[J]. 原子能科学技术, 2009, 43: 191-196. Liu Yongye, Liu Senlin, Chen Xiaoqiu. Control countermeasures about thermal pollution of thermal discharge from nuclear power plants[J]. Atomic Energy Science and Technology, 2009, 43: 191-196.
[8] Beitinger T L, Bennett W A, McCauley R W. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature[J]. Environmental Biology of Fishes, 2000, 58: 237-275.
[9] Lutterschmidt W I, Hutchison V H. The critical thermal maximum: data to support the onset of spasms as the definitive end point[J]. Canadian Journal of Zoology, 1997, 75: 1553-1560.
[10] Mora C, Ospina F. Thermal tolerance and potential impact of sea warming on reef fishes from Gorgona Island (Eastern Pacific Ocean)[J]. Marine Biology, 2001, 139: 765-769.
[11] Mora C, Maya M F. Effect of the rate of temperature increase of the dynamic method on the heat tolerance of fishes[J]. Journal of Thermal Biology, 2006, 31: 337- 341.
[12] Bennett W A, Beitinger T L. Temperature tolerance of the sheepshead minnow,[J]. Copeia, 1997, 1: 77-87.
[13] Ospina F, Mora C. Effect of body size on reef fish tolerance to extreme low and high temperatures[J]. Environmental Biology of Fishes, 2004, 70: 339-343.
[14] 张梅英, 侯文礼, 汝少国. 梭鱼幼鱼热耐受温度的研究[J]. 生态学杂志, 1999, 18(2): 60-62. Zhang Meiying, Hou Wenli, Ru Shaoguo. Study on the temperature of thermal tolerance of the mullet larva ()[J]. Chinese Journal of Ecology, 1999, 18(2): 60-62.
[15] Rajaguru S. Critical thermal maximum of seven estuarine fishes[J]. Journal of Thermal Biology, 2002, 27: 125-128.
[16] Beitinger T J, Lutterschmidt W I. Measures of thermal tolerance in encyclopedia of fish physiology—from genome to environment[M]. San Diego, Calif: Academic Press, 2011: 1695-1702.
[17] Reynolds W W. Temperature as a proximate factor in orientation behavior[J]. Journal of the Fisheries Research Board of Canada, 1977, 34(5): 734-739.
[18] 王妤, 宋志明, 刘鉴毅, 等. 点篮子鱼幼鱼的热耐受特征[J]. 海洋渔业, 2015, 37(3): 253-258. Wang Yu, Song Zhiming, Liu Jianyi, et al. Thermal tolerance of juvenile[J]. Marine Fisheries, 2015, 37(3): 253-258.

[20] 蔡泽平, 陈浩如, 金启增, 等. 热废水对大亚湾三种经济鱼类热效应的研究[J]. 热带海洋, 1999, 18(2): 11-19. Cai Zeping, Chen Haoru, Jin Qizeng, et al. Influence of thermal power effluent on three species of fishes in Daya Bay[J]. Tropic Oceanology, 1999, 18(2): 11-19.
[21] Dent L, Lutterschmidt W I. Comparative thermal physiology of two sympatric sunfishes with a discussion of microhabitat utilization[J]. Journal of Thermal Biology, 2003, 28(1): 67-74.
[22] 曾江宁. 滨海电厂温排水对亚热带海域生态影响的研究[D].杭州: 浙江大学, 2008. Zeng Jiangning. Ecological effect by thermal discharged water from subtropical coastal power plants[D]. Hangzhou: Zhejiang University, 2008.
[23] Rajaguru S, Ramachandran S. Temperature tolerance of some estuarine fishes[J]. Journal of Thermal Biology, 2001, 26: 41-45.
[24] Golovanov V K, Ruchin A B. Critical thermal maximum of amur sleeperin different seasons of the year[J]. Journal of Ichthyology, 2011, 51(9): 788-793.
[25] Zhang Y Y, Kieffer J D. Critical thermal maximum (CTmax) and hematology of shortnose sturgeons () acclimated to three temperatures[J]. Canadian Journal of Zoology, 2014, 92: 215-221.
[26] 付康康, 曹振东, 付世建. 温度驯化对高体鳑鲏热耐受及低氧耐受能力的影响[J]. 生态学杂志, 2015, 34(6): 1586-1590. Fu Kangkang, Cao Zhendong, Fu Shijian. Effects of acclimation temperature on thermal tolerance and hypoxia tolerance in[J]. Chinese Journal of Ecology, 2015, 34(6): 1586-1590.
[27] Currie R J, Bennett W A, Beitinger T L. Critical thermal minima and maxima of three freshwater game-fish species acclimated to constant temperatures[J]. Environmental Biology of Fishes, 1998, 51(2): 187-200.
[28] Bennett W A, McCauley R W, Beitinger T L. Rates of gain and loss of heat tolerance in channel catfish[J]. Transactions of the American Fisheries Society, 1998, 127(6): 1051-1058.
[29] Richards V L, Beitinger T L. Reciprocal influences of temperature and copper on survival of fathead minnows,[J]. Bulletin of Environmental Contamination and Toxicology, 1995, 55(2): 230-236.
[30] Chung K S. Critical thermal maxima and acclimation rate of the tropical guppy[J]. Hydrobiologia, 2001, 462(1-3): 253-257.
[31] Das T, Pal A K, Chakraborty S K, et al. Thermal tolerance and oxygen consumption of Indian major carps acclimated to four temperatures[J]. Journal of Thermal Biology, 2004, 29(3): 157-163.
[32] Ford T, Beitinger T L. Temperature tolerance in the goldfish,[J]. Journal of Thermal Biology, 2005, 30(2): 147-152.
[33] Akhtar M S, Pal A K, Sahu N P, et al. Thermal tolerance, oxygen consumption and haemato-biochemical variables ofjuveniles acclimated to five temperatures[J]. Fish Physiology and Biochemistry, 2013, 39: 1387-1398.
[34] Becker C D, Genoway R G. Evaluation of the critical thermal maximum for determining thermal tolerance of freshwater fish[J]. Environmental Biology of Fishes, 1979, 4: 245-256.
[35] Vinagre C, Leal I, Mendonça V. Effect of warming rate on the critical thermal maxima of crabs, shrimp and fish[J]. Journal of Thermal Biology, 2015, 47: 19-25.
(本文编辑: 谭雪静)
A comparative study of the thermal tolerance of four common fish species in Shidao Bay, the Yellow Sea
DOU Shuo-zeng1, 2, 3, NAN Ou1, 3, CAO Liang1, 2, SONG Jun-jie1, 3, TIAN Hong-lin1, 3, LIU Yong-ye4
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Nuclear and Radiation Safety Center, Ministry of Environmental Protection, Beijing 100082, China)
This study investigated the thermal tolerance of four common fish species (,,, and) in Shidao Bay using dynamic temperature and static temperature experimental methods. Critical thermal maximum (CTM) and 24 h upper incipient lethal temperature (24 h UILT50) were studied at four acclimatizing temperatures (5.0–26.0℃) and nine temperature-rising rates. The results showed that the CTM and the 24 h UILT50of the four fish species significantly positively correlated with the acclimatizing temperatures. The effects of temperature-rising rate on the thermal tolerance of the experimental fish varied among the acclimatizing temperatures, depending on the species. The four experimental fish showed the following ranking order of thermal tolerance:>>>.
thermal tolerance; temperature-rising rate; acclimation temperature; critical thermal maximum; 24 h upper incipient lethal temperature; fish
Mar. 10, 2017
窦硕增(1967-), 男, 山东沂源人, 研究员, 博士, 主要从事海洋生物资源与环境研究, 电话: 0532-82898842, E-mail: szdou@ qdio.ac.cn
Q178.1; X57
A
1000-3096(2017)09-0056-09
10.11759//hykx2017031002
2017-03-10;
2017-03-29
国家自然科学基金委员会-山东省人民政府联合资助海洋科学研究中心项目(U1606404); 国家科技重大专项(2013ZX06002001)
[NSFC-Shandong Joint Fund for Marine Science Research Centers, No.U1606404; National Science and Technology Major Project, No. 2013ZX06002001]
