藜麦皮总皂苷微波辅助提取工艺及其抗氧化活性研究
2017-03-23高凤祥边红聿张仕刚赵二劳
杨 洁 高凤祥 - 杨 敏 边红聿 - 张仕刚 - 赵二劳 -
(忻州师范学院化学系,山西 忻州 034000)
藜麦(Chenopodiumquinoa)为藜科(Chenopodiaceae)藜属(Chenopodiumspp.)双子叶1年生草本植物,原产于南美洲的玻利维亚、厄瓜多尔和秘鲁等地,具有耐旱、耐寒、耐瘠薄、耐盐碱等特性,是公认的全营养谷物[1]。目前世界各地均有引种,中国西藏、陕西、山西、四川、青海和浙江等地已大量种植[2]。研究[3-4]表明,藜麦含有皂苷、不饱和脂肪酸、维生素E等多种营养成分,皂苷主要分布在藜麦皮中。
目前,皂苷的提取方法主要有溶剂热提取法、酶法提取法、超声辅助提取法、微波辅助提取法、超临界CO2萃取法以及超声-微波联合提取法等[7-8]。微波辅助提取法因具有设备简单、提取效率高、选择性强、节约时间与溶剂、污染小等诸多优点,广泛应用于黄酮[9]、多糖[10]、多酚[11]、色素[12]等提取中。有关藜麦皮皂苷微波辅助提取的研究未见报道。因此本试验拟采用响应面法优化藜麦皂苷微波辅助提取工艺,并研究其抗氧化活性,以期为藜麦皮综合开发利用及提高藜麦资源附加值提供理论依据。
1 材料与方法
1.1 材料与试剂
藜麦皮:山西华青藜麦产品开发有限公司,石油醚脱脂后,60 ℃烘箱中烘干,粉碎后过60目筛,装瓶保存备用;
齐墩果酸标准品:含量≥98%,上海赛创科学有限公司;
DPPH•(1,1-二苯基-2-苦肼基)、ABTS[2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐]:分析纯,美国Sigma 公司;
香草醛、冰醋酸、高氯酸、过硫酸钾等:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器设备
微电脑微波化学反应器:LWMC-201型,南京陵江科技开发有限责任公司;
紫外可见分光光度计:V-1100D型,上海美谱达仪器有限公司;
电子分析天平:AL204型,梅特勒-托利多仪器(上海)有限公司;
循环水真空泵:SHZ-DⅢ型,巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 齐墩果酸标准曲线绘制 参考文献[13],分别准确移取浓度为0.05 mg/mL齐墩果酸标准溶液0.20,0.40,0.60,0.80,1.00,1.20,1.40 mL于10 mL具塞试管中,70 ℃水浴将溶剂挥干,然后加入0.20 mL 5%的香草醛-冰醋酸溶液和0.80 mL的高氯酸,加塞摇匀,于60 ℃水浴加热15 min,取出后立即用冰水冷却5 min,再加入5.0 mL冰醋酸稀释,摇匀,静置30 min后,以不加样品的平行样作为空白,在546 nm 波长下测定吸光度。以吸光度(A)为纵坐标,齐墩果酸质量浓度(c)为横坐标,绘制标准曲线,得回归方程:A=67.497c+0.003,R2=0.998 6,线性范围为0.002~0.012 mg/mL。
1.3.2 总皂苷的测定 准确移取0.20 mL藜麦皮提取液于10 mL比色管中,按1.3.1的方法测定皂苷含量,按式(1)计算总皂苷得率。
(1)
式中:
Z——总皂苷得率,mg/g;
C——测量液皂苷浓度,mg/mL;
n——测量时稀释倍数;
V——提取液的定容体积,mL;
m——样品质量,g。
1.3.3 藜麦皮总皂苷的提取 称取藜麦皮样品1.0 g,按单因素及响应面试验设计进行微波辅助提取,提取液过滤后,定容至100 mL,测定总皂苷得率。
1.3.4 单因素试验设计
(1) 乙醇浓度的选择:固定微波时间10 min,微波功率455 W,料液比1∶20 (g/mL),提取次数1次,分别考察乙醇浓度为50%,60%,70%,80%,90%时,对藜麦皮总皂苷得率的影响。
(2) 微波时间的选择:固定乙醇浓度70%,微波功率455 W,料液比1∶20 (g/mL),提取次数1次,分别考察微波时间为2,6,10,14,18 min时,对藜麦皮总皂苷得率的影响。
(3) 微波功率的选择:固定乙醇浓度70%,微波时间10 min,料液比1∶20 (g/mL),提取次数1次,分别考察微波功率为65,195,325,455,585 W时,对藜麦皮总皂苷得率的影响。
(4) 料液比的选择:固定乙醇浓度70%,微波时间10 min,微波功率455 W,提取次数1次,分别考察料液比为1∶10,1∶20,1∶30,1∶40,1∶50 (g/mL)时,对藜麦皮总皂苷得率的影响。
(5) 提取次数的选择:固定乙醇浓度70%,微波时间10 min,微波功率455 W,料液比1∶20 (g/mL)。考察提取次数分别为为1,2,3次时,对藜麦皮总皂苷得率的影响。
1.3.5 响应面优化藜麦皮总皂苷提取工艺 根据单因素试验结果,选取乙醇浓度、微波时间、微波功率、料液比4个因素为自变量,以皂苷提取得率为响应值,采用Design Expert 8.0.6.1软件设计四因素三水平响应面试验,分析并优化藜麦皮总皂苷的微波辅助提取工艺。
1.3.6 藜麦皮总皂苷的抗氧化活性 本试验选取3种自由基清除模型考察藜麦皮总皂苷的抗氧化活性,并利用SPSS 20.0软件进行差异显著性分析。
(1) DPPH•清除率测定:根据文献[14]修改如下:取2 mL 浓度为0.3 mg/mL的DPPH•溶液8份,分别置于10 mL 比色管中,分别加入一定体积的总皂苷提取液,用68%的乙醇溶液定容至刻度,使比色管中总皂苷浓度分别为5,10,15,20,40,60,80,100 μg/mL,摇匀,室温下避光反应30 min后,在517 nm处测量其吸光值为A1。测定不加总皂苷溶液仅DPPH•溶液体系吸光度为A0,测定不加DPPH•溶液体系吸光度为A2。同法测定VC对DPPH•清除率。
(2) ABTS+•清除率测定:根据文献[15]修改如下:取配制好的ABTS溶液2 mL,置于10 mL比色管中,分别加入一定体积的总皂苷提取液,用68%的乙醇溶液定容至刻度,使比色管中总皂苷浓度分别为5,10,15,20,40,60,80,100 μg/mL,摇匀,室温下放置10 min后,在734 nm处测量其吸光值A1。测定不加总皂苷溶液体系ABTS+•溶液吸光度为A0,测定不加ABTS+•溶液体系吸光度为A2。同法测定VC对ABTS+•清除率。
(3) •OH清除率测定:根据文献[16]修改如下:取6 mmol/L FeSO4溶液和6 mmol/L水杨酸溶液各2 mL置于10 mL比色管中,分别加入一定体积的总皂苷提取液,再加入2 mL 3% H2O2溶液,最后用68%的乙醇溶液定容,使比色管中总皂苷浓度分别为5,10,15,20,40,60,80,100 μg/mL,摇匀,37 ℃水浴反应15 min后,在波长510 nm下测量其吸光值为A1。测定不加总皂苷溶液体系吸光度为A0,测定不加H2O2溶液体系吸光度为A2。同法测定VC对•OH清除率。
(4) 自由基清除率:上述3种藜麦皮总皂苷清除自由基试验,按式(2)计算各自由基清除率。
(2)
式中:
s——清除率,%;
A0——空白对照液的吸光度;
A1——加入待测溶液后的吸光度;
A2——待测液本身的吸光度。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇浓度对藜麦皮总皂苷得率的影响 由图1可知,随着乙醇浓度的增加,藜麦皮总皂苷得率先增后降,当乙醇浓度为70%时,总皂苷得率达到最大,以后随乙醇浓度的增加,总皂苷得率下降。原因可能是随乙醇浓度的增加,溶剂的极性发生变化,使杂质溶出增多,从而影响总皂苷得率[11]。因此选择乙醇浓度为70%。
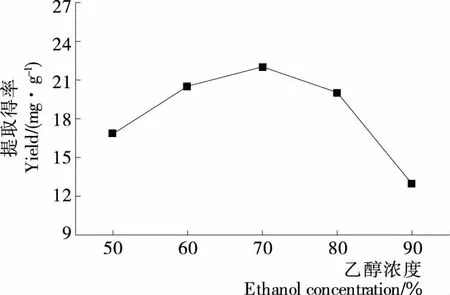
图1 乙醇浓度对藜麦皮总皂苷得率的影响Figure 1 Effect of ethanol concentration on the total saponin yield
2.1.2 微波时间对藜麦皮总皂苷得率的影响 由图2可知,藜麦皮总皂苷得率随着微波时间的延长而增大,当微波时间为10 min时,藜麦皮总皂苷得率达到最大。以后随微波时间的延长总皂苷得率逐渐降低。这可能是微波时间过长会使皂苷结构破坏,导致得率下降[11]。因此选择微波时间为10 min。
2.1.3 微波功率对藜麦皮总皂苷得率的影响 由图3可知,藜麦皮总皂苷得率随着微波功率的增加,也呈先增后降趋势。当微波功率为455 W时,总皂苷得率达到最大,以后有所下降,可能是微波功率过高使温度升高导致皂苷降解所致[11]。因此选择微波功率为455 W。
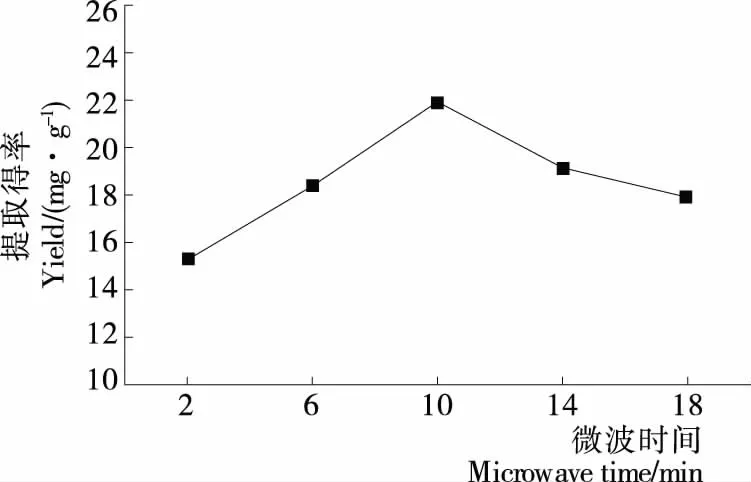
图2 微波时间对藜麦皮总皂苷得率的影响Figure 2 Effect of microwave time on the total saponin yield
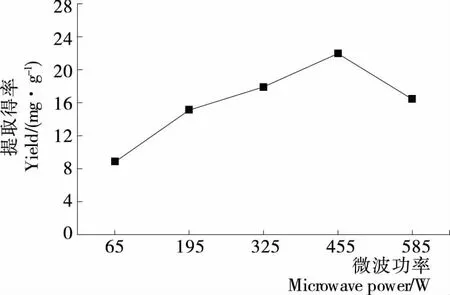
图3 微波功率对藜麦皮总皂苷得率的影响Figure 3 Effect of microwave power on the total saponin yield
2.1.4 料液比对藜麦皮总皂苷得率的影响 由图4可知,随提取剂的增加,藜麦皮总皂苷得率先增大后降低;当料液比为1∶30 (g/mL)时,藜麦皮总皂苷得率达到最大。可能是由于料液比太小,不利于皂苷溶出,料液比过大,杂质溶出增加影响皂苷溶出[11]。因此选择料液比为1∶30 (g/mL)。
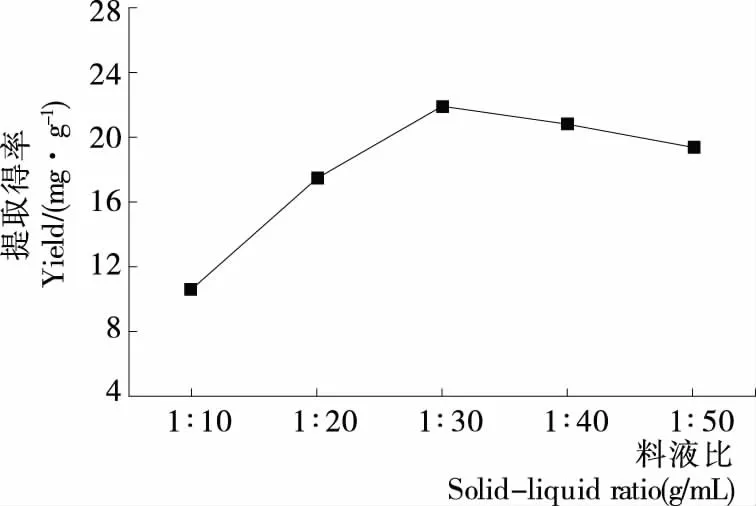
图4 料液比对藜麦皮总皂苷得率的影响Figure 4 Effect of solid-liquid ratio on the total saponin yield
2.1.5 提取次数对藜麦皮总皂苷得率的影响 由图5可知,随提取次数的增加,总皂苷得率增加,当提取为2次或3次时,藜麦皮总皂苷得率基本不变,说明此时皂苷已基本溶出,考虑成本,选择提取次数为2次。
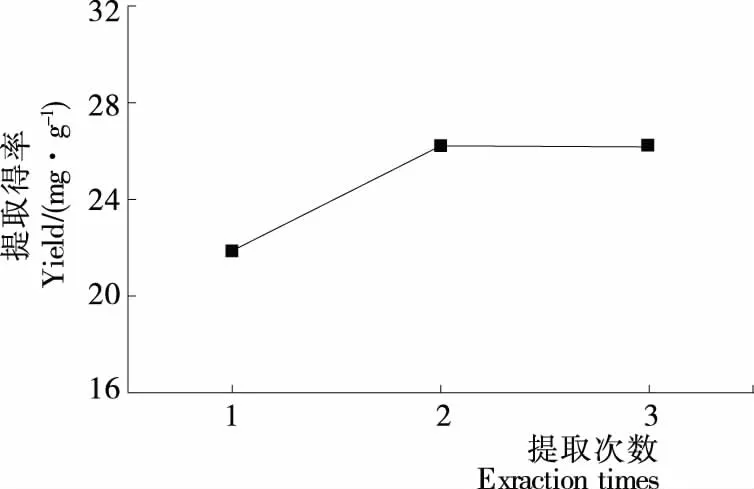
图5 提取次数对藜麦皮总皂苷得率的影响Figure 5 Effect of extraction time on the total saponin yield
2.2 响应面法优化藜麦皮总皂苷提取工艺
2.2.1 响应面试验方案设计及结果分析 按试验方法,以总皂苷得率为响应值,试验因素与水平见表1,试验设计及结果见表2。
采用Design-Expert 8.0.6.1软件对试验数据进行拟合,得总皂苷得率的多元回归方程为:
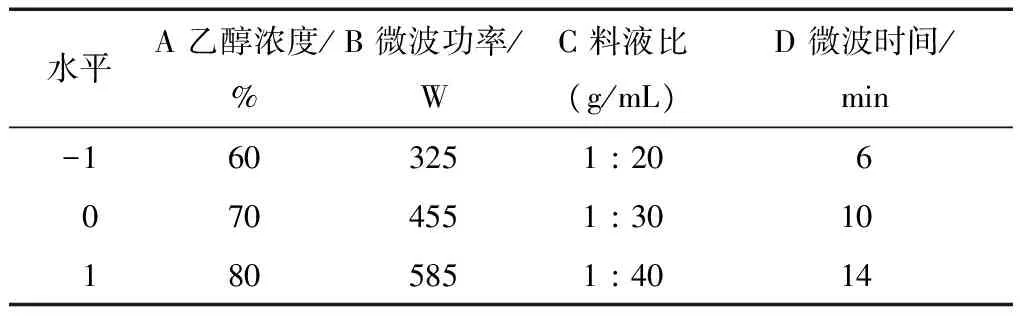
表1 响应面试验因素和水平
Y=26.26-0.47A-0.49B+0.33C-0.13D-0.026AB+0.16AC-0.55AD+0.47BC+0.43BD-1.00CD-0.80A2-0.89B2-0.70C2-1.42D2。
(3)
藜麦皮总皂苷得率回归模型的方差及显著性分析见表3。
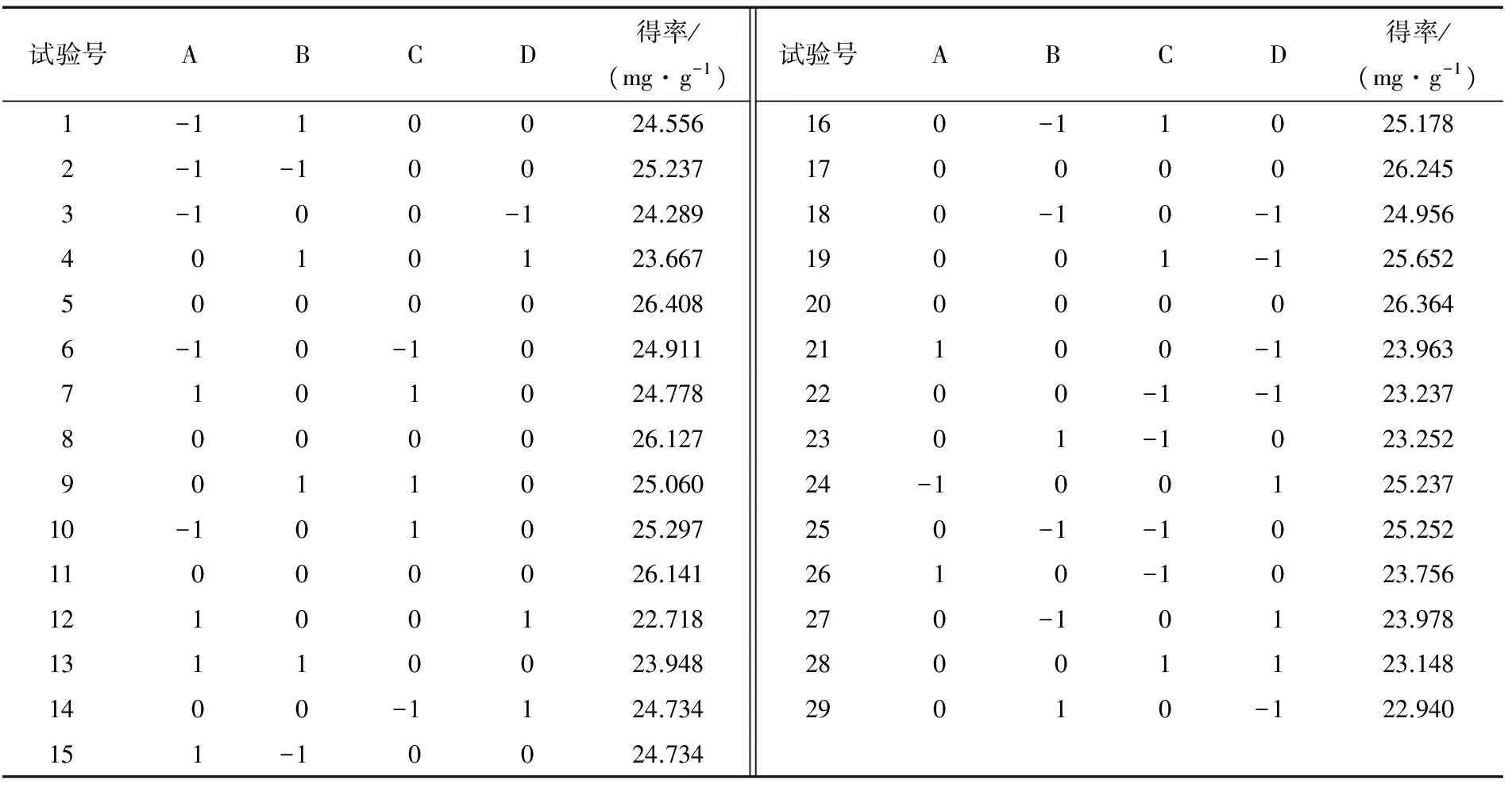
表2 响应面试验设计及结果
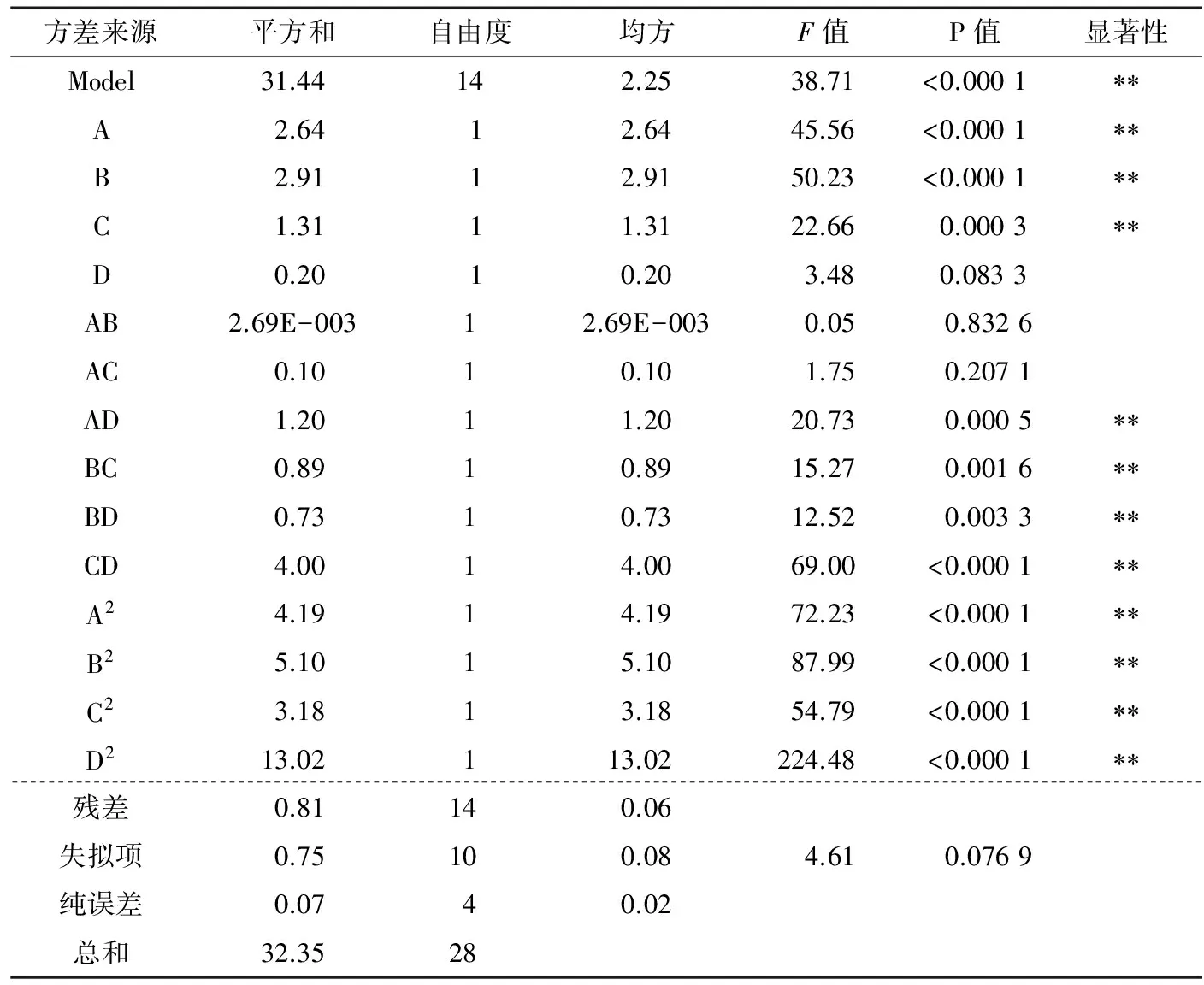
表3 回归模型方差分析†
†表示显著(P<0.05);表示极显著(P<0.01);R2= 0.974 8;;C.V%=0.98。
2.2.2 因素交互作用分析 用Design Expert 8.0.6.1软件根据回归方程进行绘图分析,得各因素间交互作用响应面及等高线图见图6~11。曲面倾斜度越高,即坡度越陡,说明两者交互作用越显著,等高线图越椭圆,则说明交互作用越显著[18]。由图6~11看出,CD、AD、BC、BD交互影响作用显著,与模型的方差分析结果一致。
2.2.3 验证实验 由回归方程得到藜麦皮总皂苷微波辅助提取最佳工艺条件为:乙醇浓度68.12%,微波功率423.05 W,料液比1∶32.22 (g/mL),微波时间9.63 min。该工艺条件下,藜麦皮总皂苷理论预测提取得率为26.411 mg/g。为了检验试验结果的可靠性,进行验证实验。考虑试验因素的实际可操作性,将上述工艺修正为:乙醇浓度68%,微波功率455 W,料液比1∶32 (g/mL),微波时间10 min,进行3次平行实验,测得总皂苷平均得率为26.329 mg/g,RSD为0.48%。与理论预测值基本相符,说明优化的提取工艺条件可靠,具有实际应用价值。
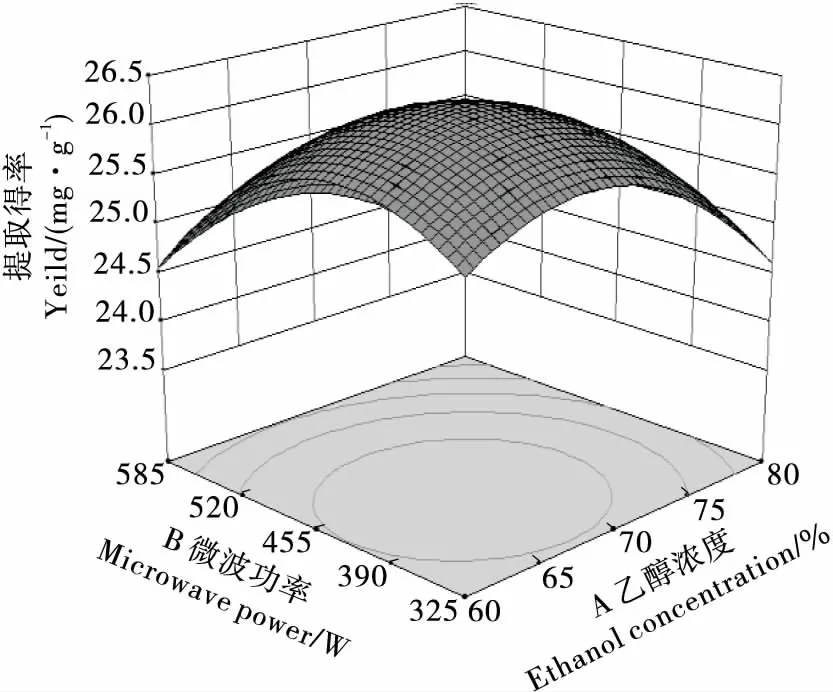
图6 乙醇浓度与微波功率的交互作用Figure 6 Interactive effects of ethanol concentraction and microwave power
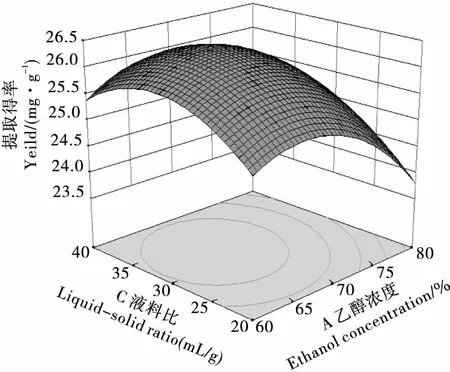
图7 乙醇浓度与料液比的交互作用Figure 7 Interactive effects of ethanol concentraction and solid-liquid ratio
2.3 藜麦皮总皂苷抗氧化活性分析
2.3.1 藜麦皮总皂苷对DPPH•的清除率 由图12可知,随藜麦皮总皂苷浓度的增加,对DPPH•的清除率增大,两者呈明显的量效关系。在测定浓度范围内,由SPSS 20.0软件多因素方差分析知,藜麦皮总皂苷与VC清除DPPH•能力具有显著差异(P<0.05),即藜麦皮总皂苷清除DPPH•能力明显低于VC,但藜麦皮总皂苷对DPPH•最大清除率仍达80.44%,IC50为34.74 μg/mL,表明藜麦皮总皂苷具有一定的DPPH•清除能力及抗氧化活性。
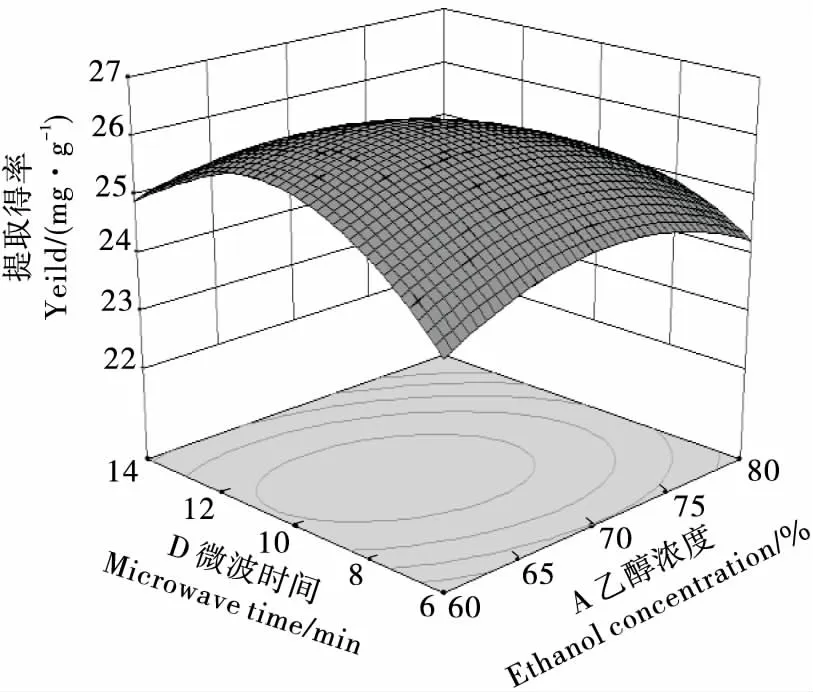
图8 乙醇浓度与微波时间的交互作用Figure 8 Interactive effects of ethanol concentraction and microwave time
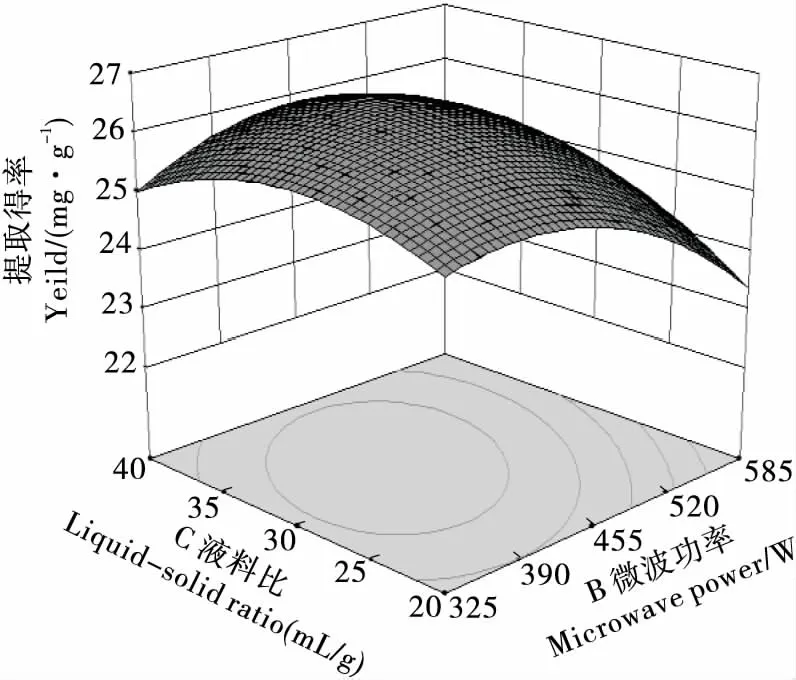
图9 料液比与微波功率的交互作用Figure 9 Interactive effects of solid-liquid ratio and microwave power

图10 微波时间与微波功率的交互作用Figure 10 Interactive effects of microwave time and microwave power
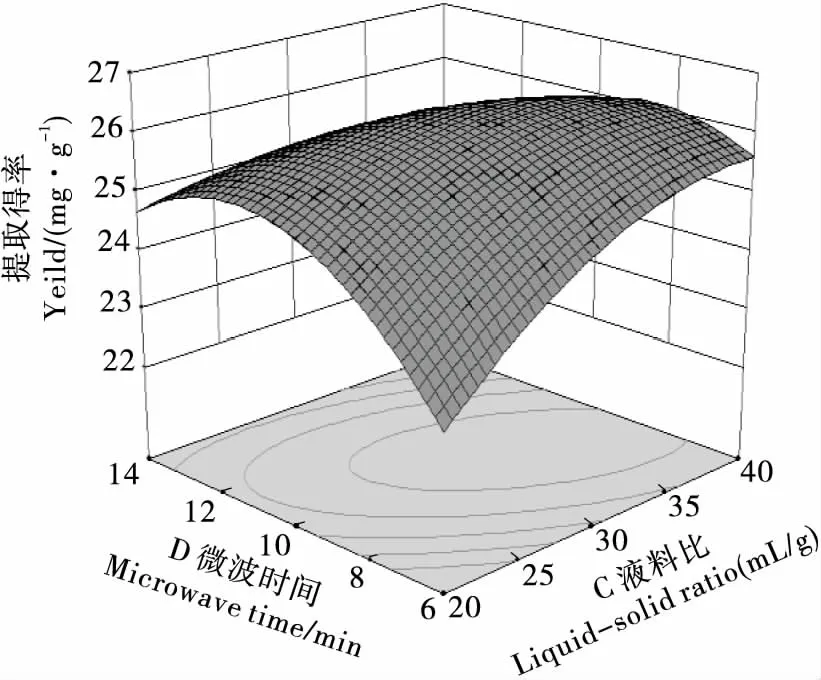
图11 微波时间与料液比的交互作用Figure 11 Interactive effects of microwave time and solid-liquid ratio
2.3.2 藜麦皮总皂苷对ABTS+•的清除率 由图13可知,藜麦皮总皂苷对ABTS+•的清除率随着浓度的增加而增大。SPSS 20.0软件ANOVA多因素方差分析知,在测定浓度范围内,尽管藜麦皮皂苷对ABTS+•的清除率远低于VC,具有显著差异(P<0.05),但藜麦皮总皂苷对ABTS+•最大清除率仍达59.16%,IC50为48.18 μg/mL,也表明藜麦皮总皂苷具有一定的ABTS+•清除能力及抗氧化活性。
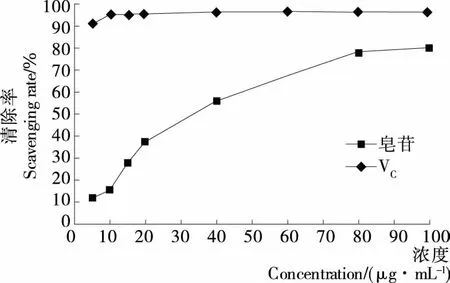
图12 藜麦皮总皂苷对DPPH•的清除率Figure 12 Scavenging rate of total saponins on DPPH •
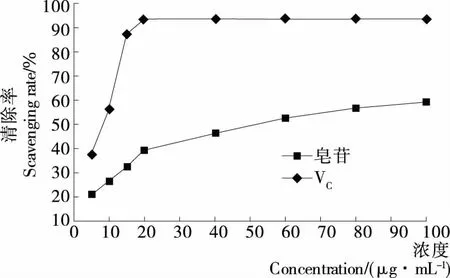
图13 藜麦皮总皂苷对ABTS+•的清除率Figure 13 Scavenging rate of total saponins on ABTS+•
2.3.3 藜麦皮总皂苷对•OH的清除率 由图14可知,随藜麦皮总皂苷浓度的增加,对•OH的清除率增强。由SPSS 20.0软件ANOVA单因素方差分析知,浓度对藜麦皮总皂苷和VC清除•OH能力有显著的影响(P<0.05)。当藜麦皮总皂苷浓度为100 μg/mL时,对•OH的清除率最大可达94.07%,IC50为5.45 μg/mL,而VC的IC50为9.79 μg/mL,藜麦皮总皂苷清除•OH能力强于VC,且具有显著差异(P<0.05)。表明藜麦皮总皂苷具有较强的•OH清除能力及抗氧化活性。
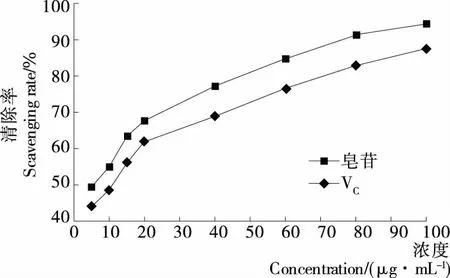
图14 藜麦皮总皂苷对•OH的清除率Figure 14 Scavenging rate of total saponins on •OH
3 结论
本试验采用微波辅助提取藜麦皮总皂苷,在单因素试验基础上采用Box-Behnken响应面法优化了藜麦皮总皂苷的提取工艺。结果表明,最优提取工艺条件为:乙醇浓度68%,微波功率455 W,料液比1∶32 (g/mL),微波时间10 min,提取次数2次。该条件下藜麦皮总皂苷得率为26.329 mg/g。采用SPSS 20.0软件对抗氧化试验数据进行方差分析,结果显示浓度对藜麦皮总皂苷自由基清除能力具有显著影响(P<0.05),随着浓度的增加其清除能力增强,清除DPPH•、ABTS+•和•OH的IC50分别为34.74,48.18,5.45 μg /mL,表明藜麦皮总皂苷具有较强的自由基清除能力及抗氧化活性,因此藜麦总皂苷的开发利用及其中抗氧化有效单体成分的发现值得进一步深入研究。
[1] 杜静婷, 陈超, 范三红. 响应面优化藜麦糠皂苷的提取及抗氧化活性[J]. 山西农业科学, 2016, 44(7): 932-937.
[2] 郭晓凤. 试论藜麦的推广前景及栽培技术[J]. 现代农业, 2015(2): 61-63.
[3] KULJANABHAGAVAD T, THONGPHASUK P, CHAMULITRAT W, et al. Triterpene saponins from Chenopodium quinoa Wild[J]. Phytochemistry, 2008, 69(9): 1 919-1 926.
[4] 王晨静, 赵习武, 陆国权, 等. 藜麦特性及开发利用研究进展[J]. 浙江农业大学学报, 2014, 31(2): 296-301.
[5] 欧阳凯, 何先元, 陈飞, 等. 四齿四棱草总皂苷提取工艺优化及抗氧化性研究[J]. 食品与机械, 2016, 32(7): 141-145.
[6] 俞琦, 蔡琨, 田维毅. 合欢皮总皂苷对H22荷瘤小鼠细胞免疫功能的影响[J]. 中国实验方剂学杂志, 2016, 22(15): 143-148.
[7] 张新宇, 张笛, 王琳, 等. 绞股蓝皂苷提取纯化工艺研究进展[J]. 食品工业科技, 2014, 35(18): 378-382, 386.
[8] 程轶群, 张帆, 周守标, 等. 超声-微波联合提取绞股蓝皂苷工艺优化及协同作用分析[J]. 食品与机械, 2016, 32(9): 135-140.
[9] 陈铁壁, 肖乐, 杨盟盟, 等. 金桂花中总黄酮的微波辅助提取工艺优化[J]. 食品与机械, 2015, 31(3): 185-188.
[10] 曾红亮, 黄灿灿, 常青, 等. 金柑多糖微波辅助提取工艺优化及抑菌效果[J]. 食品与机械, 2016, 32(9): 154-160.
[11] 黄琦, 王启越, 李颖, 等. 石榴皮总多酚的微波辅助提取工艺及抗氧化活性研究[J]. 食品研究与开发, 2016, 37(12): 46-51, 61.
[12] 师萱, 阎语, 梁旭明, 等. 银耳菌糠黑色素微波辅助提取工艺优化及其抗氧化活性[J]. 食品与机械, 2016, 32(12): 161-165, 174.
[13] 赵文婷. 藜麦皮总皂苷的提取纯化及其抗氧化和免疫增强作用[D]. 太谷: 山西农业大学, 2015: 12.
[14] 陈洪彬, 杨敏, 宋露露, 等. 龙须菜多酚提取工艺及其体外抗氧化活性[J]. 食品与机械, 2017, 33(4): 139-143, 194.
[15] 白海娜, 王振宇, 刘瑞海, 等. 白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J]. 现代食品科技, 2014, 30(3): 64-68.
[16] 王晓波, 李金芳, 王梅, 等. 山竹壳总黄酮抗氧化及抑制亚硝化作用研究[J]. 食品研究与开发, 2013, 34(6): 9-13.
[17] 吴德智, 郑强, 李安, 等. 缬草总黄酮超声辅助双水相提取工艺优化及抗氧化活性研究[J]. 食品与机械, 2017, 33(5): 162-167.
[18] 蒋玉蓉, 袁俊杰, 孙雪婷, 等. 藜麦叶片多糖最佳提取工艺及抗氧化性研究[J]. 中国食品学报, 2017, 17(2): 110-118.
