miR-567在胰腺癌细胞中的表达及其作用机制
2017-03-23张婷赵顺玉孔双喜
张婷,赵顺玉,孔双喜
(华中科技大学同济医学院附属武汉中心医院 肿瘤科,湖北 武汉 430014)
胰腺癌是种高度恶性的肿瘤,在肿瘤致死疾病中高居第4位[1]。近年来,胰腺癌的发病率呈不断上升趋势,多数患者在诊断时已处于晚期,预后较差。据统计,我国胰腺癌患者5年生存率仅1%~3%[2]。因此,对胰腺癌发生分子机制的探索,将为寻求新的诊断和预后标志物、开发新的治疗策略提供新的思路和依据。microRNA(miRNA)是一类内源性的长约22个核苷酸的高度保守性非编码RNA分子[2]。在调控基因表达方面具有重要作用,往往通过碱基配对绑定到靶基因3'UTR非翻译区,导致靶基因降解或翻译抑制[3]。miRNA能调控约60%的蛋白编码基因[4],广泛参与细胞分化、生长、发育等多种生物学过程[5]。miRNA在多种人类疾病中呈异常表达,尤其是肿瘤,其异常表达与肿瘤发生发展紧密相关[6]。研究[7]表明,miR-567失调促进乳腺癌的发生,影响肿瘤细胞增殖和迁移。但是miR-567在胰腺癌中的生物学作用尚不清楚。
本研究旨在对miR-567在胰腺癌细胞系中的表达水平进行鉴定,同时采用慢病毒转染诱导过表达分析miR-567对胰腺癌细胞增殖、凋亡及迁移能力的影响。
1 材料与方法
1.1 实验材料
正常胰腺导管上皮细胞系HPDE6-C7及胰腺癌细胞系Panc-1、AsPC-1、HPAC、BxPC-3均购自北京协和医学院细胞库,Cell Counting Kit-8购自碧云天生物科技有限公司,Annexin V/PI凋亡检测试剂盒购自天津三箭生物技术有限公司,胎牛血清及RPMI-1640培养基均购自美国Roswell公司,TRIzol购自美国Invitrogen公司,TaqMan Real-Time PCR Master Mixes购自美国Thermo Fisher Scientific公司,2×SYBR Green qPCR试剂盒购自北京索莱宝科技有限公司,All-in-One microRNA试剂盒购自美国BD公司,实验所需的KPNA4、Caspase 3、Bax及GAPDH一抗均购自美国BD公司,二抗均购自武汉博士德生物科技有限公司。
1.2 实验方法
1.2.1 慢病毒包装与纯化 miR-567慢病毒载体构建,以人的基因组为模板,用下述引物扩增前体 hsa-mir-567 MI0003573。miR-567_F(Xho I):5'-CCG CTC GAG GGA TTC TTA TAG GAC AGT AT-3';miR-567_R:5(BamHI)'- AGC GGA TCC AGC AAT AAC TTT TTT TTT TTT TAG T-3',得到前体hsa-mir-567片段后,以Xho I/BamHI克隆到pGMLV-PE1 miR过表达慢病毒载体,测序正确后即得到hsa-miR-567的慢病毒过表达载体。然后进行慢病毒包装和感染细胞。空载体慢病毒感染组为NC组。慢病毒包装使用第二代体系,12 µg pGMLV-PE1 hsa-miR-567 与 CON 载 体、9 µg pSPAX2、3 µg PMD2G 载体转入 293t细胞后,收集48 h上清,即得到病毒上清,病毒上清使用PEG纯化,将病毒上清与PEG体积比4:1混合后,4度沉淀过夜,3 000r/min离心 30min,去上清,沉淀使用无血清1640培养基重悬。
1.2.2 细胞培养、转染及分组 将正常胰腺导管上皮细胞系HPDE6-C7及胰腺癌细胞系Panc-1、AsPC-1、HPAC、BxPC-3种植于 RPMI-1640培养基(含10%胎牛血清),于37℃、5% CO2培养箱中培养。并将Panc-1细胞系分成3组,miR-567转染组、空载体转染组及空白对照组,分别用含pGMLV-PE1 miR过表达慢病毒载体的慢病毒、空载体慢病毒感染miR-567转染组及空载体转染组细胞,作为空白对照,空白对照组不转染,加PBS做对照。病毒感染复数为10 MOI(病毒:细胞=10:1),培养48 h后行后续实验。
1.2.3 RNA提 取 及 qRT-PCR ⑴ miR-567相对表达量检测:用All-in-One microRNA抽提试剂盒和All-in-One miRNA qRT-PCR 检测试盒提取和分离正常胰腺导管上皮细胞系HPDE6-C7及胰腺癌细胞系miRNA后,使用TaqMan Real-Time PCR Master Mixes 检 测 Panc-1、AsPC-1、HPAC、BxPC-3中miRNA-567的 表 达, 检 测系 统 为 ABI 7500 fast,miRNA QPCR 引 物 购 自Exiqon 公 司(Euroclone,Italy)(Accession No.MI0003573),以U6小核RNA作为内参,使用2−ΔΔCt方法定量,量化miR-567相对表达量。⑵ KPNA4 mRNA检测:使用Trizol提取细胞总RNA后,使用qRT-PCR检测miR-567转染组及空载体转染组细胞中KPNA4 mRNA的相对表达水平,KPNA4 正向引物:5'-CAG GAG ATT CTT CCA GCC CTT TGT GT-3'; 反 向 引 物:5'-ATT ACC ATC TGT ATT TGT TCA TTG CCA GCA TC-3',GAPDH 正 向 序 列:5'-TAT GCT CTC CTC ATG CAT TG-3'; 反 向 序 列 5'-GGG ACG ACC TTC GAT CTA CC-3', 按 TAKARA SYBR Premix Ex Taq反应体系进行PCR扩增反应。以GAPDH基因为内参,采用 2−ΔΔCt法计算 KPNA4 mRNA 的相对表达量,实验重复3次,取平均值。
1.2.4 细胞增殖检测 采用CCK-8法,将miR-567转染组、空载体转染组及空白对照组3组细胞消化成单细胞悬液后,按每孔2×103个细胞接种于96孔板上,培养基体积为200 µL。培养24 h后加入 5 mg/mL CCK-8 溶液 40 µL,孵育 4h 后每孔加入200 µL DMSO,摇床上充分震荡。在转染1、2、3、4 d后于450 nm波长测定吸光度值。重复3次,取平均值,作细胞增殖曲线。
1.2.5 细胞凋亡检测 采用Annexin V/PI染色检测,将miR-567转染组、空载体转染组及空白对照组3组细胞消化成单细胞悬液后,PBS清洗2次,并使用Binding Buffer重悬,加入相应比例的Annexin V抗体,避光染色10min后加入适量PBS溶液以及PI染料,流式细胞仪检测Annexin V阳性细胞比例来确定细胞凋亡的变化。
1.2.6 细胞划痕实验 将miR-567转染组、空载体转染组两组细胞接种于6孔板,培养24 h,胰蛋白酶消化细胞,待细胞长至融合后,用200 µL Tips枪头沿培养孔划直线,计算划痕后0、48 h划痕面积,并计算划痕愈合率,实验在标准状态下重复3次,取均值。划痕愈合率=(划痕后即刻的划痕面积-划痕后48 h的划痕面积)/划痕后即刻的划痕面积×100%。迁移能力越强,划痕愈合率越高。
1.2.7 Western blot 将miR-567转染组、空载体转染组两组细胞使用RIPA细胞裂解液冰上裂解30min后,加入相应比例蛋白上样缓冲液,煮沸10min,按 30 µg 的量上样,加入 Western blot预制胶,50 V恒压待样本溴酚蓝跑至浓缩胶与分离胶分界线时,切换至120 V恒压,溴酚蓝跑至胶板底部时,400 mA恒流将蛋白样本转至PVDF膜上, 加 KPNA4(1:200)、caspase-3(1:200)、Bax(1:200)及 GAPDH(1:200)一抗,37℃孵育4 h,二抗(1:500)孵育过夜,ECL液显影,Quantity One 1-D分析软件对蛋白质印迹条带进行定量。目的蛋白相对表达量=目的蛋白测定值/GAPDH,实验重复3次,取平均值。
1.3 统计学处理
数据处理用SPSS 17.0统计软件和Graph软件,计量资料以均数±标准差(±s)表示,比较采用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-567在胰腺癌细胞系中低表达
设miR-567在正常胰腺导管上皮细胞系HPDE6-C7中相对表达量为1.0,在胰腺癌细胞系Panc-1、AsPC-1、HPAC、BxPC-3的相对表达量分别为0.27±0.06、0.34±0.041、0.44±0.033、0.53±0.08,miR-567在胰腺癌细胞系中的表达均明显低于正常胰腺导管上皮细胞系HPDE6-C7(均P<0.05)(图1)。

图1 miR-567在胰腺癌细胞及正常胰腺导管上皮细胞中的表达 注:1)与HPDE6-C7比较,P<0.05Figure 1 miR-567 in pancreatic carcinoma and normal pancreatic cell line Note: 1) P<0.05 vs. HPDE6-C7
2.2 miR-567过表达抑制Panc-1细胞增殖并促进凋亡
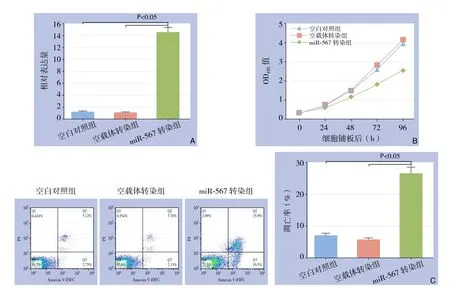
图2 miR-567慢病毒转染对Panc-1细胞miR-567表达及、增殖、凋亡的影响 A:miR-567相对表达量;B:细胞增殖曲线;C:细胞凋亡检测Figure 2 In fl uence of miR-567 lentivirus vector transfection on miR-567 expression, proliferation and apoptosis in Panc-1 cells A: Relative expression level of miR-567; B: Cell growth curves; C: Cell apoptosis analysis
qRT-PCR检测显示,miR-567转染组miR-567的相对表达量为14.53±0.81,明显高于空白对照组(P<0.001),空载体转染组与空白对照组miR-567相对表达量差异无统计学意义(P>0.05)(图2A)。CCK8实验结果显示,miR-567转染组在铺板48 h之后的时间点,OD450值明显小于空白对照组(均P<0.05),空载体转染组与空白对照组各时间点OD450值差异均无统计学意义(均P>0.05)(图2B)。流式细胞凋亡检测结果显示,miR-567转染组凋亡率为26.7%,空白对照组为7.1%,空载体转染组为5.7%,miR-567转染组凋亡率显著高于空载体转染组(P<0.001),空白对照组和空载体转染组凋亡率差异无统计学意义(P>0.05)(图2C)。
2.3 miR-567过表达抑制Panc-1细胞迁移
细胞划痕实验结果显示,miR-567转染组划痕愈合率为(42.7±2.9)%,空载体转染组为(73.50±5.3)%,差异有统计学意义(P<0.01)(图3)。
2.4 miR-567过表达对KPNA4及凋亡相关蛋白表达的影响
以空载体转染组为对照,设其各指标的表达量为1,qRT-PCR检测KPNA4 mRNA显示示,miR-567转染组KPNA4 mRNA相对表达量为0.35±0.045;Western blot显示,miR-567转染组KPNA4蛋白相对表达量为0.43±0.079、caspase-3蛋白相对表达量为3.70±0.29、Bax蛋白相对表达量为3.35±0.21,差异均有统计学意义(均P<0.05)(图4)。
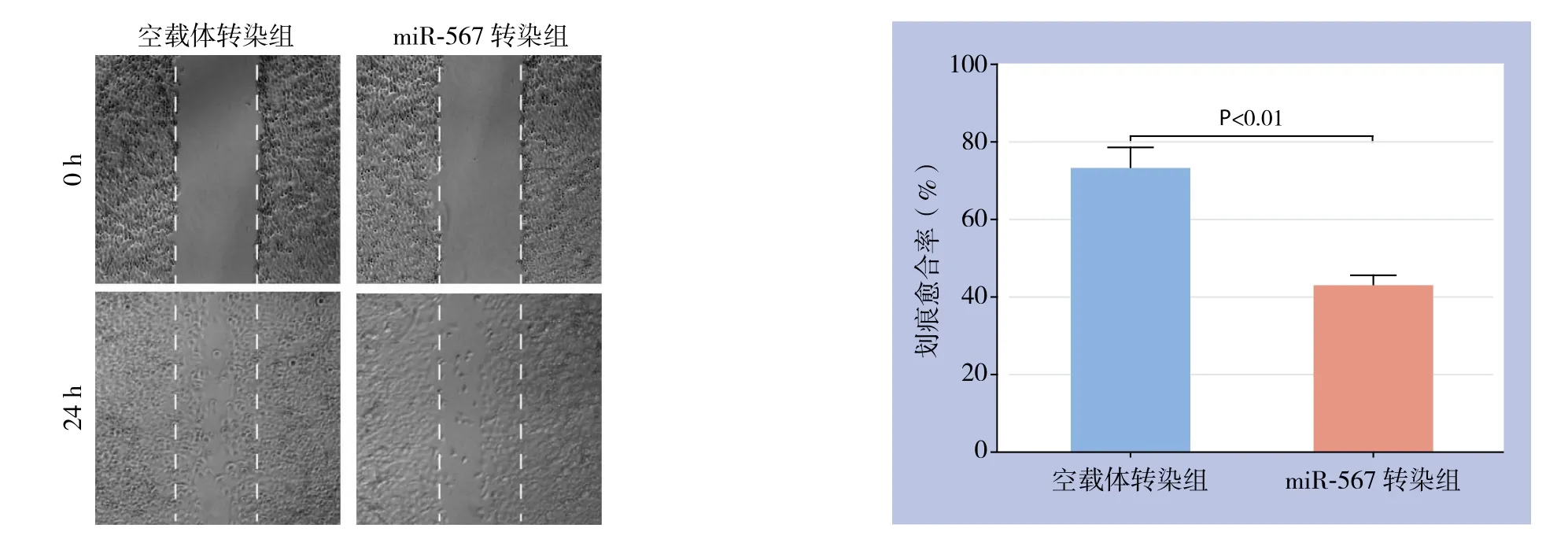
图3 细胞划痕实验检测miR-567过表达对Panc-1细胞迁移的影响Figure 3 Determination of in fl uence of miR-567 overexpression on migration of Panc-1 cells by scratch wound healing assay
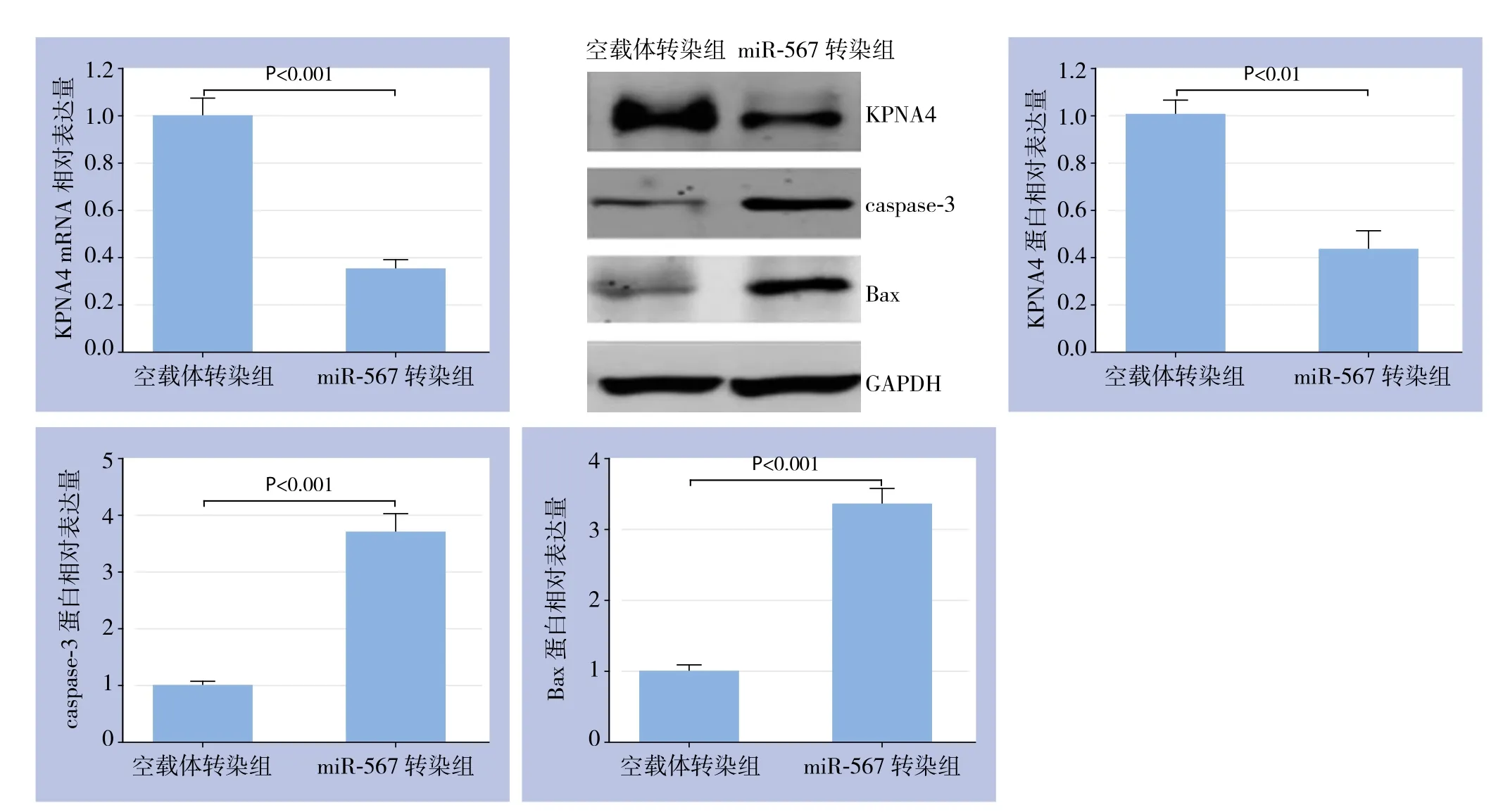
图4 KPNA4、caspase-3及Bax表达检测Figure 4 Detection of expressions of KPNA4 and apoptosis-associated proteins
3 讨 论
胰腺癌是一种高度侵袭性恶性肿瘤,患者常无明显症状,诊断时多处于晚期且常伴有淋巴结、远处转移、血管侵泛等[8]。miRNA表达失调普遍存在于在肿瘤中,包括胰腺癌[8]。比如,miR-200基因簇过表达阻碍卵巢癌细胞迁移,且可作为卵巢癌预后的标志物[9]。miR-128通过调控干细胞再生因子Bmi-1,抑制胶质瘤增殖和自我更新[10]。miR-17-5p通过抑制AIB1 mRNA的翻译,进而调控乳腺癌细胞增殖[11]。多顺反子miRNA簇miR-17-92在肺癌中过表达,能促进细胞增殖[12]。因此,探索失调miRNA的功能对于了解胰腺癌分子发生机制非常关键。研究发现,miR-567在G3级乳腺癌患者中表达低于G1级,在预后差的患者中表达低于预后较好的患者,且过表达后能显著抑制肿瘤生长、增殖和迁移[7]。本研究发现miR-567在胰腺癌细胞系中的表达显著低于正常胰腺细胞系,意味着miR-567可能作为抑癌基因参与胰腺癌发生发展过程。通过对慢病毒介导的miR-567过表达的生物学行为分析,发现Panc-1细胞的增殖和迁移能力受到显著抑制,并可促进细胞凋亡,由此证实miR-567在胰腺癌和乳腺癌中发挥类似的抑癌作用。
Bertoli等[7]还发现miR-567是核转运受体蛋白KPNA4的负调控因子,通过调控KPNA4基因的表达控制乳腺癌细胞增殖和转移。为探讨KPNA4与miR-567在胰腺癌中的关联,本研究采用qRT-PCR及Western blot检测了KPNA4的mRNA和蛋白表达水平,结果显示KPNA4基因转录和翻译水平受miR-567过表达的影响而下调。这表明,在胰腺癌中,miR-567也是KPNA4的负调控因子,推测miR-567过表达对胰腺癌细胞增殖和迁移的抑制作用也是通过降低KPNA4的表达实现的。研究[13]报道,前列腺癌KPNA4敲除后,显著降低前列腺癌细胞迁移能力,同时前列腺癌小鼠模型的瘤体侵袭和远端转移能力也受到明显抑制。这更进一步表明,KPNA4是作为促癌基因参与多种肿瘤发生发展过程,包括乳腺癌、胰腺癌、前列腺癌。
KPNA4能介导细胞核转录因子κB(NF-κB)从细胞质转运到细胞核,激活NF-κB响应基因[14]。NF-κB转录因子广泛参与多种生物学响应,在调节免疫反应和炎症方面起重要作用[15]。但越来越多的研究发现,NF-κB在多种人类恶性肿瘤中异常表达或活化,参与调控细胞增殖、转移、凋亡等多种生物过程相关的基因表达[16]。NF-κB信号途径受抑制将导致一系列抗凋亡蛋白的表达受损,如Bcl、细胞凋亡抑制蛋白2及Bcl-xL[17]。研究[18]发现,NF-κB在前列腺癌细胞中失活与血管生成、侵袭、转移受抑有密切关系。NF-κB活性与裸鼠人黑色素瘤肿瘤模型的生长、血管生成、转移相关[19]。另外,在血管内皮细胞中,miR-181b通过靶向KPNA4成为下游NF-κB信号通路的调节因子[20]。在本研究中,miR-567可能也像miR-181b那样通过调控KPNA影响NF-κB信号通路的转导,笔者推测NF-κB的核转位过程因KPNA4低表达而受到阻碍,扰乱一系列增殖、转移及抗凋亡基因的表达,从而有助于抑制胰腺癌细胞增殖和转移。
之前的研究还发现,KPNA4通过调控肿瘤微环境中肿瘤坏死因子TNF-α和TNF-β介导的细胞因子的相互作用,从而促进前列腺癌的转移[13]。笔者猜测,miR-567在胰腺癌中过表达后,由于KPNA4表达水平的降低,降低了TNF-α和TNF-β的分泌,影响了它们介导的细胞因子调控网络,改变肿瘤微环境,因而有助于抑制胰腺癌细胞增殖和转移。
细胞凋亡途径包括两条,即由肿瘤坏死因子受体1及TRAIL-R1等死亡受体介导的外源性途径[21],及由各种刺激所导致的线粒体外膜通透性改变的内源性途径[22]。而caspase-3、caspase-8为两条途径的共同执行者,当细胞发生凋亡时,DNA修复终止,核酸内切酶得以活化,DNA发生裂解,细胞骨架蛋白破坏,细胞形态失去正常。BAX亚家族起促凋亡的作用,主要包括BAK和BAX[23]。caspase-3和BAX作为细胞凋亡的标志物,在凋亡过程中上调表达,本研究发现,miR-567过表达后,caspase-3和BAX上调表达,其凋亡的机制可能是通过上调caspase-3和BAX而实现的。
本研究也存在着一些不足之处,比如miR-567-KPNA4介导的下游肿瘤相关信号通路如何,miR-567与胰腺癌患者无瘤生存率、总生存率及预后的关系如何,在基因敲除鼠中的动物实验结果如何,都值得进一步研究。
综上,miR-567在胰腺癌细胞系中低表达,miR-567高表达可抑制胰腺癌细胞增殖和迁移,并诱导凋亡,其机制可能与下调KPNA4及上调caspase-3和BAX表达有关,这可能为将来开发新的诊断和预后标志物、研发新的肿瘤靶向药物提供一定的思路。
[1]Ouyang H, Gore J, Deitz S, et al. microRNA-10b enhances pancreatic cancer cell invasion by suppressing TIP30 expression and promoting EGF and TGF-β actions[J]. Oncogene, 2014,33(38):4664–4674. doi: 10.1038/onc.2013.405.
[2]Chen CZ, Li L, Lodish HF, et al. MicroRNAs modulate hematopoietic lineage differentiation[J]. Science, 2004,303(5654):83–86.
[3]Williams AE, Perry MM, Moschos SA, et al. Role of miRNA-146a in the regulation of the innate immune response and cancer[J].Biochem Soc Trans, 2008, 36(Pt 6):1211–1215. doi: 10.1042/BST0361211.
[4]Zhang LY, Liu M, Li X, et al. m miR-490–3p modulates cell growth and epithelial to mesenchymal transition of hepatocellular carcinoma cells by targeting endoplasmic reticulum-Golgi intermediate compartment protein 3 (ERGIC3)[J]. J Biol Chem,2013, 288(6):4035–4047. doi: 10.1074/jbc.M112.410506.
[5]Ambros V. The functions of animal microRNAs[J]. Nature, 2004,431(7006):350–355.
[6]Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A, 2004,101(9):2999–3004.
[7]Bertoli G, Cava C, Diceglie C, et al. MicroRNA-567 dysregulation contributes to carcinogenesis of breast cancer, targeting tumor cell proliferation, and migration[J]. Breast Cancer Res Treat, 2017,161(3):605–616. doi: 10.1007/s10549–016–4079–2.
[8]Yonemori K, Kurahara H, Maemura K, et al. MicroRNA in pancreatic cancer[J]. J Hum Genet, 2017, 62(1):33–40. doi:10.1038/jhg.2016.59.
[9]Hu X, Macdonald DM, Huettner PC, et al. A miR-200 microRNA cluster as prognostic marker in advanced ovarian cancer [J]. Gynecol Oncol, 2009, 114(3):457–464. doi: 10.1016/j.ygyno.2009.05.022.
[10]Godlewski J, Nowicki MO, Bronisz A, et al. Targeting of the Bmi-1 oncogene/stem cell renewal factor by microRNA-128 inhibits glioma proliferation and self-renewal[J]. Cancer Res, 2008,68(22):9125–9130. doi: 10.1158/0008–5472.CAN–08–2629.
[11]Hossain A, Kuo MT, Saunders GF. Mir-17–5p regulates breast cancer cell proliferation by inhibiting translation of AIB1 mRNA[J].Mol Cell Biol, 2006, 26(21):8191–8201.
[12]Hayashita Y, Osada H, Tatematsu Y, et al. A polycistronic microRNA cluster, miR-17–92, is overexpressed in human lung cancers and enhances cell proliferation[J]. Cancer Res, 2005,65(21):9628–9632.
[13]Yang J, Lu C, Wei J, et al. Inhibition of KPNA4 attenuates prostate cancer metastasis[J]. Oncogene, 2017, 36(20):2868–2878. doi:10.1038/onc.2016.440.
[14]Zannini L, Lecis D, Lisanti S, et al. Karyopherin-alpha2 protein interacts with Chk2 and contributes to its nuclear import [J]. J Biol Chem, 2003, 278(43):42346–42351.
[15]Geymayer S, Doppler W. Activation of NF-kappaB p50/p65 is regulated in the developing mammary gland and inhibits STAT5-mediated beta-casein gene expression[J]. FASEB J, 2000,14(9):1159–1170.
[16]Dolcet X, Llobet D, Pallares J, et al. NF-kB in development and progression of human cancer[J]. Virchows Arch, 2005, 446(5):475–482.
[17]Hinz M, Löser P, Mathas S, et al. Constitutive NF-kappaB maintains high expression of a characteristic gene network, including CD40,CD86, and a set of antiapoptotic genes in Hodgkin/Reed-Sternberg cells[J]. Blood, 2001, 97(9):2798–2807.
[18]Huang S, Pettaway CA, Uehara H, et al. Blockade of NF-kappaB activity in human prostate cancer cells is associated with suppression of angiogenesis, invasion, and metastasis[J]. Oncogene,2001, 20(31):4188–4197.
[19]Huang S, DeGuzman A, Bucana CD, et al. Nuclear factor-kappaB activity correlates with growth, angiogenesis, and metastasis of human melanoma cells in nude mice[J]. Clin Cancer Res, 2000,6(6):2573–2581.
[20]Wang H, Tao T, Yan W, et al. Upregulation of miR-181s reverses mesenchymal transition by targeting KPNA4 in glioblastoma[J]. Sci Rep, 2015, 5:13072. doi: 10.1038/srep13072.
[21]钟明, 魏玲玲, 杨显富. 外源性及内源性细胞凋亡机制研究进展[J]. 实用医院临床杂志, 2014, 11(2):170–174.Zhong M, Wei LL, Yang XF. Research progress in intrinsic and extrinsic mechanism of cell apoptosis[J]. Practical Journal of Clinical Medicine, 2014, 11(2):170–174.
[22]Tait SW, Green DR. Mitochondrial regulation of cell death[J]. Cold Spring Harb Perspect Biol, 2013, 5(9). pii: a008706. doi: 10.1101/cshperspect.a008706.
[23]Czabotar P E, Westphal D, Dewson G, et al. Bax crystal structures reveal how BH3 domains activate Bax and nucleate its oligomerization to induce apoptosis[J]. Cell, 2013, 152(3):519–531.doi: 10.1016/j.cell.2012.12.031.
