ROCKI/II在转化生长因子β1诱导的主动脉平滑肌细胞表型转化中的作用
2017-03-23汪海波高旭辉朱健郗二平张瑜王正刘子豪谢彪朱水波
汪海波,高旭辉,朱健,郗二平,张瑜,王正,刘子豪,谢彪,朱水波
(中国人民解放军广州军区武汉总医院 心胸外科,湖北 武汉 430070)
血管平滑肌细胞(vascular smooth muscle cells,VSMC)的表型转化与主动脉夹层(aortic dissection,AD)的发生发展密切相关[1]。VSMC的表型转化与VSMC增殖迁移密切相关,当VSMC发生由收缩型向合成型的转化后细胞的增殖迁移能力也相应增加。有研究[2]显示,转化生长因子β1(transforming growth factor β1,TGF-β1)可呈浓度依赖性诱导人主动脉VSMC增殖迁移,发生由收缩型向合成型的表型转化。前期实验研究[3]结果显示,TGF-β1可诱导人主动脉VSMC(HA-VSMC)发生增殖与迁移,且ROCKI基因对TGF-β1诱导的HA-VSMCs迁移可能有抑制作用,而ROCKI和ROCKII基因对TGF-β1诱导的HA-VSMCs增殖均无明显影响。本实验进一步观察ROCKI和ROCKII基因下调对TGF-β1诱导HA-VSMC收缩型标志物α-平滑肌肌动蛋白(smooth muscle α-actin,α-SMA)、平滑肌22α(smooth muscle 22α,SM22α)以及合成型标志物骨桥蛋白(osteopontin,OPN)表达的影响,从而探讨ROCKI和ROCKII基因在TGF-β1诱导HA-VSMC转化中的作用。
1 材料与方法
1.1 实验材料
细胞:HA-VSMC(美国ATCC公司)。主要试剂:TGF-β1(美国Peprotech公司);胎牛血清(杭州天杭生物科技有限公司);胰酶-EDTA(吉诺生物医药技术有限公司);DMEM高糖培养基(HyClone);PBS(吉诺生物医药技术有限公司);青霉素-链霉素溶液(100×)(吉诺生物医药技术有限公司);TRIzol Reagent(Invitrogen™);三氯甲烷、异丙醇以及无水乙醇(国药集团化学试剂);PrimeScript™RT reagent Kit with gDNA Eraser和SYBR® Premix Ex Taq™(TaKaRa);siRNA(广州锐博);Y-27632(美国Selleck);Opti-MEM I Reduced serum medium(美国Gibco);Lipofectamine 2000 Transfection Reagent(美国Invitrogen);GAPDH(ab37168)、α-SMA(ab124964)、SM22α(ab14106)以及O P N(ab91655)(abcam公司);HRP-Goat anti Rabbit(074-1506)(KPL);GNM14170型D-Hanks(吉诺生物医药技术有限公司)。主要仪器:SCO6WE型CO2恒温培养箱(SHEL LAB);SW-CJ-1FD型洁净工作台(苏净安泰);IX51型倒置显微镜(OLYMPUS);TGL-16c型台式离心机(上海安亭科学仪器厂);TGL-16型冷冻离心机(湖南湘仪仪器);IMS-20型制冰机(常熟市雪科电器有限公司);基因扩增仪TC-XP型PCR仪(杭州博日科技);StepOne™ Real-Time PCR System型荧光定量PCR仪(Life technologies)。
1.2 实验方法
1.2.1 细胞培养 在37 ℃、5%CO2条件下用含10%FBS的高糖DMEM培养基培养 HA-VSMCs。培养基按照1:100加入青链霉素混合液(含1000 U/mL青霉素和10 mg/mL链霉素)。HA-VSMC培养达85%~90%融合率时用胰酶消化细胞,用细胞计数板计数,稀释至所需浓度,按照需要进行细胞干预及后续实验。
1.2.2 siRNA转染 ⑴ 转染前1 d,胰酶消化收集细胞,加入不含抗生素的培养基,调整细胞密度为2×105/mL,以每孔2 mL接种至6孔板。转染时要求细胞汇合度为50%~60%。⑵ 转染液制备(siRNA储存液浓度为20 µM),每孔用量如下:用 190 µL Opti-MEI无血清培养基将 10 µL siRNA稀释,轻轻混匀。使用前轻轻摇匀Lipofectamine 2000,取 20 µL Lipofectamine 2000 在 18 µL 无血清培养基中稀释,室温孵育5 min。将前2步缩稀释的siRNA和Lipofectamine 2000混合(总体积400 µL),轻轻混匀,室温静置20 min。⑶ 将孔板内的培养基更换为不含FBS的DMEM培养基,转染孔加1.6 mL,空白孔加2 mL。⑷ 在需要转染的孔中加入400 µL转染液,轻轻摇匀。⑸ 37 ℃培养,转染4~6 h后,细胞换液为含FBS的DMEM培养基,24 h后倒置显微镜下观察转染效果(绿色荧光),记录图片;转染48 h后,用Western blot两种转染后的细胞、两种转染后的细胞加TGF-β1(5 ng/mL)处理以及HA-VSMC单纯TGF-β1(5 ng/mL)处理后ROCKI和ROCKII蛋白的表达。
1.2.3 ROCKI和ROCKII对TGF-β1诱 导的HA-VSMC表型转化 将细胞分成5组:⑴ 空白对照组(正常细胞在完全培养基中培养24 h);⑵ TGF-β1组(正常细胞在含5 ng/mL TGF-β1的完全培养基中培养24 h);⑶ ROCKI siRNA+TGF-β1组(转染ROCKI siRNA的 细胞在含5 ng/mL TGF-β1的完全培养基中培养24 h); ⑷ ROCKII siRNA+TGF-β1组( 转 染ROCKII siRNA的细胞在含5 ng/mL TGF-β1的完全培养基中培养24 h);⑸ Y-27632+TGF-β1组(正常细胞用10 µmol/mL ROCK非特异性抑制剂Y-27632预处理1 h,之后换培养液,在含5 ng/mL TGF-β1的完全培养基中培养24 h)。提取上述5组细胞内总蛋白进行Western blot和荧光定量PCR检测α-SMA、SM22α、OPN蛋白表达水平及mRNA表达表达水平。各实验重复3次。胶片扫描为TIF格式图片,AlphaEaseFC软件分析目标带的光密度值。
1.3 统计学处理
结果用SPSS软件做方差分析,不同组之间应用分析方法为ANOVA单因素方差分析,数据以均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结 果
2.1 ROCKI和ROCKII的siRNA转染结果以及转染后ROCKI和ROCKII蛋白的表达
HA-VSMC转染ROCKI和ROCKII的siRNA 24 h后,使用倒置显微镜观察转染结果,镜下可见大量转染成功的HA-VSMC(图1)。Western bolt检测结果显示,HA-VSMC转染ROCKI和ROCKII的siRNA 48 h后,细胞ROCKI和ROCKII蛋白表水平达较空白对照组明显降低(均P<0.05),TGF-β1处理能明显升高HA-VSMC中ROCKI蛋白表水平(P<0.05),但对ROCKII蛋白表水平明无明显影响(P>0.05),ROCKI siRNA转染+TGF-β1处理的细胞中ROCKI蛋白表水平也较单独TGF-β1处理的细胞明显降低(P<0.05)(图2)。
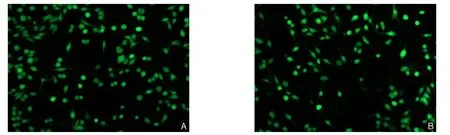
图1 荧光显微镜检测转染结果(×100) A:ROCKI siRNA转染;B:ROCKII siRNA转染Figure 1 Transfection results observed by fluorescence microscope (×100) A: ROCKI siRNA transfection; B: ROCKII siRNA transfection
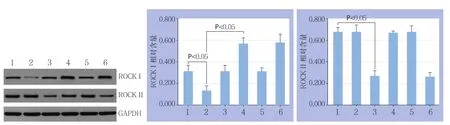
图2 Western bolt检测转染后ROCKI/II蛋白表达 1:空白对照组;2:ROCKI siRNA转染组;3:ROCKII siRNA转染组;4:TGF-β1组;5:ROCKI siRNA转染+TGF-β1组;6:ROCKII siRNA转染+TGF-β1组Figure 2 Western bolt detection for ROCKI/II protein expressions after transfection 1: Blank control group; 2: ROCKI siRNA transfection group; 3: ROCKII siRNA transfection group; 4: TGF-β1 treatment group; 5: ROCKI siRNA transfection+TGF-β1 treatment group; 6: ROCKII siRNA transfection+TGF-β1 treatment group
2.2 ROCKI和ROCKII对TGF-β1诱导的HAVSMC表型标志物蛋白表达的影响
与空白对照组比较,TGF-β1组收缩型VSMC的标志物α-SMA、SM22α蛋白表达量明显减少,而合成型VSMC的标志物OPN蛋白表达量明显增加(均P<0.05)。与TGF-β1组比较,ROCKI siRNA+TGF-β1组与Y-27632+TGF-β1组收缩型VSMC的标志物α-SMA、SM22α蛋白表达明显增加,而合成型VSMC的标志物OPN蛋白表达量减少(均P<0.05);与TGF-β1组比较,ROCKIIsiRNA+TGF-β1组的收缩型VSMC的标志物α-SMA、SM22α和合成型VSMC的标志物OPN的蛋白表达量均无明显差异(均P>0.05)(图3)。
2.3 ROCKI和ROCKII对TGF-β1诱导的HAVSMC表型标志物mRNA表达的影响
与空白对照组比较,TGF-β1组的收缩型VSMC的标志物α-SMA、SM22α的mRNA含量明显减少,而合成型VSMC的标志物OPN的mRNA含量明显增加(均P<0.05)。与TGF-β1组比较,ROCKI siRNA+TGF-β1组与Y-27632+TGF-β1组收缩型VSMC的标志物α-SMA、SM22α的mRNA含量明显增加,而合成型VSMC的标志物OPN的mRNA含量明显减少(均P<0.05);与TGF-β1组相比,ROCKII siRNA+TGF-β1组的收缩型VSMC的标志物α-SMA、SM22α和合成型VSMC的标志物OPN的mRNA含量均无明显差异(均P>0.05)(图4)。
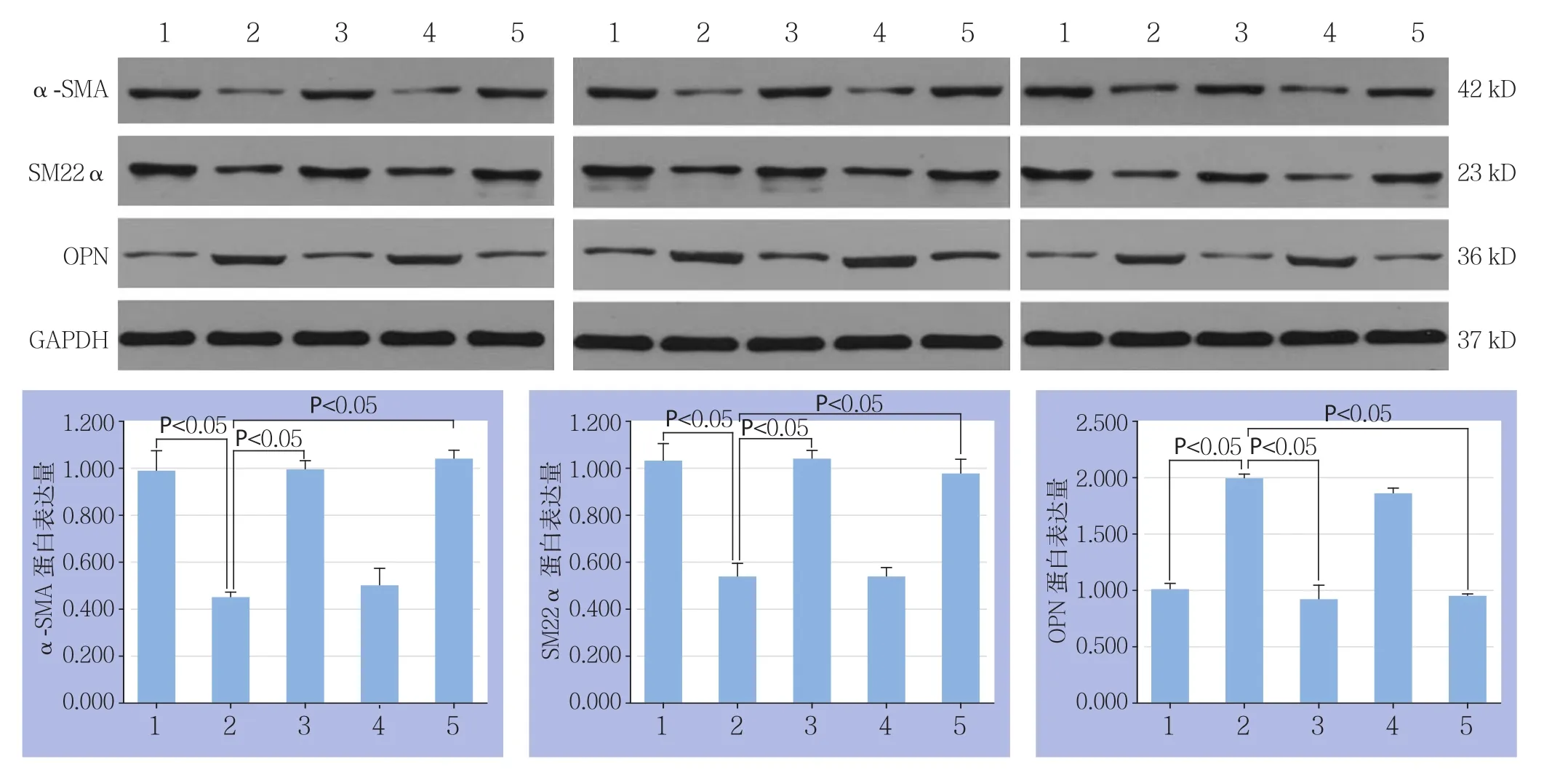
图3 Western bolt检测各组α-SMA、SM22α及OPN蛋白表达量 1:空白对照组;2:TGF-β1组;3:ROCKI siRNA转染+TGF-β1组;4:ROCKII siRNA转染+TGF-β1组;5:Y-27632+TGF-β1组Figure 3 Western bolt analysis for protein expressions of α-SMA, SM22α and OPN in each group 1: Blank control group; 2: TGF-β1 treatment group; 3: ROCKI siRNA transfection+TGF-β1 treatment group; 4: ROCK II siRNA transfection+TGF-β1 treatment group;5: Y-27632+TGF-β1 treatment group

图4 RT-PCR检测各组α-SMA、SM22α及OPN mRNA含量 1:空白对照组;2:TGF-β1组;3:ROCKI siRNA转染+TGF-β1组;4:ROCKII siRNA转染+TGF-β1组;5:Y-27632+TGF-β1组Figure 4 RT-PCR detection of mRNA expressions of α-SMA, SM22α and OPN in each group 1: Blank control group; 2: TGF-β1 treatment group; 3: ROCKI siRNA transfection+TGF-β1 treatment group; 4: ROCK II siRNA transfection+TGF-β1 treatment group;5: Y-27632+TGF-β1 treatment group
3 讨 论
AD是急诊中常见的危急重症,进展快且病死率高,多发生于青壮年男性[4]。近年来,随着生活水平的提高及社会压力的增加,国内AD的发生率呈逐年增加的趋势。有关AD的研究显示,AD的最初病变位于主动脉中膜层的平滑肌细胞[5-6]。相较于正常人,AD患者的VSMC增殖、迁移能力均增强,收缩型VSMC的标志物α-SMA、SM22α表达减少,而合成型VSMC的标志物OPN表达增加[7-9]。有研究[10]表明,在AD患者主动脉中膜层中TGF-β1的含量明显较正常人主动脉组织中高。在TGF-β1的作用下HA-VSMC可发生由收缩型向合成型的表型转化并且其增殖、迁移能力明显增强[2,11]。
ROCK是Rho下游的效应器之一。ROCK的分子结构包括氨基酸端的催化结构域,中间的Rho结合α卷曲螺旋结构域和羧基端PH结构域。当激活状态的Rho与ROCK的激酶结合结构域相互作用时,ROCK可发生多个氨基酸位点的磷酸化而被激活,从而引导其下游一系列磷酸化/脱磷酸化反应。ROCK蛋白在Rho/Rock信号通路中扮演重要作用,而该信号通路参与细胞的多种生物学行为,可调节细胞分裂、收缩、迁移、黏附、分泌等重要生命活动,是近年来研究比较热门的一条重要信号转导通路。ROCK包括ROCKI和ROCKII两种异构体,两者激酶区的同源性可达90%[12]。有研究[13]通过siRNA转染下调ROCKI和ROCKII基因表达证实,ROCKI在大鼠平滑肌细胞的迁移中起主导作用,而ROCKII的作用不明显;在大鼠平滑肌细胞的增殖中,两者的作用均不明显。此外,TGF-β1可通过Rho/ROCK信号通路刺激大鼠颈内平滑肌细胞(ISMC)表型转化[14]。因此,ROCKI/II在TGF-β1刺激的HA-VSMC表型转化中可能起到一定的作用。
本实验采用体外培养HA-VSMC,通过转染技术下调HA-VSMC的ROCKI和ROCKII基因表达,利用外源性TGF-β1刺激细胞。根据前期试验结果[2],本实验选择浓度为5 ng/mL的TGF-β1,作用时间为2 4 h。将细胞分为空白对照组、TGF-β1组,ROCKI siRNA+TGF-β1组,ROCKII siRNA+TGF-β1组和Y-27632+TGF-β1组进行Western bolt和RT-PCR检测。其中,Y-27632为ROCK非特异性抑制剂。选取收缩型VSMC标志物α-SMA、SM22α和合成型VSMC标志物OPN,采用Western bolt和RT-PCR技术检测相关VSMC表型转化的标志物。与空白对照组相比,TGF-β1组的α-SMA、SM22α蛋白表达量和mRNA表达量减少而OPN蛋白表达量和mRNA表达量均增加,进一步证实TGF-β1可诱导HA-VSMCs发生由收缩型向合成型转化。与TGF-β1组相比,ROCKI siRNA+TGF-β1组α-SMA、SM22α蛋白表达量和mRNA表达量增加而OPN蛋白表达量和mRNA表达量减少;ROCKII siRNA+TGF-β1组α-SMA、SM22α和OPN蛋白表达量和mRNA表达量均无显著差异。可见ROCKI基因下调可抑制TGF-β1诱导HA-VSMCs由收缩型向合成型转化的作用,而ROCKII基因下调后对TGF-β1诱导HAVSMC由收缩型向合成型转化的作用无明显影响。
综上,在TGF-β1诱导下的HA-VSMC表型转化中ROCKI起主要作用,而可能与ROCKII无关。此外,后续研究将通过稳转细胞系及过表达等技术进一步探究ROCKI和ROCKII对TGF-β1诱导HA-VSMC表型转化的影响,从而为进一步探讨HA-VSMC结构功能改变的分子机制及其与AD发病的关系提供了更多实验依据,为抑制HA-VSMCs表型转化提供潜在的治疗靶点,并为临床治疗AD提供一定的研究基础。
[1]El-Hamamsy I, Yacoub MH.Cellular and molecular mechanisms of thoracic aortic aneurysms[J].Nat Rev Cardiol, 2009, 6(12):771–786.doi: 10.1038/nrcardio.2009.191.
[2]朱水波, 周孜孜, 郗二平, 等.不同浓度转化生长因子β1对人主动脉平滑肌细胞增殖及迁移的影响[J].临床外科杂志, 2016,24(5):366–368.doi:10.3969/j.issn.1005–6483.2016.05.016.Zhu SB, Zhou ZZ, Xi EP, et al.Effects of TGF-β1 on proliferation and migration of human aortic vascular smooth muscle cells[J].Journal of Clinical Surgery, 2016, 24(5):366–368.doi:10.3969/j.issn.1005–6483.2016.05.016.
[3]汪海波, 朱健, 郗二平, 等.ROCKI/II基因下调对TGF-β1诱导的人主动脉平滑肌细胞迁移及增殖的影响[J].中国普通外科杂志,2017, 26(6):735–741.doi:10.3978/j.issn.1005–6947.2017.06.011.Wang HB, Zhu J, Xi EP, et al.Effects of ROCKI/II gene downregulation on TGF-β1 induced migration and proliferation in human aortic vascular smooth muscle cells[J].Chinese Journal of General Surgery, 2017, 26(6):735–741.doi:10.3978/j.issn.1005–6947.2017.06.011.
[4]Lemaire SA, Russell L.Epidemiology of thoracic aortic dissection[J].Nat Rev Cardiol, 2011, 8(2):103–113.doi: 10.1038/nrcardio.2010.187.
[5]Grond-Ginsbach C, Pjontek R, Aksay SS, et al.Spontaneous arterial dissection: phenotype and molecular pathogenesis[J].Cell Mol Life Sci, 2010, 67(11):1799–1815.doi: 10.1007/s00018–010–0276-z.
[6]Wang X, Lemaire SA, Chen L, et al.Increased collagen deposition and elevated expression of connective tissue growth factor in human thoracic aortic dissection[J].Circulation, 2006, 114(1 Suppl):I200–205.
[7]Mack CP.Signaling mechanisms that regulate smooth muscle cell differentiation [J].Arterioscler Thromb Vasc Biol, 2011,31(7):1495–1505.doi: 10.1161/ATVBAHA.110.221135.
[8]Yuan SM, Wang J, Huang HR, et al.Osteopontin expression and its possible functions in the aortic disorders and coronary artery disease[J].Rev Bras Cir Cardiovasc, 2011, 26(2):173–182.
[9]Bergeron SE, Wedemeyer EW, Lee R, et al.Allele-specific effects of thoracic aortic aneurysm and dissection alpha-smooth muscle actin mutations on actin function[J].J Biol Chem, 2011, 286(13):11356–11369.doi: 10.1074/jbc.M110.203174.
[10]杨守国, 王春生, 陈昊, 等.胸主动脉夹层动脉壁TGF-β1表达与细胞外基质分布[J].中华胸心血管外科杂志, 2010, 26(1):33–36.doi:10.3760/cma.j.issn.1001–4497.2010.01.013.Yang SG, Wang CS, Chen H, et al.TGF-β1 expression and distribution in the extracellular matrix of the dissected wall of thoracic aorta[J].Chinese Journal of Thoracic and Cardiovascular Surgery, 2010, 26(1):33–36.doi:10.3760/cma.j.issn.1001–4497.2010.01.013.
[11]周孜孜, 郗二平, 王荣平, 等.转化生长因子-β1对人主动脉平滑肌细胞表型转化的影响及其机制[J].中华实验外科杂志, 2015,32(11):2771–2774.doi:10.3760/cma.j.issn.1001–9030.2015.11.043.Zhou ZZ, Xi EP, Wang RP, et al.Effect of transforming growth factor-β1 on human aortic vascular smooth muscle cell phenotype switch and mechanism[J].Chinese Journal of Experimental Surgery, 2015, 32(11):2771–2774.doi:10.3760/cma.j.issn.1001–9030.2015.11.043.
[12]Schofield AV, Bernard O.Rho-associated coiled-coil kinase (ROCK)signaling and disease[J].Crit Rev Biochem Mol Biol, 2013,48(4):301–316.doi: 10.3109/10409238.2013.786671.
[13]赵莹, 杨福春, 魏晓晴, 等.ROCKI/II基因下调对血管平滑肌细胞迁移及增殖的影响[J].现代生物医学进展, 2009, 9(17):3232–3234.Zhao Y, Yang FC, Wei XQ, et al.Effects of ROCKI/II gene expression down-regulated on migration and proliferation of vascular smooth muscle cells[J].Progress in Modern Biomedicine,2009, 9(17):3232–3234.
[14]曹飞鹏, 黄树文, 麦树荣.Rho/Rock 信号通路在 TGF β1刺激大鼠颈内动脉平滑肌细胞表型转化中的作用及可能机制[J].广东医学, 2016, 37(15):2228–2233.Cao FP, Huang SW, Mai SR.The effect and possible mechanism of the Rho/Rock signaling pathway during TGF-β1 -induced ISMCs pheno-typic modulation in rats[J].Guangdong Medical Journal,2016, 37(15):2228–2233.
