Ki-67、Her-2及Top2A在乳腺癌中的扩增表达与蒽环类药物疗效关系的研究
2017-03-23张成娟董凤梅徐本玲
张成娟,董凤梅,徐本玲,袁 鹏
(1.郑州大学附属肿瘤医院、河南省肿瘤医院,河南 郑州 450008;2.郑州大学附属郑州中心医院,河南 郑州 450007)
Ki-67、Her-2及Top2A在乳腺癌中的扩增表达与蒽环类药物疗效关系的研究
张成娟1,董凤梅2,徐本玲1,袁 鹏1
(1.郑州大学附属肿瘤医院、河南省肿瘤医院,河南 郑州 450008;2.郑州大学附属郑州中心医院,河南 郑州 450007)
目的 探讨Ki-67、Her-2及Top2A在乳腺癌中的扩增表达与蒽环类药物疗效的关系。方法 207例经病理证实的乳腺癌患者均接受FEC方案新辅助化疗,并测定其Ki-67、Her-2及Top2A基因的表达。结果 207例乳腺癌患者中,Ki-67分级为(-)32例,(+)58例,(++)95例,(+++)22例;Her-2基因扩增26例(12.6%),未扩增181例(87.4%);Top2A基因扩增26例(12.6%),未扩增181例(87.4%)。Ki-67分级与Her-2基因、Top2A基因扩增无关 (P>0.05)。Her-2、Top2A的扩增与化疗疗效均呈正相关(r=0.59、0.58,P<0.05)。结论 Her-2、Top2A的表达对乳腺癌患者化疗药物的选择及预后的判断具有重要的指导价值。
Ki-67;Her-2;DNA拓扑异构酶Ⅱα;乳腺癌;蒽环类药物
近年来,乳腺癌已成为全世界威胁女性健康的第一大恶性肿瘤,其发病率正以每年5%的速度呈增长状态,且年轻、低龄化的趋势越来越明显[1-3]。在乳腺癌各种治疗中,化疗的地位较为重要,而肿瘤细胞存在的多药耐药现象是化疗失败的主要因素。蒽环类药物作为乳腺癌化疗较为传统的一类药物,近年来关于其急性不良反应的报道较多,且有少数患者出现了复发,提示部分蒽环类药物选择性不高的现状[4]。因此,寻找能够准确预测蒽环类药物敏感性的新的生物学标志物质,对临床个体化治疗手段的选择尤为重要。目前人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)、DNA拓扑异构酶Ⅱα(DNA topoisomerase Ⅱα,Top2A)及Ki-67在乳腺癌中的扩增表达研究较少。因此本文通过对接受新辅助化疗的乳腺癌患者中Ki-67、Her-2及Top2A的扩增表达及其与蒽环类药物疗效的关系进行研究,探讨其能否成为预测蒽环类化疗药物疗效的生物学指标。
1 资料与方法
1.1 一般资料 收集我院2008年1月至2013年12月收治的207例接受新辅助化疗的经病理证实的乳腺癌患者,均为女性,年龄23~56(40±16)岁,参照TNM标准分期为Ⅱ期71例,Ⅲ期136例。患者乳房上均存在可测量的病灶,肿瘤直径3~12 cm。化疗前行常规血及心、肝、肾功能检查,排除化疗禁忌证者、年龄>56岁者以及不配合研究者。
1.2 化疗方案的选择 所有患者均采用FEC方案进行化疗:5-氟尿嘧啶500 mg·m-2,环磷酰胺500 mg·m-2,表阿霉素100 mg·m-2,均采取静脉滴注,化疗结束后3 d给予患者行疗效评估。
1.3 Ki-67的检测 采用Envision二步法,石蜡切片并脱蜡,放入乙二胺四乙酸修复液行修复5 min;行PBS冲洗,加入一抗过夜(4 ℃)。重复PBS冲洗,加入二抗40 min(37 ℃);重复PBS冲洗,二氨基联苯胺液显色,苏木素-尹红复染后封片行镜下观察。其中每张切片中选择5个高倍视野,根据切片中所选视野的阳性细胞占全部细胞的比例进行结果判定,其中<5%为阴性(-)、5%~<25%为弱阳性(+)、25%~50%为阳性(++)、>50%为强阳性(+++)。
1.4 Her-2及Top2A基因表达的检测 采用荧光原位杂交(FISH)检测Her-2、Top2A的基因表达。具体过程为:石蜡切片脱蜡,放入预处理液中10 min(95 ℃),胃蛋白酶孵育10 min(25 ℃),杂交仪中变性5 min(80 ℃)后45 ℃杂交过夜,DAPI中显色。100高倍镜下观察FISH结果并对肿瘤细胞核的信号进行计数。结果红色信号的总数/绿色信号的总数比值≥2.2时,即为Her-2基因、Top2A基因扩增;不超过1.8时为无扩增; 1.8~2.2时,则需要再计数20个细胞核中的信号。
1.5 疗效评估 疗效按WHO制定的统一标准评估,完全缓解(CR):所有病灶均完全消失;部分缓解(PR):靶病灶最大径之和减少≥50%,至少维持30 d;疾病进展(PD):靶病灶最大径之和至少增加≥25%,或出现新病灶。疾病稳定(SD) 靶病灶最大径之和缩小未达PR,或增大未达PD。以CR+PR为有效,以PD+SD为无效。
1.6 统计学处理 采用SPSS 16.0进行数据分析,等级计数资料比较采用Fisher确切概率法,相关性分析采用Spearman相关检验,检验水准为α=0.05。
2 结果
2.1 Ki-67分级及其与Top2A、Her-2基因扩增的关系 207例患者中,Ki-67分级为(-)32例,(+)58例,(++)95例,(+++)22例。Her-2基因扩增26例(12.6%),未扩增181例(87.4%);Top2A基因扩增26例(12.6%),未扩增181例(87.4%);Ki-67分级与Top2A基因、Her-2基因扩增无关(χ2=1.28、1.33,P>0.05)。见表1、图1。
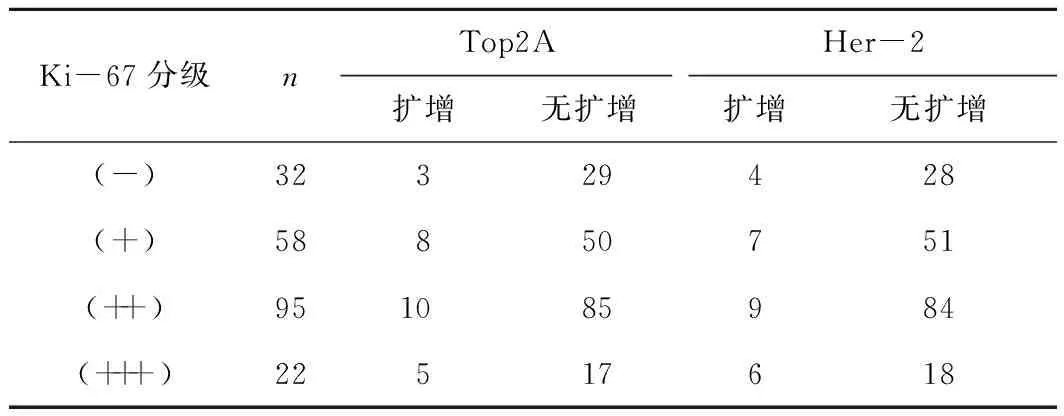
表1 Ki-67分级及其与Top2A、Her-2基因扩增的关系
2.2 乳腺癌患者Her-2及Top2A扩增与含蒽环类药物化疗疗效的关系 Her-2基因扩增26例中有效为10例(38.5%),无扩增的118例患者中无有效病例出现,差异有统计学意义(P<0.05)。Top2A基因扩增的26例患者中有效为21例(80.77%),无扩增的118例患者中有效为30例(16.6%),差异有统计学意义(P<0.05)。且Her-2、Top2A的扩增与化疗疗效均呈正相关(r=0.59、0.58,P<0.05)。见表2。

图1 Her-2及Top2A基因在乳腺癌患者中的扩增情况
A:Her-2基因在乳腺癌上无扩增,红色信号的Her-2基因与绿色信号的CEN17比值<1.8;B:Her-2基因在乳腺癌上扩增,红色信号的Her-2基因与绿色信号的CEN17比值≥2.2;C:Top2A基因在乳腺癌上无扩增,红色信号的Top2A基因与绿色信号的CEN17比值<1.8;D: Top2A基因在乳腺癌上无扩增,红色信号的Top2A基因与绿色信号的CEN17比值不低于2.2
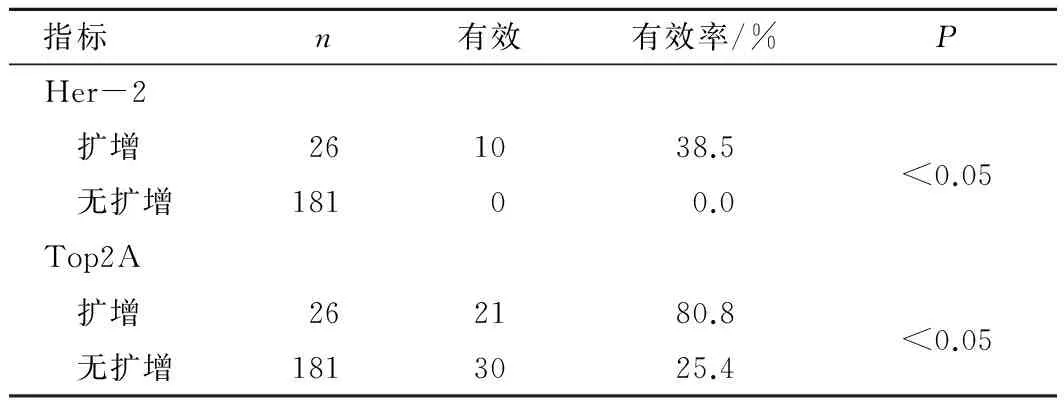
表2 乳腺癌患者Her-2及Top2A扩增与含蒽环类药物化疗疗效的关系
3 讨论
乳腺癌新辅助化疗针对肿瘤,可有效缩小其病灶范围,提高保乳治疗的效果及概率,针对化疗后的肿瘤变化,能够及时调整方案,使得该病的治疗更有选择及针对性,效果较为明显。含蒽环类药物的治疗方案是目前最为常用的方案之一。
Top2A作为调节核酸空间结构动态变化、控制核酸生理功能的一种关键酶,在多种细胞的酶类中均有存在,且在增殖细胞中呈现有周期特异性表达。Top2A在肿瘤增殖的不同细胞周期中表达各异,一般表现为在DNA复制后期及有丝分裂期延长,有丝分裂期结束后表达有所下降,提示肿瘤增殖受Top2A表达的影响[5]。目前较为一致的观点认为,Her-2蛋白的过表达与基因扩增存在一定的相关性,且Her-2与乳腺癌的发生、发展关系较为密切[6]。
有学者认为位于17q12-21基因座的基因,可能在调节乳腺癌对药物的反应性中起作用[7-8]。作为蒽环类药物重要的作用靶点之一,Top2A基因的扩增或缺失可影响蒽环类药物的反应及其药效。Top2A阳性表达可提示患者的预后不良,对患者的预后评估比较重要[9-11]。另外,Her-2基因突变可导致基因扩增表达过度,引起Top2A基因出现异常,Her-2状态对预测蒽环类化疗药物的化疗效果尚无统一定论。Ki-67在临床监测中也较为重要,其高水平的表达可提示细胞增殖活动较为活跃,表明此类患者的预后不良。新辅助化疗后Ki-67表达的下降可反映肿瘤细胞的减少及对化疗的敏感程度,并有利于乳腺癌的预后[12-13]。有学者通过对385例化疗前核心穿刺标本、新辅助化疗后手术标本的Ki-67检测发现新辅助化疗前后Ki-67的阳性细胞百分比的改变可作为影响预后的因素[14-17]。而本研究中Ki-67的表达未发现相关性,提示Ki-67蛋白表达与预后相关性不明显,可能与本研究的研究例数、治疗时间有关。本研究结果显示,207例患者中,Ki-67分级为(-)32例,(+)58例,(++)95例,(+++)22例;Her-2基因扩增26例(12.6%),未扩增181例(87.4%);Top2A基因扩增26例(12.6%),未扩增181例(87.4%),Ki-67分级与Top2A基因、Her-2基因扩增无关(P>0.05)。另外,HER-2基因扩增26例中有效为10例(38.5%),无扩增的118例患者中无有效病例出现,差异有统计学意义(P<0.05),Top2A基因扩增的26例患者中有效为21例(80.77%),无扩增的118例患者中有效为30例(16.6%),差异有统计学意义(P<0.05)。且Her-2的扩增、Top2A的扩增与化疗效果均呈正相关(r=0.59、0.58,P<0.05),可见Top2A对疗效影响的相关系数高于Her-2对疗效影响的相关系数,提示Top2A扩增时,对含蒽环类化疗药物敏感性较高,化疗获益较大,蒽环类化疗药物的疗效更好,Top2A可能比Her-2对蒽环类药物更有预测作用。可能的原因分析为:Her-2可能并不能直接预测蒽环类药物的反应性,Her-2和蒽环类药物效能的关系可能依赖于Top2A的同时扩增,并且Her-2激活可以直接增加Top2A的活性。
综上所述,通过对乳腺癌中Ki-67、Her-2基因、Top2A基因表达的研究发现,Her-2、Top2A基因不仅可以对乳腺癌患者进行较为准确的个体化分析和评价,Ki-67的表达较不明显。可将Her-2基因、Top2A基因作为准确预测蒽环类药物敏感性的生物学标志物,对于降低肿瘤对蒽环类药物耐药性,提高化疗药物的敏感性,最终达到提高乳腺癌患者无病生存期和总生存期的目的有一定作用。
[1]SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1): 11-30.
[2]WEISS JR,MOYSICH KB,SWEDE H.Epidemiology of male breast cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(1): 20-26.
[3]DEB S,JENE N,FOX SB.Genotypic and phenotypic analysis of familial male breast cancer shows under representation of the HER2 and basal subtypes in BRCA-associated carcinomas[J].BMC Cancer,2012,12:510.
[4]JI M,TANG J,ZHAO J,et al.Polymorphisms in genes involved in drug detoxification and clinical outcomes of anthracycline-based neoadjuvant chemotherapy in Chinese Han breast cancer patients[J].Cancer Biol Ther,2012,13(5):264-271.
[5]ROMERO A,CALDéS T,DíAZ-RUBIO E,et al.Topoisomerase 2 alpha: a real predictor of anthracycline efficacy[J].Clin Transl Oncol,2012,14(3):163-168.
[6]KÜMLER I,TUXEN MK,NIELSEN DL.A systematic review of dual targeting in HER-2-positive breast cancer[J].Cancer Treat Rev,2014,40(2):259-270.
[7]WATANABE N,OTSUKA S,SASAKI Y,et al.Cardiac tolerability of concurrent administration of trastuzumab and anthracycline-based regimen as adjuvant chemotherapy for breast cancer[J].Breast Care (Basel),2014,9(1):46-51.
[8]RECCHIA F,CANDELORO G,CESTA A,et al.Anthracycline-based induction chemotherapy followed by concurrent cyclophosphamide,methotrexate and 5-fluorouracil and radiation therapy in surgically resected axillary node-positive breast cancer[J].Mol Clin Oncol,2014,2(3):473-478.
[9]BARINOFF J,TRAUT A,BAUERSCHLAG D,et al.Chemotherapy for 70-year-old women with breast cancer in Germany: A survey by the German breast group[J].Geburtshilfe Frauenheilkd,2013,73(5):433-439.
[10]GOGIA A,RAINA V,DEO SV,et al.Taxane and anthracycline based neoadjuvant chemotherapy for locally advanced breast cancer: institutional experience[J].Asian Pac J Cancer Prev,2014,15(5):1989-1992.
[11]SOLIMAN AA,CSORBA R,ULLRICH A,et al.Antiphopholipid antibodies and functional activated protein C resistance in patients with breast cancer during anthracycline-based chemotherapy administered through an intravenous port-catheter device[J].Clin Appl Thromb Hemost,2014,20(3):338-340.
[12]ANDERSON K,WILLIAMS EM,KAPLAN J,et al.Utility of Immunohistochemical Markers in Irradiated Breast Tissue: An Analysis of the Role of Myoepithelial Markers,p53,and Ki-67[J].Am J Surg Pathol,2014,38(8):1128-1137.
[13]ZHANG G,XIE W,LIU Z,et al.Prognostic function of Ki-67 for pathological complete response rate of neoadjuvant chemotherapy in triple-negative breast cancer[J].Tumori,2014,100(2):136-142.
[14]STATHOPOULOS GP,MALAMOS NA,MARKOPOULOS C,et al.The role of Ki-67 in the proliferation and prognosis of breast cancer molecular classification subtypes[J].Anticancer Drugs,2014,25(8):950-957.
[15]KIM KI,LEE KH,KIM TR,et al.Ki-67 as a predictor of response to neoadjuvant chemotherapy in breast cancer patients[J].J Breast Cancer,2014,17(1):40-46.
[16]CHANTZI NI,PALAIOLOGOU M,STYLIANIDOU A,et al.Estrogen receptor β2 is inversely correlated with Ki-67 in hyperplastic and noninvasive neoplastic breast lesions[J].J Cancer Res Clin Oncol,2014,140(6):1057-1066.
[17]LIN Q,LIU Y,CHEN H,et al.Survivin,Ki-67 and tumor grade as predictors of response to docetaxel-based neoadjuvant chemotherapy in locally advanced breast cancer[J].Mol Clin Oncol,2013,1(5):839-844.
Relationship Between Ki-67,Her-2 and Top2A Amplification in the Breast Cancer and Efficacy of Anthracycline-based Regimen
ZHANG Chengjuan1,DONG Fengmei2,XU Benling1,YUAN Peng1
(1.HenanProvincialTumorHospital,Zhengzhou450008,China;2.ZhengzhouCentralHospital,Zhengzhou450007,China)
Objective To explore the relationship of Ki-67,Her-2 and Top2A amplification in the breast cancer and efficacy of anthracycline-based regimen.Methods The 207 patients with breast cancer confirmed by pathology underwent the FCC regimen neoadjuvant chemotherapy,and the Ki-67,Her-2,Top2A gene expressions were detected.Results Among the 207 patients,Ki-67 classification of (-) were 32 patients,58 patients were (+),95 patients were (++),22 patients were (+++).Her-2 gene amplification were 26 patients (12.6%),no-amplification were 181 patients (87.4%).Top2A gene amplification were 26 patients (12.6%),no-amplification were 181 patients (87.4%).Ki-67 classification was unrelated with the amplification of Her-2 and Top2A genes (P>0.05).Her-2 and Top2A amplification were positive correlated with the effect of chemotherapy (r=0.59,0.58;P<0.05).Conclusion The expression of Her-2 and Top2A has important guiding value in the selection of chemotherapy drugs and prognosis of patients with breast cancer.
Ki-67; human epidermal growth factor receptor 2; DNA topoisomerase Ⅱα; breast cancer; augmentation; anthracycline-based drugs
国家自然科学基金青年基金资助项目(编号:81602637);河南省科技攻关计划项目(编号:162102410046)
张成娟(1981-),女,博士,主治医师,主要从事肿瘤靶向治疗相关基因检测及其临床应用的研究工作。E-mail:zcj2016@126.com
袁鹏(1979-),男,博士,主治医师,主要从事乳腺癌的诊治及其分子靶点研究工作。E-mail:yuanpeng117@163.com
10.3969/j.issn.1673-5412.2017.01.003
R737.9;R730.53
A
1673-5412(2017)01-0011-04
2016-10-21)
