基于宏基因组学技术分析不同贮藏条件下 鲶鱼片中的菌相变化
2017-03-22朱迎春王洋樊晓盼马俪珍王凯丽
朱迎春,王洋,樊晓盼,马俪珍,王凯丽
基于宏基因组学技术分析不同贮藏条件下 鲶鱼片中的菌相变化
朱迎春1,王洋2,樊晓盼3,马俪珍3,王凯丽1
(1山西农业大学食品科学与工程学院,山西太谷 030801;2天津农学院水产学院/天津市水产生态及养殖重点实验室,天津 300384;3天津农学院食品科学与生物工程学院/天津市农副产品深加工技术工程中心,天津 300384)
【目的】分析鲶鱼肉片贮藏过程中微生物多样性和菌群动态变化,探究天然保鲜剂对鲶鱼肉片菌相及菌落组成的影响。【方法】试验分8组,即新鲜鲶鱼片(CK0);空气包装(air-package,AP)鲶鱼片低温贮藏(4±1)℃第4、7天(AP4和AP7)样品;气调包装(modified atmosphere package,MAP,60% CO2/40% N2)鲶鱼片冰温贮藏(-0.7±0.02℃)第10、30天(MAP10和MAP30)样品;添加5%天然保鲜液(由壳聚糖、蜂胶、溶菌酶、Nisin和茶多酚复配而成)MAP鲶鱼片冰温贮藏第10、30和40天(MAPP10、MAPP30和MAPP40)样品。采用宏基因组学技术,测定并分析不同贮藏方式鲶鱼片全部微生物的16S rDNA序列,比较各组菌群的物种组成和丰度信息,通过Alpha多样性分析和主成分分析,考察包装方式、贮藏温度和天然保鲜液对微生物的抑制作用。【结果】8组样品中454焦磷酸测序共鉴定出25个门、433个属的细菌。MAP10、MAPP10、MAPP30中的最优势菌属和CK0一致,均为;而AP4和AP7中的最优势菌分别为(70.49%)和(59.01%)。从微生物角度来看,MAP+冰温贮藏优于AP+冷藏。随着贮藏时间的延长,气调包装中的丰度由15.78%(MAP10)急剧上升为82.85%(MAP30)。添加天然保鲜液的MAPP10和MAPP30中几乎检测不到。【结论】气调包装协同冰温贮藏显著降低了鲶鱼片中细菌菌群的丰度和多样性,有利于延长鲶鱼肉的保质期。天然保鲜液中的茶多酚、Nisin和壳聚糖等能显著抑制MAP+冰温贮藏的鲶鱼片中的主要腐败菌属的生长繁殖。
鲶鱼片;宏基因组学;菌相变化;天然保鲜液
0 引言
【研究意义】革胡子鲶鱼()肉质细嫩,无肌间刺,蛋白质、脂肪含量高,深受人们喜爱。但宰杀后的鲶鱼肉极易因多种微生物的生长繁殖而腐败变质。对于食品中微生物的群落组成及变化,常用的传统培养分离方法存在费时、费力、片面的缺陷,无法真正解析微生物的组成、丰度及其变化情况,而省去培养过程的宏基因组学(metagenomics)技术直接从样品中提取基因组DNA后进行测序分析,借助高通量测序方法,结合生物信息学工具,能够发现大量过去无法分离培养的微生物[1-2]。因此,利用宏基因组学技术研究和分析冰温贮藏过程中鲶鱼肉菌群构成及其演替规律并研究其控制措施,具有重要的理论意义和潜在的实用价值。【前人研究进展】目前在食品领域中已将宏基因组学技术用于食品中微生物群落动态的追踪[3-5],分析了干酪[6]、韩国泡菜[7-9]等发酵食品中微生物群落结构和动态变化规律,揭示了发酵食品酿造过程中微生物的演替变化及其与代谢产物之间的联系。在肉制品加工方面,BENSON等[10]研究了不同处理的冷藏猪肉香肠的微生物变化。发现香肠经过乳酸/双醋酸酯处理对微生物动力学有显著影响,导致微生物多样性发生改变,而微生物变化与化学变化紧密相关。在肉制品贮藏方面,XIAO等[11]利用宏基因组学技术,鉴定出真空包装水晶肴肉含有169个属的细菌,是贮藏0、7和30 d时的优势菌群;及是贮藏15、22和30 d时的优势菌群;所有样品在贮藏期内微生物多样性呈增加趋势且有不同的群落结构,15 d后群落结构开始发生变化,30 d后群落结构有显著性差异。Zhao等[12]考查了真空包装冷却猪肉21 d贮藏过程中的菌相变化规律,发现新鲜猪肉(0 d)的微生物多样性高,贮藏0—7 d,丰度急剧下降,而和丰度逐渐上升并在第7天达到峰值,之后急剧下降至检测不出,丰度值持续上升最终成为优势菌。【本研究切入点】通过前期试验已经获知鲶鱼片进行气调包装(modified atmosphere package,MAP,60% CO2/40% N2)后冰温(-0.7℃)贮藏,比常规的空气包装(air-package,AP)低温贮藏(4℃)更有利于维持鲶鱼片的食用品质及理化特性[13]。但是虽然大多数微生物在此贮藏条件下生长受到抑制,仍有一些嗜冷性微生物可以生长繁殖,从而对鲶鱼肉的品质及人类健康安全造成威胁,有必要进一步开展相关研究。【拟解决的关键问题】利用宏基因组学技术对鲶鱼肉片贮藏过程中微生物种群构成和演替变化进行监测,并将笔者实验室已研究出的天然保鲜剂[14]作用于鲶鱼片,考察其对鲶鱼肉片菌相变化规律及菌落组成的影响,了解不同贮藏条件下鲶鱼片的优势腐败菌群变化,以针对性地靶向抑制优势腐败菌,提高鲶鱼片的微生物安全性。
1 材料与方法
试验于2014年11月在天津农学院食品加工车间进行。
1.1 试验材料及样品采集
10条革胡子鲶鱼(),平均每条重(1 250±25)g,体长(30±2)cm,30 min内鲜活运至天津农学院食品加工车间进行宰杀。首先放入(5—7)℃冰水中10 min使其致晕,立即去头、去皮、去内脏,去骨剖片后,用无菌冰水洗涤,沥干水分,切成4 cm×3 cm×1 cm鱼片,每片重为(20±2)g,将得到的160片鲶鱼片充分混合,随机分4组:(1)20片鱼片用于0 d微生物群落结构的分析,标记为CK0;(2)40片鱼片空气包装(AP)之后冷藏库((4±1)℃)贮藏,在贮藏的4 d(货架期终点)和7 d(腐败阶段)取样分析,分别用AP4和AP7表示;(3)40片鱼片直接进行气调包装(MAP,60% CO2/40% N2)后置于国家农产品保鲜工程技术研究中心冰温库((-0.7±0.02)℃)中贮藏,在10 d(新鲜阶段)和30 d(腐败阶段)取样,分别标记为MAP10、MAP30;(4)60片鱼片加入肉重5%的保鲜液(由0.5%壳聚糖、0.1%蜂胶、0.075%Nisin、0.075%溶菌酶、0.5%茶多酚配制而成),搅拌均匀,再以同样方式进行气调包装(MAP),置于冰温库((-0.7±0.02)℃)中贮藏,分别在10 d(新鲜阶段)、30 d(次新鲜阶段)和40 d(货架期终点)取样分析,分别标记为MAPP10、MAPP30和MAPP40。所取样品装入无菌自封袋中,于-80℃超低温冰箱保存。将全部8个样品(CK0、AP4、AP7、MAPP10、MAPP30、MAPP40、MAP10、MAP30)以冷冻运输方式运送到上海派森诺生物科技有限公司,进行宏基因组测序和生物信息学分析。
1.2 试验方法
1.2.1 宏基因组DNA的提取 按照1.1所取的样品,参照OMEGA Soil DNA Kit试剂盒说明,分别抽提不同鲶鱼肉样品的细菌基因组DNA。所得DNA采用紫外分光光度计检测浓度和纯度,并采用0.8%琼脂糖凝胶电泳检测DNA完整性。
1.2.2 16S rDNA PCR扩增 以1.2.1获得的基因组DNA为模板,扩增 16S V1—V3区全长,引物(F:5′- 454adapter-mid-AGAGTTTGATCCTGGCTCAG-3′;R:5′-454adapter-TTACCGCGG CTGCTGGCAC-3′)。
PCR反应体系为:8.75 μL灭菌超纯水;5.00 μL 5×Q5 Buffer,5×GC Enhancer,5.00 μL dNTP(2.5 mmol·L-1);2.00 μL模板(2 ng·μL-1);1.00 μL引物F(10 μmol·L-1);1.00 μL引物R(10 μmol·L-1);0.25 μL Q5 DNA polymeras。PCR循环梯度反应参数:98℃预变性4 min;98℃变性30 s,55℃退火45 s,72℃延伸1 min,27个循环;72℃延伸7 min,冷却至4℃。PCR产物用1.5%琼脂糖凝胶电泳检测。
1.2.3 焦磷酸测序 使用AMPure Beads对PCR产物进行纯化,将纯化后的PCR产物使用PicoGreen dsDNS Assay Kit在酶标仪上对文库进行定量,然后将PCR纯化产物稀释,等量混合。混合后的样本进行454焦磷酸测序。454测序按照标准的454/Roche GS-FLX Titanium方案进行,利用GS DNA Library Preparation kit制备成单链模板DNA(single-stranded DNA)文库,并利用GS emPCR kit 固定在磁珠上,在一个油包水的体系里进行扩增。
1.2.4 序列分析
1.2.4.1 原始双端序列的过滤和连接 采用Illumina MiSeq平台进行测序。去除准确率低于99%的以及模糊碱基N;然后利用软件Flash(http://www. genomics. jhu.edu/software/FLASH/index. shtml)对通过质量过滤的序列进行连接,要求read1和read2的overlap≥10 bp,且不容许碱基错配。最后,根据index信息提取每个样品的有效序列(要求Index完全匹配)。
1.2.4.2 优质序列的获取及统计 为了保证分析结果的准确性,运用Qiime软件[15](version 1.7.0,http://qiime.org/)进行序列过滤,运用mothur[16](version 1.31.2,http://www.mothur.org/)软件中uchime的方法去除嵌合体序列,得到用于后续分析的优质序列。
1.2.4.3 生物信息学分析 本试验在Qiime中调用uclust的方法对优质序列按相似度0.97进行OUT(Operational Taxomomic Units,操作分类单元)聚类分析,选取每个类最长的序列为代表序列。在Qiime中采用blast的方法对序列数据库进行比对,比对后得到每个OTU的分类学信息,并设置置信区间为95%,默认为cut off=0.03,即序列相似度在3%以下就认为“未分类”。使用OUT表,利用Qiime软件绘制稀释曲线图。
群落结构多样性分析选用Chao-the Chao1 estimator(http://www.mothur.org/wiki/Chao),Ace(abundance based coverage estimator)-the ACE estimator(http: //www.mothur.org/wiki/Ace),Shannon-the Shannon index(http://www.mothur.org/wiki/Shannon),Simpson- the Simpson index(http://www.mothur.org/wiki/ Simpson)等参数进行评估,根据OTU列表中的各样品物种丰度情况,应用软件mothur中的summary.single命令,计算4种常用的生物多样性指数。物种丰度差异分析根据门和属两个层次上序列数的统计信息,将各物种丰度归一到同数量级,应用软件mothur中的metastats(http://metastats. cbcb.umd.edu/)命令,进行两组之间的差异显著性分析,多组之间采用SPSS进行方差分析和LSD多重比较,sig值小于0.05的物种认为在组间存在显著性差异。此外,将所有细菌按分类学统计并利用软件Qiime进行主成分分析(PCA),观察不同样本间微生物群落结构多样性的分类学差异。
2 结果
2.1 宏基因组DNA的提取
表1为鲶鱼微生物基因组DNA的纯度检测结果。基因组DNA在OD260处具有完整的波峰,证明所提取的微生物基因组DNA纯度较好。基因组 DNA的平均浓度为87.38 ng·μL-1,所提取基因组DNA的总量为4.40 μg,符合琼脂糖凝胶电泳的基本要求。

表1 鲶鱼片细菌宏基因组质量检测结果
图1为细菌16S rDNA V1—V3区片段琼脂糖凝胶电泳图谱,可知,以样品DNA为模板可以扩增出细菌的16S V1—V3区片段,大小500 bp左右且条带清晰,大小正确,浓度适当,可进行后续试验。
2.2 优质序列的获取与统计
本试验采用454 FLX+平台进行测序,将测序得到的原始序列进行筛选,丢弃长度短于200 bp、含有模糊碱基、引物碱基含2个以上错配、单碱基重复超过6个的序列,得到质量较高、符合要求的有效序列。但是高通量测序建库过程中PCR扩增会产生嵌合体序列(chimera sequence),测序过程中会产生点突变和同聚物等测序错误,随着测序长度的增加,序列末端的质量会降低。为了保证分析结果的准确性,需要对有效序列进行过滤和去除嵌合体处理,得到最终用于后续分析的优质序列。表2为8个样品中有效序列和优质序列的统计结果,共获得有效序列40 834个,优质序列为29 646个,优质序列的平均长度为458 bp。

M:DL2000 marker,1:CK0;2:AP4;3:AP7;4:MAP10;5:MAP30;6:MAPP10;7:MAPP30;8:MAPP40

表2 样品序列数统计表
2.3 MAP鲶鱼片冰温贮藏过程中细菌群落结构及动态变化
2.3.1 鲶鱼片基于门水平的微生物群落结构分析 图2是基于门绘制的微生物群落结构变化图,由图2可知,所有的样品细菌群落可以分为25个门,其中放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)的微生物占了极大的比例。新鲜鲶鱼片(CK0)中Proteobacteria、Actinobacteria和Firmicutes是鲶鱼肉样品的主要微生物,分别占到29.70%、29.35%和22.25%,其次为Bacteroidetes和Cyanobacteria,所占比例为8.97%和7.89%,5种微生物的丰度总和达到98.06%,其他20种不同门的微生物只占很小比例。随着包装方式和贮藏温度的不同,基于门的微生物群落结构发生了变化。

图2 基于门的细菌群落结构变化
AP鲶鱼片4℃贮藏期间Proteobacteria丰度显著增加,新鲜鱼片丰度为29.70%,贮藏4 d上升为82.82%,7 d达到93.58%,成为优势腐败菌;Actinobacteria丰度下降,从29.35%下降到1.31%(4 d),之后略有上升但比例仍然很低(3.69%,7 d);Firmicutes丰度逐渐下降,从22.25%下降到12.15%(4 d)至1.84%(7 d)。MAP鲶鱼片冰温贮藏4 d与CK0相比,群落结构未发生显著变化,贮藏至第30天时,Proteobacteria和Actinobacteria的丰度分别下降到13.96%和1.59%;Firmicutes的丰度大幅上升为83.01%。添加保鲜液的MAPP鲶鱼片Proteobacteria的丰度在31.81%— 50.03%呈现波动变化,贮藏第10天、30天和40天时Actinobacteria丰度下降速率小于其他处理组,最终达到14.78%(40 d)。Firmiciutes在贮藏期间的丰度分别为20.25%(10 d)、10.45%(30 d)和48.50%(40 d),呈先下降后上升的趋势。
拟杆菌门(Bacteroidetes)和蓝藻门(Cyanobacteria)在鲶鱼片所有样品中所占比例较小且变化规律相同,均随着贮藏时间的延长呈下降趋势,新鲜鲶鱼片Bacteroidetes丰度值为8.97%,至样品贮藏终点,达到0.84%—3.53%。Cyanobacteria丰度值则从7.89%下降至0.03%—0.09%。
由此可知,在鲶鱼片贮藏过程中,Proteobacteria、Actinobacteria和Firmicutes是优势菌群。冰温贮藏及加入天然保鲜液可以抑制Proteobacteria、Cyanobacteria和Bacteroidetes的生长,但冰温贮藏结合保鲜液作用对Actinobacteria的作用不明显,而对Firmicutes无显著抑制作用,这可能是由于很多Firmicutes会产生芽孢,可以抵抗脱水和极端环境,具有较强抗性的缘故。
2.3.2 基于属水平的微生物群落结构分析 图3—图5是基于属水平绘制的微生物群落结构变化图,它可以更清楚地表示鲶鱼肉在贮藏过程中菌群结构的动态变化。本试验共鉴定出433个属的细菌,表明鲶鱼片菌落形态极为丰富。新鲜鲶鱼片共含有170个属的细菌,其中丰度大于1%的菌属共有16个,丰度总和为96.90%,放线菌()丰度达到22.26%,占优势地位。其他依次为芽孢杆菌属()(15.98%),苍白杆菌属()(6.10%)和不动杆菌属()(4.01%),其余的菌属虽然丰度不高但数量众多。
AP鲶鱼片在4℃贮藏4 d 时菌相和新鲜鱼片(CK0)相比有了很大的变化,气单胞菌属()丰度最高,达到70.49%,成为优势菌群;乳酸球菌菌属()所占比例为11.93%,假单胞菌属()为9.95%。贮存至7 d,气单胞菌属()比例下降为5.54%,假单胞菌属()成为优势菌群,丰度达到59.01%。因此,普通的空气包装食品导致其腐败的主要优势菌是气单胞菌属和假单胞菌属,为了更好地保持AP包装鲶鱼肉片的品质,应当设法控制它们的生长繁殖。
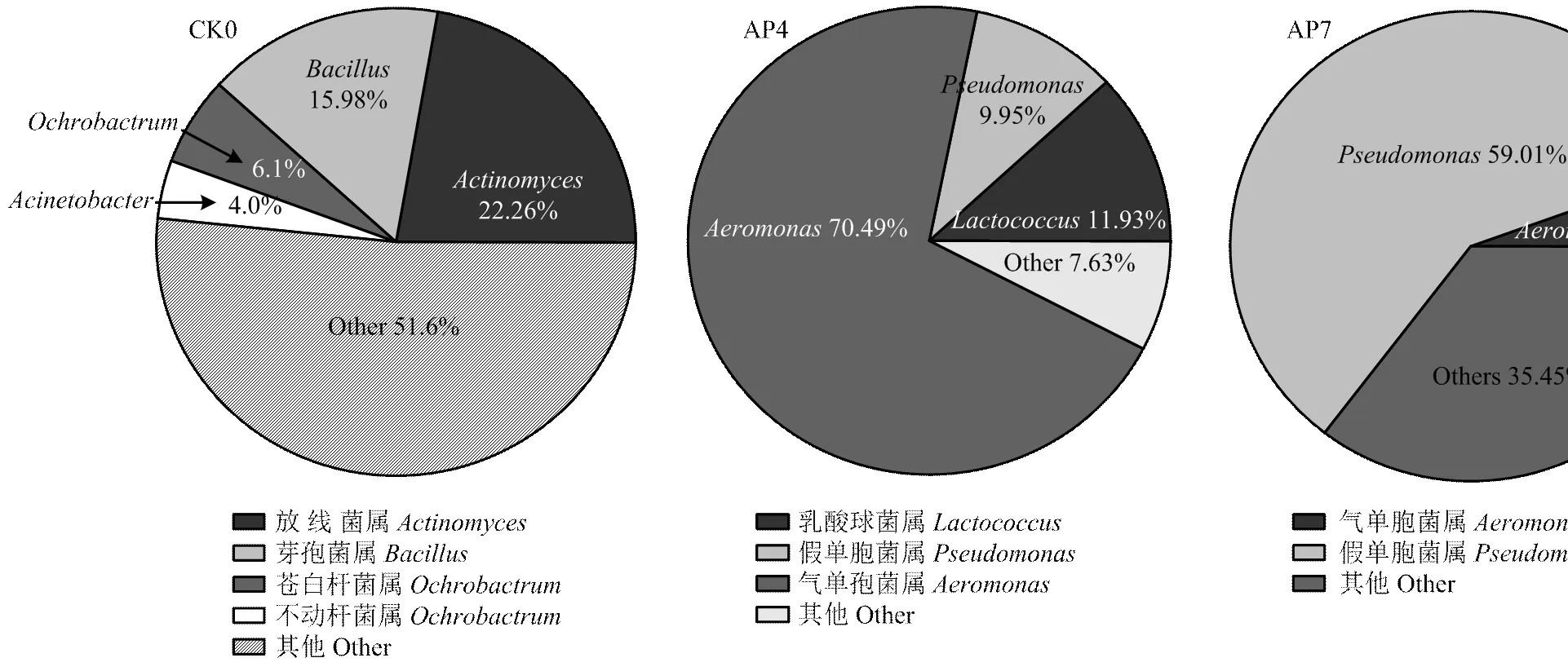
图3 基于属水平的鲶鱼片微生物群落结构(CK0组及AP组)

图4 基于属水平的鲶鱼片微生物群落结构(MAP组)
MAP鲶鱼片冰温贮藏10 d时,微生物群落结构与新鲜鲶鱼片(CK0)比较并没有显著差异。至贮藏终点(30 d)时,丰度急剧上升为82.85%,其次为占8.09%,占2.47%,这3种菌属占总微生物的比例为94%,菌落组成结构逐渐变得单一。成为MAP鲶鱼片的优势腐败菌。
天然保鲜液作用的MAPP组鲶鱼片在冰温贮藏过程中所占比例逐渐下降,由21.73% (10 d)降低到20.13%(30 d)和12.29%(40 d)。10 d时的葡萄球菌属()(3.72%)、肠球菌属()(8.24%)和苍白杆菌属()(5.20%)至贮藏第30、40天时逐渐下降到较小的比例:(1.51%,0.57%)、(2.18%,0.41%)和(3.26%,1.89%)。而奈瑟菌属()的丰度由0.07%(10 d)上升到22.76%(30 d);在贮藏前期丰度较低,为 2.03%(10 d),而贮藏40 d达到46.44%;不动杆菌属()的比例由10.79%(10 d)上升为17.98%(40 d)。所以,和成为MAPP鲶鱼片贮藏后期的优势致腐菌属。
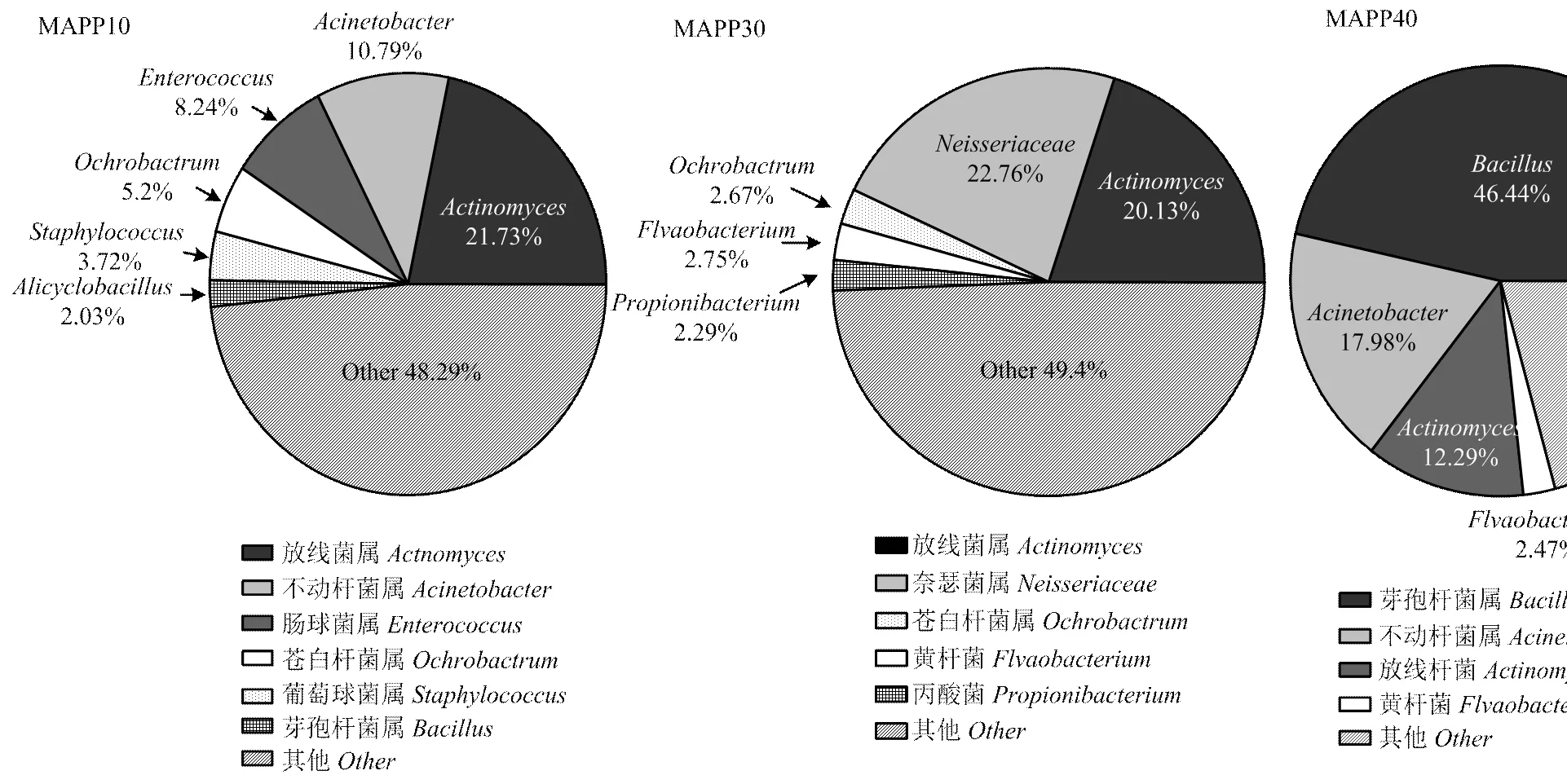
图5 基于属水平的鲶鱼片微生物群落结构(MAPP组)
2.4 鲶鱼片贮藏过程中细菌群落的Alpha多样性分析
表3为鲶鱼片微生物Alpha多样性指数表。Chao1、ACE、Chao/ACE为群落丰度指数(community richness),指数越大,群落丰度越高;Shannon和Simpson代表群落多样性(Community diversity),Shannon值越大,群落多样性越高,Simpson指数值越大,则群落多样性越低。
由细菌群落的Alpha多样性分析表明,随着贮藏时间的延长,细菌群落组成发生较大的变化,新鲜鲶鱼片(CK0)Chao1指数、Ace指数和Shannon指数均较高,Simpson指数较低,这表明新鲜鲶鱼肉细菌群落丰富,具有较高的多样性。随着贮藏时间的延长,AP鲶鱼片冷藏4 d细菌的丰度和多样性逐渐降低,说明低温对某些嗜温性细菌具有抑制性,导致其生长受阻。贮藏7 d,进入鲶鱼片腐败阶段,蛋白质和脂肪分解产生一些低分子碱性化合物,肉的pH升高,为某些适于分解蛋白质和脂肪的微生物创造了生长和繁殖的机会,细菌多样性提高,群落丰度随之提高。

表3 生物多样性指数表
对冰温贮藏MAP鲶鱼片而言,在贮藏前期,细菌多样性和丰度(Chao 1、Ace,Chao/Ace和Shannon、Simpson指数)与新鲜鲶鱼片相比无较大变化。在贮藏终点,多样性和丰度仍明显低于AP冷藏组相同阶段(即AP7)。经保鲜液作用的MAPP组细菌多样性和丰度在贮藏第10天与CK0组无明显差异,贮藏30 d高于MAP组,这可能是添加壳聚糖、蜂胶、Nisin等保鲜液后改变了微生态的内环境所致,但随着贮藏时间的延长,细菌多样性和丰度逐渐降低,也说明冰温+气调+保鲜液三重作用对细菌群落的抑制作用。
2.5 鲶鱼片贮藏过程中细菌群落的主成分分析
由图6可知,CK0、MAP10、MAPP10、MAPP30和MAPP40样品的微生物组成较为接近,可认为是一个群体;AP7则和这个群体的组成有一定的差别;而MAP30、AP4和这个群体的差别很大。由此可知,冰温贮藏+气调包装可以很好地维持鲶鱼肉的品质,使鲶鱼肉的微生物菌群结构在整个贮藏过程中与CK0(即新鲜鲶鱼片)相比并没有发生显著的变化,这种保鲜作用在添加保鲜剂的MAPP样品组贮藏30、40 d的时候依然有效。而MAP30样品根据感官判定已经达到腐败阶段,其中腐败菌大量繁殖,致病菌活力增强,微生物组成发生了很大的变化。和气调包装冰温贮藏的条件不同,空气包装的鲶鱼片在低温条件下微生物组成与前者有所差异,部分需氧或兼性厌氧菌如大量繁殖(AP4),进而成为腐败的优势菌群(AP7),样品的细菌群落结构有了显著性的差异。图6说明冰温贮藏的样品在货架期内其细菌群落结构与新鲜样品差异性小,而空气包装样品在贮藏期间均有不同的细菌群落分布,与新鲜样品的差异性大,而添加天然保鲜液的样品在贮藏期内(40 d之内)能很好的保持微生物组成不发生显著变化。

图6 鲶鱼片细菌群落贮藏过程中主成分分析
3 讨论
新鲜鲶鱼片初始微生物数量不高,但丰度较大,各种微生物相互制衡。无论采用哪种方式包装和贮藏,随着贮藏时间的延长,部分微生物生长繁殖,成为优势腐败菌,而其他微生物受到抑制,因此微生物丰度急速下降。和成为鲶鱼片空气包装低温贮藏的优势腐败菌。是水产品中的常见致腐菌,它与其他腐败菌协同作用,水解蛋白质、淀粉和脂肪等,产生的尸胺是腐败时不良气味的直接来源[17]。KROVACEK[18]和MANO[19]等研究表明,能够在-2—10℃的低温下生存和繁殖,在冷藏的牛肉、烤牛肉和猪肉中都发现过该菌。李苗云等[20]也发现是冷却猪肉贮藏过程中主要的优势腐败菌之一。是冷链流通中高蛋白水产品腐败的主要原因[21-22]。DAINTY[23]研究表明,肉品的腐败在很大程度上取决于肉品初期的数量和该菌在菌系中所占的比例。本试验中,AP鲶鱼片贮藏4 d以后,丰度大大超过成为冷藏条件下有氧包装的优势腐败菌,这是因为属好氧菌,属兼性厌氧菌,所以在有氧包装条件下,逐渐成为优势菌并使鱼肉发黏、变色,产生NH3和H2S等散发出刺鼻的臭味,使鱼肉在感官上难以接受,这与许多研究报道一致[24-26]。
包装方式和贮藏温度的不同带来微生物群落结构的差异,与AP鲶鱼片相比,MAP鲶鱼片菌相构成不及前者丰富,体现了气调包装对细菌菌群的抑制作用。气调包装中高浓度CO2通过改变微生物细胞内酶结构或影响细胞膜功能等方式来抑制细菌的生长代谢[27],特别是对等需氧菌的抑制。贮藏终点,丰度降低为0.14%。成为MAP鲶鱼片冰温贮藏后期的优势腐败菌,丰度值高达82.85%。励建荣等[28]研究发现冷藏((3±0.5)℃)的气调包装(75% CO2/25% N2及50% CO2/50% N2)鱼丸中为优势腐败菌。STAMATIS[29]也发现是气调包装(75% CO2/25% N2及50% CO2/50% N2)鲭鱼在3℃或6℃下微生物最多的种群之一。
本研究中并未成为MAPP鲶鱼片的优势菌属,贮藏过程中丰度在0.12%—1.42%,MAP鲶鱼片中丰度较高的在MAPP鲶鱼片中丰度值始终小于0.10%,丰度也逐渐降低,至贮藏40 d为0.41%,试验说明天然保鲜液抑制其生长,改变了鲶鱼片菌群结构。这是因为本试验所用的复合保鲜液由溶菌酶、壳聚糖、蜂胶和Nisin等按比例配合而成。Nisin和溶菌酶等对革兰氏阳性菌作用强;蜂胶对革兰氏阴性菌作用强;茶多酚既有抑菌作用又有抗氧化作用;壳聚糖则对肠杆菌、沙门氏菌及葡萄球菌等多种微生物都有较强的抑制作用[30],研究报道壳聚糖还可以有效抑制三甲胺生成和脂肪氧化,降低生物胺生成量,使尸胺被完全抑制,组胺质量分数小于50 mg·kg-1[31]。抑菌剂不同,抑菌谱亦不同。试验说明5种天然抑菌剂按照一定比例复配起来可以拓宽抑菌谱,起到明显的抑菌作用。
MAPP组鲶鱼片贮藏后期、奈瑟菌属()和的丰度较高。为革兰氏阳性菌,其芽孢位于菌体内,具有厚而含水量低的多层结构和高含量吡啶二羧酸,所以对热、干燥、辐射、化学消毒剂和其他理化因素有较强的抵抗力,对保鲜液有比较强的抵抗性,保鲜液并不能将其很好抑制,当保鲜液发挥抑菌效能,将其他细菌抑制之后,它的丰度相应提高。专性需氧,本不是MAP贮藏的优势菌,但随着包装袋内CO2的逐步消耗及外界O2通过包装袋的渗透改变了鲶鱼片贮藏的内环境,为奈瑟菌属()的生长繁殖创造了条件。此外,也成为MAPP组鲶鱼片贮藏后期的优势菌群之一。孙丽霞[32]对气调包装结合茶多酚、Nisin和壳聚糖涂膜保鲜后的大黄鱼货架期终点(20 d)的菌落结构进行分析,也得出为主要致腐菌的结论。
本试验发现,在新鲜(CK0)及气调包装鲶鱼片(MAP10、MAPP10、MAPP30、MAPP40)中一直存在并占较大比例,说明也是贮藏过程中的主要污染微生物之一,应该引起足够重视。无芽孢、无运动性、呈分枝状或棍棒状,厌氧或兼性厌氧菌,二氧化碳能促进其生长。在其他文献中,极少报道,也未见在水产品中的生物学特性的研究报道,而本试验中成为鲶鱼片冰温贮藏的优势腐败菌之一,因此有必要在以后的研究中对其做进一步的深入研究。据报道,是厌氧包装的优势腐败菌,但是本试验中,的丰度较低,与传统微生物培养的结果一致,可能与原料鱼的品种、饲养环境等有关。
本试验采用以454 FLX+平台高通量测序为基础的宏基因组学技术全面研究了鲶鱼片贮藏过程中微生物的物种组成及丰度信息,这为充分认识不可培养微生物并从完整的群落水平上研究微生物活动提供了可能,对于解析贮藏过程中微生物的动态变化以及贮藏过程的质量安全监测具有重要的意义和应用价值。
然而,任何一种微生物的研究手段都有其自身的优势和局限性。高通量测序技术涵盖的信息量巨大,某些未知序列因没有足够的参照标准,使得海量信息的归类整合相对模糊。同时高通量测序技术是以微生物DNA作为检测基础,无法判别菌体的存活状态[33]。传统纯培养鉴定方法尽管只能进行一般的表性特征描述,但其具有成本低、分离出的菌体纯度高等特点,在水产品贮藏保鲜研究中仍占有重要地位,可以作为高通量测序技术的有益补充。
4 结论
采用宏基因组学方法分析了鲶鱼片贮藏过程中细菌群落的组成及其丰度变化,考察了天然保鲜剂对贮藏过程中菌相变化规律及菌落结构的影响,共鉴定出25个门、433个属的细菌。基于门水平,Proteobacteria、Actinobacteria和Firmicutes是优势菌群。基于属水平,新鲜鲶鱼肉初始菌群主要是和,空气包装鲶鱼片低温贮藏过程中优势菌为和,气调包装鲶鱼片在冰温贮藏过程中逐渐成为优势菌群。添加天然保鲜液后,丰度降低。茶多酚、Nisin和壳聚糖等天然保鲜液能显著抑制鲶鱼片中等菌属的生长繁殖,降低了鲶鱼片细菌菌群的丰度和多样性。
References
[1] HANDELSMAN J. Metagenomics application of genomics to uncultured in microorganisms., 2004, 68(4): 669-685.
[2] HANDELSMAN J, RONDON M R, BRADY S F, CLARDY J, GOODMAN R M. Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products., 1998, 5(10): 245-249.
[3] KERGOURLAY G, TAMINIAU B, DAUBE G, VERGES M C. Metagenomic insights into the dynamics of microbial communities in food., 2015, 213: 31-39.
[4] WOLFE B E, DUTTON R J. Fermented foods as experimentally tractable microbial ecosystems., 2015, 161(1): 49-55.
[5] LOPEZ-VELASCO G, WELBAUM G E, BOYER R R, MANE S P, PONDER M A. Changes in spinach phylloepiphytic bacteria communities following minimal processing and refrigerated storage described using pyrosequencing of 16S rRNA amplicons., 2011, 110(110): 1203-1214.
[6] ALDRETE-TAPIA A, ESCOBAR-RAMIREZ M C, TAMPLIN M, HERNANDEZ-ITURRIAGA M. High-throughput sequencing of microbial communities in Poro cheese, an artisanal Mexican cheese., 2014, 44(6): 136-141.
[7] JUNG J Y, LEE S H, KIM J M, PARK M S, BAS J W, HAHN Y, MADSEN E L, JEON C OMetagenomic analysis of kimchi, a traditional Korean fermented food., 2011, 77(7): 2264-2274.
[8] JUNG J Y, LEE S H, LEE H J, SEO H Y PARK W S.Effects ofstarter cultures on microbial communities andmetabolites during kimchi fermentation., 2012, 153(3): 378-387.
[9] PARK E J, CHUN J, CHA C J, PARK W S, CHE O J.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing., 2012, 30(1): 197-204.
[10] BENSON A K, DAVID J R, GILBRETH S E, SMITH G, NIETFELDT J, LEGGE R, KIM J, SINHA R,DUNCAN C E, MA J, SINGH I. Microbial successions are associated with changes in chemical profiles of a model refrigerated fresh pork sausage during an 80-day shelf life study., 2014, 80(17): 5178-5194.
[11] XIAO X, DONG Y, ZHU Y, CUI H. Bacterial diversity analysis of Zhenjiang yao meat during refrigerated and vacuum-packed storage by 454 pyrosequencing., 2013, 66(4): 398-405.
[12] ZHAO F, ZHOU G, YE K,WANG S, XU X, LI C. Microbial changes in vacuum-packed chilled pork during storage., 2014, 100(100): 145-149.
[13] ZHU Y C,MA L Z, XIONG Y L. Super-chilling (-0.7℃) with high-CO2packaging inhibits biochemical changes of microbial origin in catfish () muscle during storage, 2016, 206: 182-190.
[14] 马俪珍. 冷却猪肉生物和物理综合保鲜技术及保鲜机理的研究[D]. 北京: 中国农业大学, 2003.
MA L Z. Studies on the biological and physical integrated preservation techniques and preservation effect of chilled pork [D]. Beijing: China Agricultural University, 2003. (in chinese)
[15] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, BITTINGER K, BUSHMAN F D. QIIME allows analysis of high-throughput community sequencing data., 2010, 7(5): 335-336.
[16] SCHLOSS P D,WESTCOTT S L, RYABIN T, HALL J R, HARTMANN M. Introducing mother: Open-source,platform-independent,community-supported software for describing and comparing microbial communities., 2009, 75(23): 7537-7541.
[17] DUAN J, CHERIAN Q, ZHAO Y. Quality enhancement in fresh and frozen lingcod () fillets by employment of fish oil incorporated chitosan coatings., 2010, 119(2): 524-532.
[18] KROVACEK K, FARIS A, BALODA S B, PETERZ M, LINDBERG T. Prevalence and characterization ofsppisolated from foods in Uppsala, Sweden., 1992, 9(1): 29-36.
[19] MANO S B, ORDONEZ J A, FERNANDO G D. Growth/survival of natural flora andon refrigerated uncooked pork and turkey packaged in modified atmospheres., 2000, 17(6): 657-669.
[20] 李苗云, 周光宏, 徐幸莲.应用PCR-DGGE研究冷却猪肉贮藏过程中的优势菌.西北农林科技大学学报(自然科学版), 2008, 36(9): 185-189.
LI M Y, ZHOU G H, XU X L. Study on the dominant bacteria during the storage period on chilled pork using PCR-DGGE., 2008, 36(9): 185-189. (in Chinese)
[21] OLSSON C, AHRNE S, PETTERSSON B, MOLIN G. The bacterial flora of fresh and chill-stored pork: Analysis by cloning and sequencing of l6S rRNA genes., 2003, 83(3): 245-252.
[22] GILL C O, DUSSAULT F, HOLLEY R A, HOUDE A, JONES T. Evaluation of the hygienic performances of the processes for cleaning,dressing and cooling pig carcasses at eight packing plants., 2000, 58(1/2): 65-72.
[23] DAINTY H, MACKEY B M. The relationship between the phenotypic properties of bacteria from chilled-stored meat and spoilage processes., 1992, 73(supplement s21): 103s-114s.
[24] LABADIE J. Consequences of packaging on bacterial growth: Meat is an ecological niche., 1999, 52(3): 299-305.
[25] ERCOLINI D, RUSSO F, BLAIOTTA G, PEPE O, MAURIELLO G.Simultaneous detection of, andfrom meat by use of a multiplex PCR assay targeting the carA gene., 2007, 73(7): 2354-2359.
[26] ARNAUT-ROLLIER I, ZUTTER L D, HOOF J V. Identities of thespp. in flora from chilled chicken., 1999, 48(2): 87-96.
[27] JYDEGARRD-AXELSEN A M, HØIBY P E, HOLMSTROM K, ROSSELL N, KNØCHEL S. CO2and anaerobiosis-induced changes inphysiology and gene expression of different Listeriamonocytogenes strains., 2004, 70(7): 4111-4117.
[28] 励建荣, 刘永吉, 朱军莉, 张旭光, 傅俏, 赵羽, 周小敏, 李钰金. 真空、空气和气调包装对冷藏鱼糜制品品质的影响. 水产学报, 2011, 35(3): 446-455.
LI J R, LIU Y J, ZHU J L , ZHANG X G, FU Q, ZHAO Y, ZHOUX M, LI Y J. Influence of vacuum packaging, air packaging and modified atmosphere Packaging on the quality of refrigerated surimi-based product., 2011, 35(3): 446-455. (in Chinese)
[29] STAMATIS N N, ARKOUDEL S J. Quality assessment of Scomber colias japonicus under modified atmosphere and vacuum packaging., 2007, 18(4): 292-300.
[30] CHANTARASATAPOM P, TEPKASIKUL P, KINGCHA Y, YOKSAN R, PICHYANGKURA R. Water-based oligochitosan and nanowhisker chitosan as potential food preservatives for shelf-life extension of minced pork., 2014, 159(1): 463-470.
[31] 李苗苗, 王江峰, 徐大伦, 张后程, 杨文鸽. 4种保鲜处理对冰温贮藏金枪鱼片生物胺的影响. 中国食品学报, 2015, 15(2): 111-119.
LI M M, WANG J F, XU D L, ZHANG H C,YANG W G. Effects of 4 packaging methods on biogenic amines formation in yellowfin Tuna () fillets under controlled freezing-point temperature., 2015, 15(2): 111-119. (in Chinese)
[32] 孙丽霞. 气调包装结合生物保鲜剂对冷藏大黄鱼品质及菌相的研究[D]. 杭州: 浙江工商大学, 2014.
Sun L X. The Effect of Modified atmosphere packaging with biological antistaling agent on storage quality of large yellow croaker and bacteria phase [D]. Hangzhou: Zhejiang Gongshang University, 2014. (in Chinese)
[33] 曹荣, 刘淇, 赵玲, 孟辉辉. 基于高通量测序的牡蛎冷藏过程中微生物群落分析. 农业工程学报, 2016, 32(20): 275-280.
Cao R, Liu Q, Zhao L, Meng H H. Microbial flora analysis of oyster during refrigerated storage by high throughput sequencing technology., 2016, 32(20): 275-280. (in Chinese)
(责任编辑赵伶俐)
Metagenomic Analysis of Bacterial Phases of Catfish Fillets under Different Storage Conditions
ZHU YingChun1, Wang Yang2, Fan XiaoPan3, MA LiZhen3, Wang KaiLi1
(1College of Food Science and Engineering, Shanxi Agriculture University, Taigu 030801, Shanxi;2The Department of Aquaculture Science of Tianjin Agriculture University/Tianjin Key Laboratory of Aqua-Ecology and Aquaculture, Tianjin 300384;3The Department of Food Science and Biological Engineering of Tianjin Agriculture University/Tianjin Engineering and Technology Research Center of Agricultural Products Processing, Tianjin 300384)
【Objective】The objective of this experiment is to analyze the dynamic changes of bacterial phase of catfish fillet stored under different storage conditions, evaluate the effect of natural preservative on the special spoilage bacteria. 【Method】There were 8 groups in this experiment including fresh catfish () fillets (CK0), AP (air-package) catfish fillets stored at (4±1)℃ for 4 and 7 d (AP4, AP7),MAP (modified atmosphere package, 60%CO2/40%N2) catfish fillets stored at controlled freezing-point temperature (0.7±0.02)℃ for 10 and 30 d(MAP10,MAP30), MAP catfish fillets added with 5% natural preservative stored at controlled freezing-point temperature (0.7±0.02)℃ for 10, 30 and 40 d (MAPP10, MAPP30 and MAPP40). The natural preservative consists of 0.5% chitosan, 0.1% propolis, 0.075% lysozyme, 0.075% Nisin and 0.5% tea polyphenol. Microbial16S rDNA of different samples were sequenced in metagenomics analysis, bacterial composition and abundance of these groups were compared. Alpha diversity and principal component analysis were carried out to investigate the effect of the natural preservative, package and storage temperature on bacterial phase changing.【Result】Totally 25 phylum, 433 genuses of bacteria were identified in 8 sample groups. The same as CK0, the principal genus in MAP10, MAPP10, MAPP30 was, while it was(70.49%) and(59.01%) in AP4 and AP7, respectively. From the respect of microbiology, MAP + controlled freezing-point temperature was better than AP + low temperature storage. During the storage, the abundance ofincreased sharply from 15.78% (MAP10) to 82.85% (MAP30), while in the MAPP group (MAPP10 and MAPP30) which supplemented with natural preservativesrarely could be detected. 【Conclusion】MAP + controlled freezing-point storage significantly lowered the bacterial abundance and diversity, therefore is useful to prolong the shelf life of catfish fillets. The components of tea polyphenol, Nisin and chitosan in the natural preservative used in this study markedly inhibited the growth and the multiplication ofwhich is the special spoilage bacteria in the MAP fillets stored at controlled freezing point. This is important for improving the security of catfish meat against microbial contamination through precise target inhibition.
catfish fillet; metagenomics; bacteria phase changes; natural preservative
2016-08-01;接受日期:2017-01-05
天津市水产产业技术体系创新团队项目、山西农业大学博士科研启动基金(2015ZZ06)
朱迎春,Tel:13835487476;E-mail:yingchun0417@163.com。 通信作者马俪珍,Tel:18622200780;E-mail:Malizhen-6329@163.com
