气孔导度对环境因素响应及模型研究进展
2017-03-21杨伟才毛晓敏
杨伟才,毛晓敏
(中国农业大学农业水问题研究中心,水利与土木工程学院,北京100083)
0 引 言
干旱是限制作物生产的重要因素之一。植物抗旱机理的核心问题是水分关系的调控,而在水分关系的调控中气孔运动的调节发挥着关键作用[1]。气孔是植物与外界环境之间水、气交换的主要通道,直接控制作物蒸腾光合等生理过程, 在干旱胁迫下,调节气孔开闭可减少植物蒸腾量,从而减少水分消耗。同时,气孔开闭也影响CO2的通量,对植物光合作用和作物产量产生影响。气孔导度指水汽通过气孔的强度,与气孔阻力呈倒数关系。气孔导度的模拟研究是SPAC研究中一个很重要的方面,同时也为不同学科背景领域的研究提供一个有力的连接手段[2]。此外,气孔运动的调节受多重因素的综合影响,只有将这些因素区分开才能准确判断植物气孔运动状态,进行水分调控,调节作物生产。
多年来,围绕气孔运动的机理开展了大量研究,建立了气孔导度的模型,探究了在各因素的影响下气孔开度的变化机理。本文介绍国内外气孔导度的研究成果和存在的问题,有关气孔导度模型的建立及其发展,影响气孔导度的各类因素的研究,以便为今后进一步的科研工作提供参考。
1 气孔导度对影响因素的响应
气孔开闭受多种因素影响,其运动机理十分复杂。通常,将气孔导度(或者其倒数气孔阻力)作为表示气孔运动状态的一项生理指标。凡是影响光合作用和叶子水分状况的环境因素都会影响气孔的运动。
1.1 气孔导度对环境因子变化的响应
(1)光。在无水分胁迫的自然条件下,光是影响气孔运动的主要环境因素。气孔导度随光的增强而增大,但光强达到一定强度后,这种增大的趋势会逐渐减小。光强过于强烈,会破坏植物组织从而抑制气孔的张开。
(2)湿度环境。在大气湿度低、饱和差大,而水分的运输又不足以补充其蒸腾引起的水分消耗时,为了防止蒸腾过快,植物会自动关闭气孔,这样的气孔关闭机制称为被动脱水关闭[3]。
(3)水分环境。当植物的整个叶片或根缺水时,保卫细胞通过其自身代谢过程减少细胞内的溶质而使其水势增高,细胞因而失水,气孔关闭,这样的气孔关闭称之为主动脱水关闭。通常,大气湿度在短时间内即可影响气孔运动,并引起蒸腾的瞬时变化,而土壤水分在一天内的变化梯度并不明显,更多的是影响蒸腾的日平均值,而后者通常比前者在影响气孔、调节蒸腾方面更为重要。
(4)温度。气孔运动同时受到温度变化的影响。通常,气孔开度随温度升高而增大,在最适温度下达到最大,一般植物多为20~30 ℃。
(5)CO2浓度。较低浓度CO2促使气孔张开,而较高浓度的则能诱导气孔关闭。王健林[4]对北方粳稻光合速率、气孔导度对CO2浓度相应的研究发现,CO2浓度越高,气孔导度越小。
1.2 对气孔运动调节机制理解的发展
气孔导度的开闭不仅受外界各种环境因素的影响,同时还与植物自身生理状态和化学调节机制存在着密切的联系。而气孔运动与各方面之间的相互关系十分复杂,受到众多专家学者的关注。人们对于气孔运动的调节机制、各因素与气孔关系的了解是逐渐深入的。
早期有关气孔运动与植物抗旱关系的研究表明,植物在干旱胁迫下叶片水势发生变化,从而导致气孔导度的下降,降低水分消耗,即干旱条件下气孔的关闭是由叶片水势下降引起的。
此后又有试验现象发现,在干旱胁迫下,当叶水势未下降之前,气孔导度即开始下降,说明气孔导度的下降并不完全是由叶水势操纵的。通过深入的研究表明干旱情况下气孔运动的主动调控是由化学信号引起的。植物激素脱落酸(ABA)和pH值在根与叶片之间的信息交流中起着核心的作用[5,6]。
随着研究的逐步系统和深入,人们发现在某些情况下,这种根与叶片之间的信息传递可能没有普遍性,或者说,气孔运动对化学信号的敏感性存在着很大的差异。造成这一敏感性差异的因素有很多,不同植物、不同条件下,根系化学信号对气孔导度的调节能力都会存在较大差异。例如,在玉米中干旱诱导的根信号可以灵敏地操纵气孔运动,但在小麦中这种根信号对气孔运动的调节作用不明显[7,8]。王晶晶[9]对干旱条件下葡萄叶片气孔导度和水势与节位变化的关系的研究发现,葡萄不同节位叶片对干旱的响应敏感度也存在明显差异,中上部比下部叶片敏感。轻度干旱就可导致中上部叶片气孔导度呈下降趋势。其具体的机理原因和植物生理状态还有待进一步研究。
除了气孔敏感度问题外,系统化学信号和叶水势(即水信号)对气孔运动调节的相互关系也值得深入研究。在什么条件下,水信号和化学信号对气孔运动的调节究竟谁占主导,叶片水势和气孔信号之间的相互关系如何,有待进一步深入讨论。有关这一点,纪文龙[10]的研究指出,不同的水分条件,气孔导度和叶片水势对干旱的反应是不同的,气孔导度的调控方式也不完全不同。
浇水良好的情况下,尽管气孔导度随叶片节位的升高而增加,但不同节位叶片的水势并没有显著性差异,说明气孔导度和叶水势之间没有关系,或者说,气孔导度并没有受到叶水势的调控;半根胁迫下,当叶水势还没有下降时,气孔导度即开始下降,说明气孔导度可能受系统化学信号的控制;这应是植物对干旱做出的主动响应,在水分胁迫并不严重的情况下即主动调控,降低水分消耗;全根胁迫情况下,土壤水分亏缺速度过快,从而导致叶水势快速下降,导致气孔导度减小。因此,在全根胁迫下,气孔运动的调节主要是由叶水势,即主要是由水信号控制的。
2 气孔导度模型的建立与发展
尽管人们对气孔与环境因子之间的关系进行了大量的试验与深入的探讨,但由于气孔运动受植物生理和环境要素变化的共同影响,生理生化机制非常复杂,人们对气孔开闭的生理生化机制有很多方面的未知,从理论上建立推测气孔导度的机理模型存在一定的困难,只能通过实测或者利用经验公式来估算。同时时至今日,人们仍无法直接测量气孔导度,在实际测量中气孔导度是通过测量叶表面与大气间水汽浓度差计算得到。因此建立可以准确描述气孔运动的气孔导度模型显得十分重要。
比较有代表性的气孔模型有两类, 即以Jarvis为代表建立的气孔导度与环境因子的多因子阶乘模型和以Ball等人为代表建立的气孔导度与净光合速率及环境因子的组合因子模型[11,12]。
2.1 多因子阶乘模型
Jarvis气孔导度模型认为,在土壤水分供应充足条件下,影响气孔导度的主要因素有光强、空气饱和差、风速、CO2浓度等。假定各变量对气孔导度的作用是相互独立的, 根据植物叶片气孔导度对单一环境因子的响应, 叠加得到多个环境因子同时变化时对叶片气孔导度的综合影响,通常可以采用如下的一般形式:
gs=gn+gxf(Qp)f(VPD)f(φ)f(T)f(Ca)
(1)
式中:gs为气孔导度,mol/(m2·s);gn、gx二者分别是最小和最大气孔导度,最小气孔导度gn一般出现在夜间,通常接近于0;f(Qp)、f(VPD)、f(φ)、f(T)、f(Ca)分别为气孔导度对光合有效辐射[μmol/(m2·s)]、饱和水汽压差(kPa)、叶水势(kPa)、温度(℃)和CO2浓度(μmol/mol)环境因子的响应函数,其值均介于0~1之间, 它模拟了气孔导度对不同环境因子的响应特征。
Jarvis模型因原理简单、形式灵活,被广泛应用于农田蒸散、陆面过程和生物地球化学循环,亦作为很多蒸散或者光合作用模拟研究中的气孔导度子模型被应用。但此模型假设条件是在土壤水分充足条件下的气孔导度对其他环境因子的响应,所以此模型并不能很好的模拟水分胁迫条件下气孔导度的变化。同时它假设各环境因子独立地作用于植物气孔,未考虑气孔导度与细胞间CO2浓度、蒸腾、湿度亏缺、叶水势间复杂的反馈作用。
2.2 组合因子模型
考虑到气孔具有维持胞间CO2浓度为常数的功能, 在稳定状态下当叶片表层CO2浓度和大气湿度不变时, 气孔导度与净光合速率具有线性关系, 由此提出的基于气孔导度与光合速率关系的组合模型如下:
(2)
式中:An为净光合速率,μmol/(m-2·s);hs为叶表面处空气的相对湿度,%;Cs为叶表面CO2浓度,μmol/ mol;e1和g1分别为模型待定参数。
该模型把影响气孔导度的环境影响因子分为两大类,一类直接表达在模型中,另一类如光、温度等因子的影响隐含在An中。
模型中An可表达为Qp等的函数形式,
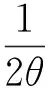
4θ[aQp(Ax-(1-θ)Rd)-RdAx]}1/2)
(3)
式中:Ax是特定条件下的光合能力;a是初始光合速率;Rd是暗呼吸速率。
该模型依据光合作用与气孔调节之间的偶联关系, 以光合速率作为中间变量,考虑了气孔调节中的反馈机制, 其导出有明确的生理学意义。
Ball-Berry模型考虑了因子的交互作用,有较高的精度,模型形式简单,模型模拟的效果较好,是气孔导度模拟时较为经济的选择,也是目前很多主流的单叶片尺度模型、区域尺度模型和全球尺度模型中常用的气孔导度模型。
2.3 气孔导度模型的发展
Jarvis模型是一个典型阶乘型的经验模型,注重描述环境要素对气孔开度的影响,但无法反映气孔与环境要素间复杂的反馈作用[13],机理意义不明确。后人对此进行了多方面的修正。这些工作或是对环境变量函数组合的改进,或是气孔对各环境变量响应函数的表现形式的修正,或者对环境变量及其各因子的响应函数优化组合[14-16]。
Ball-Berry模型仍是一个半经验型模型,认为气孔导度和光合速率之间存在着线性关系。在此基础上,人们给出了不同形式的修正模型[17-19]。这些修正模型的本质仍然是Ball-Berry模型。这些模型中气孔导度与部分环境因子之间的响应关系依然是经验性的。
Jarvis模型和Ball-Berry模型中因子影响函数均存在多种表达式,为了准确模拟气孔导度,需要进行大量的参数调试和校正,而随着输入参数的增多,计算过程也变得复杂。选择适合的气孔导度模型,不仅能够提高预测精度,同时也可减轻参数确定的难度和强度。李永秀[20]为评估不同模型模拟冬小麦气孔导度的适用性,从常用的Jarvis模型和Ball是JBerry模型中分别选择两种,根据试验资料估算模型参数,并对模型预测效果进行了检验和比较,为冬小麦气孔导度模型的选择提供了一定的参考。但此研究只针对南京地区一个冬小麦品种的试验资料,缺乏地区和作物品种上的通用性和推广型。在实际应用中,模型的参数会因地域、品种、水肥供应情况的不同而不同,需要根据实际情况进行订正。因此,模型参数数量直接影响其实用性,也是评价模型的一个重要指标。
袁国富[21]对冬小麦气孔导度模型水分响应函数的参数化进行了研究。结果显示,在气孔导度对空气湿度的响应函数中,采用双曲线形式和幂指数形式来拟合冬小麦的气孔导度时不存在明显的差异。这与Wang[22]的结论不同,Wang认为幂指数形式更适合湿润气候下的应用。究其原因,冬小麦作为一种主要生长在我国北方地区的作物,空气湿度相对偏低,应用环境不同,所以两者得出不同结论。
除了最常见的Jarvis模型和Ball-Berry模型,近年来运用人工神经网络(ANN)进行气孔导度的模拟也取得了一定的进展[23]。同时一些更加机理性的气孔模型也被提出,如叶子飘[24]从CO2分子在气孔中扩散这个最基本的过程出发,应用物理学中的分子扩散和碰撞理论、流体力学与植物光合生理等知识,推导出叶片气孔导度与光合速率和胞间CO2浓度之间的关系,并给出了气孔导度的机理模型。用此机理模型拟合冬小麦气孔导度的测量数据,可较好地描述植物气孔导度对光强的响应问题。
许多学者还致力于开发气孔导度在土壤水分亏缺时气孔模型[25]。此外还有基于水力学控制理论的模型,气孔导度与ABA浓度、土壤水势、叶水势等的耦合模型[26-28],这些模型注重气孔运动的生理机制,具有广阔的应用前景。
3 结 语
(1) 影响气孔导度的因素多种多样,不仅与各种环境因素相关,同时跟植物自身生理状态和化学调节机制有关。水信号和化学信号对气孔运动调节的相互关系,气孔调节的敏感度问题,各种环境因素,水肥,地域区别,植物种类的不同导致气孔运动的差异,这些都是仍需关注的问题,可在植物生理方面进行更加深入的研究,弄清气孔运动的生理生化机制。
(2)Jarvis模型和Ball-Berry模型是气孔导度模型中基本的、最常用的模型,存在多种修正模型,参数的多少,模型的模拟效果均存在差异。此两者仍是偏经验性的模型,机理方面存在不足。未来需要发展更加机理性的模型,综合考虑植物本身遗传因素,生理生化调节机制和外界环境因素变化的影响,提高对气孔运动模拟的效果。
(3)春小麦是我国西北地区的主要粮食作物之一,区域性的水资源匮乏是制约该地区春小麦进一步增产的主要因素。同时,西北地区光热资源丰富,蒸发量大,因此小麦覆膜应用广泛。因该地区光照充足,光强不太可能成为气孔导度的限制因素,有必要研究在干旱胁迫下西北干旱半干旱地区春小麦气孔导度的响应机理。同时,对比覆膜与不覆膜春小麦气孔导度的差异。可结合目前在西北地区正在开展的大田试验,研究该地区春小麦在不同生育期、在同一生育期不同时段,同一天不同时刻气孔导度对土壤含水量、叶水势响应的变化规律。
□
[1] 刘 婧, 王宝山, 谢先芝. 植物气孔发育及其调控研究[J]. 遗传, 2011,(2):131-137.
[2] 石培华, 冷石林, 梅旭荣. 气孔导度、表面温度的环境响应模型研究[J]. 中国农业气象, 1995,(5):51-54.
[3] 于贵瑞, 王秋凤. 植物光合、蒸腾与水分利用的生理生态学[M]. 北京:科学出版社, 2010.
[4] 王建林, 于贵瑞, 王伯伦, 等. 北方粳稻光合速率、气孔导度对光强和CO2浓度的响应[J]. 植物生态学报, 2005,(1):16-25.
[5] Tardieu F, Zhang J, Katerji N, et al. Xylem ABA controls the stomatal conductance of field-grown maize subjected to soil compaction or soil drying[J]. Plant, Cell and Environment,1992,15(12):193-197.
[6] Wilkinson S. pH as a stress signal[J]. Plant Growth Regul,1999,29:87-99.
[7] 康绍忠, 潘英华, 石培泽, 等. 控制性作物根系分区交替灌溉的理论与试验[J]. 水利学报, 2001,(11):80-86.
[8] Munns R, King R W. Abscisic acid is not the only stomtatal inhibitor in the transpiration stream of wheat plants[J]. Plant Physiology,1988,88:703-708.
[9] 王晶晶, 莫伟平, 贾文锁, 等. 干旱条件下葡萄叶片气孔导度和水势与节位变化的关系[J]. 中国农业科学, 2013,(10):2 151-2 158.
[10] 纪文龙, 范意娟, 李 辰, 等. 干旱胁迫下葡萄叶片气孔导度和水势动态的变化规律[J]. 中国农业大学学报, 2014,(4):74-80.
[11] Jarvis P G. The interpretation of the variations in leaf water potential and stomatal conductance found in canopies in the field[J]. Philosophical Transactions of the Royal Society, 1976:593-610.
[12] J Timothy Ball, Ian E Woodrow, Joseph A berry. Model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental conditions[J]. In: Biggens J ed. Progress in Photosynthesis, 1987:221-224.
[13] Jones C A. Effect of soil texture on critical bulk densities for root growth[J].Soil Science Society of America Journal,1983,47:1 208-1 211.
[14] Dolman A J.A multiple-source land surface energy balance model for use in general circulation models[J].Agricultural and Forest Meteorology,1993,65(1-2):21-45.
[15] Matsumoto K, Ohta T, Tanaka T. Dependence of stomatal conductance on leaf chlorophyll concentration and meteorological variables[J]. Agricultural & Forest Meteorology, 2005,132(1-2):44-57.
[16] Yu G R,Nakayama K,Matsuoka N, et al.A combination model for estimating stomatal conductance of maize(Zea mays L.)leaves over a long term[J]. A gricultural and Forest Meteorology,1998,92(1):9-28.
[17] Leuning R. A critical appraisal of a combined stomatal-photosynthesis model for C3 plants[J]. Plant, Cell and Environment, 1995,(18):339-355.
[18] Collatz G J, Ball J T, Grivet C, et al. Physiological and environmental regulation of stomatal conductance, photosynthesis and transpiration: a model that includes a laminar boundary layer[J]. Agricultural and Forest Meteorology, 1991,(54):107-136.
[19] Kim S-H, Lieth H. A coupled model of photosynthesis, stomatal conductance and transpiration for a rose leaf (Rosa hybrida L.)[J]. Annals of Botany, 2003,(91): 771-781.
[20] 李永秀. 冬小麦气孔导度模型的比较研究[C]∥ 第27届中国气象学会年会现代农业气象防灾减灾与粮食安全分会场, 中国北京, 2010.
[21] 袁国富, 庄 伟, 罗 毅. 冬小麦叶片气孔导度模型水分响应函数的参数化[J]. 植物生态学报, 2012,(5):463-470.
[22] Wang S S, Yan Y, Trishchenko A P, et al. Modeling the response of canopy stomatal conductance to humidity[J]. Journal of Hydrometeorology, 2009,(10):521-532.
[23] 吴大千, 徐 飞, 郭卫华, 等. 中国北方城市常见绿化植物夏季气孔导度影响因素及模型比较[J]. 生态学报, 2007,(10):4 141-4 148.
[24] 叶子飘, 于 强. 植物气孔导度的机理模型[J]. 植物生态学报, 2009,(4):772-782.
[25] Tardieu F, Davies W J. Stomatal response to abscisic Acid is a function of current plant water status[J]. Plant Physiology, 1992,98(2):540-545.
[26] Cochard H, Coll L, Le R X, et al. Unraveling the effects of plant hydraulics on stomatal closure during water stress in walnut[J]. Plant Physiology, 2002,128(1):282-290.
[27] Tardieu F, Davies W J. Integration of hydraulic and chemical signalling in the control of stomatal conductance and water status of droughted plants[J]. Plant Cell & Environment, 1993,16(4):341-349.
[28] 陈 骎. 气孔对土壤和空气湿度的反应及其模拟[D]. 北京:中国科学院研究生院(教育部水土保持与生态环境研究中心), 2013.
