熊去氧胆酸与羟甲烟胺治疗慢性肝内胆汁淤积的疗效及安全性对比
2017-03-20蒋羽毕卉
蒋羽 毕卉
【摘要】 目的 探究熊去氧胆酸与羟甲烟胺治疗慢性肝内胆汁淤积的疗效及安全性。方法 100例慢性肝内胆汁淤积患者, 采用随机数字表法分为A组和B组, 各50例。两组患者均给予护肝、抗病毒等对症支持治疗措施, A组在此基础上加用熊去氧胆酸治疗, B组在此基础上加用羟甲烟胺治疗。对比两组患者治疗2、4周后的临床疗效、肝功能变化及不良反应发生情况。结果 A组患者治疗总有效率为80.0%, 显著高于B组的62.0%, 差异具有统计学意义(P<0.05);两组患者治疗前各项肝功能指标比较差异无统计学意義(P>0.05), 治疗2、4周后两组患者的各项肝功能指标均较治疗前明显改善(P<0.05), 治疗2周后两组患者肝功能指标比较差异无统计学意义(P>0.05), 治疗4周后A组患者的肝功能指标改善情况显著优于B组, 差异具有统计学意义(P<0.05);两组患者均未发现明显的药物相关不良反应。结论 熊去氧胆酸在慢性肝内胆汁淤积的治疗上较羟甲烟胺更具优势, 长期用药可明显提高疗效且安全性较好, 值得在临床上推广和应用。
【关键词】 慢性肝内胆汁淤积;熊去氧胆酸;羟甲烟胺;疗效;安全性
DOI:10.14163/j.cnki.11-5547/r.2017.03.002
慢性乙型肝炎是世界范围内的传染病, 严重的威胁患者的健康。慢性乙肝会导致患者发生肝内胆汁淤积, 而肝内胆汁淤积又会进一步的加重肝细胞的损伤, 导致病情恶化, 如何有效的防治肝内胆汁淤积是改善症状缓解病情的重要基础[1, 2]。目前对于慢性肝内胆汁淤积的治疗除针对病因的措施外, 还有众多促胆汁排泄、减轻胆汁淤积的药物, 包括熊去氧胆酸、羟甲烟胺、腺苷蛋氨酸等[3, 4], 临床关于这些药物的疗效、安全性方面的研究尚处于初期阶段, 尚未达成统一认知, 本文就熊去氧胆酸与羟甲烟胺治疗慢性肝内胆汁淤积的疗效及安全性进行了对比研究, 现报告如下。
1 资料与方法
1. 1 一般资料 研究对象选取为2015年1~12月本院收治的100例慢性肝内胆汁淤积患者, 均符合《慢性乙型肝炎防治指南》[5]中的相关诊断标准, 采用随机数字表法分为A组和B组, 各50例。A组患者中男31例、女19例, 平均年龄(44.9±9.6)岁;B组患者中男32例、女18例, 平均年龄(45.1±9.4)岁。两组患者年龄、性别等一般资料比较差异无统计学意义(P>0.05), 具有可比性。本次研究经医院伦理委员会审批通过。
1. 2 治疗方法 两组患者均给予护肝、抗病毒等对症支持治疗措施, A组在此基础上加用熊去氧胆酸治疗, 给予患者熊去氧胆酸片(江苏克胜药业有限公司, 国药准字H32023777)250 mg/次, 2次/d口服;B组患者则在基础治疗基础上给予羟甲烟胺片(江苏鹏鹞药业有限公司, 国药准字H32021008)500 mg/次, 2次/d口服。两组患者均连续用药4周。
1. 3 观察指标及疗效判定标准 对比两组患者治疗2、4周后的临床疗效、肝功能变化及不良反应情况。疗效根据患者的症状表现情况, 分为显效、有效、无效[6], 显效:患者巩膜黄染等症状消退, 肝功能恢复正常;有效:患者患者巩膜黄染等症状显著改善, 肝功能基本恢复正常;无效:未能达到以上两种标准或出现加重。总有效率=显效率+有效率。肝功能指标统计包括总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、碱性磷酸酶(ALP)丙氨酸氨基转移酶(ALT)、谷氨酸氨基转移酶(AST)。观察两组患者不良反应发生情况。
1. 4 统计学方法 采用SPSS20.0统计学软件对研究数据进行统计分析。计量资料以均数 ± 标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
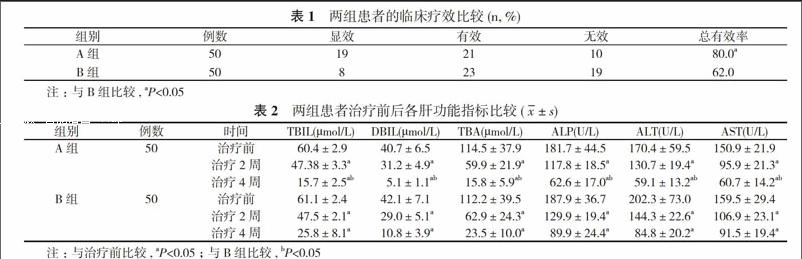
2. 1 临床疗效 A组患者治疗总有效率为80.0%, 显著高于B组的62.0%, 差异具有统计学意义(P<0.05)。
2. 2 肝功能指标 两组患者治疗前各项肝功能指标比较差异无统计学意义(P>0.05), 治疗2、4周后两组患者的各项肝功能指标均较治疗前明显改善(P<0.05), 治疗2周后两组患者肝功能指标比较差异无统计学意义(P>0.05), 治疗4周后A组患者的肝功能指标改善情况显著优于B组, 差异具有统计学意义(P<0.05)。
2. 3 不良反应 两组患者均未发现明显的药物相关不良反应。
3 讨论
肝内胆汁淤积的诱发因素较多, 包括饮食因素、环境因素、遗传因素及感染因素等[7, 8], 肝内胆汁淤积患者会出现胆汁分泌障碍, 部分经胆汁排泌的物质大量积蓄在肝脏和血液内, 导致患者皮肤、巩膜出现黄疸样变, 部分患者还会出现皮肤瘙痒、白陶土样便等表现, 查肝功能可见TBIL、DBIL、TBA等多种肝功能指标异常升高[9]。慢性肝内胆汁淤积会导致患者的肝炎症状进一步加重, 肝细胞进一步受损, 积极治疗肝内胆汁淤积是提高慢性乙肝疗效的前提[10]。临床除了针对慢性乙肝的病因治疗外, 还强调采用促胆汁排泄药物来进行对症治疗, 常用药包括熊去氧胆酸、羟甲烟胺等。熊去氧胆酸属于三级胆酸, 能够利用熊去氧胆酸的亲水性和细胞保护作用来替代疏水性的毒性胆汁酸, 促进肝细胞分泌, 调节免疫机能, 从而加速胆汁的分泌和排除来避免胆汁酸诱导的肝细胞凋亡[11]。临床研究表明, 熊去氧胆酸在治疗慢性肝内胆汁淤积、慢性肝炎等相关疾病上均有较好疗效[12]。羟甲烟胺同样具有保肝利胆的作用, 在进入人体后能够分解为烟酰胺和甲醛, 前者能够有效的保护肝细胞, 促进肝脏自我修复, 后者则具有良好的抗菌、抗病毒作用[13]。Perin等[14]的研究采用羟甲烟胺进行肝内胆汁淤积症患者的治疗, 有效率达到70.14%。
从本次研究情况来看, A组患者的总有效率为80.0%, 显著高于B组的62.0%, 差异具有统计学意义(P<0.05)。从总体疗效反应可以看出熊去氧胆酸在治疗慢性肝内胆汁淤积的疗效上更具优势, A组患者的整体疗效有所提高。进一步从肝功能改善方面来看, 治疗2、4周后两组患者的各项肝功能指标均较治疗前明显改善(P<0.05), 治疗2周后两组患者肝功能指标比较差异无统计学意义(P>0.05), 治疗4周后A组患者的肝功能指标改善情况显著优于B组, 差异具有统计学意义(P<0.05)。这说明在短期治疗内熊去氧胆酸和羟甲烟胺的疗效并无明显差异, 但随着治疗时间的增加, 熊去氧膽酸的疗效逐渐凸显, 患者的各项肝功能改善程度也逐渐提高, 考虑原因可能与熊去氧胆酸能够通过激活表皮生长因子受体, 阻止线粒体功能失调, 抑制肝细胞凋亡等功能有关。也有研究认为熊去氧胆酸联合还原型谷胱甘肽的疗效要明显优于羟甲烟胺联合还原型谷胱甘肽, 并指出前者的组合能够相互协同作用提高对肝细胞的修复机制[15]。从安全性来看, 两组患者均未发现明显的药物相关不良反应, 这说明两种药物在治疗慢性肝内胆汁淤积的安全性上均较好。
综上所述, 熊去氧胆酸在慢性肝内胆汁淤积的治疗上较羟甲烟胺更具优势, 长期用药可明显提高疗效且安全性较好, 值得在临床上推广和应用。
参考文献
[1] Qiao L, Yacoub A, Studer E, et al. Inhibition of the MAPK and PI3K pathways enhances UDCA-induced apoptosis in primary rodent hepatocytes. Hepatology, 2002, 35(4):779-783.
[2] 中华医学会传染病与寄生虫病学分会, 肝病学分会. 病毒性肝炎防治方案. 中华传染病杂志, 2000, 19(1):324.
[3] Ribalta J, Reyes H, Gonzalez MC, et al. S-adenosyl-L-methionine in the treatment of patients with intrahepatic cholestasis of pregnancy: a randomized, double-blind, placebo-controlled study with negative results. Hepatology, 1991, 13(6):1084-1089.
[4] Paumgartner G, Beuers U. Mechanisms of action and therapeutic efficacy of ursodeoxycholic acid in cholestatic liver disease. Clin Liver Dis, 2004, 8(1):67-81.
[5] 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南. 中华传染病杂志, 2005, 23(6):421.
[6] 胆汁淤积性肝病临床诊断治疗专家委员会. 胆汁淤积性肝病临床诊断治疗专家共识. 中国肝脏病杂志(电子版), 2009, 1(2):474.
[7] Almasio P, Bortolini M, Pagliaro L, et al. Role of S-adenosyl-L-methionine in the treatment of intrahepatic cholestasis. Drugs, 1990, 40(3):111-123.
[8] Schneider G, Paus TC, Kullak-Ublick GA, et al. Linkage between a new splicing site mutation in the MDR3 alias ABCB4 gene and intrahepatic cholestasis of pregnancy. Hepatology, 2007, 45(1):150-158.
[9] Ostrow JD, Pascolo L, Tiribelli C. Reassessment of the unbound concent rations of unconjugated bilirubin in relation to neurotoxicity in vitro . Pediat r Res, 2003, 54(1):98-104.
[10] Ahlfors CE, Shapiro SM. Auditory brainstem response and unbound bilirubin in jaundiced (jj)Gunn rat pups. Biol Neonate, 2001, 80(2):158-162.
[11] 陈淮军. 熊去氧胆酸联合抑酸促动力剂治疗胆汁反流性胃炎疗效观察. 现代消化及介入诊疗, 2011, 16(4):266-267.
[12] 赵振飞, 高鸿亮, 姚萍. 熊去氧胆酸治疗胆汁反流性胃炎疗效的系统评价. 世界华人消化杂志, 2013, 21(26):2708-2716.
[13] Sentilhes L, Verspyck E, Roman H, et al. Intrahepatic cholestasis ofpregnancy and bile acid levels. Hepatology, 2005, 42(3):737-738.
[14] Perin E, Cacciaguerra G, Driul L, et al. Intrahepatic cholestasis of pregnancy: diagnosis and obstetric management. Minerva Ginecol, 2010, 62(2):97-103.
[15] Meier Y, Zodan T, Lang C, et al. Increased susceptibility for intrahepatic cholestasis of pregnancy and contraceptive-induced cholestasis in carriers of the 1331T>C polymorphism in the bile salt export pump. World J Gastroenterol, 2008, 14(1):38-45.
[收稿日期:2016-12-07]
