S2O32-在强酸中的水解动力学及反应机理研究
2017-03-19陆永超路瑶高庆宇
陆永超,路瑶,高庆宇
S2O32-在强酸中的水解动力学及反应机理研究
陆永超1*,路瑶2,高庆宇3
(1. 徐州医科大学公共教育学院, 江苏 徐州 221004; 2. 中国矿业大学现代分析与计算中心, 江苏 徐州 221116; 3. 中国矿业大学化工学院, 江苏 徐州 221116)
采用毛细管电泳对硫代硫酸根离子S2O32-在强酸性条件下的水解反应动力学进行了研究。反应体系中检测到多种含硫物种,包括硫S8、HSO3-、HS-、HS2O3-、HSn-、HSnO3-和SnO62-等。动力学分析表明,在溶液pH 1.20~2.50范围内,S2O32-的水解反应对于S2O32-的浓度为1级反应,而受pH的影响却不明显,水解速率常数为8.8×10-4min-1。提出17步反应机理,其中揭示了HSn-和HSnO3-是产生S8和SnO62-的主要途径。
硫代硫酸根离子; 酸性; 水解; 动力学
硫代硫酸盐S2O32-在浸金、造纸和糅革等行业被广泛应用,也常被用做定影剂和氰化物的解毒剂[1]。其化学性质相对较为稳定,但在酸性溶液中会快速分解,主要生成硫和二氧化硫[2]。然而,截至目前,对于S2O32-在酸性溶液中的水解反应动力学机理仍不清楚,S及SO2产生的途径也不十分明确。初步研究结果表明,在该反应体系内,可产生多种产物,除S及SO2外,还有H2S、连多硫离子HSn-/Sn2-和连多硫酸根离子SnO62-等[3,4]。该反应过程十分复杂,涉及质子H+、硫原子的传递过程以及各含硫物种之间的氧化还原反应等;此外,该分解反应也是合成SnO62-的重要途径。
毛细管电泳技术具有分离效率高、分离速度快和分离模式多样等优势,广泛应用于生物化学、药物分析以及环境监测等领域[5]。基于这些优势和自身特点,毛细管电泳可对化学反应过程中的反应物、产物以及中间产物在快速分离的基础上实现定性和定量分析,以完成对化学反应动力学的监测和追踪,还可对进一步完善化学反应机理提供直接证据[3]。
本文采用毛细管电泳对S2O32-在强酸性水溶液中的水解反应过程中各含硫物种及其浓度变化进行监测,对化学反应动力学和反应机理进行研究。
1 实验部分
1.1 试剂与设备
实验中所采用试剂分别用于缓冲溶液配置、反应溶液和电泳分离方法的运行缓冲液及各种硫化合物等。H2SO4、醋酸HAc及醋酸钾KAc、磷酸H3PO4及磷酸二氢钠NaH2PO4等用来配置背景缓冲溶液、反应缓冲溶液的试剂都采用分析纯级别(上海苏懿化学试剂有限公司),未进行进一步的处理。硫代硫酸钠Na2S2O3和连四硫酸钾K2S4O6采用优级纯(美国Fluka公司)试剂。其他含硫化合物K2SnO6均由实验室自行合成制备。连三硫酸钾K2S3O6采用在低温下,浓H2O2氧化饱和Na2S2O3溶液的方法得到[3]。连五硫酸钾K2S5O6·1.5H2O合成是在As2O3催化条件下,饱和Na2S2O3溶液在浓盐酸溶液中的水解反应后,经分离提纯和多次重结晶等后续处理后制得[3]。
所有溶液均采用由Millipore MilliQ超纯水系统(18.2 MΩ·cm, Millipore, USA)制备的超纯水配置。动力学实验研究中,将反应溶液在恒温振荡水浴槽中进行,恒定温度25oC。所有试剂和溶液在使用前,采用0.22 μm微孔滤膜过滤。
毛细管电泳分离检测在Beckman Coulter P/ACE MDQ毛细管电泳仪(美国Beckman Coulter公司)上完成,配备了自动进样器和二极管阵列检测器(DAD),数据采集及处理在32 Karat Software软件工作站进行。
单独检测通道设置为195、214和254 nm。检测过程采用压力进样,0.5 psi.×5 s。采用聚酰亚胺外涂层的熔融硅毛细管(河北永年锐沣光导纤维厂),75 μm i.d.×57 cm(有效长度50 cm),分离检测设定温度为25oC。进样采用自动进样器定时从样品小瓶中抽取溶液进行分离检测。
1.2 实验方法
1.2.1 各物种分析检测方法
建立毛细管电泳用于定性和定量分析反应溶液中各含硫化合物的方法[3]。采用浓度为10 mM的NaH2PO4水溶液为背景缓冲溶液,以H2SO4调节pH值为1.90;分离电压-20 kV;检测波长为214 nm。实现反应体系中多种含硫化合物的基线分离,并进行定性与定量分析,建立浓度校准曲线;主要对于S2O32-在反应过程中的浓度变化进行实时监测,获得动力学数据。
1.2.2 动力学分析
以HAc-KAc及H3PO4及NaH2PO4配置pH 1.20~2.50的反应缓冲溶液,溶液离子强度为0.5 M;将一定量的反应物Na2S2O3储备液加入到250 mL特定pH值的反应缓冲溶液中,使Na2S2O3初始浓度[Na2S2O3]0为1.0 mM;将反应体系置于恒温水浴槽中开始反应,控制反应温度25oC。
在反应的不同时间,定时从反应溶液中抽取反应液,对不同pH值下进行的Na2S2O3酸性溶液中的分解反应进行跟踪检测,确定反应过程中的反应物与生成物的类型及其分布规律;通过外标法确定S2O32-在不同反应时间的浓度变化曲线。需要特别指出的是,由于所检测反应的反应速率相对于分离速率慢的多,或在所使用的检测方法下化学反应停止或更慢,因此可认为进样时间即为反应时间,分离测定的物质浓度代表进样时体系各物质的浓度。
2 S2O32-水解反应动力学
2.1 水解产物测定
采用毛细管电泳对水解反应过程中间产物进行了分离测定,如图1所示。
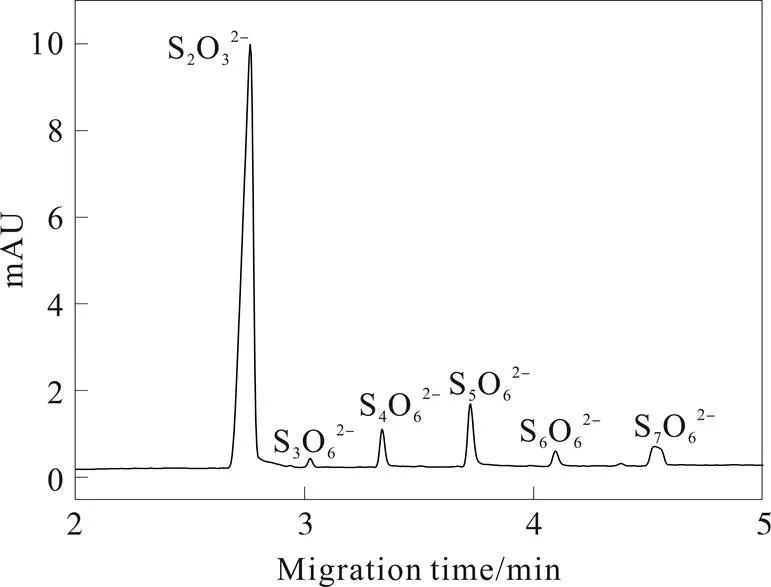
图1 S2O32-在酸性溶液中水解反应过程中含硫化合物的毛细管电泳分析
背景缓冲溶液为10 mM的NaH2PO4水溶液,以H2SO4调节pH值为1.90;分离电压-20 kV;检测波长为214 nm
可检测物种中,除了反应物S2O32-外,还包括产物中的多种连多硫酸盐SO62-(从S3O62-至S7O62-)。由于体系中产生了乳白色及淡黄色的沉淀物物,认为是硫S8;反应容器中气体收集,用湿润的醋酸铅试纸检验确定气体产物中含有H2S;另外,气体产物中还含有SO2。
采用积分峰面积建立了S2O32-、S3O62-、S4O62-和S5O62-定量分析的浓度校准曲线,确定了检测线性范围及检测限,如表1所示。
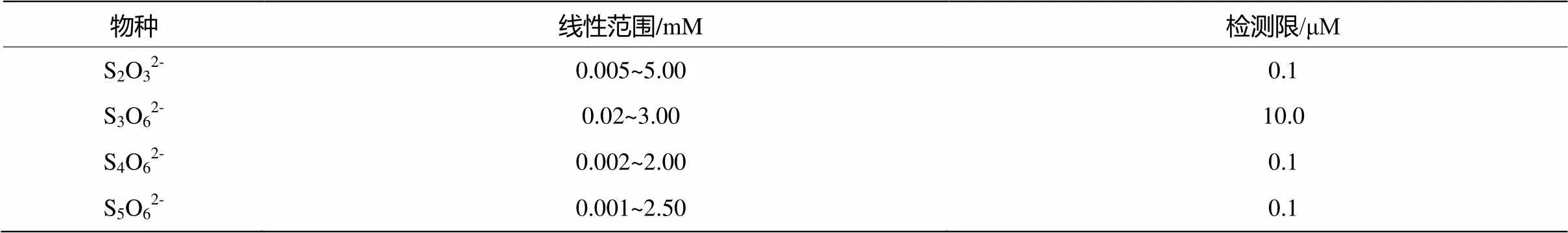
表1 毛细管电泳分离分别对S2O32-、S3O62-、S4O62-和S5O62-检测的线性范围和检测限
水解反应初级阶段,体系中存在的最主要的中间产物为S4O62-;随着反应的进行,出现了其它更高级的SO62-;S3O62-由于生成量极少且吸收很弱,只在部分体系中检测到。没有检测到SO32-,因为强酸条件下生成SO2而逸出;在反应历程中,采用沉淀法和间接紫外检测法均未检测到SO42-。
2.2 S2O32-水解反应的动力学测定
通过对反应历程的实时测定,得到水解反应中反应物和产物浓度的动力学变化曲线,得到了酸性分解反应对S2O32-的反应级数和速率,如图2所示为pH 2.0条件下的相关曲线。如图2.a所示,随着S2O32-的浓度因消耗而逐渐降低,S4O62-和S5O62-浓度缓慢升高,但浓度都较低,均在10-4~10-5M范围,其他产物无法定量或浓度极低未给出。从图中可以看出,在所检测的反应条件下,S2O32-降解较慢,但在整个历程中,对于S2O32-为1级反应;从图2.b中求得此反应pH下分解反应速率常数为8.8×10-4min-1。

(a) S2O32-、S4O62-和S5O62-浓度随时间变化动力学曲线;(b) ln([S2O32-]0/[S2O32-])与反应时间的关系曲线。反应溶液[S2O32-]0= 1.0 mM,pH 2.0,25oC
2.3 pH值对反应速率的影响
通过对S2O32-的水解反应在pH 1.20~2.50范围内进行动力学分析,发现在此pH值范围内,固定S2O32-的初始浓度不变,H+浓度对反应速率无显著影响(见表2)。虽然随着pH值的降低,S2O32-的水解速率有所提高,但变化不大。因此可近似认为S2O32-的酸性水解反应速率不依赖于反应体系所在溶液的pH值。因此,S2O32-的酸性水解反应速率方程为= 8.8 ×10-4[S2O32-]mol·L-1·min-1。
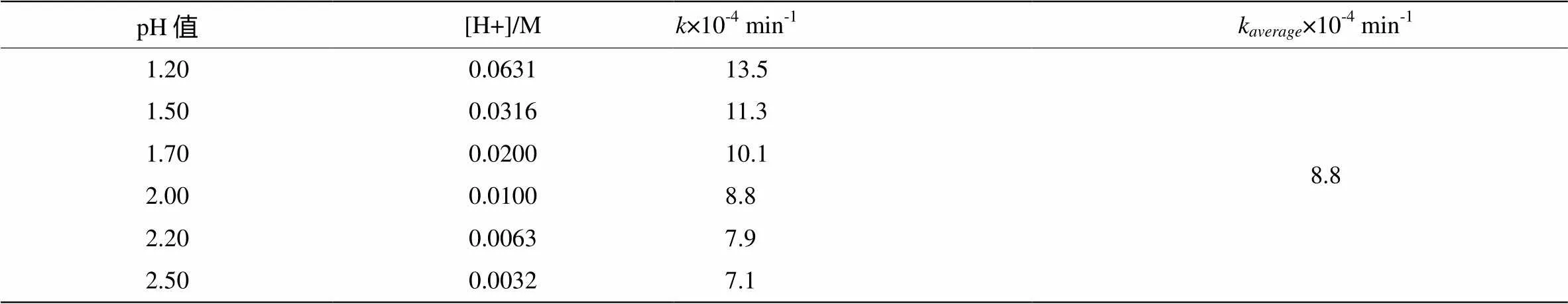
表2 pH值对S2O32-分解反应速率的影响
注 :[S2O32-]0= 1.0 mM,25oC。
2.4 水解反应机理及讨论
本研究中发现,在所考察pH范围内(pH 1.20-2.50),反应速率与两种反应物分别为1级和0级反应。基于反应过程中产物的检测分析和文献报道[4,6,7],提出了如下17步反应机理:
M1 H++ S2O32-↔ HS2O3-
M2 S2O32-+ HS2O3-→ HS3O3-+ SO32-
M3 H++ SO32-↔ HSO3-
M4 H++ HSO3-↔ H2SO3
M5 H2SO3↔ H2O + SO2
M6 HS3O3-+ 6S2O32-→ HS9O3-+ 6SO32-
M7 HS9O3-→ S8+ HSO3-
M8 S2O32-+ HS3O3-↔ S4O62-+ HS-
M9 H++ HS-↔ H2S
M10 S2O32-+ S4O62-→ S5O62-+ SO32-
M11 S2O32-+ S5O62-→ S6O62-+ SO32-
M12 S2O32-+ HSO3-↔ S+1O62-+ HS-
M13 H2S + SO2→ H2S2O2
M14 H2S2O2+ 2H+→ 2HS(OH)
M15 HS(OH) + HS-↔ HS2-+ H2O
M16 HS(OH) + HS-↔ HS+1-+ H2O
M17 HS9-→ S8+ HS-
该机理中包含的反应物种涉及H2S/HS-、H2SO3/HSO3-/SO32-、HS2O3-/S2O32-、HS-、HSO3-、SO62-和S8等组成17步反应,包括4步酸碱平衡反应(M1、M3、M4和M9),涉及气体反应(M5、M9和M13),硫析出反应(M7和M17),连多硫酸盐SO62-生成和消耗反应(M8、M10、M11和M12),活性硫HS(OH)参与和连多硫离子的反应(M14-M16)以及HSO3-硫原子链反应(M2和M6)等。
反应M1为HS2O3-和S2O32-之间的快速平衡反应,反应平衡常数为0.01[7]。反应M2生成活性物质HS3O3-和SO3-,前者是形成胶体硫最基本的成分,而后者经历快速的酸碱平衡反应(M3-M5)而被消耗。反应M6是总和反应,是HS3O3-中硫原子链加长的反应,遵循与反应M2相似的规律。反应M7为HS9O3-中硫原子成环而形成S8,该反应是体系中硫产生的最主要因素。反应M8是S4O62-形成的可逆反应,将HS-、HS3O3-和SO62-之间建立联系,是造成体系复杂的重要因素。M10和M11是SO62-中硫原子链加长反应,这两个反应是可逆的,然而,由于逆向反应中所必需的SO32-在反应条件下含量极微,故舍去逆向反应而只保留正向反应。反应M12与M8类似,是HS-、HSO3-和SO62-之间的转化。H2S 和SO2直接化合生成H2S2O2,后者在溶液中极不稳定,在酸性溶液中形成可溶性硫进而生成硫化物HS-、多硫化物HS+1-和SO62-,反应历程和特征与Wackenroder溶液相似,反应M13-M16。反应M17显示了连多硫离子HS9-也是生成S8的重要途径。
此17步机理中很多反应不是基元反应,而是多个反应的总和,如M6、M12和M16是一系列的硫原子链加长反应,都是快速反应。即使机理中尽量包括了可检测到或文献报道的所有可能的产物,对它们之间的反应也都建立了相应的联系,然而体系的复杂历程还不十分清楚,关于反应速率等动力学参数大多也都没有准确测定或验证,仍需要进行更深入细致的研究。
3 结 论
S2O32-在酸性水溶液中(pH 1.20~2.50)的水解反应遵循1级反应动力学,即反应速率只与[S2O32-]有关,而与pH值无关。采用毛细管电泳分离的方法能够快速测定反应过程中反应物与生成物的浓度变化,可以作为慢反应化学反应动力学分析的有力手段。根据产物和反应物的分析及动力学研究,并结合前人研究工作基础上,提出17步反应机理,能够较好地解释反应特征中反应产物分布和浓度变化规律。
然而该反应过程十分复杂,仍难以完全了解真实过程。进一步的研究工作应集中于反应过程中中间产物尤其是不稳定化合物的直接测定和相关反应动力学测定,如利用顺磁共振技术和Stopped-flow技术[8,9]等。
[1]WHO Model Formulary 2008. World Health Organization. 2009. ISBN 9789241547659, p. 66.
[2]A F Holleman, E Wiberg. Inorganic Chemistry[M], Academic Press: San Diego, 2001.
[3]陆永超. 反应过程中硫氧化合物的检测和动力学分析[D]. 中国矿业大学,2010.
[4]R E Davis. Displacement reactions at the sulfur atom. I. An interpretation of the decomposition of acidified thiosulfate[J]. ournal of American Chemistry Society, 1958, 80(14): 3565-3569.
[5]G Kemp. Capillary electrophoresis: a versatile family of analytical techniques[J]. Biotechnology and Applied Biochemistry, 1998, 27, 9-17.
[6]R Dinegar, R Smellie, V La Mer. Additions and corrections kinetics of the acid decompo- sition of sodium thiosulfate in dilute solutions[J]. Journal of American Chemistry Society, 1951, 73 (12): 5929-5931.
[7]R Dinegar, R Smellie, V La Mer. Kinetics of the acid decomposition of sodium thiosulfate in dilute solutions[J]. Journal of American Chemistry Society, 1991, 73, 2050-2054.
[8]M Weitzer, M Schatz, F Hampel, FW Heinemann, S Schindler. Low temperature stopped-flow studies in inorganic chemistry[J]. Journal of the Chemical Society Dalton Transactions, 2002, 5(5): 686-694.
[9]I Fábián, G Grodon. Iron(III)-catalyzed decomposition of the chlorite ion: an inorganic application of the quenched stopped-flow method[J]. Inorganic Chemistry, 1992, 31(11): 2144-2150.
Studyon Hydrolysis Kinetics and ReactionMechanism of Thiosulfate Under Strong Acidic Condition
1,*,2,3
(1. Xuzhou Medical University, Jiangsu Xuzhou 221004, China; 2. Advanced Analysis & Computation Center, China University of Mining & Technology, Jiangsu Xuzhou 221116, China; 3. School of Chemical Engineering & Technology, China University of Mining & Technology, Jiangsu Xuzhou 221116, China)
The hydrolysis reaction kinetics of S2O32-under strong acidic condition was studied by using capillary electrophoresis. Several sulfur-containing species were detected, such as colloid sulfur (S8), bisulfite (HSO3-), hydrogen sulfide (HS-), bithiosulfate (HS2O3-), polysulfides (HS-,≥3) and polythionates (SO62-,≥3). It was found that the hydrolysis of S2O32-was first order with respect to [S2O32-] within the pH range between 1.20 and 2.50; meanwhile, this reaction kinetic was independent of pH. The reaction rate constant was 8.8×10-4min-1. A 17-step mechanism was proposed with SO62-, HS-and HSO3-as the main intermadiates. It was also shown that HS-and HSO3-were the main source for the formation of S8and SO62-.
thiosulfate; acidic condition; hydrolysis; kinetics; mechanism
2017-11-21
陆永超(1983-),男,讲师,博士,江苏省徐州市人,2010年毕业于中国矿业大学应用化学专业,研究方向:从事硫化学及色谱分析等研究。
徐州医科大学优秀人才科研启动基金项目,项目号:D2015020。
TQ 013
A
1004-0935(2017)12-1162-04
